137份桃种质资源耐热性评价
张杨 龚林忠 艾小艳 朱炜 王会良 刘勇 诸小敏 王富荣 何华平

摘要:【目的】利用葉绿素荧光参数法对137份桃种质进行耐热性鉴定,为耐热桃品种的培育及耐热机理的研究提供理论依据。【方法】以湖北省桃种质资源圃中的桃种质为研究对象,利用便携式叶绿素荧光仪测定桃一年生枝条嫩叶高温水浴处理后的Fv/Fm,确定适用于桃耐热性鉴定的临界温度(TC)和热处理时间,并以此评价137份桃种质的耐热性。【结果】对丰光24-2、早仙红和金辉3份桃种质材料在25~55 ℃条件下的Fv/Fm进行测定,得出桃耐热性评价的TC为47.0 ℃。47.0 ℃条件下,当处理时间为50 min时,3个品种间的Fv/Fm差异显著(P<0.05),确定桃高温处理的条件为47.0 ℃,50 min。在此条件下鉴定不同桃品种的耐热性,结果显示137份桃种质的Fv/Fm为0.1723~0.6968,桃耐热性性状符合正态分布,说明其为多基因控制的数量性状。利用最优分割聚类法将137份桃种质材料的耐热性分为强、中、弱3类,其中,耐热性强(Fv/Fm>0.6)的种质材料有26份,占19%;耐热性中等(0.6≥Fv/Fm>0.4)的种质材料94份,占69%;耐热性弱(Fv/Fm≤0.4)的种质材料有17份,占12%。【结论】高温胁迫影响桃叶片的光合作用能力,不同种质材料间耐热性存在明显差异,其中,丰光24-2、14-101、04-1-41、中桃10号、夏之梦、14-3-9-1和春雪等26份耐热性强的种质可作为亲本用于耐热桃新品种选育和耐热机理研究。
关键词: 桃;耐热性;叶绿素荧光参数(Fv/Fm);鉴定评价
中图分类号: S662.102.4 文献标志码: A 文章编号:2095-1191(2023)02-0467-09
Abstract:【Objective】This research aim to explore one method to identify the heat tolerance of 137 peach germplasm resources by using the chlorophyll fluorescence parameter(Fv/Fm). This result would provide theoretical basis for cultiva-ting heat-resistant peach varieties and further research on illustrating the heat-resistant mechanism. 【Method】The peach germplasm resources from Hubei Peach resources nursery were used as experimental materials. Under heat water bath stress,the Fv/Fm value of gender leaves of peach annual branches were measured by the portable fluorometer. The critical temperature (TC) and heat treatment time suitable for peach heat resistance evaluation were determine. On this basis,the heat resistance of 137 peach germplasm resources was evaluated. 【Result】In 25-55 ℃ water bath,the Fv/Fm values of three different peach germplasm resources, Fengguang 24-2,Zaoxianhong and Jinhui, were measured. Data analysis showed that TC for evaluating the heat resistance of peach was 47.0 ℃.At 47.0 ℃,when the treatment time was 50 min,the Fv/Fm values among the three cultivars were significantly different(P<0.05). Based on the above,the optimal temperature (47.0 ℃) and heat stress treatment time (50 min) were used to determinate the heat tolerance of peach cultivars. Fv/Fm of heat tolerance of 137 peach germplasm resources was between 0.1723 to 0.6968. The peach heat tolerance traits basically followed the normal distribution,it proved that the peach heat-resistant was quantitative trait controlled by multi-genes. The heatresistance of 137 peach germplasm resources was divided into three levels by optimal segmentation:strong,mo-derate and weak. Among them,26 cultivars with strong heat resistance (Fv/Fm>0.6) accounted for 19%, 94 cultivars with moderate heat resistance (0.6≥Fv/Fm>0.4) accounted for 69%,and 17 cultivars with weak heat resistance (Fv/Fm≤0.4) accounted for 12%. 【Conclusion】High temperature has an impact on the photosynthesis of peach leaves,and there are some heat resistance differences among different germplasm resources. Among them,26 strong heatresistance germplasms,such as Fengguang 24-2,14-101,04-1-41,Zhongtao 10,Xiazhimeng, Chunxue and Taobadan,can be used as pa-rents to breed heat tolerant peach and used for investigating the peach heat tolerance mechanisms.
Key words: peach; heat resistance; chlorophyll fluorescence (Fv/Fm); evaluation
Foundation items: China Agriculture Research System-Peach Industry (CARS-30); Post-doctoral Innovation Practice Project of Hubei (Erenshehan〔2022〕80);Youth Science Foundation of Hubei Academy of Agricultural Sciences (2023NKYJJ21)
0 引言
【研究意义】桃[Prunus persica(L.) Batsch]是蔷薇科李属多年生果树,原产中国,在全世界广泛种植,作为一种温带果树,其适宜生长温度为18~23 ℃,成熟期多集中于6—9月,但湖北地区夏季炎热高温,日均温可达30 °C,最高温在40 °C以上,高温胁迫致使桃树叶片萎蔫,枝条生长量降低,树干流胶,严重影响桃的生长发育、产量和品质(刘勇等,2018;Lian et al.,2021)。因此,开展桃耐热种质资源的鉴定评价工作,发掘和利用耐高温品种,对耐热新品种的选育和解决夏季高温胁迫下的果树栽培生产具有重要意义。【前人研究进展】高温胁迫可影响植物生长发育的多种生理过程,如光合作用、呼吸作用、蒸腾作用、膜热稳定性和渗透调节反应等(姜燕等,2014;Wang et al.,2020;Zhao et al.,2020)。对早红珠油桃进行高温处理后发现,叶片呈现卷曲皱缩、叶绿素和类胡萝卜素含量显著下降,丙二醛含量与受害程度呈正相关,高温对油桃植株造成了严重的侵害(尤超等,2016)。目前,植物耐热性评价主要包括田间鉴定、间接鉴定和人工模拟,评断的耐热指标主要包括表型观察、生理生化指标测定、显微结构观测、光合作用参数测定等(郝召君等,2017;孔令接等,2019;Hu et al.,2020;陈雷等2021)。研究表明,光合作用中光系统II(Photosystem II,PSII)对外界环境敏感,该系统先于其他反应系统响应逆境胁迫(Sheikh et al.,2010;Venios et al.,2020)。Fv/Fm通常为描述PSⅡ最大光化学量子产量的叶绿素荧光参数,正常生长条件下,该参数变化极小,而逆境胁迫条件下,该参数明显下降,可被用于评价植物逆境损伤(Perera-Castro et al.,2018;Liu et al.,2020)。Xu等(2014)对葡萄进行高温处理,通过Fv/Fm测定,得出葡萄耐热性判定的临界条件为47 ℃,40 min,并认为OJIP-test可作为简便、快速、精确评判植物耐热性的方法。姜建福等(2017)利用叶绿素荧光成像系统对离体叶片最大光合效率Fv/Fm进行测定,评价196份葡萄种质资源的耐热性,筛选出了腺枝葡萄双溪03、刺葡萄梅岭山1301等46份耐热性强的葡萄种质。【本研究切入点】高温热害严重影响桃产业的健康可持续发展,湖北生产应用的桃品种较多,蕴藏着耐热性强的品种,但目前关于桃耐高温种质资源评价的研究鲜见报道。【拟解决的关键问题】利用叶绿素荧光参数法探究桃耐热性鉴定的温度和时间,并对湖北省桃资源圃中的桃种质资源进行耐热性评价,以期为耐高温桃品种的选育及高温胁迫应答机制的研究提供理论依据。
1 材料与方法
1. 1 试验材料
供试的137份桃种质材料来源于湖北省武汉市江夏区金水闸湖北省农业科学院果树茶叶研究所(东经114°08',北纬30°17'),品种具体情况见表1。金水闸试验园海拔38 m,年平均气温16.9 ℃,年降水量900~1400 mm。土壤为黄壤土,肥力中等,排灌通畅,栽植株南北行向分布,统一管理,生长正常。
1. 2 试验方法
1. 2. 1 高温处理和Fv/Fm的测定 离体叶片高温胁迫处理方法参照Weng和Lai(2005)的文献。于晴朗无风的天气采集桃一年生枝条上完全展开的健康幼嫩叶片,用湿润的滤纸包裹后,迅速带回实验室,每个品种采集四片叶子作为生物学重复,将叶片放入水浴锅中,控制温度,高温处理一段时间后取出,室温黑暗处理20 min。利用FluorPen FP110手持式叶绿素荧光仪(Drasov,捷克)测定叶片的Fv/Fm。
1. 2. 2 临界温度(TC)和热处理时间确定 具体方法参考Xu等(2014)的文献。TC是指叶绿素荧光参数Fv/Fm迅速降低的温度转折点,以丰光24-2、早仙红和金辉3个桃品种为研究对象,采集其叶片置于水浴中,温度从25 ℃加热至55 ℃,利用FluorPen FP110每30~60 s测定1次叶绿素荧光参数Fv/Fm,绘制成曲线,利用方程计算出平缓曲线和急剧下降曲线的交点温度值即为TC。在TC温度下处理60 min,每10 min测定1次Fv/Fm,以确定最适耐热性评价的时间。
1. 3 统计分析
使用Excel 2019进行统计数据,用平均值±SE表示差异。采用SPSS 16.0进行方差分析和正态分布检验,以及利用DPS 7.05数据处理系统中的有序样本最优分割聚类法对测定的Fv/Fm进行分类,以评判桃种质材料的耐热性。
2 结果与分析
2. 1 桃叶片耐热性评价TC确定
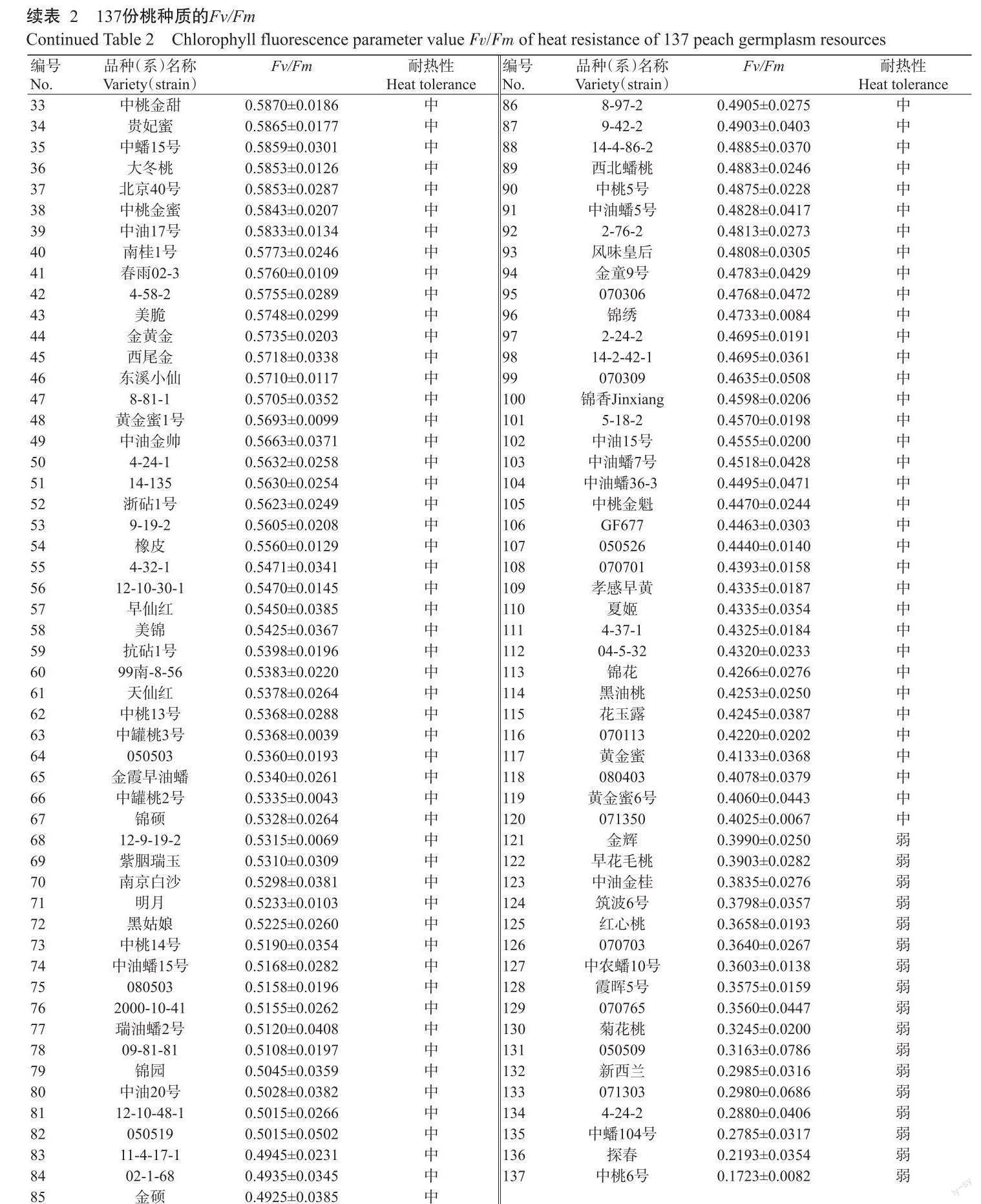
对丰光24-2、早仙红和金辉3个桃品种的Fv/Fm進行测定,根据每个品种平缓和急剧变化曲线的方程,计算出两曲线的交点,结果(图1)可知,丰光24-2、早仙红和金辉的TC分别为47.3、46.6和46.1 ℃,处理温度小于TC时,Fv/Fm无明显变化,处理温度大于TC时Fv/Fm急剧下降。由于三者的TC温度接近于47.0 ℃,故以47.0 ℃作为耐热性评价的TC。
2. 2 桃叶片耐热性评价时间的确定
将叶片浸没于47.0 ℃水浴中,热处理60 min,每10 min测定1次叶片的Fv/Fm,如图2所示。随着处理时间的加长,3个品种的Fv/Fm逐渐降低,在高温处理50和60 min,3个品种间的Fv/Fm存在显著差异(P<0.05)。因此,以47.0 ℃处理50 min作为桃耐热性评价的最适条件。从图2还可看出,丰光24-2的耐热性最强,其次是早仙红和金辉。
2. 3 桃种质资源的Fv/Fm测定结果
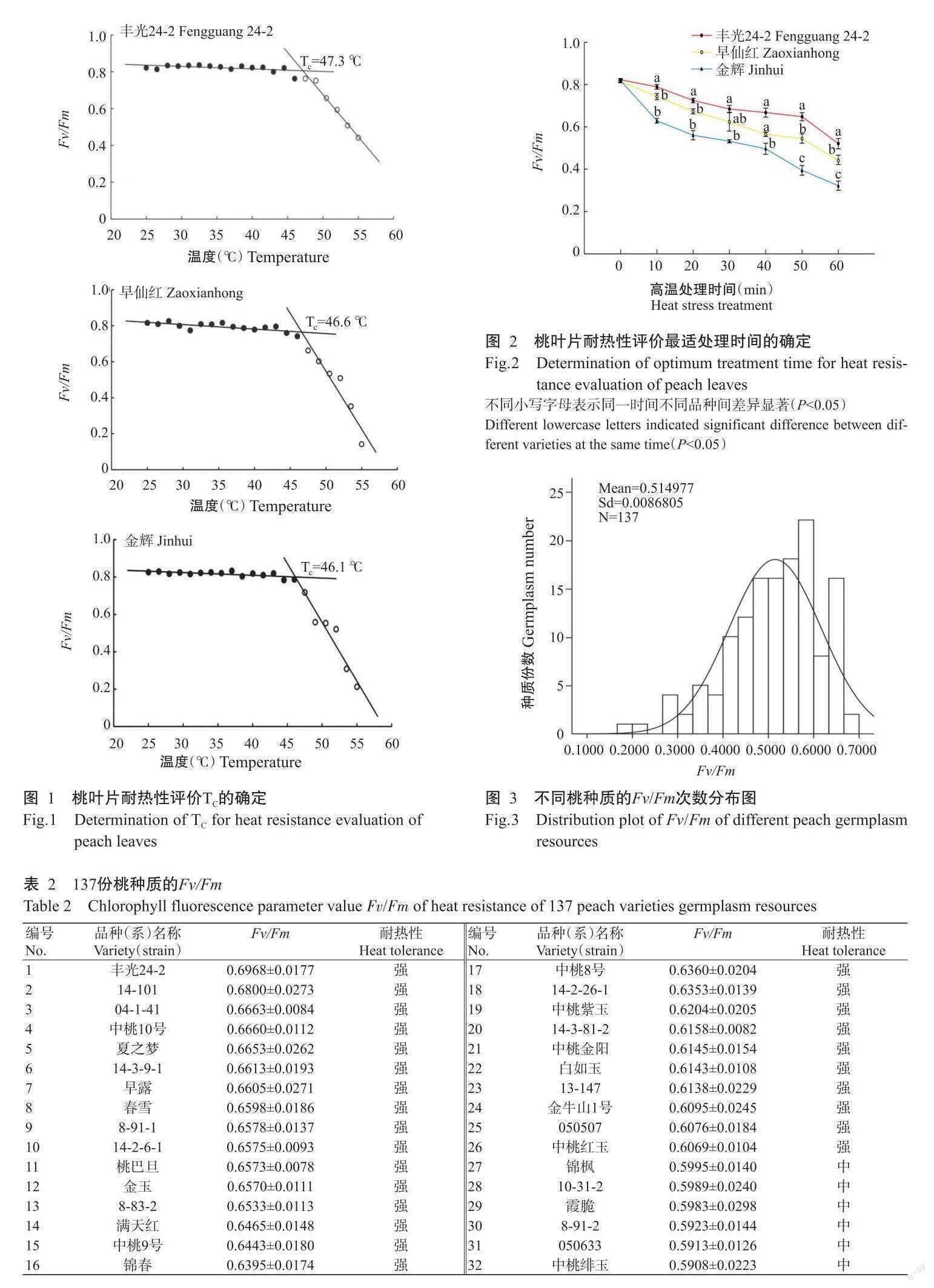
將137份桃种质的Fv/Fm由大到小进行排列,如表2所示。Fv/Fm为0.1723~0.6968,不同种质材料的耐热性不同。对以上数据进行正态检测分析,结果显示,样本总体与正态分布无显著差异(P>0.05),且直方图呈钟型(图3),说明桃种质的耐热性符合正态分布,故推测桃的耐热性状是由多基因控制的数量性状。
2. 4 桃种质资源的耐热性分级
利用DPS 7.05的有序样本最优分割聚类法,对137份桃种质的Fv/Fm进行分析,分类类别、误差函数及最优分割结果如表3所示。为了更直观地显示分类结果,分别以分类类别和误差函数为横、纵坐标绘制曲线图,误差函数曲线拐点在3和4之间,之后曲线逐步趋于稳定(图4),且结合桃高温处理的Fv/Fm变化范围较小,故初步将其耐热性分为三大类,之后进行单因素差异显著性分析,结果显示,各分级在1%置信区间水平下差异极显著(P<0.01),由此确定最优分割为3级。以强、中、弱3类分别表示桃种质耐热性,将叶Fv/Fm阈值四舍五入后,耐热性强的种质Fv/Fm>0.6,耐热性中等的种质0.6≥Fv/Fm>0.4,耐热性弱的种质Fv/Fm≤0.4。耐热性强、中、弱的种质份数分别为26、94和17,所占例分别为19%、69%和12%(图5)。26份耐热性强的种质如丰光24-2、14-101、04-1-41、中桃10号、夏之梦、14-3-9-1、春雪等,可用于后续耐热桃品种选育的亲本材料。
3 讨论
3. 1 叶绿素荧光参数法鉴定桃耐热性
开展耐热性鉴定的首要工作是找到一种行之有效的方法,田间自然鉴定和人工气候室模拟等方法受环境、群体规模、树体大小影响较大,广泛适用性低。前人研究结果发现,PSII系统的光合作用对高温胁迫反应敏感,Fv/Fm可直接反映PSⅡ光系统反应中心的内禀光能转换效率,如杜国栋等(2011)对不同温度下仁用杏叶片的光合适应机制进行研究,结果发现50 ℃高温导致仁用杏叶片Fv/Fm和光化学性能指数PIABS急剧下降,PSⅡ系统反应中心部分失活,光合机构受损,光合能力下降;计玮玮等(2012)研究表明,高温胁迫致使砂梨叶片D1蛋白含量减少和Deg1蛋白酶受损,PSⅡ自我修复被阻碍,光合作用受到抑制。本研究供试种质丰光24-2、早仙红和金辉叶片的Fv/Fm均受温度影响,当温度大于TC(47.0 ℃)或伴随47.0 ℃处理时间的延长,3个品种叶片的Fv/Fm呈现不同程度下降,说明高温胁迫对桃叶片的PSII系统造成影响,与尤超等(2016)研究认为高温影响油桃光合作用相符,可通过测定Fv/Fm反映高温对光合作用的损害程度来评价桃耐热性。Yamada等(1996)利用叶绿素荧光参数法,在45.0 ℃,20 min的条件下对23份热带和亚热带果树种质进行耐热性评价。Strasser(1997)建立了快速叶绿素荧光动力学OJIP曲线和JIP-test的分析处理方法,为研究植株的光合作用提供了便利。Xu等(2014)比较了高温胁迫下葡萄品种的光合放氧速率、电解质渗出率和OJIP-test中的Fv/Fm变化,3种方法得到的结果一致,且叶绿素荧光参数法在不同年份和月份的重复性较高,提出OJIP-test是一种简便可行的耐热性鉴定方法。参考Xu等(2014)的方法,本研究确立了利用叶绿素荧光参数法评价桃耐热性的条件为47.0 ℃,50 min,以此条件鉴定了137份不同桃种质的耐热性。本研究不仅为桃田间耐热性快速简便鉴定提供了一种新思路,还为桃耐热性评价方面提供了一些高温胁迫数据,具有一定的理论参考价值,但本方法仅以单一叶绿素荧光参数值为依据,存在着一些局限性,后续应结合高温胁迫下的其他生理指标,综合评判桃的耐高温能力。
3. 2 不同桃品种耐热性评价
遗传学中将自然群体或杂种后代群体中的性状分为质量性状和数量性状,质量性状不连续分布,由主基因控制性状;数量性状状态呈连续性,接近于正态分布,由微效多基因控制。对群体进行性状判断,有助于对耐热性状遗传机制进行更深一步的探索。本研究鉴定出桃种质的耐热性评价条件(即47.0 ℃水浴处理50 min),对137份桃种质资源的Fv/Fm进行了测定,之后对该数据进行正态性检验,结果表明,供试品种的耐热性呈连续性分布,且符合正态分布,说明桃的耐热性是多基因控制的数量性状。前人研究发现CHS、DFR、F3H等花青素代谢相关基因参与了紫叶桃的高温胁迫应答(Zhou et al.,2013)。此外,对黄水蜜(普通型)×中油桃14(温度敏感型半矮化)的杂交群体进行测序,结果发现定位在3号染色体区间的PpTIP2基因表达与温度敏感型半矮化性状呈极相关,且启动子活性分析发现,高温条件下,中油桃14中的PpTIP2基因特异启动子活性显著高于黄水蜜,表明中油桃14的PpTIP2基因特异启动子受温度诱导(Lian et al.,2021)。中油桃14的热激转录因子(HSFBs)和热激蛋白(HSP70、HSP90)等蛋白编码基因可随温度的升高上调表达(连晓东,2019)。这些研究表明桃自身可通过多种途径应答高温胁迫,后续可以耐热性强或耐热性敏感桃品种为研究对象,利用QTL定位、转录组测序和代谢组质谱检测等技术,挖掘高温胁迫响应通路,发掘关键热响应基因进行功能鉴定和分子机理研究。
有序样品最优分割法可将按顺序排布的样品进行分割,使得各分割组内样品差异最小,而各分割组间差异最大。李德等(2015)利用聚类分析法确定了夏玉米花期高温热害的分级阈值,将其热害分为轻、中、重、特重4个等级,为田间高温监测预警、调查评估等工作提供了参考依据。本研究利用有序樣品最优分割聚类法对137份桃种质的耐热性进行了分级,分为强、中、弱三类,其中,耐热性强和中等的种质数量较多,占种质材料总数的88%(图5),说明大多数桃种质耐高温能力较强。
4 结论
高温胁迫影响桃叶片的光合作用能力,不同种质材料间耐热性存在明显差异,其中,丰光24-2、14-101、04-1-41、中桃10号、夏之梦、14-3-9-1和春雪等26份耐热性强的种质可作为亲本用于耐热桃新品种选育和耐热机理研究。
参考文献:
陈雷,王强,张晓丽,高国庆,吕荣华,陶伟,潘英华,江立庚,唐茂艳,梁天锋. 2021. 不同水稻基因型花期耐热性鉴定与评价[J]. 南方农业学报,52(10):2641-2649. [Chen L,Wang Q,Zhang X L,Gao G Q,Lü R H,Tao W,Pan Y H,Jiang L G,Tang M Y,Liang T F. 2021. Identification and evaluation for heat tolerance at the flowering stage in different rice genotypes[J]. Journal of Southern Agriculture,52(10):2641-2649.] doi:10.3969/j.issn.2095-1191.2021.10.003.
杜国栋,吕德国,赵玲,王素素,蔡倩. 2011. 高温对仁用杏光合特性及PSⅡ光化学活性的影响[J]. 应用生态学报,22(3):701-706. [Du G D,Lü D G,Zhao L,Wang S S,Cai Q. 2011. Effects of high temperature on leaf photosynthetic characteristics and photosystemⅡ photochemical activity of kernel-used apricot[J]. Chinese Journal of Applied Ecology,22(3):701-706.] doi:10.13287/j.1001-9332. 2011.0137.
郝召君,周春华,刘定,魏梦苒,陶俊. 2017. 高温胁迫对芍药光合作用、叶绿素荧光特性及超微结构的影响[J]. 分子植物育种,15(6):2359-2367. [Hao Z J,Zhou C H,Liu D,Wei M R,Tao J. 2017. Effects of high temperature stress on photosynthesis,chlorophyll fluorescence and ultrastructure of Herbaceous Peony (Paeonia lactiflora Pall.)[J]. Molecular Plant Breeding,15(6):2359-2367.] doi:10. 13271/j.mpb.015.002359.
计玮玮,邱翠花,焦云,郭延平,滕元文. 2012. 高温强光胁迫对砂梨叶片光合作用、D1蛋白和Deg1蛋白酶的影响[J]. 果树学报,29(5):794-799. [Ji W W,Qiu C H,Jiao Y,Guo Y P,Teng Y W. 2012. Effects of high temperature and strong light on photosynthesis,D1 protein,and the Deg1 protease in pear (Pyrus pyrifolia) leaves[J]. Journal of Fruit Science,29(5):794-799.] doi:10.13925/j.cnki. gsxb.2012.05.017.
姜建福,马寅峰,樊秀彩,张颖,孙海生,王利军,刘崇怀. 2017. 196份葡萄属(Vitis L.)种质资源耐热性评价[J]. 植物遗传资源学报,18(1):70-79. [Jiang J F,Ma Y F,Fan X C,Zhang Y,Sun H S,Wang L J,Liu C H. 2017. Evaluation of 196 Vitis L. germplasm resources to heat tolerance[J]. Journal of Plant Genetic Resources,18(1):70-79.] doi:10.13430/j.cnki.jpgr.2017.01.009.
姜燕,黄新根,杨寅桂,周庆红,郑咪,肖旭峰. 2014. 辣椒苗期耐热性及其生理生化特性研究[J]. 长江蔬菜,(12):47-50. [Jiang Y,Huang X G,Yang Y G,Zhou Q H,Zheng M,Xiao X F. 2014. Study on heat tolerance and physiological-biochemical characteristics of hot pepper seedlings[J]. Journal of Changjiang Vegetables,(12):47-50. doi:10.3865/j.issn.1001-3547.2014.12.015.
孔令接,陈言博,王亚琴. 2019. 不同夏菊品种的耐热性研究[J]. 园艺学报,46(12):2437-2448. [Kong L J,Chen Y B,Wang Y Q. 2019. Studies on heat tolerance of different summer chrysanthemum cultivars[J]. Acta Horticulturae Sinica,46(12):2437-2448.] doi:10.16420/j.issn.0513-353x.2019-0145.
李德,孫义,孙有丰. 2015. 淮北平原夏玉米花期高温热害综合气候指标研究[J]. 中国生态农业学报,23(8):1035-1044. [Li D,Sun Y,Sun Y F. 2015. Use of integrated climatic index to determine high temperature damage to summer maize at florescence in the Huaibei Plain[J]. Chinese Journal of Eco-Agriculture,23(8):1035-1044.] doi:10.13930/j.cnki.cjea.150061.
连晓东. 2019. 基于高密度遗传图谱的桃重要性状基因定位及其形成机制研究[D]. 郑州:河南农业大学. [Lian X D. 2019. Based on high-density genetic linkage map,gene mapping and molecular mechanism analysis of important traits in peach (Prunus persica)[D]. Zhengzhou:Henan Agricultural University.]
刘勇,龚林忠,王富荣,王会良,艾小艳,何华平,王泽琼. 2018. 桃流胶病在湖北省发生的影响因子分析[J]. 长江大学学报(自然版),15(22):5-8. [Liu Y,Gong L Z,Wang F R,Wang H L,Ai X Y,He H P,Wang Z Q. 2018. Analysis on the impact factors of peach gummosis occurrence in Hubei Province[J]. Journal of Yangtze University (Natural Science Edition),15(22):5-8.] doi:10.16772/j.cnki. 1673-1409.2018.22.002.
尤超,沈虹,郭世荣,孙锦. 2016. 高温逆境胁迫对油桃生理特征影响的研究[J]. 中国农学通报,32(10):79-84. [You C,Shen H,Guo S R,Sun J. 2016. Physiological characteri-stics of nectarine seedlings under high temperature stress[J]. Chinese Agricultural Science Bulletin,32(10):79-84.] doi:10.11924/j.issn.1000-6850.casb15090001.
Hu S S,Ding Y F,Zhu C. 2020. Sensitivity and responses of chloroplasts to heat stress in plants[J]. Frontiers in Plant Science,11:375. doi:10.3389/fpls.2020.00375.
Lian X D,Zhang H P,Jiang C,Gao F,Yan L,Zheng X B,Cheng J,Wang W,Wang X B,Ye X,Li J D,Zhang L L,Li Z Q,Tan B,Feng J C. 2021. De novo chromosome-level genome of a semi-dwarf cultivar of Prunus persica identifies the aquaporin PpTIP2 as responsible for temperature-sensitive semi-dwarf trait and PpB3-1 for flower type and size[J]. Plant Biotechnology Journal,20(5):886-902. doi:10.1111/pbi.13767.
Liu Y X,Jiang J F,Fan X C,Zhang Y,Wu J Y,Wang L J,Liu C H. 2020. Identification of heat tolerance in Chinese wild grape germplasm resources[J]. Horticulturae,6:68. doi:10.3390/horticulturae6040068.
Perera-Castro A V,Brito P,González-Rodríguez A M. 2018. Changes in thermic limits and acclimation assessment for an alpine plant by chlorophyll fluorescence analysis:Fv/Fm vs. Rfd[J]. Photosynthetica,56:527-536. doi:10.1007/s11099-017-0691-6.
Sheikh S,Behl R H,Dhanda S S,Munjal R. 2010. Membrane thermostability and chlorophyll fluorescence as indices of high temperature stress tolerance and performance in wheat (Triticum aestivum L.)[J]. Cereal Research Communications,38(3):335-334. doi:10.1556/CRC.38.2010.3.4.
Strasser B J. 1997. Donor side capacity of Photosystem II probed by chlorophyll a fluorescence transients[J]. Photosynthesis Research 52:147-155. doi:10.1023/A:10058 96029778.
Venios X,Korkas E,Nisiotou A,Banilas G. 2020. Grapevine responses to heat stress and global warming[J]. Plants,9(12):1754. doi:10.3390/plants9121754.
Wang L,Ma K B,Lu Z G,Ren,S X,Jiang H R,Cui J W,Chen G,Teng N J,Lam H M,Jin B. 2020. Differential physiological,transcriptomic and metabolomic responses of Arabidopsis leaves under prolonged warming and heat shock[J]. BMC Plant Biology,20(1):86. doi:10.1186/s 12870-020-2292-y.
Weng J H,Lai M F. 2005. Estimating heat tolerance among plant species by twochlorophyll fluorescence parameters[J]. Photosynthetica,43(3):439-444. doi:10.1007/s11099- 005-0070-6.
Xu H G,Liu G J,Liu G T,Yan B F,Duan W,Wang L J,Li S H. 2014. Comparison of investigation methodsof heat injury in grapevine(Vitis) and assessment to heat tolerance in different cultivars and species[J]. BMC Plant Biology,14:156-165. doi:10.1186/1471-2229-14-156.
Yamada M,Hidaka T,Fukamachi H. 1996. Heat tolerance in leaves of tropical fruit crops as measured by chlorophyll fluorescence[J]. Scientia Horticulturae,67(1-2):39-48. doi:10.1016/S0304-4238(96)00931-4.
Zhao J G,Lu Z G,Wang L,Jin B. 2020. Plant responses to heat stress:Physiology,transcription,noncoding RNAs,and epigenetics[J]. International Journal of Molecular Sciences,22(1):117. doi:10.3390/ijms22010117.
Zhou Y,Guo D,Li J,Cheng J,Zhou H,Gu C,Gardiner S,Han Y P. 2013. Coordinated regulation of anthocyanin biosynthesis through photorespiration and temperature in peach (Prunus persica f. atropurpurea)[J]. Tree Genetics and Genomes,9:265-278. doi:10.1007/s11295-012-0552-1.
(責任编辑 陈 燕)

