靶向抑制Myc对小鼠LLC全细胞疫苗免疫原性的影响
张学明 王惠 钱冬萌 王斌
(青岛大学基础医学院,山东 青岛 266071)
肺癌是全球最常见的恶性肿瘤之一,患者的发病率和死亡率持续攀升[1]。尽管手术、放疗、化疗等方法可延长患者生存,但副作用和治疗失败的问题仍然存在。肿瘤免疫疗法,尤其是全细胞疫苗研究备受关注[2-3]。通过对患者癌细胞进行体外培养和处理,可制备出保留免疫原性的非活性全癌细胞颗粒疫苗。然而,由于肿瘤细胞对免疫系统的抑制作用,使肿瘤细胞制备的疫苗治疗效果受到影响[4]。
MYC家族由c-MYC、N-MYC和L-MYC组成,其中c-MYC和N-MYC在许多人类肿瘤的发生和发展中扮演关键角色[5]。MYC可以促使肿瘤细胞增殖并抑制免疫细胞浸润[6]。已有研究表明靶向抑制MYC可增强黑色素瘤及神经母细胞瘤的免疫原性,但在肺腺癌(LUAD)领域相关研究尚缺乏[7]。(+)-JQ1以及I-BET151均可以靶向抑制小鼠细胞中c-Myc和N-Myc表达,两者联合使用后,其抑制作用会增强[7-9]。本研究通过数据库分析MYC扩增对人类LUAD细胞免疫原性的影响,同时在小鼠模型中通过给予靶向抑制Myc的小鼠Lewis肺癌(LLC)全细胞疫苗,探索其在激活小鼠免疫系统杀伤LLC细胞方面的效果。
1 材料和方法
1.1 LUAD组织和癌旁正常组织中免疫细胞浸润丰度的比较
获取TCGA数据库中LUAD患者(包含501例LUAD组织样本和54例癌旁正常组织样本)的基因表达矩阵,以LUAD组织中c-MYC和N-MYC表达量的中位数为界,将LUAD患者分为c-MYC高、低表达组以及N-MYC高、低表达组。并采用CIBERSORT R脚本计算LUAD组织和癌旁正常组织中不同免疫细胞的浸润丰度,比较N-MYC高、低表达组之间以及c-MYC高、低表达组之间不同免疫细胞浸润丰度。
1.2 试剂及动物和细胞
(+)-JQ1和I-BET151购自上海陶术生物科技公司。RNA提取试剂盒购自天根生化科技(北京)有限公司,反转录试剂盒购自南京诺唯赞生物科技股份有限公司。肿瘤坏死因子-α(TNF-α)ELISA试剂盒购自上海赛默飞世尔科技(中国)有限公司,干扰素-γ(IFN-γ)ELISA试剂盒购自杭州联科生物技术股份有限公司。6周龄雌性C57BL/6N小鼠45只,体质量17~18 g,购自北京维通利华公司,许可证号:SCXK(京)2021-0006。小鼠LLC细胞系(上海ATCC公司)置于含体积分数为0.10胎牛血清的DMEM培养基、双抗(100 kU/L青霉素和100 mg/L链霉素)混合溶液中,于37 ℃、含体积分数0.05的CO2孵箱中进行培养。
1.3 CCK-8实验确定LLC细胞的最佳紫外线照射时长
将生长状态良好并占据皿底面积大约40%~50%的LLC细胞分为处理组和对照组,置于直径为10 cm的圆形培养皿当中。处理组LLC细胞的DMEM培养基中加入0.4 μmol/L的(+)-JQ1和0.4 μmol/L的I-BET151,对照组LLC细胞置于常规DMEM培养基中,均培养4 d。然后将两组细胞置于光学显微镜下观察细胞的形态;在培养皿中将两组细胞均制备成浓度1×1010/L、高度1 mm的均匀悬液,置于摇床上以50 r/min的速度晃动细胞悬液,同时用波长为254 nm的紫外线对其进行照射,照射时长分别为0、5、10、15、20、25、30 min。在照射LLC细胞不同时长后的第0、12、24小时,使用CCK-8试剂盒检测LLC细胞的吸光度值,以评估LLC细胞的增殖活性。操作严格遵循说明书执行,实验重复3次,结果取均值。
1.4 实时荧光定量PCR(RT-qPCR)检测LLC细胞中Myc和PD-L1 mRNA的表达
将培养4 d的对照组和处理组LLC细胞,用PBS制备成浓度为1×1010/L的均匀细胞悬液,紫外线照射两组LLC细胞15 min后,立即用RNA提取试剂盒提取细胞总RNA,反转录试剂盒反转录合成cDNA,加入含有c-Myc、N-Myc和PD-L1引物的预混液进行RT-qPCR扩增。采用2-△△CT方法计算LLC细胞中目标mRNA的相对表达水平,引物名称及其序列见表1。每次实验设置3个复孔,实验重复3次,结果取均值。

表1 引物名称及其序列
1.5 小鼠肿瘤模型的构建
将培养4 d的对照组和处理组LLC细胞,用PBS制备成浓度为1×1010/L的均匀细胞悬液。紫外线照射两组LLC细胞15 min后,立即与PBS以1∶1混合,得到对照组和处理组的LLC全细胞疫苗,4 ℃下储存。将45只C57BL/6N雌性小鼠随机均分为未免疫组(PBS组)、单纯紫外线疫苗组(Irra组)、紫外线试剂处理疫苗组(Irra处理组),每组15只。所有小鼠第1天于左腋窝皮下接种5×105个LLC细胞,PBS组小鼠第5、12、19天于右侧大腿内侧肌肉注射200 μL PBS,Irra组小鼠第5、12、19天于右侧大腿内侧肌肉注射5×109/L对照LLC全细胞疫苗200 μL,Irra处理组小鼠第5、12、19天于右侧大腿内侧肌肉注射5×109/L处理组LLC全细胞疫苗200 μL。所有小鼠注射完成后均常规饲养。
每组小鼠随机取出5只,隔1 d测量1次体质量,隔2 d测量1次肿瘤体积,均测量至第25天,计算肿瘤体积(V)。V=肿瘤最长径×肿瘤最短径2×0.52。每组小鼠再随机取出5只,以肿瘤直径达到伦理阈值(15~20 mm)时为死亡终点,分别行全麻后脱颈处死。记录小鼠生存期,采用Kaplan-Meier法进行生存分析。
1.6 ELISA方法检测各组小鼠血清中促炎性因子TNF-α和IFN-γ的表达水平
每组小鼠随机取出5只,在接种LLC全细胞疫苗第25天时,麻醉后眼球取血,脱颈处死,解剖分离小鼠的脾脏和肿瘤组织。将小鼠血液样本室温下放置2 h,置于水平离心机上4 ℃下以3 000 r/min离心15 min,收集血清,使用ELISA试剂盒检测血清中TNF-α和IFN-γ水平,测试步骤严格按照试剂盒说明书中的要求进行。
1.7 流式细胞术检测小鼠脾脏以及肿瘤组织中CD3+CD8+/CD3+ T细胞比值
将3组小鼠的脾脏和肿瘤组织研磨后,以200目铜网过滤得到单细胞悬液。将细胞接种于96孔板中,每孔约1×106个细胞,每孔细胞中加入混合抗体(PE anti-mouse CD3、PE anti-mouse CD4、PE anti-mouse CD8),4 ℃下孵育30 min。置于流式细胞仪上进行检测,采用FlowJo软件(版本10.8.1)分析CD3+CD8+/CD3+T细胞比值。
1.8 统计学分析
2 结 果
2.1 LUAD组织和癌旁正常组织中免疫细胞浸润丰度比较
通过TCGA数据库计算LUAD患者的LUAD组织与癌旁正常组织中免疫细胞的浸润丰度,结果显示,与癌旁正常组织相比,LUAD组织内CD8+T细胞、CD4+记忆T细胞、NK细胞及M0巨噬细胞的浸润丰度显著性降低(W=9 276~20 086,P<0.05),调节性T细胞(Tregs)的浸润丰度显著升高(W=18 672,P<0.05);相较于N-MYC低表达组,N-MYC高表达组的激活CD4+记忆T细胞与激活NK细胞的浸润丰度显著降低(W=28 233、27 990,P<0.05),Tregs细胞的浸润丰度显著性升高(W=36 074,P<0.05);c-MYC高、低表达组之间比较,免疫细胞的浸润丰度均无显著差异(P>0.05)。
2.2 LLC细胞的最佳紫外线照射时长
光学显微镜下观察发现,与对照组相比,处理组LLC细胞的数量明显减少,细胞聚集程度明显降低(图1)。重复测量方差分析显示,测量时点、照射时长及两者的交互作用对细胞的吸光度值均有显著影响(F=5.51~188.97,P<0.05)。单独效应分析显示,在相同测量时点下,各组LLC细胞在照射时长为0、5、10、15 min时的吸光度值比较,差异均有显著性(P<0.05)。在相同测量时点下,各组LLC细胞在照射时长为15、20、25、30 min时的吸光度值比较,差异均无显著性(P>0.05);在相同的照射时长下,即15、20、25、30 min,各组LLC细胞在第0、12、24小时时的吸光度值比较,差异均无显著性(P>0.05),见图2。因此在经过紫外线照射15 min的后第0小时时,两组LLC细胞均失去了活性,故后续采用紫外线照射15 min后第0小时的LLC细胞制备LLC全细胞疫苗。

A:对照组,B:处理组,200倍

A:对照组,B:处理组
2.3 Myc与PD-L1 mRNA在对照组和处理组中的表达差异
RT-qPCR结果显示,与对照组相比较,处理组LLC细胞c-Myc、N-Myc、PD-L1 mRNA相对表达水平显著降低(t=6.26~13.51,P<0.05),见表2。

表2 两组LLC细胞的c-Myc、N-Myc、PD-L1 mRNA相对表达水平比较
2.4 小鼠模型中体质量、肿瘤体积和生存期的分析
各组小鼠在接种LLC全细胞疫苗4~5 d后,左侧腋窝处均出现肿瘤肿块。重复测量方差分析结果显示,测量时间对小鼠体质量具有显著影响(F=288.08,P<0.05),而分组和分组与测量时间交互作用对小鼠的体质量均无显著影响(P>0.05);单独效应分析显示,同一个测量时点,3组小鼠的体质量比较无显著差异(P>0.05)。见图3A。分组、测量时间以及两者交互作用对小鼠的肿瘤体积均有显著性影响(F=2.32~908.04,P<0.05);单独效应分析显示,在接种LLC细胞后第19、22、25天时,Irra组小鼠肿瘤体积均显著小于PBS组,Irra处理组小鼠肿瘤体积均显著小于Irra组(P<0.05),见图3B。

A、B、C分别为各组小鼠体质量、肿瘤体积和生存期比较
Kaplan-Meier法分析各组小鼠的生存率,经过Log-rank检验,3组小鼠的生存曲线比较差异有显著性(χ2=20.60,P<0.05),其中Irra组优于PBS组,Irra处理组优于Irra组(P<0.05),见图3C。
2.5 各组小鼠血清TNF-α和IFN-γ表达水平比较
PBS组、Irra组和Irra处理组小鼠血清TNF-α的表达水平分别为(5.81±0.47)、(9.76±1.01)、(19.82±1.09)ng/L,PBS组、Irra组和Irra处理组小鼠血清IFN-γ表达水平分别为(19.54±2.44)、(35.84±1.75)、(75.31±4.83)ng/L。3组小鼠血清中TNF-α和IFN-γ的表达水平比较均有显著差异(F=320.70、381.10,P<0.05),其中Irra组两个指标均显著高于PBS组,Irra处理组均显著高于Irra组(P<0.05)。
2.6 各组小鼠脾脏和肿瘤内CD3+CD8+/CD3+ T细胞比值比较
PBS组、Irra组和Irra处理组小鼠脾脏组织中CD3+CD8+/CD3+T细胞比值分别为0.12±0.02、0.16±0.01、0.22±0.02,3组小鼠肿瘤组织中分别为0.13±0.01、0.21±0.02、0.30±0.01。3组小鼠脾脏和肿瘤中CD3+CD8+/CD3+T细胞比值比较均有显著统计意义(F=54.83、143.70,P<0.05),其中Irra组脾脏和肿瘤组织中CD3+CD8+/CD3+T细胞比值均显著高于PBS组,Irra处理组均显著高于Irra组(P<0.05)。见图4。
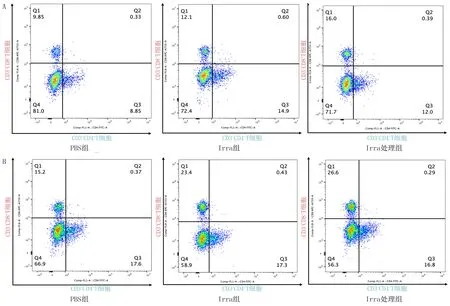
A:小鼠脾脏组织,B:小鼠肿瘤组织
3 讨 论
肺癌是全球最常见的恶性肿瘤之一,其发病和死亡率不断上升。传统治疗方法,如手术、放疗和化疗,受到副作用和治疗失败的严重制约。近年来,肿瘤全细胞疫苗因其保留肿瘤细胞所有抗原逐渐受到关注。然而,由于对免疫系统的抑制作用,全细胞疫苗的治疗效果仍然受到很大限制。因此,寻找一种简单有效的方法以提高肿瘤全细胞疫苗的免疫原性变得尤为重要。
已有的研究显示,抑制致癌基因MYC可以提高黑色素瘤和神经母细胞瘤的免疫原性。然而,在LUAD领域,相关研究仍然缺乏。本研究对LUAD细胞及其MYC扩增表达在肿瘤微环境(TME)中对免疫细胞的影响进行了探讨。首先,本研究对比分析了TCGA数据库中的LUAD组织样本和癌旁组织样本间免疫细胞浸润差异。研究发现,LUAD组织中CD8+T细胞、CD4+记忆T细胞、NK细胞和M0巨噬细胞的浸润丰度显著性降低,而激活Tregs细胞的浸润丰度显著提高。在这些免疫细胞中,CD8+T细胞和NK细胞具有直接杀死肿瘤的能力,而CD4+记忆T细胞参与长期免疫应答,并且协助其他免疫细胞(如CD8+T细胞)发挥抗肿瘤作用[10-13]。然而,在TME中,Tregs细胞通常对肿瘤的增长和扩散具有促进作用[14]。这些研究结果表明,LUAD细胞能有效地抑制TME中的免疫细胞对其进行的攻击和持续免疫反应。其次,本研究又进一步在LUAD组织c-MYC高、低表达样本以及N-MYC高、低表达样本间进行比较,发现c-MYC高、低表达样本间免疫细胞浸润丰度无差异,而在N-MYC高表达样本中,CD4+记忆T细胞和激活NK细胞浸润丰度显著降低,Tregs细胞浸润丰度显著提高。这表明N-MYC基因的过度表达可能会进一步加强LUAD细胞抵抗TME中免疫细胞的攻击和持久免疫响应能力。
鉴于上述N-MYC在TME中的影响,将MYC视为提高LUAD全细胞疫苗免疫原性的潜在靶点具有重要的研究意义。为了对人类LUAD免疫治疗提供参考,本研究在小鼠LLC细胞和小鼠模型中进行了相关全细胞疫苗的实验研究。
(+)-JQ1和I-BET151是两种重要的Myc抑制剂,它们联合使用会对Myc的抑制作用增强。本研究结果显示,(+)-JQ1和I-BET151与LLC细胞共培育4 d后,LLC细胞中c-Myc和N-Myc的表达量显著下降,并且PD-L1的表达量也显著下降。PD-L1蛋白位于细胞表面,通过与其受体PD-1结合,可以抑制免疫细胞的活性,从而阻止其对肿瘤细胞的攻击。研究表明,约30%~50%的LUAD患者肿瘤细胞中可以检测到PD-L1的过度表达[15-16]。这表明(+)-JQ1和I-BET151通过靶向抑制Myc使LLC细胞中PD-L1的表达量显著下降,从而减轻LLC细胞对TME的抑制作用。
目前,制备肿瘤全细胞疫苗的手段主要包括热灭活和辐射灭活(如使用紫外线、伽马射线或X射线等辐射源处理肿瘤细胞)[17]。热灭活法因温度控制困难导致肿瘤抗原蛋白变性受到限制,而γ或X射线辐射方法受设备沉重、昂贵的影响,也限制了其广泛应用。尽管紫外线设备轻便且廉价,但透射性差限制了其使用。本研究通过设定1×1010/L细胞悬液浓度、1 mm高度并在摇床上以50 r/min摇晃,并进行15 min的紫外线照射后,成功制备出LLC全细胞疫苗。采用这种方法制备的全细胞疫苗能够最大限度地保留LLC细胞表面的肿瘤抗原及其免疫原性。
然后,本研究在小鼠模型中评估了针对Myc靶向抑制的LLC全细胞疫苗抵抗LLC的效果。相比接种无抑制剂处理的LLC全细胞疫苗,接种抑制剂处理的LLC全细胞疫苗可以使小鼠肿瘤增长明显减缓,生存期也得到显著提高。并且,接种抑制剂处理的LLC疫苗后小鼠脾脏和肿瘤内CD3+CD8+/CD3+T细胞比值以及血清TNF-α、IFN-γ表达水平均有显著提高。CD3+CD8+T细胞是细胞毒性T淋巴细胞(CTLs)的主要成分,在免疫监视过程中起到关键作用。CD3+CD8+T细胞能够识别肿瘤细胞表面的特异性抗原并结合,激活CTLs,进而释放细胞毒性分子如穿孔素和颗粒酶B,导致肿瘤细胞的凋亡[18]。此外,CD3+CD8+T细胞还能分泌细胞因子如TNF-α和IFN-γ,进一步增强免疫系统对肿瘤的攻击能力[19]。TNF-α和IFN-γ由免疫系统的细胞(如巨噬细胞、树突状细胞、NK细胞等)分泌产生,通过直接杀伤肿瘤细胞、抑制肿瘤细胞生长、抗血管生成以及调节免疫细胞活性等作用共同促使免疫系统对肿瘤细胞的清除。这些研究结果均表明,通过抑制Myc,能够显著增强LLC全细胞疫苗对免疫系统的激活作用,进而提升免疫系统对肿瘤细胞的杀伤能力。
综上所述,本研究成功制备了针对Myc靶向抑制的LLC全细胞疫苗。在小鼠模型中,接种这种LLC全细胞疫苗可以增强免疫系统对LLC的攻击能力,从而显著减缓肿瘤的生长速度,延长小鼠的生存期。这一发现为应用全细胞疫苗治疗人LUAD提供了数据参考。
伦理批准和知情同意:本研究涉及的所有动物实验均已通过青岛大学实验动物福利伦理委员会的审核批准(文件号20220405C5718-202206097)。所有实验过程均遵照《实验动物管理条例》规定进行。
作者声明:所有作者参与了研究设计及论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。

