FGF2对矿化诱导下STAT3介导的hDPSCs成牙分化作用研究*
王晔,于淼,魏朝,张丞,马永平
龋齿或牙髓炎造成的牙体或牙髓组织不可逆性损伤和坏死是临床上常见的牙齿疾病,因此,牙体或牙髓组织再生在口腔领域一直是研究热点。人牙髓干细胞(humen dental pulp stem cells,hDPSCs)具有自我更新和多向分化潜能的特点,且来源广、获取方便,因此在牙组织再生方面的应用受到全球学者的广泛关注[1]。Chen 等[2]研究发现,hDPSCs 来源的外泌体通过功能性愈合促进牙髓再生,在再生牙髓中具有潜在应用价值。富血小板纤维蛋白通过激活BMP2/Smads 信号通路可促进hDPSCs 成骨分化[3]。硅酸二钙可促进hDPSCs 增殖和成骨向分化能力[4]。成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)具有多种生理活性,有报道称,将编码FGF-2 的纳米复合材料与hDPSCs 共培养,可增强hDPSCs 的增殖活性和矿化特性[5]。Novais A 等[6]研究表明FGF2培养的hDPSCs 植入颅面骨缺损部位可促进颅面骨修复。信号转导子与激活子3(signal transducer and activator of transcription 3,STAT3)是一种核转录因子,在细胞增殖、分化和凋亡过程中具有重要作用[7],研究发现,抑瘤素M 激活STAT3 诱导hDPSCs 成骨分化,抑制STAT3 后阻断分化过程[8]。本实验通过抑制STAT3,探讨FGF2 对hDPSCs 成牙本质分化的影响。
1 材料和方法
1.1 材料
1.1.1 细胞系 原代人牙髓干细胞(humen dental pulp stem cells,hDPSCs)株购自美国ATCC 公司,货号:YS-ATCC813,来源于人的正常牙组织。
1.1.2 试剂和仪器 STAT3 抑制剂Stattic( 19983-44- 9,Cayman Chemical,美国);碱性磷酸酶(alkaline phosphatase,ALP)试剂盒( A059-2-2,南京建成);CCK-8 试剂盒( C0038,上海碧云天生物技术有限公司);牙本质基质蛋白1(dentin matrix protein 1,DMP-1)和牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)引物序列(广州锐博生物有限公司);PCR 逆转录试剂盒(RP1200-100,北京索莱宝科技有限公司);DMEM 培养基和胎牛血清( 12634010,16000-044,Gibco 公司,美国);兔抗人FGF2、p-STAT3、STAT3 抗体(ab208687,ab267373,ab68153,Abcam 公司,美国);茜素红和辣根过氧化物酶标记的山羊抗兔IgG(130-22-3,11-11-11,Sigm 公司,美国)。
荧光定量PCR 系统(QuantStudio,赛默飞世尔科技,德国);多功能酶标仪(iMark 0601,上海伯乐生命医学产品有限公司);恒温恒湿培养箱(AW100,上海铂温仪器有限公司);垂直电泳仪( 165-8001,Bio-Rad 公司,美国)。
1.2 方法
1.2.1 流式细胞术 检测hDPSCs 表面标志物hDPSCs 进行常规培养并传代,0.25%胰蛋白酶消化第3 代hDPSCs,4℃ 3000 r/min 离心10 min,去上清,收集细胞。预冷PBS 漂洗细胞,调整细胞浓度为5×105个/mL,取100 μL 单细胞悬液于无菌EP 管中,加入FITC 标记的CD29、CD44、CD45、CD90、CD34 和CD31 抗体 4℃避光孵育30 min,流式细胞仪检测细胞表面标志物表达情况。
1.2.2 CCK-8 检测不同浓度FGF2 对hDPSCs 活力的影响 将hDPSCs 以3.0×103个/孔的密度接种于96 孔板,置于37℃、5% CO2培养箱中培养。细胞贴壁生长后,换用含不同浓度(0、5、10、15、20、25 和30 ng/mL)的FGF2 培养基培养细胞,每个浓度设置5 个复孔,培养至1、5、7 和14 d 时,取出培养板,每孔加入10 μL CCK-8 工作液,37℃孵育4 h,置于酶标仪上测定450 nm 波长处吸光度(OD 值),计算细胞活力。细胞活力(%)=(实验组OD 值/空白对照组OD 值)×100%。
1.2.3 实验分组及细胞活性检测 将hDPSCs 以3.0×103个/孔的密度接种于96 孔板,置于37℃、5% CO2培养箱中培养。细胞贴壁生长后随机分为对照组(仅用矿化诱导液培养)、FGF2 组(含20 ng/mLFGF2 矿化诱导液培养)、Stattic 组(含4 μM Stattic 的矿化诱导液处理30 min,Stattic 溶于DMSO)、FGF2+Stattic 组(含4 μM Stattic 的矿化诱导液处理30 min 后,再换用含20 ng/mL FGF2 的矿化诱导液培养,Stattic 溶于DMSO),矿化诱导液含10% FBS 的DMEM 培养基、1×10-8mol/L 地塞米松、50 μg/mL维生素和10 mmol/L β-甘油磷酸钠)。参照1.2.2 的实验方法检测细胞活性。
1.2.4 qRT-PCR 检测DMP-1 和DSPP mRNA 相对表达量 将hDPSCs 以6.0×104个/孔的密度接种于6孔板,置于37℃、5% CO2培养箱中培养,细胞贴壁生长后按照1.5 中的方法进行处理,培养至14 d时,3000 r/min 离心10 min,收集细胞。Trizol 试剂提取细胞中总RNA,根据逆转录试剂盒说明书将RNA 逆转录成cDNA,进行PCR 反应,预变性温度:95 ℃反应30 s,进行1个循环;循环反应温度:95℃ 5 s、60℃ 30 s,72℃ 45 s,进行40 个循环,以2-△△CT 法计算DMP-1 和DSPP mRNA 相对表达量。引物序列见表1。
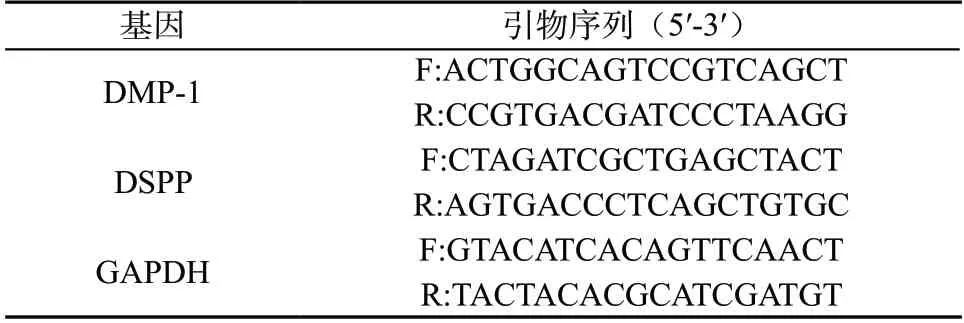
表1 引物序列
1.2.5 ALP 活性检测及ALP 染色 将hDPSCs 以6.0×104个/孔的密度接种于6 孔板,置于37 ℃、5%CO2培养箱中培养,细胞贴壁生长后按照1.5 中的方法进行处理,培养至14 d 时,3000 r/min 离心10 min,收集细胞。
ALP 活性检测:预冷PBS 清洗,加入RIPA 裂解液,裂解10 min,4℃ 1000 r/min 离心5 min,收集上清液。取5 μL 蛋白样品或标准品加入到0.9 mmol/L 的2- 氨基-2 甲基-1 丙醇(AMP)缓冲液中,再加入25 μL 磷酸对硝基苯酯中,充分混匀,37℃恒温孵育30 min,置于酶标仪上,设定波长405 nm,测定吸光度(A)值,ALP 活性以每毫克总蛋白生成1 mol/L 磷酸硝基苯进行量化。
ALP 染色:预冷PBS 清洗,4%多聚甲醛固定20 min,双蒸水清洗2 次,每孔加入300 μL ALP染液染色15 min,双蒸水清洗直至无染液残留,光学显微镜下观察并拍照。
1.2.6 茜素红染色 将hDPSCs 以6.0×104个/孔的密度接种于6 孔板,置于37℃、5% CO2培养箱
中培养,细胞贴壁生长后按照1.6 中的方法进行处理。培养至14 d 时,3000 r/min 离心10 min,收集细胞,蒸馏水清洗3 次,4%多聚甲醛室温固定15 min,1%茜素红(PH 4.2)染色15 min,蒸馏水多次清洗直至把茜素红染液冲洗干净,显微镜下观察并拍照。
1.2.7 蛋白印迹法检测细胞中FGF2 和p-STAT3蛋白相对表达量 将hDPSCs 以6.0×104个/孔的密度接种于6 孔板,置于37℃、5% CO2 培养箱中培养,细胞贴壁生长后按照1.6 中的方法进行处理。培养至14 d 时,收集各组细胞,裂解,4℃12000 r/min 离心10 min,收集上清液。BCA 法测定蛋白浓度,煮沸变性。12% SDS-PAGE 电泳,将蛋白湿转至PVDF 膜上,5%胎牛血清室温封闭,兔抗人FGF2、p-STAT3、STAT3、GAPDH 一抗(1:1000)4℃孵育过夜,辣根过氧化物酶标记的山羊抗兔二抗(1:5000)室温孵育2 h,ECL 发光液显色,Image J 软件分析蛋白条带灰度值,目的蛋白条带灰度值/GAPDH 蛋白条带灰度值为目的蛋白相对表达量。
1.3 统计学分析 采用SPSS21.0 统计学软件分析数据,计量资料均以(±s)描述,多样本计量资料比较采用单因素方差分析,进一步两两比较采用LSD-t 检验,P <0.05 为差异有统计学意义。
2 结 果
2.1 hDPSCs 表面标志物鉴定结果 流式细胞术检测结果显示:CD90、CD44 和CD29 呈高表达,阳性率分别为97.46、98.53%、98.28%,而CD31、CD34 和CD45 呈低表达,阳性率分别为0.21%、0.22%、0.28%。见图1。
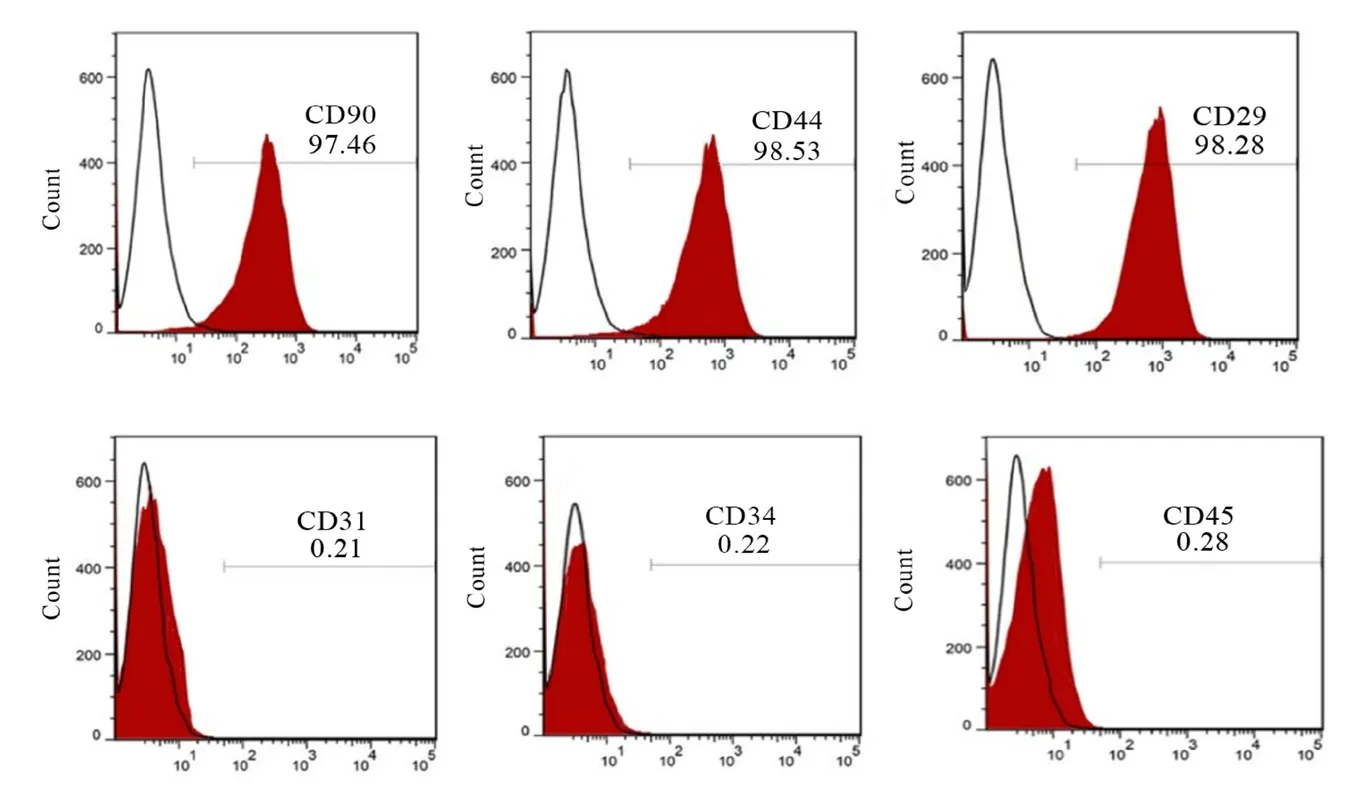
图1 流式细胞术鉴定hDPSCs 表面标志物
2.2 不同浓度FGF2 对hDPSCs 增殖活性的影响 与0 ng/mL 比较,细胞活力在FGF2 5、10、15、20、25 和30 ng/mL 各个时间点均增强,且具有浓度依赖性,从20 ng/mL 以后细胞活力呈下降趋势,因此选择FGF2 浓度为20 ng/mL用于后续实验。见表2。
表2 不同浓度FGF2 对hDPSCs 活力的影响(±s,n=5)
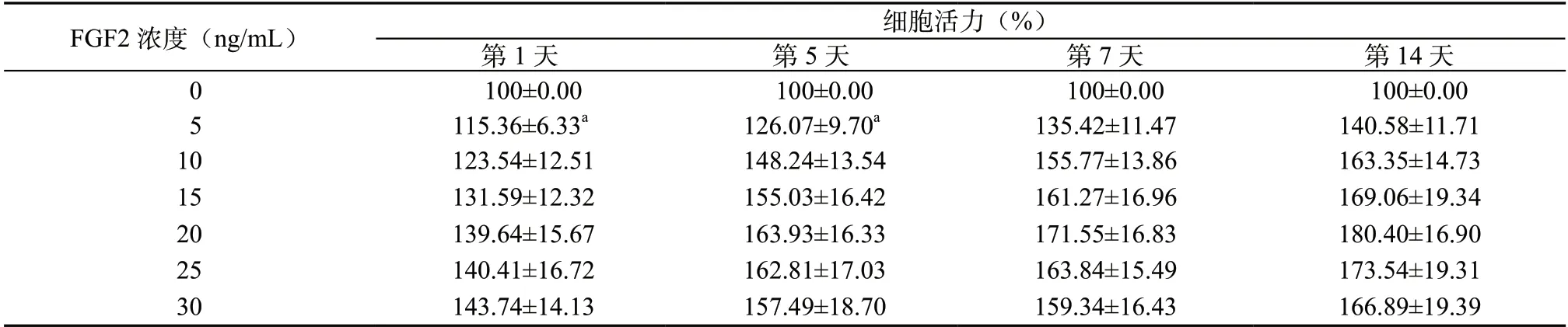
表2 不同浓度FGF2 对hDPSCs 活力的影响(±s,n=5)
注:与0 ng/mL 比较,aP <0.05。
FGF2 浓度(ng/mL)细胞活力(%)第1 天第5 天第7 天第14 天100±0.00 100±0.00 100±0.00 100±0.00 5 115.36±6.33a126.07±9.70a135.42±11.47140.58±11.71 0 10 123.54±12.51 148.24±13.54155.77±13.86163.35±14.73 15 131.59±12.32 155.03±16.42 161.27±16.96169.06±19.34 20 139.64±15.67 163.93±16.33171.55±16.83180.40±16.90 25 140.41±16.72 162.81±17.03163.84±15.49173.54±19.31 30 143.74±14.13 157.49±18.70159.34±16.43166.89±19.39
2.3 CCK-8 检测结果 与对照组比较,FGF2 组细胞活力在各个时间点均增强,Stattic 组细胞活力在各个时间点均减弱(P <0.05);与FGF2 组比较,FGF2+Stattic 组细胞活力在各个时间点均减弱(P<0.05);与Stattic 组比较,FGF2+Stattic 组细胞活力在各个时间点均增强(P <0.05)。见表3,图2。
图2 第14 天细胞生长情况
表3 FGF2 对hDPSCs 活力的影响(±s,n=5)

表3 FGF2 对hDPSCs 活力的影响(±s,n=5)
注:与对照组比较,aP <0.05;与FGF2 组比较,bP <0.05;与Stattic 组比较,cP <0.05;
组别细胞活力(%)第1 天第5 天第7 天第14 天对照组 100±0.00 100±0.00 100±0.00 100±0.00 FGF2 组122.67±10.06 144.53±11.18a173.99±9.35 a194.97±11.67 a Stattic 组84.90±5.25 70.63±5.35a 55.67±7.06 a41.65±6.06 a FGF2+Stattic 组111.75±10.37127.82±6.54bc 141.80±10.95 bc 163.89±12.75 bc
2.4 qRT-PCR 检测结果 DMP-1、DSPP mRNA 相对表达量组间比较,差异有统计学意义(P <0.05)。与对照组比较,FGF2 组DMP-1 和DSPP mRNA 相对表达量升高,Stattic 组DMP-1 和DSPP mRNA相对表达量降低(P <0.05);与FGF2 组比较,FGF2+Stattic 组DMP-1 和DSPP mRNA 相对表达量降低(P <0.05);与Stattic 组比较,FGF2+Stattic 组DMP-1 和DSPP mRNA 相对表达量升高(P <0.05)。见表4。
表4 FGF2 对hDPSCs 中DSPP、DMP-1 mRNA 相对表达量的影响(±s,n=5)
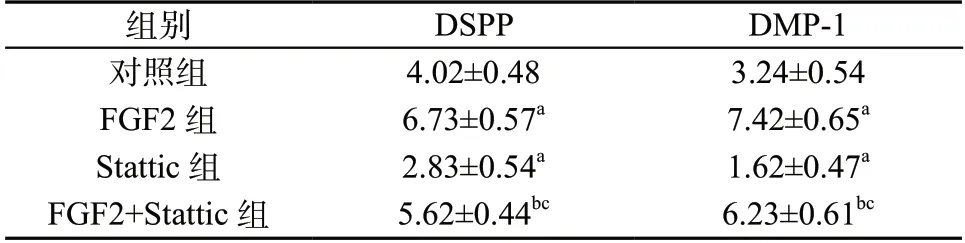
表4 FGF2 对hDPSCs 中DSPP、DMP-1 mRNA 相对表达量的影响(±s,n=5)
注:与对照组比较,aP <0.05;与FGF2 组比较,bP <0.05;与Stattic 组比较,cP <0.05;
组别DSPPDMP-1对照组4.02±0.483.24±0.54 FGF2 组6.73±0.57a7.42±0.65a Stattic 组2.83±0.54a1.62±0.47a FGF2+Stattic 组5.62±0.44bc6.23±0.61bc
2.5 ALP 活性和染色结果 ALP 活性组间比较,差异有统计学意义(P <0.05)。与对照组比较,FGF2 组ALP 活性升高,Stattic 组ALP 活性降低(P <0.05);与FGF2 组比较,FGF2+Stattic组ALP 活性降低(P <0.05);与Stattic 组比较,FGF2+Stattic 组ALP 活性升高(P <0.05)。见表5,图3。
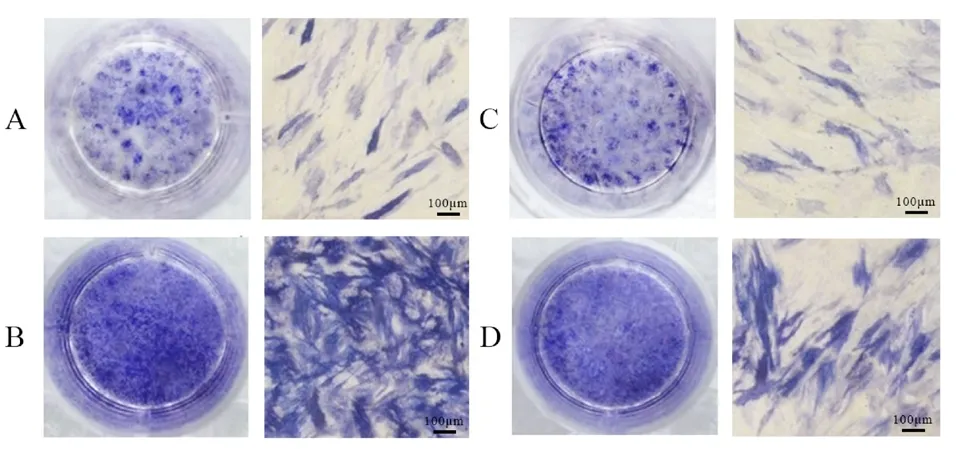
图3 ALP 染色 ×40
表5 FGF2 对hDPSCs 中ALP 活性的影响(±s,n=5)
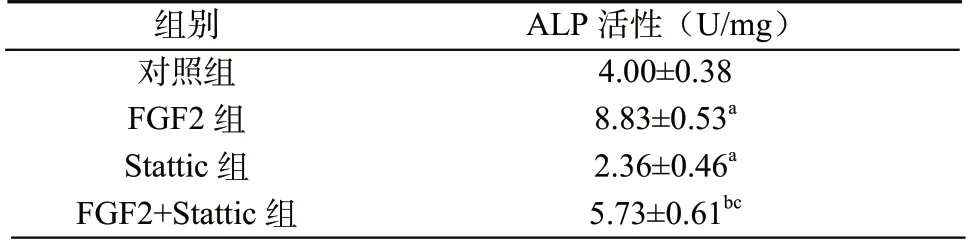
表5 FGF2 对hDPSCs 中ALP 活性的影响(±s,n=5)
注:与对照组比较,aP <0.05;与FGF2 组比较,bP <0.05;与Stattic 组比较,cP <0.05;
组别ALP 活性(U/mg)对照组4.00±0.38 FGF2 组8.83±0.53a Stattic 组2.36±0.46a FGF2+Stattic 组5.73±0.61bc
2.6 茜素红染色结果 FGF2 组染色较对照组加深,矿化结节增多;Stattic 组染色较FGF2 组减淡,矿化结节减少;FGF2 组染色较FGF2+Stattic组加深;Stattic 组染色较FGF2+Stattic 组减淡。见图4。
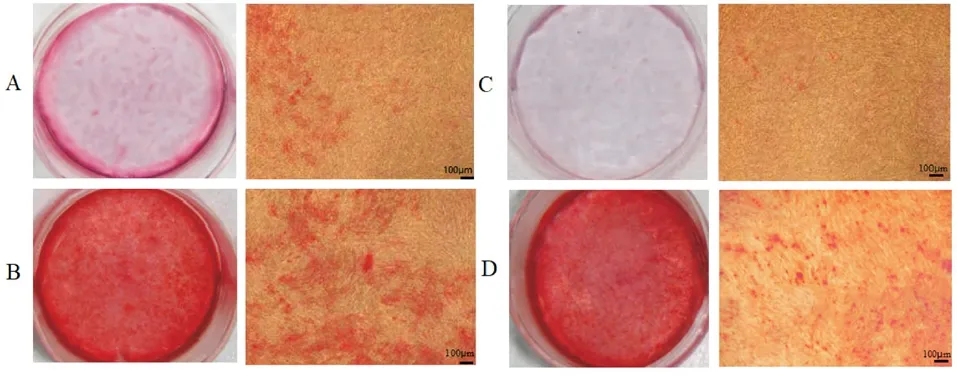
图4 茜素红染色 ×40
2.7 蛋白印迹法检测结果 FGF2、p-STAT3、DMP-1 和DSPP 蛋白相对表达量组间比较,差异有统计学意义(P <0.05)。与对照组比较,FGF2 组FGF2、p-STAT3、DMP-1 和DSPP 蛋白相对表达量升高,Stattic 组FGF2、p-STAT3、DMP-1 和DSPP 蛋白相对表达量降低(P <0.05);与FGF2 组比较,FGF2+Stattic 组FGF2、p-STAT3、DMP-1 和DSPP 蛋白相对表达量降低(P <0.05);与Stattic 组比较,FGF2+Stattic 组FGF2、p-STAT3、DMP-1 和DSPP 蛋白相对表达量升高(P <0.05)。见表6,图5。
表6 FGF2 对hDPSCs 中FGF2、p-STAT3、DMP-1 和DSPP 蛋白相对表达量的影响(±s,n=5)
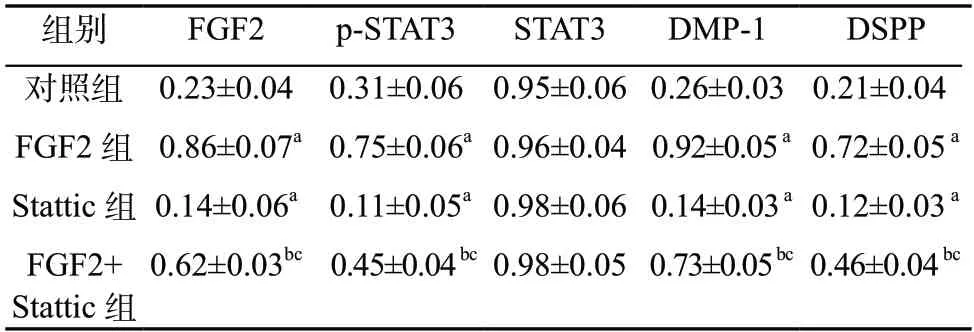
表6 FGF2 对hDPSCs 中FGF2、p-STAT3、DMP-1 和DSPP 蛋白相对表达量的影响(±s,n=5)
注:与对照组比较,aP <0.05;与FGF2 组比较,bP <0.05;与Stattic 组比较,cP <0.05;
组别FGF2p-STAT3STAT3DMP-1DSPP对照组 0.23±0.04 0.31±0.06 0.95±0.06 0.26±0.03 0.21±0.04 FGF2 组 0.86±0.07a 0.75±0.06a 0.96±0.04 0.92±0.05 a 0.72±0.05 a Stattic 组0.14±0.06a 0.11±0.05a 0.98±0.06 0.14±0.03 a 0.12±0.03 a FGF2+Stattic 组0.62±0.03bc 0.45±0.04 bc 0.98±0.05 0.73±0.05 bc 0.46±0.04 bc
3 讨 论
龋病是在以细菌为主的多种因素影响下,牙体组织发生的一种慢性进行性破坏疾病,发生龋病时,细菌通过牙本质小管侵害牙髓组织,发展成牙髓炎甚至根尖周炎[9]。临床上常通过去除炎症牙髓或无机材料填充的方式治疗由牙髓创伤或感染造成的牙髓炎或根尖周炎,但传统治疗方法根管治疗法存在一定弊端,去除牙髓后由于血运丧失及免疫系统破坏,牙齿脆性增强,抗压性能下降,根折风险增加[10]。近几年,有学者提出再生牙髓治疗法,即通过再生因子、干细胞等实现牙髓牙本质样组织再生。hDPSCs 具备间充质干细胞特性,具有高度可塑性和多向分化潜能,在一定刺激因子作用下可分化为成牙本质细胞,形成修复性牙本质,隔断牙本质小管阻断外界刺激,从而保护牙髓组织[11]。因此,深入了解hDPSCs 牙本质分化再生机制,找到发挥作用的关键因子对治疗牙髓炎或根尖周炎至关重要。
FGF2 具有多种生物学功能。体外研究证明,FGF2 可促进间充质干细胞增殖、软骨分化以及成骨分化,在骨组织再生方面发挥重要作用[12-13]。壳聚糖纳米颗粒共转染BMP2 和FGF2 可增强人脂肪源性基质细胞的成骨能力[14]。体内研究表明,FGF2 可促进兔桡骨骨缺损修复[15]。Yuan等[16-17]研究发现在牙齿发育过程中,细胞纤毛内转运蛋白可促进细胞增殖、分化和极化,该蛋白缺失的hDPSCs 中,FGF2/FGFR1 信号通路被阻断,hDPSCs 牙本质分化过程被抑制。根据以上研究结果,我们推测FGF2 在调节骨再生和成骨分化过程中具有重要作用,但是对于FGF2 在hDPSCs 成牙分化过程中的作用知之甚少,本研究通过含不同浓度的FGF2 培养基培养hDPSCs,发现hDPSCs 活力随FGF2 浓度的增大而升高,且具有时间和浓度依赖性。说明FGF2 可促进hDPSCs增殖活性。之后选用FGF2 20 ng/mL 进行后续实验。ALP 是一种水解酶,通过促进钙和无机质结晶沉积形成钙化参与牙齿、骨骼等矿化组织的形成,随着细胞分化程度增高,细胞外基质和矿化越多,ALP 活性越高。牙本质是由成熟的牙本质细胞分泌的细胞外基质矿化形成的,细胞外基质包括DMP1、DSPP、骨钙素等。本实验结果显示,含FGF2 20 ng/mL 的培养基培养hDPSCs 14 d 后,ALP 活性增强、DMP1 和DSPP 表达增多、矿化结节明显,以上结果提示:FGF2 促进hDPSCs 成牙分化过程。
STAT 是一种细胞质转移因子,被激活发生磷酸化后,2 个STAT 的SH2 结构域相互作用发生二聚化,可将信号由细胞表面传递至细胞核内,在细胞增殖、分化和凋亡中发挥重要调控作用,同时参与炎症反应。体内外实验均表明,STAT3 缺失造成股骨骨密度、骨强度以及骨形成率降低,骨矿物质含量减少,成骨细胞增殖率降低[18]。STAT3 激活可促进成骨细胞分化和骨形成[19],Yang 等[20]研究发现STAT3 可调节破骨细胞稳定和分化。但是,STAT3 是否在hDPSCs 成牙分化过程中发挥作用鲜有报道,因此本研究通过STAT3 抑制剂Stattic 阻断该信号通路,发现hDPSCs 增殖能力降低,DMP-1 和DSPP 表达降低,ALP 活性减弱,细胞矿化能力减弱,说明阻断STAT3 后,hDPSCs 成牙本质分化能力减弱。而Stattic 对hDPSCs 预处理后,再用含FGF2 的培养液处理,则可使hDPSCs 增殖能力升高,DMP-1和DSPP 表达升高,ALP 活性增强,细胞矿化能力增强,说明FGF2 可削弱STAT3 抑制剂Stattic的作用,增强hDPSCs 成牙本质分化能力。
综上所述,FGF2 可促进hDPSCs 成牙分化,其可能是通过激活STAT3 通路发挥调控作用,为临床治疗龋齿或牙周炎等疾病提供理论依据。

