方酸菁光敏剂在肿瘤光热治疗领域的应用
李蕙芳,韦思平,唐薪杰,罗宇驰,唐盈盈,李晓昀,黎荣祝 综述 杨琳 审校
西南医科大学 药学院(泸州 646000)
癌症是影响全人类生命健康的重大危险因素之一[1-3]。目前,癌症的临床治疗手段主要包括手术切除、化学药物治疗、放射治疗以及联合治疗等,但这些方法存在复发率高、正常组织器官功能受损、副作用严重等缺点[1,4-5]。因此,研究人员开发了一批新兴的癌症治疗手段,如光动力学治疗(photodynamic therapy,PDT)、光热治疗(photothermal therapy,PTT)、免疫治疗、基因治疗以及多种模式联合治疗等[1,6-8]。其中,光热治疗由于具有高选择性、非侵入性、低损伤性等优点受到了人们广泛的关注[1,2,9-13]。
1 光热治疗
1.1 光热治疗的作用机制
光热治疗是利用光热剂(又称光敏剂)在光照条件下吸收光能并将其转化为热能后对肿瘤细胞或组织造成热损伤和热消融来杀死肿瘤细胞的一种治疗方法[1,14]。光热治疗的作用机制是光敏剂在特定波长的激发光照射下其电子从基态(S0)跃迁到最低单线态激发态(S1),电子可以通过发射光子(即荧光)、非辐射弛豫、系间窜越跃迁到三重态激发态(T1)等途径从S1失活回到S0,其中非辐射弛豫失活途径往往可以将光能转化为热能(图1),从而使肿瘤局部环境温度升高,诱导肿瘤细胞的凋亡或坏死,达到治疗肿瘤的目的[14-15]。PTT 过程需要激发光源和光敏剂,而且激发光源波长的选用往往取决于光敏剂的最大吸收波长,因此,光敏剂是决定PTT效果的关键因素之一[11]。

图1 光敏剂的PTT机理图Figure 1 PTT mechanism diagram of photosensitizer
1.2 光热治疗光敏剂
理想的PTT光敏剂需要满足以下条件[14,16-18]:①在近红外(near infrared,NIR)区域具有强烈的吸收,因为NIR 区域波长的光比可见光具有更深的组织穿透深度、更高的时间和空间分辨率、更低的生物组织背景干扰;②高效的光热转化效率;③在无光照时低毒性,在光照条件下选择性地杀死肿瘤细胞;④良好的生物相容性及生物降解性;⑤良好的光稳定性;⑥结构易于修饰等。
PTT 光敏剂包括无机材料和有机材料两大类。无机光敏剂主要包括金纳米颗粒、碳纳米颗粒、氧化物纳米颗粒、黑磷、量子点等[12,19-21],有机光敏剂主要包括卟啉类、酞菁类、硼-二吡咯甲烷(BODIPY)、花菁类、方酸菁、共轭聚合物等[1,12,22-24]。无机光敏剂在体内通常具有不可生物降解和长时间蓄积产生毒性等缺点,相比之下,有机光敏剂具有确定的化学结构、丰富可调的结构与性能、良好的生物相容性、低毒性、容易代谢等优点,已被证明在PTT 临床应用方面具有极大潜力[12,20,22]。但是,有机光敏剂分子通常缺乏水溶性和肿瘤靶向性,因此往往将有机光敏剂分子包封、吸附或共价连接到胶束、脂质体以及蛋白质上制成纳米颗粒(nanoparticles,NPs),并通过纳米颗粒的EPR 效应(enhanced permeability and retention effect)来增强其肿瘤靶向性[5,12,25-26]。目前文献中已报道了较多的有机光敏剂,其中只有一例花菁类的吲哚菁绿(ICG)光敏剂已被美国FDA 批准可用于临床诊断成像,由于它也具有良好的光热转换效率,因此也可用于光热治疗[1,14]。但是ICG 稳定性较差,本身缺乏靶向性,易被机体清除,限制了其在光热治疗临床上的应用[1,14]。因此,开发寻找理想的PTT光敏剂为推进光热治疗的临床实际应用具有重要意义。
2 方酸菁光热治疗光敏剂
2.1 方酸菁染料
方酸菁(squaraine,见图2)是一类由两个相同或不同的富电子给电单元(donor,D 或D')和一个强吸电子的方酸核单元(acceptor,A)缩合形成的D-A-D 型共轭有机分子,具有共振稳定的两性离子结构[27-28]。大多数方酸菁在可见及近红外区有强烈吸收和发射,其摩尔消光系数(ε)高达105L/mol·cm;其次,方酸菁还具有易聚集、合成路线简单、光/热稳定性好、结构修饰性强等优点[29-33]。因此,方酸菁染料被广泛应用于光动力治疗、生物成像、生物标记、荧光探针、有机发光二极管、有机敏化太阳能电池、有机太阳能电池等领域[27,31-32,34-35]。近年来随着光热治疗的发展,方酸菁染料作为PTT 光敏剂的应用也渐渐得到了研究人员的关注。
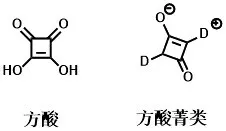
图2 方酸、方酸菁染料的化学结构Figure 2 Chemical structures of squaric acid and squaraine dyes
2.2 方酸菁光敏剂的构建
目前文献中报道的方酸菁PTT 光敏剂有十余例,主要通过选择不同的D单元、修饰方酸核吸电子单元、调节分子聚集状态等方式来构建,它们的化学结构式如图3 所示[16,36-43]。通过选择不同D 单元如吲哚衍生物(SQ1-6)[16,37,40,43]、三苯胺(SQ4、SQ5)[16]、苯并噻唑衍生物(SQ7)[38]、吡咯衍生物(SQ8、SQ9)[39,42]、薁衍生物(SQ10、SQ11)[36]、喹啉衍生物(SQ12)[41]等来构建的光敏剂的最大吸收和发射波长都位于近红外区,其中SQ3、SQ6、SQ8、SQ9 的吸收和发射波长甚至红移至近红外二区,这有利于增强激发光源和荧光的组织穿透深度,从而达到深层成像和深层肿瘤治疗的目的。在方酸核吸电子单元上引入二氰基乙烯基单元可获得具有更长吸收和发射波长、更高荧光量子效率、更高化学稳定性的光敏剂(SQ1、SQ3)[40,43];在方酸核吸电子单元上连接亲水PEG 链可获得两亲性方酸菁(SQ6),提高光敏剂的水溶性与生物相容性[37];在方酸核吸电子单元上通过二硫键连接上Cy7 可获得具有PDT/PTT 协同治疗的光敏剂(Cy7-SQ7)[38]。方酸菁染料在水溶液中容易聚集形成H-聚集体和/或J-聚集体,这两种聚集形态赋予了方酸菁染料不同的光物理和光化学性质,对这两种聚集形态进行调控可有效调节其光热治疗性能[30,44-48]。SQ8 与两亲性共聚物F-127(PEG-b-PEGb-PEG)通过不同的共沉降法进行自组装可得到J-聚集的纳米颗粒SQ8-NPs(J)和H-聚集的纳米颗粒SQ8-NPs(H),其中SQ8-NPs(J)的最大发射波长在1 100 nm左右,其发射强度是SQ8-NPs(H)的4.8倍,荧光成像深度可达8 mm[42]。SQ6在水溶液中通过自组装形成具有H-二聚体亚结构的均匀纳米球SQ6-NPs,其光热转化效率高达81.3%[37],高于绝大多数808 nm 激发的光热剂,并与同等条件下的最高光热转化效率88.3%相媲美[49]。
3 方酸菁光敏剂在光热治疗领域的应用
3.1 方酸菁光敏剂用于肿瘤光热治疗
方酸菁染料在上世纪末作为第二代光敏剂已被广泛应用于光动力治疗[27,34,50],而随着光热治疗的发展,方酸菁染料也逐渐被用作光热光敏剂,获得了良好的肿瘤光热治疗效果。2014 年,国家纳米科学技术中心王浩研究员、德国维尔茨堡大学WÜRTHNER教授和中国科学院高能物理研究所李敬源研究员等合成了方酸菁光敏剂SQ1,将SQ1 与牛血清白蛋白(bovine serum albumin,BSA)、叶酸(folic acid,FA)结合获得了高稳定性和生物相容性、叶酸靶向的SQ1-BSA-FA,并首次将其应用于肿瘤光热治疗领域[43]。体外细胞实验发现KB细胞与SQ1-BSA或SQ1-BSA-FA共孵育12 h后,不用激光照射处理时,细胞存活率大于90%;用激光照射处理后(680 nm,20 W/cm2,10 min),细胞存活率分别降低至63%和42%。KB 细胞异种移植裸鼠经尾部分别注射SQ1-BSA(200 μL,300 mg/mL)和SQ1-BSA-FA(200 μL,300 mg/mL),4 h后用激光光源照射肿瘤部位(680 nm,20 W/cm2,30 min),每隔两天重复注射并用激光照射治疗,治疗16 d后,SQ1-BSA组和SQ1-BSA-FA组的肿瘤抑制率分别达到32%和78%。体外细胞实验和体内实验都表明SQ1-BSA-FA能够靶向肿瘤细胞及肿瘤部位,并表现出良好的成像和光热治疗效果。
2018 年,南京邮电大学范曲立教授等合成了第二例方酸菁光敏剂SQ8,将它与两亲性的共聚物F-127通过共沉降法获得J-聚集的纳米颗粒SQ8-NPs(J),其最大发射波长在1 100 nm 左右,荧光成像深度可达8 mm[42]。SQ8-NPs(J)的去离子水溶液(100 μg/mL)在光源照射下(810 nm,1.5 W/cm2,6 min)温度从24°C上升至67 °C,光热转换效率为36%。体外细胞实验发现MCF-7 乳腺癌细胞与SQ8-NPs(J)(100 μg/mL)孵育4 h 后细胞存活率为92%,当进行光照处理后(808 nm,0.8 W/cm2,10 min),细胞存活率仅为27%。MCF-7 荷瘤裸鼠通过静脉注射SQ8-NPs(J)(100 μL,2.0 mg/mL),24 h 后用光源照射肿瘤部位(808 nm,0.8 W/cm2,10 min),肿瘤部位的温度升高了48°C,同时光热治疗实验表明SQ8-NPs(J)具有良好的NIR-II 成像和肿瘤抑制效果,且具有很高的生物安全性。2020年,范曲立教授团队基于SQ8的化学结构获得了一例共轭聚合物光敏剂SQ9,并将疏水性的SQ9包裹进两亲性的DSPEPEG5000-NH2壳中获得水溶性的纳米粒子SQ9-NPs,SQ9-NPs再与DBCO-NHS反应获得表面具有反应性炔基的SQ9-NPs-DBCD[39]。SQ9-NPs 在1 064 nm 处具有强吸收,并在1 064 nm 激光激发后出现NIR-II 发射峰(1 290 nm),其NIR-II 荧光信号极大地提高了体内的成像质量。SQ9-NPs-DBCD 的水溶液(125 μg/mL)在1 064 nm 激光照射下(1 W/cm2,5 min)温度从20°C 上升至86.5 °C,光热转换效率为33.4%;同等条件下用808 nm激光照射的光热转换效率仅为15.8%。动物实验表明,结合生物正交标记技术,SQ9-NPs-DBCD可在肿瘤组织中大量积累,并具有良好的成像信号背景比以及肿瘤NIR-II光热治疗效率。
2020 年,华东理工大学赵春常教授和复旦大学古险峰教授等合成了两例不对称方酸菁光敏剂SQ4 和SQ5,其最大吸收波长都处在近红外区域[16]。SQ4 和SQ5 通过纳米沉降的方法制备得到的有机纳米颗粒SQ4-NPs和SQ5-NPs表现出良好的生物相容性和水分散性。SQ4-NPs 和SQ5-NPs 水溶液(30 μM)在光源照射下(785 nm 激光,2.24 W/cm2,10 min)的光热转换效率分别为10.3%和16.2%,并且表现出明显的光声信号。体外细胞实验表明SQ5-NPs 即使在较高浓度时(30 μM)对HepG2 细胞的暗毒性仍然较低,相比之下经过785 nm 光源照射后,SQ5-NPs 表现出高的细胞毒性。细胞成像实验也表明经过SQ5-NPs 和785 nm 光源的照射处理后,HepG2 细胞表现出明显的光热消融情况,细胞死亡率高。这表明新型的SQ5-NPs 光热光敏剂具有良好的肿瘤治疗前景。
同年,上海交通大学医学院汪登斌教授和同济大学医学院张兵波研究员等合成了方酸菁SQ2,在SQ2的方酸核上引入二氰基乙烯基单元获得方酸菁光敏剂SQ3(图3),成功将其最大吸收波长和发射波长调谐至NIR-II 区,分别为930 nm 和970 nm[40]。SQ3 通过与DSPE-PEG2000 和DSPE-PEG2000-Mal 在水中共沉淀后经半胱氨酸共价连接靶向基团肽CREKA 获得光热诊疗SQ3 纳米探针,其在血管造影和肿瘤成像中显示出优异的NIR-II成像性能。该纳米探针的磷酸盐缓冲溶液(PBS,1 mg/mL)在激光光源照射下(915 nm,0.5 W/cm2,5 min)温度从29.3°C 上升至70.5°C,光热转换效率为25.6%。在MDA-MB-231乳腺癌荷瘤小鼠模型上通过静脉注射SQ3纳米探针,12 h后进行激光治疗,小鼠肿瘤部位的温度从33.2°C上升至59.1°C,而注射PBS的对照组温度则无明显变化。体内光热治疗实验表明MDA-MB-231 乳腺癌荷瘤小鼠在注射SQ3 纳米探针(5 mg/kg)后进行NIR 激光治疗,其肿瘤生长速度明显慢于对照组,表现出良好的光热治疗效果。而且,SQ3 及其纳米探针在连续激光照射下比花菁染料ICG(FDA 批准的造影剂)表现出更好的光稳定性,说明方酸菁光敏剂具有很大的临床应用潜力。
2022 年,南昌大学王红明教授等在SQ2 的结构中引入亲水锚PEG链获得了具有NIR吸收的两亲性方酸菁光敏剂SQ6[37]。SQ6 在水溶液中通过自组装形成具有H-二聚体亚结构的均匀纳米球SQ6-NPs。重组能计算表明SQ6H-二聚体的低频面外振动模式加速了电子的非辐射衰减过程,使得激发态能量能快速转变为热能。因此,SQ6-NPs 的水溶液(80 μM)在808 nm激光(0.3 W/cm2,4 min)照射下温度可达96.1°C,光热转化效率高达81.3%。B16F10 黑色素瘤细胞与SQ6-NPs 在无光照条件下共孵育,即使SQ6-NPs 的浓度高达100 μM也未引发明显的细胞毒性,但用808 nm(0.3 W/cm2)激光照射5 min后,细胞存活率随着SQ6-NPs浓度的增加而显著下降,说明SQ6-NPs 对肿瘤细胞有明显的光毒性。在黑色素瘤荷瘤小鼠模型上通过尾部静脉注射SQ6-NPs(10 mg/kg),24 h 后经808 nm(0.3 W/cm2)激光照射7 min,肿瘤部位的温度快速升至53.8°C,而注射生理盐水的对照组温度仅升至36.1 °C。注射SQ6-NPs 的荷瘤小鼠经激光治疗22 h,其肿瘤体积比对照组有明显的减小,而小鼠体重有所增加。体内和体外的光热治疗实验表明SQ6-NPs 具有良好的水溶性、生理稳定性和生物相容性,以及有效的肿瘤积累和肿瘤抑制作用。
同年,中国科学院上海有机化学研究所高希珂研究员、南京医科大学徐华娥教授和南开大学史洋老师等制备获得了两例方酸菁光敏剂SQ10 和SQ11[36]。SQ10 和SQ11 分别与DSPE-PEG2000 通过纳米沉降的方法制备得到纳米颗粒SQ10-NPs和SQ11-NPs。在相同激光照射条件下(808 nm,0.8 W/cm2,5 min),SQ11-NPs、SQ10-NPs 和ICG 水溶液(100 μM)的温度分别上升约66°C、52°C 和53°C。SQ11-NPs 和SQ10-NPs 的光热转化效率分别为53.2%和47.3%。SQ11-NPs 或SQ10-NPs 与各种肿瘤细胞共孵育的实验结果表明SQ11-NPs和SQ10-NPs在无光照条件下表现出良好的生物安全性,而在激光照射后则对肿瘤细胞表现出高效的光消融效果,而且SQ11-NPs组的光热效果明显好于SQ10-NPs组。体内实验表明,在4T1荷瘤小鼠体内注射SQ11-NPs(200 μL,500 μg/mL),6 h后用激光照射肿瘤部位(808 nm,0.8 W/cm2,5 min),肿瘤部位温度在2 min 内升至65°C,而注射生理盐水的对照组温度仅升高约3°C。同时,小鼠体内注射SQ11-NPs并经过光照治疗后,肿瘤生长速度明显变慢,经光照治疗8 d 后显示出良好的抗肿瘤疗效。
3.2 方酸菁光敏剂用于多模态肿瘤诊疗体系
传统的光热治疗和光动力治疗在肿瘤治疗领域取得了重大突破,但单一的疗法因存在内在缺陷而疗效仍然有限。单模态光动力治疗的治疗效果往往受制于肿瘤微环境的乏氧特性[51],而单模态PTT 的治疗效果则受制于热休克蛋白(heat shock proteins,HSP)介导的耐热性[10]。因此,多模态协同肿瘤治疗方法可以通过不同的治疗机理提供互补的肿瘤治疗方式,从而有效提高肿瘤治疗效果[38,41,52]。
2019 年,印度CSIR-国家交叉科学技术研究所MAITI 等合成了方酸菁光敏剂SQ12,并同达卡巴嗪(DAC)、生物源金纳米团簇(BSA-AuNC)包覆的金纳米棒(BSA-AuNC@AuNR)和黑色素瘤靶向的抗DR5单克隆抗体构建了一种协同光热、光动力和化学疗法的新型黑色素瘤多功能诊疗体系[41]。其中,SQ12 的结构中含有碘原子,具有重原子效应,因此表现出良好的单线态氧生成能力,在体系中用作光动力治疗的光敏剂;BSA-AuNC@AuNR 在体系中用作光热治疗的光敏剂;DAC为达卡巴嗪,用作黑色素瘤的化学治疗药物;DR5为抗DR5 单克隆抗体,在体系中用作靶向基团。细胞实验和动物实验表明该体系具有良好的稳定性、光热转换效率、表面增强拉曼散射(SERS)增强效率和生物相容性。
2021 年,西北农林科技大学孙世国教授和大连理工大学刘凤玉副教授等将光热剂Cy7 与方酸菁染料SQ7通过二硫键共价连接合成了化合物Cy7-SQ7[38],以提高Cy7和SQ7的光稳定性和热稳定性。随后,他们将BSA 作为药物输送载体,格尔德霉素(GM)作为HSP-90 抑制剂和抗癌剂,与Cy7-SQ7 一起通过自组装形成纳米粒子BSA/Cy7-SQ7/GM-NPs。BSA/Cy7-SQ7/GMNPs将Cy7-SQ7和GM选择性地递送至肿瘤细胞后,肿瘤微环境中的高浓度谷胱甘肽可断裂二硫键释放出Cy7 和SQ7,赋予其光动力治疗和PTT 性能;同时,GM可以抑制Hsp-90,降低PTT过程中肿瘤的耐热性,而且可以抑制PDT过程中抗凋亡蛋白抑制剂生存素的过表达,从而实现了NIR照射下HSP-90调节的PDT/PTT/化学多模式肿瘤联合治疗。
4 小结
方酸菁染料在光热肿瘤诊疗领域具有广阔的前景。首先,方酸菁染料在近红外区域具有强吸收和发射,通过选择优异的给电子单元、修饰吸电子单元等可将其吸收和发射调谐至近红外二区,可有效地增强激发光源和荧光的组织穿透深度,从而达到治疗深层肿瘤的目的。其次,方酸菁染料容易聚集形成H-聚集体和/或J-聚集体,这两种聚集形态赋予了方酸菁染料不同的光物理和光化学性质,对这两种聚集形态进行调控可有效调节其光热治疗性能。但是,方酸菁染料本身的水溶性较差,因此往往在方酸菁结构上修饰亲水性基团或将方酸菁封装于BSA或两亲性聚合物中以提高其生物相容性。最后,方酸菁染料可以与其他光敏剂、成像试剂、化学治疗药物等相结合构建多模态成像引导的癌症联合治疗体系,可有效改善单一模态成像及治疗所存在的缺陷。

