生物酶预处理对桐木脱色的影响*
李书磊 张 红 李一博 袁洁莹 谢非凡 王寒星 楚 杰 余瑞金
(1. 西北农林科技大学化学与药学院 杨凌 712100;2. 临沂市检验检测中心 临沂 276699;3. 西北农林科技大学林学院 杨凌 712100)
我国是世界上唯一拥有最完整的泡桐属(Paulownia)植物种群的国家,每年泡桐木材产量超过1 000 万m3;桐木作为重要的工业用材,广泛用于室内建筑装修及家具和工业建筑等行业,每年约有200 万m3桐木制品出口日本、韩国等国家,桐木的生产利用已得到越来越多国家的青睐(常德龙等,2018)。然而在实际生产中,泡桐易变色的问题会使材色品质降低,开展桐木漂白研究对提升桐木附加值及提高桐木品质具有重要意义。
漂白预处理是木材材色改良的有效途径之一,当前木质材料漂白主要采用化学试剂法和物理蒸煮法(曹惠敏等,2020;陆弘毅等,2021)。Shi 等(2018)利用酸和碱水溶液对木材进行热处理,结果表明,随着温度升高,样品亮度值降低,化学结构发生变化,半纤维素和木质素有所降解;Wu 等(2019)研究发现,过氧化氢漂白可以保持木质细胞的微观结构;也有学者应用不同条件水热处理进行木材漂白(刘志佳等,2009)。这些传统漂白预处理方法为提高木材漂白效果及优化木材漂白工艺提供了一定基础,但目前采用的漂白预处理试剂多为含氯漂白剂,其使用中会产生二噁英化合物,从而造成环境毒性污染(许开绍等,2002)。张润青等(2020)采用臭氧对非木质纤维进行漂白和改性,该方法虽污染小但存在漂白成本高且工艺复杂等问题。为了进一步获得绿色高效的木质原料漂白效果,国内外学者在原料脱色机理方面也相继开展研究。有学者认为,泡桐木材变色是多因素共同作用的结果,pH 是影响梓醇变色的主要因素,光照和氧气同时作用可导致泡桐素和芝麻素变色(常德龙等,2018);木质素内的羰基结构有助于增加热处理过程中的木材色度值,色度值受C—O 基团影响(曹惠敏等,2020);且显示与木质素的O/C 比相反的趋势(Zhanget al.,2018)。这些研究为桐木变色机理分析奠定了一定基础,但对试剂脱色处理相关机理探索还有待进一步深入,尤其对绿色低碳预处理条件下不同脱色方法的研究还较为罕见。
生物酶因绿色、温和、高效的特点,被认为是一种具有较大发展前景的漂白方法。生物酶漂白主要通过降解材料中残留的木质素或增强纸浆的可漂性,减少纸浆漂白过程中的氯用量,从而减少漂白对环境的污染(卢庆华等,2013;冯严严,2014;潘梦丽等,2015;李峰等,2018)。当前,采用生物酶预处理体系对桐木材料进行漂白还鲜见报道。鉴于此,本研究以兰考泡桐(Paulownia elongata)为研究对象,探讨二代生物复合酶对桐木的漂白效果和影响规律,获得生物复合酶漂白桐木的最佳工艺参数,初步探明生物复合酶漂白桐木的机理,以期为桐木脱色和生物学改良及桐木制浆的发展提供理论基础和科学依据。
1 材料与方法
1.1 试验材料与仪器
兰考泡桐样品由国家林业和草原局泡桐研究中心提供。样品洗净、干燥,切成5.0 cm×5.0 cm×0.5 cm小块,烘干,装入密封袋并标记名称、日期等置于阴凉干燥处。
所用生物复合酶酶种为CTEC2,来源Novozymes,酶活147 FPU·mL-1;柠檬酸、碳酸钙、溴化钾、氢氧化钠等,均为分析纯。
所用仪器包括水浴锅、电子天平、真空泵、干燥箱、离心机、紫外可见分光光度计、振荡器、粉碎机、高压灭菌锅等;葡萄糖、木糖含量使用高效液相色谱(high performance liquid chromatography,HPLC)检测。
1.2 预处理样品制备
配制5 FPU·mL-1酶溶液,用柠檬酸和氢氧化钠调节pH。每块样品质量约15 g,料液比1∶10。木块经绝干处理后置于试管中,加入已配制好的酶溶液摇匀,抽真空。水浴锅温度分别设30、50 和70 ℃。试管放入水浴锅加热,每15 min 摇匀1 次,直至分别反应60、75、90 和105 min 后取出试管,抽滤。抽滤后用蒸馏水冲洗,置于玻璃培养皿内,烘至绝干后装入密封袋中。同时,设置1 组未经预处理的平行试验。
1.3 颜色测定
采用杭州彩谱科技有限公司生产的CS-820 可见光分光测色仪,照明光源为脉冲氙灯,测量波长范围400~700 nm,波长间隔10 nm,反射测量D/8 结构,操作温度15~32 ℃,相对湿度不超过80%,反射测量孔径为1.5 cm 的中孔径。每块样品由边缘向中心测量3个点,结果取平均值。
采用CIELab 表色系统,使用分光测色仪测量泡桐木材样品表面预处理前后的明度L*、红绿轴色品指数a*和黄蓝轴色品指数b*。用脱色处理前后参数差值表示各参数变化,即ΔL*、Δa*、Δb*和色差ΔE*,计算公式如下:
式中:下标t 表示脱色处理后;下标u 表示脱色处理前。
1.4 主要化学组成测定
1.4.1 抽提物含量 滤纸折叠包好装入的原料,置于索氏抽提器内,量取200 mL 乙醇倒入索氏抽提器。水浴锅95 ℃抽提16 h,直至抽提管中液体完全无色、透明。取出滤纸包置于通风橱中至乙醇挥发完全,再将其放入烘箱内60 ℃烘至绝干后称重,计算抽提物含量。
1.4.2 纤维素、半纤维素含量 参照美国国家可再生能源实验室(national renewable energy laboratory,NREL)方法测定样品三大素含量。首先称取0.3 g 预处理样品(未处理原料用苯醇进行索式抽提,以除去树脂、色素等)于100 mL 旋盖烧口瓶中,加入 3 mL 72% H2SO4,混合均匀后置于30±3 ℃水浴中保温1 h,每隔10 min 搅拌摇匀1 次;然后向瓶中加入84 mL 蒸馏水(稀释H2SO4溶液质量分数至4%),拧紧瓶盖置于高压灭菌锅内,121 ℃下水解1 h。水解完成后,利用已称重的G3 砂芯漏斗进行真空抽滤,分离残渣和水解液,一部分水解液用于测定酸溶木质素含量;另一部分水解液用碳酸钙中和至中性,采用高效液相色谱(HPLC)HITACHI L-2000 分析其葡萄糖和木糖含量。分析柱为Bio-Rad Aminex HPX-87P,长×直径为300 mm×7.8 mm,保护柱为Cation-H Refill Cartridges,长×直径为30 mm×4.6 mm,检测器为RID 示差折光检测器。进样量20 µL,流动相0.005 mmol·L-1H2SO4,流速0.5 mL·min-1,柱温45 ℃。检测结果为水解液单糖含量,六碳糖乘以0.9、五碳糖乘以0.88 即可换算出样品纤维素和半纤维素含量。
1.4.3 木质素含量 预热紫外可见分光光度计20 min 后,开始稀释滤液(稀释后总体积1 mL 左右),摇匀,倒入溶液中,测定吸光度,显示吸光度0.7~1.0范围内即为可行。采用该方法测定并记录所有收集的滤液,按下式计算酸溶木质素(acid-soluble lignin,ASL)含量:
式中:N为稀释倍数;A为紫外吸收值;V为滤液吸收总体积(0.087 L);15 为吸收系数(L·g-1cm-1);W为酸解前样品绝干质量。
水解后残渣用热蒸馏水多次洗涤抽滤,直至10%BaCl2检测滤液无白色沉淀生成后,置于事先用3%H2SO4浸泡润洗、干燥并称重的定量滤纸上。恒温干燥箱内105 ℃烘至恒重,称重,总质重扣除定量滤纸的质量即为酸不溶木质素质量。
1.4.4 脱色率 采用分光光度法测定吸附前后溶液的吸光度。根据标准曲线方程计算染料质量分数,按下式计算脱色率:
式中:c0为处理前桐木溶液吸光度测定值;c为处理后桐木溶液吸光度测定值。
1.5 样品热重分析
热重分析(thermo gravimetric analysis,TGA)/微分热重(derivative thermo gravimetry,DTG)采用TGA/DSC3型热重同步分析仪进行。样品粉碎,过80 目筛,随机称取2 mg 进行分析。热解温度800 ℃,升温速率20 ℃·min-1,同时加入20 mL·min-1流量氮气。
1.6 电镜扫描
采用TM4000 Plus 台式扫描电镜,电子束能量为15 kV。样品粉碎,过80 目筛,使用导电胶粘取少量粉末固定在观察台上进行扫描,观察预处理后样品纤维微观形态变化。
1.7 X 射线衍射
采用X 射线衍射(D8 ADVANCE A25)测定样品纤维素结晶度,探究不同预处理条件对样品结晶的影响。样品粉碎,过200 目筛,称取10 mg 进行测量。操作电压40 kV,电流40 mA,扫描角度2θ 范围5°~50°,铜靶。
2 结果与分析
2.1 预处理前后桐木颜色变化分析
未处理泡桐木材颜色参数为L*=60.70、a*=3.73、b*=16.60,预处理后颜色参数变化如表1 所示。可以看出,与未处理相比,生物酶预处理后的泡桐木材明度L*、红绿轴色品指数a*、黄蓝轴色品指数b*均有所提高,表明生物酶预处理可有效提高白度。由温度分析可知,50 ℃预处理条件下样品明度L*最大,红绿轴色品指数a*和黄蓝轴色品指数b*随温度升高而降低。在pH 变化条件下,红绿轴色品指数a*和黄蓝轴色品指数b*随pH 升高而降低,当pH 为7 时,样品明度L*最大。随着预处理时间延长,样品明度L*越来越高,红绿轴色品指数a*和黄蓝轴色品指数b*越来越低。考虑到明度L*是色差的主要影响因素,故在温度50 ℃、pH 7、预处理时间105 min 条件下泡桐木材脱色效果最佳。
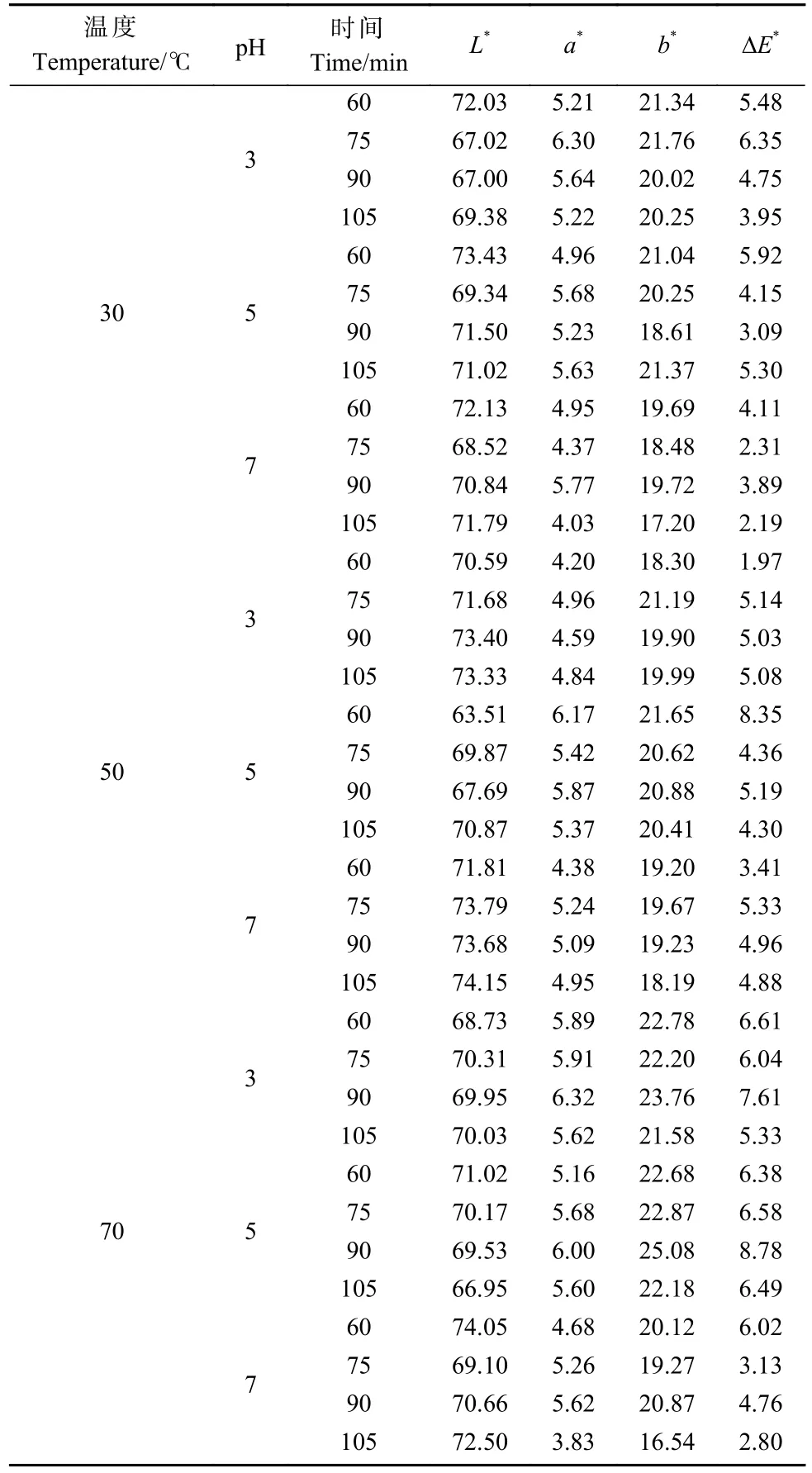
表1 预处理后脱色桐木的颜色参数Tab. 1 Color parameters of decolorization of paulownia after pretreatment
2.2 预处理前后桐木主要化学组分变化分析
由图1 可知,经生物复合酶预处理,泡桐木材主要化学组分均发生较明显变化,纤维素相对含量有所增加,半纤维素、木质素和抽提物含量有所降低。在温度50 ℃、pH 为7 的条件下,主要化学组分相对含量变化最大,其中纤维素含量由49.11%增至59.87%,半纤维素含量由18.58%降至7.45%,酸溶木质素含量由7.12%降至4.07%,酸不溶木质素含量由24.64%降至20.42%,抽提物含量由3.24%降至2.09%。从pH分析可知,pH 为7 时泡桐木材主要化学组分相对含量变化最大,其次是pH 为5,pH 为3 时泡桐木材主要化学组分相对含量变化最小,原因在于pH 降低导致CTEC2 生物酶活性降低,从而引起其作用效果下降(Patelet al.,2019);半纤维素、木质素等结构复杂,比纤维素更易发生酸性水解(Pathaniaet al.,2016)。从温度条件可知, 50 ℃预处理条件下泡桐木材主要化学组分相对含量变化最大,其次是30 ℃,70 ℃时泡桐木材主要化学组分相对含量变化最小,这可能是因为预处理温度50 ℃时CTEC2 生物酶活性最好,作用效率最高(Patelet al.,2019);而与30 ℃相比,70 ℃对酶活性影响更大,导致酶活性更低,进而降低酶对组分的作用效果。
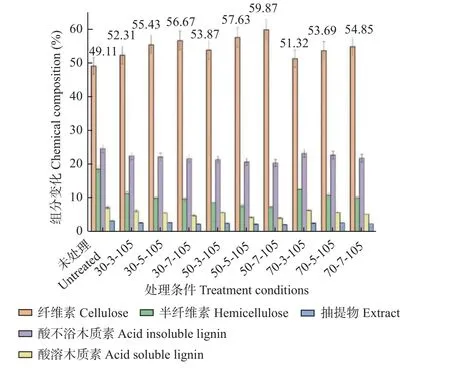
图1 生物复合酶预处理桐木主要化学组分变化情况Fig. 1 Main chemical components of paulownia under the condition of biological complex enzyme pretreatment
2.3 预处理前后桐木脱色率变化分析
由图2 可知,在温度50 ℃、pH 为3 的条件下,桐木脱色率最低,仅21.8%;在温度30 ℃、pH 为7 的条件下,桐木脱色率达68.8%。50 ℃预处理条件下,pH由3 到7,桐木脱色率由21.8%升至49.9%;70 ℃预处理条件下,桐木脱色率变化幅度很小,基本保持不变。针对以上结果,有学者认为桐木变色与抽提物有关,抽提物中酚类物质是引起变色的重要原因(常德龙等,2018);也有学者认为主要是糖或有机酸在变色中起作用(祖勃荪等,1998),此外还有花苷类(邱乾栋等,2013);常德龙等(2006)指出,在真菌引起变色的泡桐木材中,半纤维素发生明显降解,半纤维素含量发生变化导致桐木脱色。本研究提出的预处理前后桐木脱色率变化与前人观点基本一致。
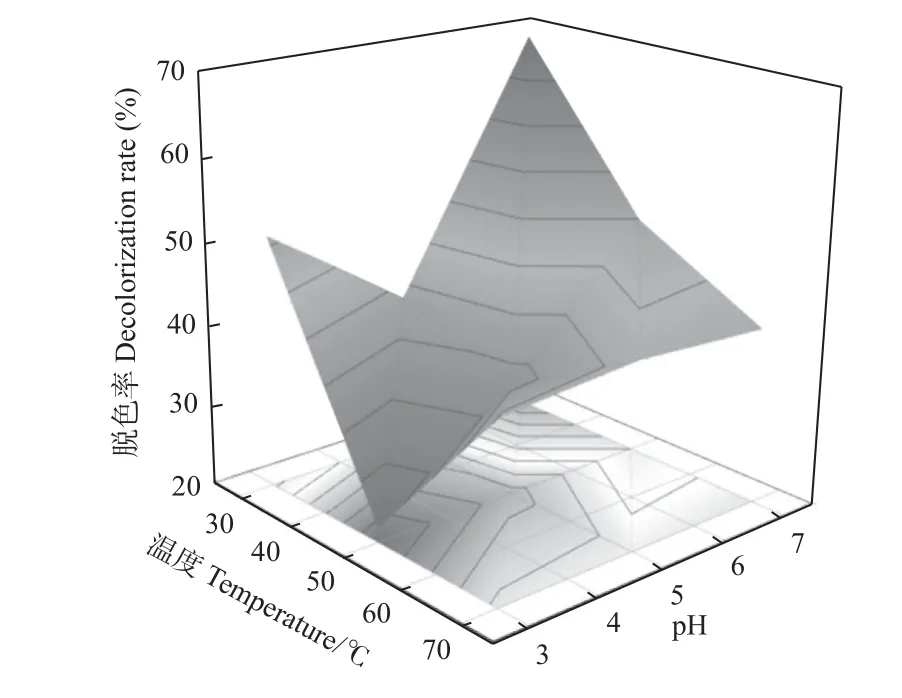
图2 温度和pH 对桐木脱色率的交互作用Fig. 2 Interaction of temperature and pH value on decolorization rate for paulownia of enzyme pretreatment
2.4 预处理前后桐木热重变化分析
不同温度和pH 预处理桐木的TGA 和DTG 曲线如图3、4 所示,所有样品的TGA 曲线变化趋势基本一致,除温度70 ℃和pH 为7 条件下样品的热稳定性变化不明显外,其他样品热稳定性均有所提升。样品质量损失主要包括50~300 ℃的平稳热解阶段、300~400 ℃的主要热解阶段和400~600 ℃的炭化阶段。
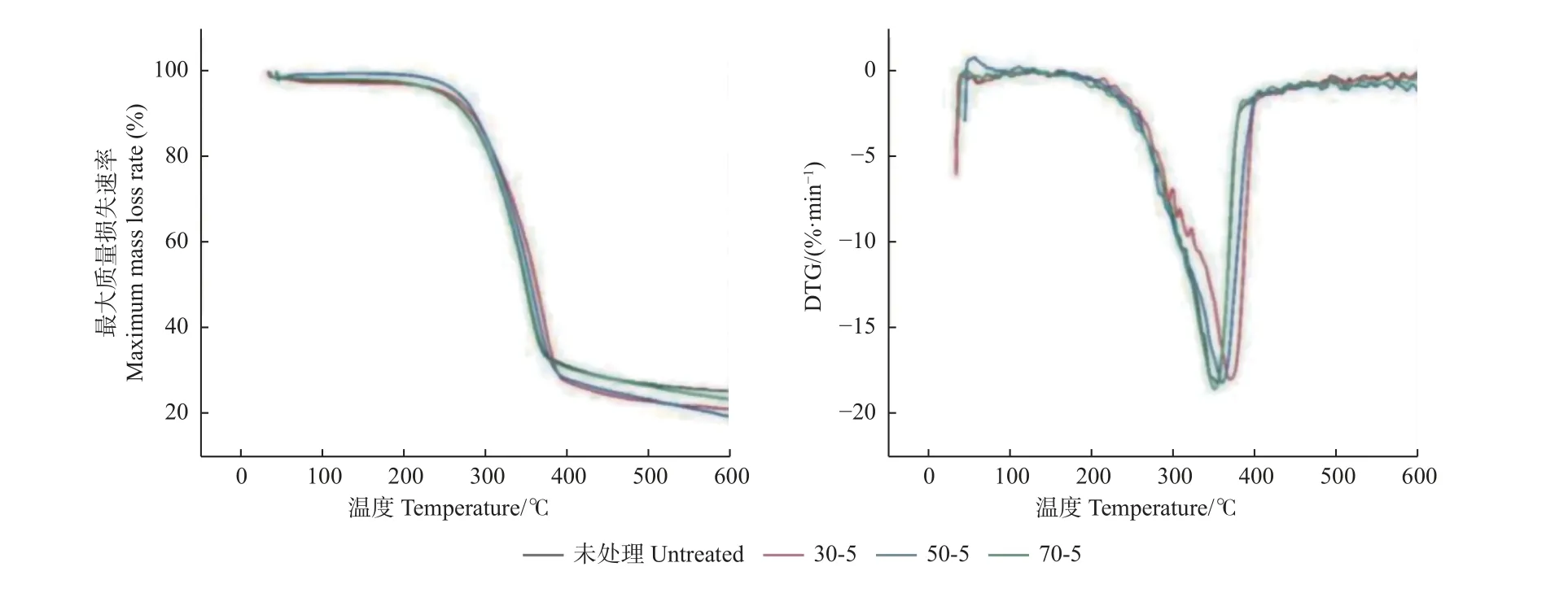
图3 不同温度预处理桐木的TGA 和DTG 曲线Fig. 3 TGA and DTG curves at different temperatures
由图3 可知,预处理后主要热解阶段样品最大质量损失速率均有所降低,最大质量损失速率对应的温度有所增加,说明预处理可延长达到最大质量损失速率的时间。在主要热解阶段,30 ℃和50 ℃条件下预处理样品热解失重峰温度升高,热稳定性有所上升;70 ℃条件下预处理样品与未处理样品热解温度差别不大;不同温度预处理样品的热解温度由大到小依次为30 ℃、50 ℃和70 ℃。这与CTEC2 酶最适温度有关,高温时酶活性降低,导致其对木质纤维的破坏程度降低(Patelet al.,2019)。综上所述,桐木热稳定性变化预处理温度依次为30 ℃>50 ℃>70 ℃。
由图4 可知,在主要热解阶段,pH 变化导致桐木热解温度和速率发生变化,最大质量损失速率有所降低。预处理样品最大质量损失速率对应的温度有所增加,说明pH 不同会导致桐木主要化学组分在热解和成分转化过程中产生差异(楚杰等 ,2017)。pH 为3 和5 时,预处理桐木的热解温度有所升高,热稳定性有所提高;pH 为7 时,预处理桐木的热解温度变化不大。综上所述,桐木热稳定性变化的预处理pH 依次为 3>5>7。
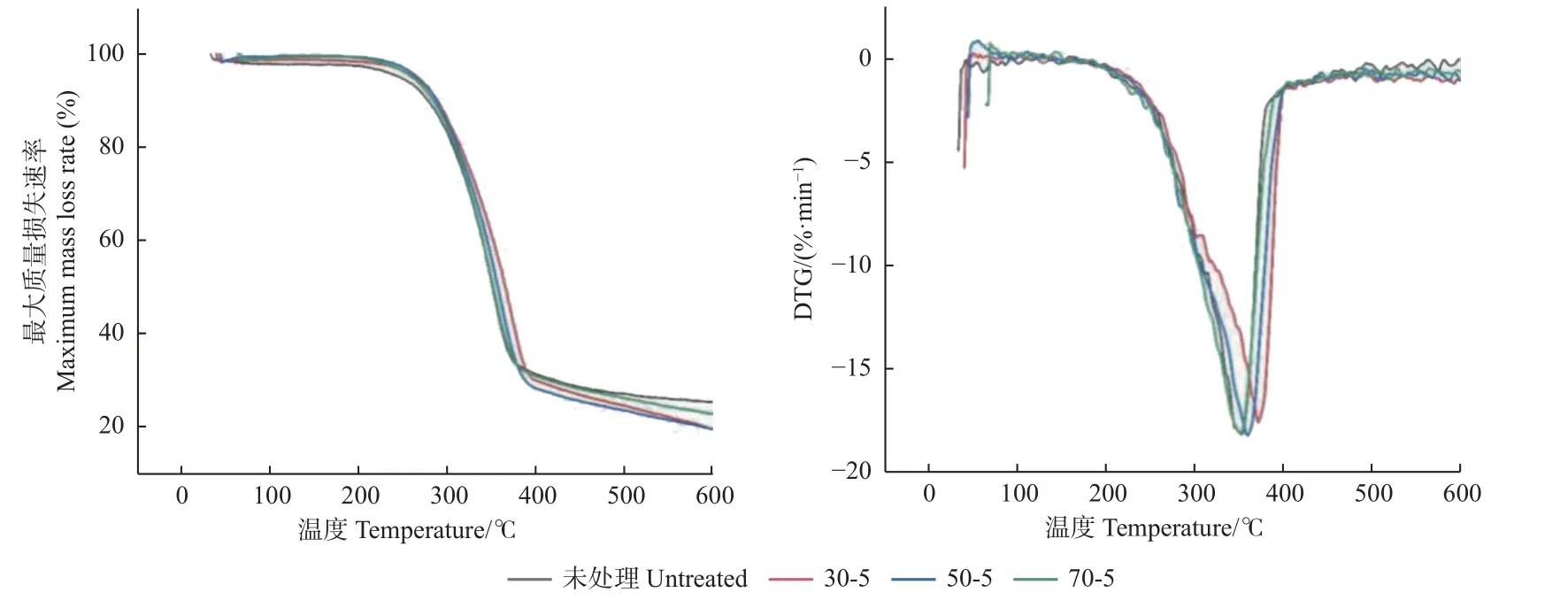
图4 不同pH 预处理桐木的TGA 和DTG 曲线Fig. 4 TGA and DTG curves at different pH values
2.5 预处理前后桐木电镜扫描图像分析
预处理前后泡桐木质纤维素组分变化示意如图5所示。未经预处理的木质纤维素组分中层状木质素与半纤维素呈半包裹状态,木质素密实细胞覆盖纤维素结构细胞;经生物酶预处理后, 木质素细胞脱除,暴露出更多规则成束的纤维素细胞。
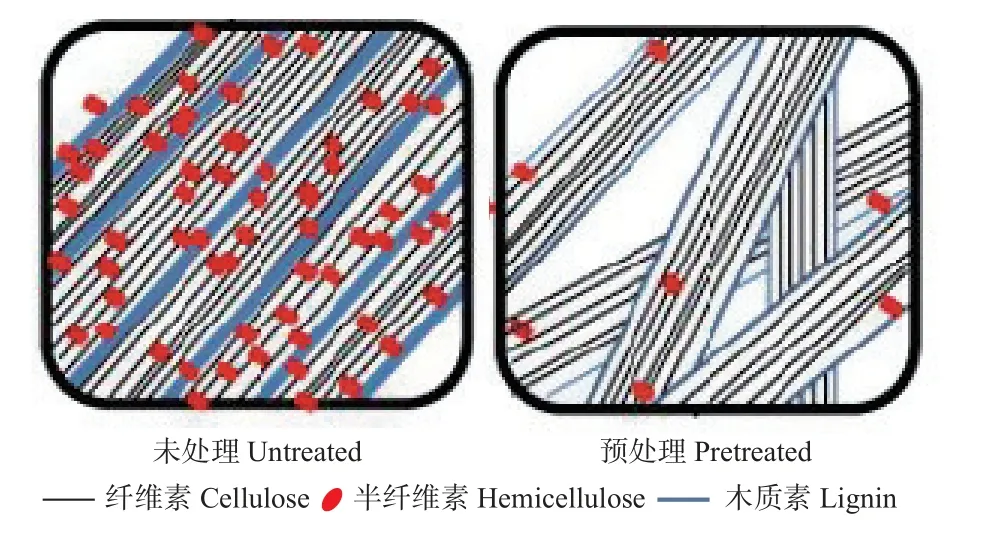
图5 预处理前后泡桐木质纤维素组分变化示意Fig. 5 Schematic diagram of changes in lignocellulose components before and after pretreatment
未处理样品表面无明显结构破坏,木质纤维较完整(图6A);温度30 ℃时,不同pH 预处理样品(图6B、C 和D)木质纤维表层结构遭到破坏,木质纤维素开始解体,纤维素互相分离,且随着pH 升高,结构变化明显;温度50 ℃时,不同pH 预处理样品(图6E、F 和G)木质纤维素解体更加严重,纤维素分离更加显著,且随着pH 升高,结构变化更加明显;温度70 ℃时,不同pH 预处理样品图6H、I、J)木质纤维的变化趋势与30 ℃和50 ℃预处理样品一致,且随着pH 升高,结构变化更加显著,但70 ℃预处理样品的结构变化不如50 ℃明显。可见,复合生物酶能有效降解桐木的木质纤维组分,破坏其木质纤维结构。
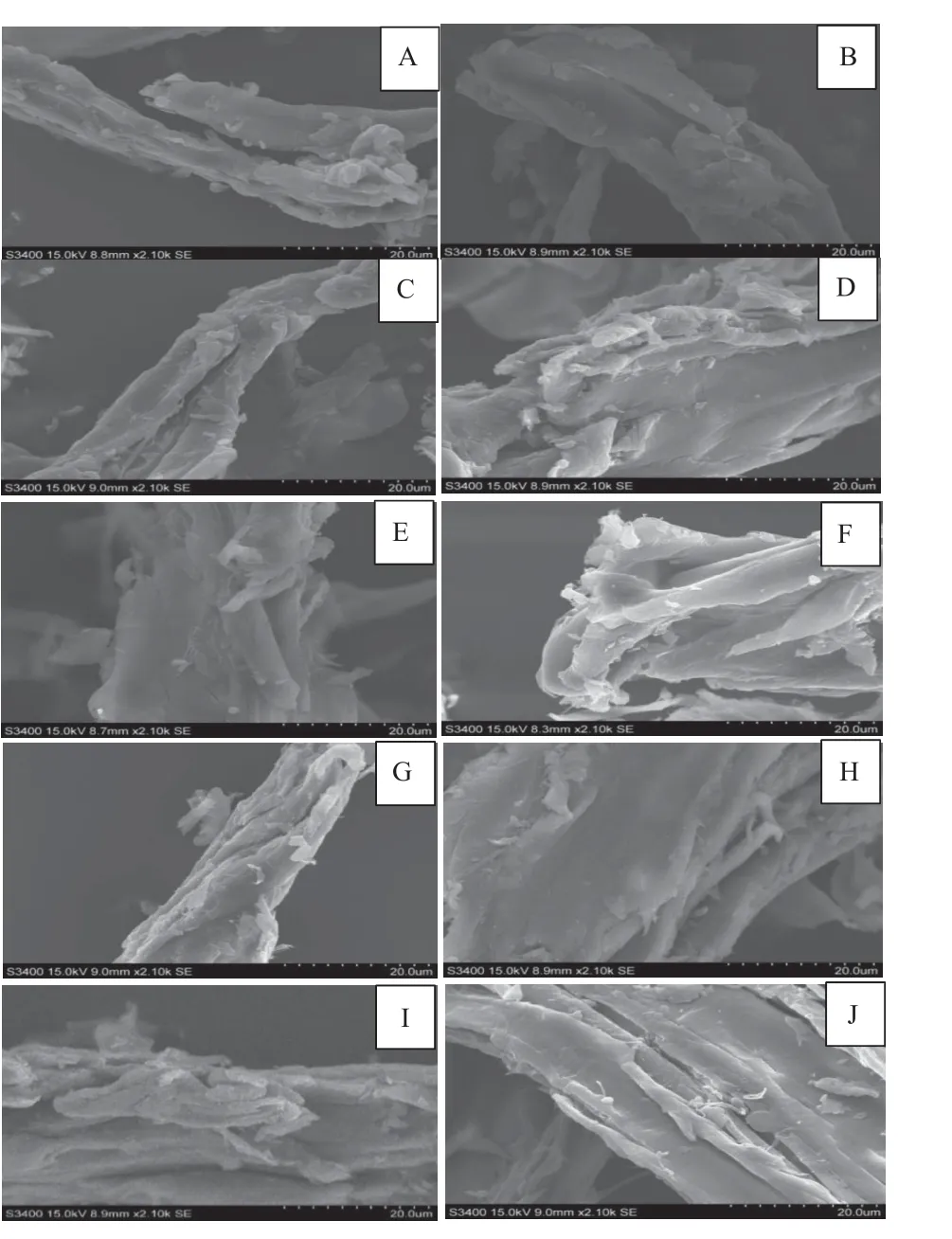
图6 不同预处理桐木的SEMFig. 6 SEM images of enzyme pretreatment paulownia
2.6 预处理前后桐木X 射线衍射分析
预处理前后桐木X 射线衍射图谱如图7 所示,101、002 和040 峰是典型的纤维素Ⅰ的特征,其衍射角分别为16.02°、22°和34.76°。经生物酶预处理后,101 峰衍射强度无明显变化;但经50 ℃预处理后,002 峰衍射强度明显增强,说明此时半纤维素、木质素等无定形区降解效率最高;040 峰尖锐程度明显增大,且位置有所向右偏移,说明经50 ℃预处理后,衍射强度明显增强,纤维素结晶度增大,结晶区晶胞参数变小、晶面间距变小。
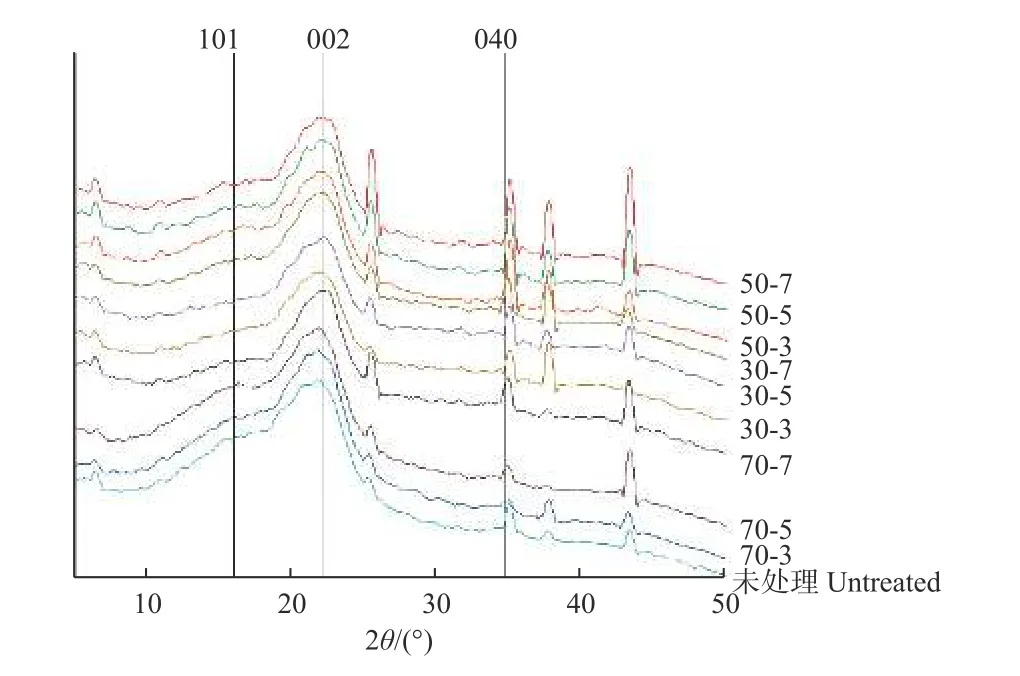
图7 预处理前后桐木X 射线衍射图谱Fig. 7 The X-ray diffraction spectrogram of paulownia sample before and after pretreatment
纤维素结晶度是由X 射线衍射测得的光谱峰高,计算公式如下:
式中:CI 为纤维素结晶度;I002为002 晶面的极大衍射强度,2θ 约22°;Iam为非结晶背景的衍射强度,2θ 约18°。
由表2 可知,未处理桐木样品纤维素结晶度为16.91%,这主要是因为木质素和半纤维素等部分无定形物质的存在使得结晶度较低。经生物酶预处理后,桐木样品结晶区表面纤维素分子链中的低聚糖被溶出,无定形区活性基团裸露,半纤维素与生物酶发生反应,部分木聚糖被降解,导致纤维素结晶度提高(楚杰等,2017)。生物酶降解,结晶度增加较为明显的预处理条件为温度50 ℃、pH 7,但由于酶的作用使纤维素结晶区发生部分水解,因此结晶度提升程度不大。
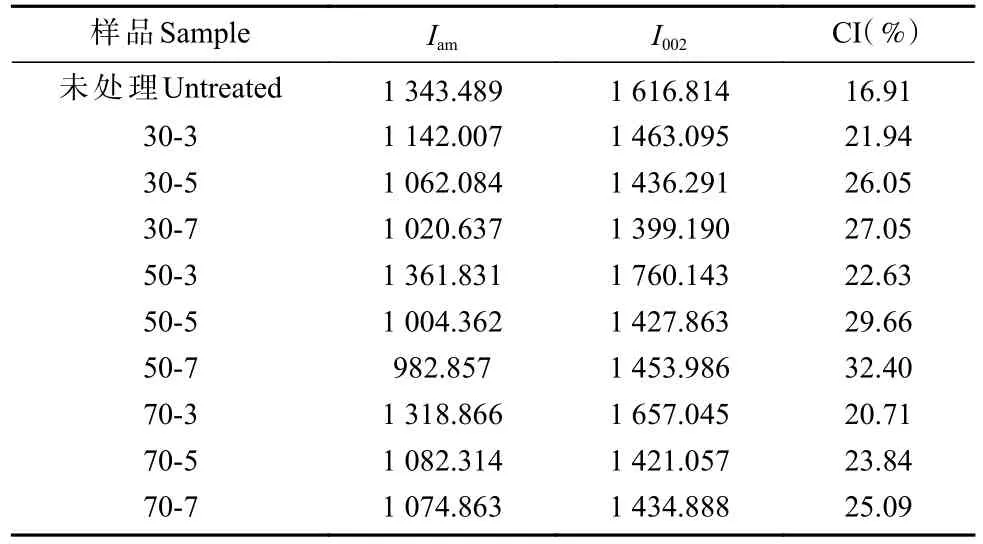
表2 不同预处理泡桐的纤维素结晶度①Tab. 2 Crystallinity calculation parameters
利用Scherer 公式(Segalet al.,1959)计算桐木结晶区尺寸,公式如下:
式中:D为结晶区长度或宽度;d为晶面层间距(nm);B为衍射峰半宽,计算中需将其转换为弧度;λ 为入射波波长(0.154 nm);θ 为衍射角;K为衍射常数。
由表3 可知,预处理后样品结晶区长度D增大,表明酶预处理能够提高桐木结晶区尺寸,且在一定范围内随温度和pH 上升提高更加明显,温度70 ℃、pH为7 时D达最大。此外,预处理后样品晶面层间距变小,但变化幅度较小,主要是因为桐木结晶区表面纤维素分子链中拥有的部分低聚糖溶解,导致细胞壁吸附能力变强,加速半纤维素与生物复合酶的反应,从而使d减小(楚杰等, 2017)。
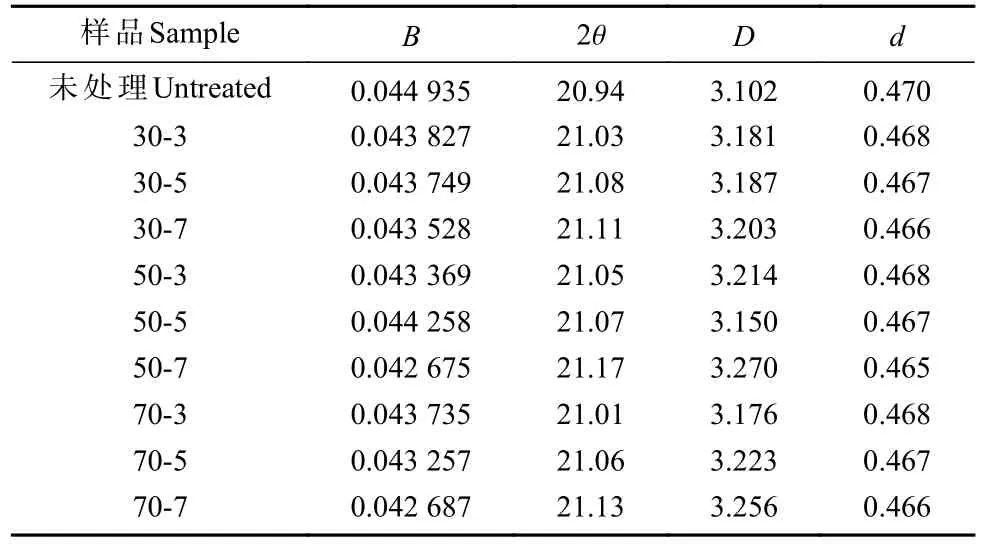
表3 不同预处理桐木结晶区大小①Tab. 3 Calculation parameters of crystallization zone
3 结论
1) CTEC2 生物酶可使泡桐木材主要化学组分发生变化,最佳预处理条件为温度50 ℃、pH 7,木材纤维素含量由49.11%增至59.87%,半纤维素含量由18.58%减至7.45%,酸溶木质素含量由7.12%减至4.07%,酸不溶木质素含量由24.64%减至20.42%,抽提物含量由3.24%减至2.09%。
2) CTEC2 生物酶预处理泡桐木材时,温度50 ℃、pH 7、预处理时间105 min 的漂白效果最好,木材明度最大。
3) CTEC2 生物酶预处理泡桐木材可以提高其热稳定性(处理条件温度70 ℃、pH 为7 时变化不明显)。依据热稳定性高低排序的预处理温度为30 ℃>50 ℃>70 ℃、pH 为3>5>7。CTEC2 生物酶预处理泡桐木材最大质量损失速率对应的温度在不同温度和pH 条件下均有所增加,预处理可延长达到最大质量损失速率的时间。
4) CTEC2 生物酶预处理泡桐木材不仅能够提高纤维素结晶度,使其结晶区尺寸增大,晶面层间距变小,而且能够有效破坏木质纤维素的致密结构,在相同温度下,其作用随预处理pH 提高而更加明显。

