光强和盐度对龙须菜生长及光合特性的影响
王津果,陈泽宇,石梦琪,倪嘉璇,武 卉,蒋书英,黄晶晶,王静文,周 伟*
(1.江苏海洋大学海洋科学与水产学院、江苏省海洋生物资源与环境重点实验室、自然资源部滨海盐沼湿地生态与资源重点实验室、江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005;2.连江罗源湾金牌渔业科技有限公司,福建 福州 350512)
龙须菜(Gracilariopsislemaneiformis)是一种重要的产琼胶海藻,其生长迅速,可用于多营养层次综合养殖和海洋牧场生态系统的构建,兼具经济效益和生态效益[1]。截止目前,龙须菜年产量高达398 920 t,栽培面积11 634 hm2,仅次于海带,成为国内第二大栽培藻类,并呈上升的趋势[2]。数据进一步表明,福建省龙须菜产量为308 933 t,栽培面积10 062 hm2,占全国总量的77.44%[2],成为我国栽培的主产地。福建省属于亚热带季风气候,沿海海域秋冬季节适宜龙须菜生长,其产量稳定,但随着春季尤其是梅雨季节的到来,降雨量、海水表层盐度、光照强度等逐渐变化,影响龙须菜生长,导致其产量的剧烈波动,引发龙须菜产量区域化差异严重,不利于地方藻类栽培产业的健康发展。
环境条件是影响大型海藻生物量累积的重要非生物因素,盐度和光照强度是其中的两个关键因素。近岸海水表层盐度一般在30~35之间,易受降水或淡水涌入的影响而降低。大量研究表明,低盐会影响大型海藻的生长和生理生化指标[3-6]。例如,25盐度处理对长型龙须菜(Gracilariopsislongissima)的生长速率及叶绿素a、类胡萝卜素和藻红蛋白含量无显著影响,但抑制藻蓝蛋白合成[7];25盐度培养条件下,龙须菜的生长速率最高,15盐度环境下其生长速率和光合速率下降,暗呼吸速率上升[8];26.98盐度培养条件下,江蓠属(Gracilaria)藻类琼胶、叶绿素a、胡萝卜素和蛋白质的含量显著增加,其含水率、碳水化合物、脂肪和灰分含量无明显变化[9];24、28盐度处理促进绿藻强壮硬毛藻(Chaetomorphavalid)的特定生长率,对其最大光合量子产率无显著影响[10];24.84盐度处理条件下,褐藻半叶马尾藻(Sargassumhemiphyllum)幼苗的藻体质量增长率和光合色素含量最高,17.01、19.62盐度处理使藻体质量增长率和光合色素含量显著下降[11];10盐度处理促进了绿藻浒苔(Ulvaprolifera)叶绿素a和叶绿素b的合成,对其最大光合量子产率无显著影响[12]。由此可见,大型海藻对低盐的响应机制存在明显的种间差异。光照强度易受到水深、日照长短、季节等的影响,对于藻类的生长和光合作用至关重要,影响大型海藻的生长速率、光合活性、色素合成等生物过程[13-16]。前人大量研究表明,低光照强度使大型海藻的生长受到抑制,光合色素含量呈现降低[17]、升高[18-19,20-21]或不受影响[22]等不同特征。另外,低光条件下,褐藻裙带菜(Undariapinnatifida)的最大光合量子产率、电子传递速率升高[19],龙须菜的最大光合量子产率等荧光参数升高[22],绳状龙须菜(Gracilariachorda)的光合速率降低[23],缘管浒苔(Ulvalinza)的净光合速率和最大光合量子产率下降[20],浒苔的净光合速率和呼吸速率下降[21],表明低光对大型海藻光合作用的影响具有种属特异性。
目前已有大量关于龙须菜响应非生物因素如光照强度和盐度变化的研究[9,22,24-26],但关于二者耦合作用的研究鲜有报道。另外,近年来受梅雨季节影响,南方栽培龙须菜的产量呈现大幅度波动状态,这与周边环境因素的变化有着潜在密切关系,其中降雨直接导致的光照强度和表层盐度变化最为明显。因此,有必要研究不同光照强度和盐度处理条件下龙须菜的生长、叶绿素荧光参数和光合色素含量变化,以期揭示南方梅雨季节栽培龙须菜产量不稳定的原因,为南方梅雨季节龙须菜的栽培提供理论基础和参考依据。
1 材料与方法
1.1 材料及培养条件
龙须菜随机采自福建省连江县罗源湾海域养殖筏架(26°25′N,119°41′E),低温避光保存带回实验室,用过滤海水冲洗掉藻体表面的附生生物和泥沙,挑选颜色鲜红、杂藻附生少的藻体,剪成2~3 cm的小段,置于含Pro培养基[27]的灭菌海水中,在温度为20 ℃、光照强度为120 μmol/(m2·s)、光周期为12 L∶12 D的智能光照培养箱(GXZ-500C,宁波江南仪器厂)中预培养1周。
1.2 实验设计
实验选取光照强度和盐度两个环境因子,根据梅雨季龙须菜栽培海域实际监测数据,将光强设置低光(lower light intensity,LL)30 μmol/(m2·s)和高光(higher light intensity,HL)120 μmol/(m2·s)两个水平,每个光照强度水平下设置低盐(lower salinity,LS)16、中盐(medium salinity,MS)24(即盐度适当降低)、高盐(higher salinity,HS)32三个盐度梯度,共6个光照强度和盐度组合(LLLS、LLMS、LLHS、HLLS、HLMS、HLHS),每个组合设3个平行样。将(0.20±0.01)g藻体置于含Pro培养基灭菌海水的500 mL培养瓶中,在温度20 ℃、光周期为12 L∶12 D的智能光照培养箱中培养,每两天更换1次培养液。
以HLHS处理组为对照。通过在培养瓶外部遮盖不同层数的中性网来实现120 μmol/(m2·s)和30 μmol/(m2·s)水平的光照强度。根据不同比例混合海水和双蒸水来配制16、24、32盐度水平的海水。光照强度的测定采用光合有效辐射测量仪(QSL-2100,美国Biospherical公司),海水盐度的测定采用手持式折光仪(LS10T,广州市铭睿电子科技有限公司)。
1.3 相对生长速率的测定
每两天测定1次6个处理组龙须菜的质量。称重前,利用吸水纸将藻体表面的水分轻轻吸干,吸水纸的层数和吸水的时间尽量保持一致。每次称量由同一人操作,以减少操作误差,同时为减少对藻体生理活性的损伤,尽量缩短其干露时长[28]。根据下列公式计算藻体的相对生长速率(relative growth rate,RGR,单位为%/d):
RGR=100×[ln(Wt/W0)]/t
(1)
式(1)中:Wt是第t天藻体质量(g),W0是藻体最开始的质量(g),t是藻体的培养天数(d)。
1.4 叶绿素荧光参数的测定
利用手持式PAM叶绿素荧光仪(AquaPen AP 100,捷克PSI公司)测定6个处理组龙须菜的叶绿素荧光参数。将样品暗处理15 min后,置于培养光强下测定其有效光合量子产率[Y(II)]。在8个光化光强[0、10、20、50、100、200、500、1 000 μmol/(m2·s)]下测定快速光响应曲线(rapid light curve,RLC),快速光响应曲线根据Eilers等[29]的光强与相对电子传递速率关系进行拟合,计算公式如下:
rETR=PAR/(a×PAR2+b×PAR+c)
(2)
式(2)中:rETR是藻体的相对电子传递速率,PAR是设置的光化光强[μmol/(m2·s)],a、b、c是拟合参数。
根据下列公式计算藻体的最大相对电子传递速率(rETRmax)、光能利用效率(α)和饱和光强[Ek,单位为μmol/(m2·s)]:
rETRmax=1/[b+2(a×c)1/2]
(3)
α=1/c
(4)
Ek=rETRmax/α
(5)
1.5 净光合速率和呼吸速率的测定
利用液相氧电极(YSI 5300A,美国YSI公司)测定6个处理组龙须菜的净光合速率和呼吸速率。称重前,使用刀片将藻体切成长度约1 cm的藻段,为降低机械损伤,将其置于培养条件下1 h以上。随后称取0.1 g左右的藻体,将其放入反应槽中,其中含有8 mL培养基。使用恒温循环器(DHX-2005,南京先欧仪器制造有限公司)将反应槽中培养基的温度控制在20 ℃。待暗适应20 min之后,在黑暗条件下记录反应槽中O2浓度变化,即呼吸速率[Rd,单位为μmol/(g·h)]。通过调整提供外源光照强度的卤素灯与反应槽间距离,获得培养光照强度,记录反应槽中O2浓度变化,即净光合速率[Pn,单位为μmol/(g·h)]。
1.6 色素含量的测定
称取0.05 g左右龙须菜置于5 mL无水乙醇中,4 ℃暗处理24 h后,取上清液。利用分光光度计(Ultrospec 3300 pro,英国安玛西亚公司)分别测定上清液在470、653、666 nm波长处的吸光值。根据下列公式计算叶绿素a、类胡萝卜素的含量[30]:
CChl a=15.65×A666-7.53×A653
(6)
CCar=(1 000×A470+1 403.57×A666
-3 473.87×A653)/221
(7)
式(6)至(7)中:CChl a是叶绿素a含量(mg/g);CCar是类胡萝卜素含量(mg/g);A470、A653、A666分别是470、653、666 nm波长处的吸光值。
采用机械研磨法测定藻红蛋白的含量。称取0.10 g藻体于研钵中充分研磨,转移至含10 mL磷酸缓冲液(0.1 mol/L,pH=6.8)的离心管中,于4 ℃下5 000 r/min离心15 min后,取上清液。利用分光光度计分别测定上清液在455、564、592 nm波长处的吸光值。藻红蛋白含量的计算公式如下[31]:
CPE=[(A564-A592) -(A455-A592)×0.2]×0.12
(8)
式(8)中:CPE是藻红蛋白的含量(mg/g);A592、A564、A455分别是592、564、455 nm波长处的吸光值。
1.7 数据统计及分析
所有数据用平均值±标准差(X±SD)表示。利用Origin 9.1与 SPSS 26.0分别对实验数据进行作图与统计分析。采用K-S、Levene检验先后对数据进行正态性、方差齐性分析。利用Turkey’s多重比较和单因素方差分析(One-way ANOVA)检验处理组间的统计学差异。利用双因素方差分析(Two-way ANOVA)检验光强和盐度对龙须菜的RGR、Y(II)、rETRmax、α、Ek、Pn、Rd及叶绿素a、类胡萝卜素、藻红蛋白含量的交互作用。以P<0.05作为差异显著性水平。
2 结果与讨论
2.1 不同处理下相对生长速率变化
双因素方差分析显示,光照强度和盐度对龙须菜的相对生长速率存在显著影响,且二者交互作用显著(P<0.05)(表1)。如图1所示,在同一光强条件下,藻体相对生长速率随着盐度增加呈现出先升高后降低的趋势,在盐度适当降低培养条件下达到高值,分别为(8.19±0.76)%/d(LLMS)、(9.83±0.31)%/d(HLMS),比高盐处理组分别提高10.38%(LLLS)、15.38%(HLLS),表明盐度的适当降低促进龙须菜的生长;低盐处理组的相对生长速率显著低于高盐处理组(P<0.05),降幅为51.89%(LLLS)、54.11%(HLLS),表明盐度过低抑制龙须菜的生长。此外,在低盐培养条件下,低光处理组与高光处理组间藻体的相对生长速率无显著性差异(P>0.05);在盐度适当降低、高盐培养条件下,低光处理组藻体相对生长速率显著低于高光处理组(P<0.05),降幅分别为16.68%、12.91%。
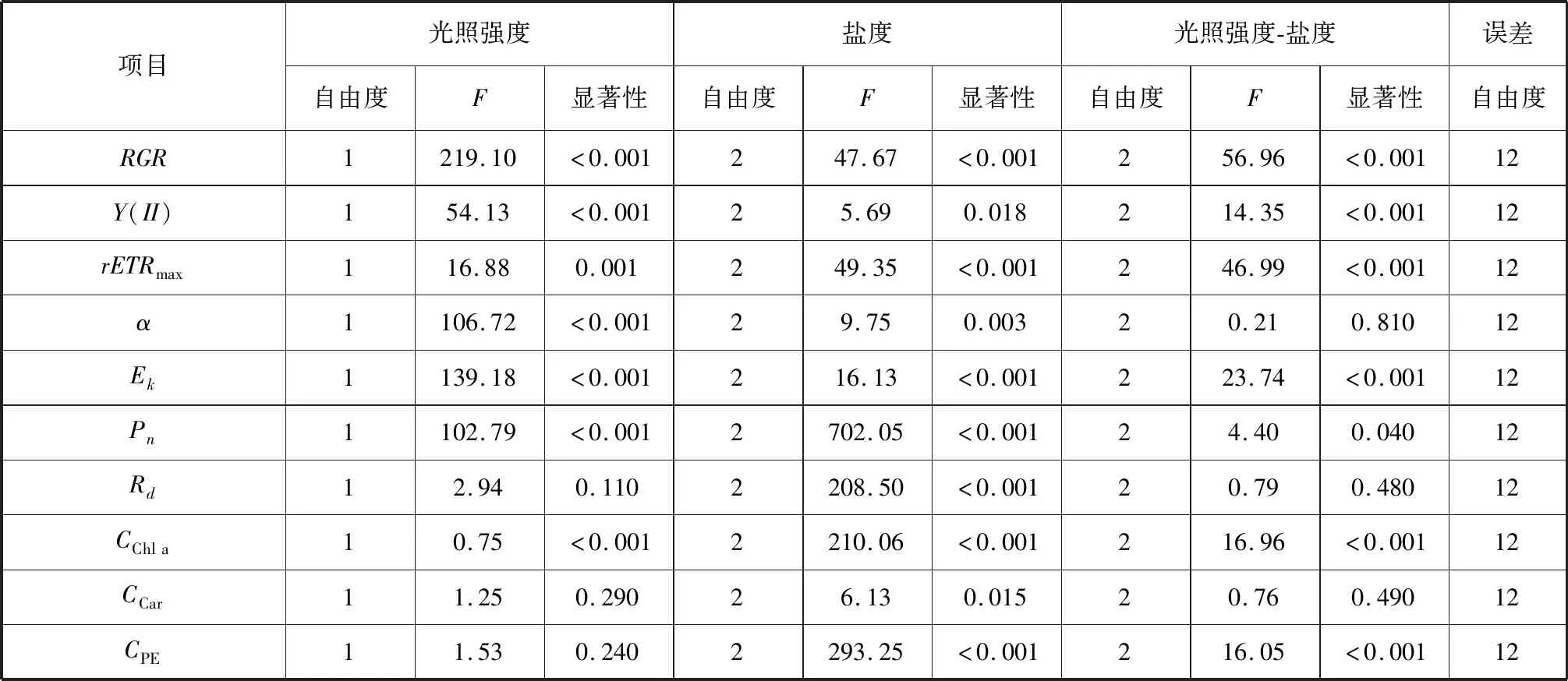
表1 光照强度和盐度对龙须菜生长和光合参数影响的双因素方差分析Tab.1 Two-way analysis of variance for the effects of light intensities and salinities on physiological parameters of G. lemaneiformis
2.2 不同处理下荧光参数变化
双因素方差分析显示,光照强度和盐度对龙须菜的有效光合量子产率存在显著影响,且二者交互作用显著(P<0.05)(表1)。如图2所示,在高光培养条件下:随着盐度增加,藻体的有效光合量子产率呈现出与相对生长速率相同的变化趋势,即先升高后降低,在盐度适当降低培养条件下达到最高值0.38±0.03,比低盐处理组、高盐处理组分别显著提高153.33%、26.67%(P<0.05),表明高光条件下盐度的适当降低提高龙须菜的有效光合量子产率。在低光培养条件下:藻体有效光合量子产率随着盐度增加而逐渐增加,在高盐培养条件下达到高值0.32±0.03,显著高于低盐处理组(P<0.05),增幅为60.00%,与盐度适当降低处理组无显著差异(P>0.05)。此外,盐度适当降低和正常盐度培养条件下,低光处理组和高光处理组间藻体的有效光合量子产率无显著影响(P>0.05);在低盐培养条件下,低光处理组藻体有效光合量子产率显著高于高光处理组(P<0.05),增幅为33.33%。
最大相对电子传递速率、光能利用效率、饱和光强由快速光响应曲线计算得出,如表2所示。双因素方差分析显示,光照强度和盐度对龙须菜的最大相对电子传递速率、光能利用效率和饱和光强有显著影响(P<0.05),二者交互作用显著影响最大相对电子传递速率和饱和光强(P<0.05),对光能利用效率无显著影响(P>0.05)(表1)。如表2所示,在同一光强条件下,藻体光能利用效率随着盐度增加呈现出先升高后降低的趋势;在高光培养条件下,藻体最大相对电子传递速率和饱和光强随着盐度增加呈现出与光能利用效率相同的变化趋势,先升高后降低;在低光培养条件下,随着盐度增加,最大相对电子传递速率逐渐降低,饱和光强先降低后升高。此外,在低盐培养条件下,低光处理组的最大相对电子传递速率显著高于高光处理组(P<0.05),增幅84.02%;低光处理组的光能利用效率显著低于高光处理组(P<0.05),降幅50.00%。同一盐度下,低光处理组藻体的饱和光强比高光处理组显著提高306.85%(LLLS)、63.10%(LLMS)、112.01%(LLHS)(P<0.05)。

表2 不同处理下龙须菜的最大相对电子传递速率、光能利用效率和饱和光强Tab.2 Maximum rETR,light utilization efficiency and saturation irradiance of G. lemaneiformis under various light intensities and salinities
2.3 不同处理下净光合速率和呼吸速率变化
盐度、光强及二者交互作用显著影响龙须菜的净光合速率(P<0.05),盐度显著影响其呼吸速率(P<0.05),光照强度和二者交互作用对其呼吸速率无显著影响(P>0.05)(表1)。如图3(a)所示,在同一光强条件下,随着盐度增加,藻体净光合速率呈现出与相对生长速率相同的变化趋势,即先升高后降低,在盐度适当降低培养条件下达到高值,分别为(22.80±0.54)μmol/(g·h)(LLMS)、(26.23±0.16)μmol/(g·h)(HLMS),比高盐处理组分别提高11.49%、10.35%,表明盐度的适当降低提高了龙须菜的净光合速率;在同一光强条件下,低盐处理组的净光合速率显著低于高盐处理组(P<0.05),降幅为42.69%(LLLS)、43.79%(HLLS),表明盐度过低使龙须菜的净光合速率下降。此外,同一盐度下,低光处理组藻体的净光合速率显著低于高光处理组(P<0.05),降幅为12.28%(LLLS)、13.08%(LLMS)、13.97%(LLHS),表明光照强度下降抑制了龙须菜的净光合速率。

图3 不同处理下龙须菜的净光合速率和呼吸速率Fig.3 Net photosynthetic rate and respiratory rate of G. lemaneiformis under various light intensities and salinities
如图3(b)所示,龙须菜的呼吸速率随盐度增加呈先降低后升高的变化趋势,与净光合速率相反,在低盐培养条件下达到高值,分别为(27.75±1.20) μmol/(g·h)(LLLS)、(29.60±1.50 )μmol/(g·h)(HLLS),比高盐处理组分别提高20.92%、28.19%;在同一光强条件下,盐度适当降低处理组的呼吸速率显著低于高盐处理组(P<0.05),降幅为37.12%(LLMS)、33.78%(HLMS)。此外,同一盐度下,龙须菜的呼吸速率在不同光照强度处理间无显著变化(P>0.05)。
2.4 不同处理下光合色素含量变化
盐度、光强及二者交互作用显著影响龙须菜的叶绿素a含量,盐度显著影响其类胡萝卜素含量,盐度和二者交互作用显著影响其藻红蛋白含量(P<0.05)(表1)。如图4(a)所示,在同一光强条件下,随着盐度增加,叶绿素a含量呈现出与相对生长速率相同的变化趋势,即先升高后降低,在盐度适当降低培养条件下达到高值,分别为(0.16±0.00) mg/g(LLMS)、(0.17±0.01) mg/g(HLMS),比高盐处理组分别增加了11.36%、32.56%;在同一光强条件下,低盐处理组的叶绿素a含量显著低于高盐处理组(P<0.05),降幅为46.15%(LLLS)、20.00%(HLLS)。此外,盐度适当降低、高盐处理组的叶绿素a含量在不同光照强度间存在显著差异(P<0.05);低盐处理组的叶绿素a含量在不同光强处理间差异不显著(P>0.05)。如图4(b)所示,类胡萝卜素含量在不同处理组间无显著变化(P>0.05)。如图4(c)所示,藻红蛋白含量随着盐度增加先升高后降低,与叶绿素a含量的变化趋势相同,在盐度适当降低培养条件下达到高值,分别为(0.57±0.04) mg/g(LLMS)、(0.70±0.05) mg/g(HLMS),比高盐处理组分别增加32.56%、112.12%;在同一光强条件下,低盐处理组的藻红蛋白含量显著低于高盐处理组(P<0.05),降幅为60.47%(LLLS)、42.42%(HLLS)。此外,盐度适当降低、高盐处理组的藻红蛋白含量在不同光照强度间存在显著差异(P<0.05);低盐处理组的藻红蛋白含量在不同光照强度间无显著差异(P>0.05)。

图4 不同处理下龙须菜的叶绿素a、类胡萝卜素和藻红蛋白含量Fig.4 Contents of chlorophyll a,caroteniod and phycoerythrin in G. lemaneiformis under various light intensities and salinities
2.5 讨论
盐度的变化对于大多数海藻来说都是一种胁迫,其波动会改变细胞渗透压,从而影响生物体的化学成分如光合色素、蛋白质等的合成[32]。龙须菜的相对生长速率和净光合速率在MS培养条件下达到高值,表明盐度适当降低促进龙须菜的生长。这种现象在菊花心江蓠(Gracilarialichenoides)[3]、半叶马尾藻[11]、Gracilariacorticata[33]等大型藻类中均有报道。随着盐度增加,叶绿素a和藻红蛋白含量呈现出先升高后降低的变化趋势,与相对生长速率、净光合速率相同,在低盐培养条件下最低,盐度适当降低培养条件下最高,表明叶绿素a和藻红蛋白是将光能转化为化学能的关键色素,与藻类的光合作用密切相关[34]。在低盐培养条件下,龙须菜的净光合速率被抑制,表明盐度过低会降低龙须菜的光合性能,可能是由色素含量下降引起的[28],因为藻类通过调整自身色素含量来适应环境变化是一种普遍现象[35],而叶绿素a在光系统的电子传递中起着非常重要的作用[36]。此外,盐度的适当降低促进龙须菜的净光合速率和相对生长速率,可能与降雨量增加导致携带营养盐的大量陆源淡水入海,引起近岸海水营养盐浓度增加有关[37-38]。
光照是影响藻类生长和光合作用的主要非生物因子之一,过高或过低都会影响光合作用,进而影响藻体的正常生长[15,19]。光照强度过低引起能量短缺或者光合作用的关键酶未能充分活化,导致藻体的光合活性下降。龙须菜在高光培养条件下的相对生长速率、净光合速率显著高于低光处理组,这与其他大型海藻如裙带菜[19]、绳状龙须菜[23]、缘管浒苔[22]、浒苔[23]、真江蓠(Gracilariaasiatica)[39]的研究结果一致。此外,低光培养条件下龙须菜的光能利用效率低于高光处理组。福建梅雨季引起的持续阴天,导致栽培海域光照强度下降,不利于龙须菜生物量的累积。叶绿素a和藻红蛋白是藻体进行光合作用的反应中心及捕光系统,其中藻红蛋白捕获光能并将其传递给光系统II,最终到达反应中心叶绿素a,二者易受外界环境的影响[30-31]。在高盐培养条件下,低光处理促进龙须菜叶绿素a和藻红蛋白的合成,光合色素含量与光照强度呈负相关的现象在其他海藻中普遍存在。原因在于光强不足引起的生长速率、光能利用效率下降,藻体会通过补偿性的合成光合色素来弥补上述不足,这是藻体响应外界环境变化的一种积极策略,具备重要的生理、生态作用[19-20]。
本研究中龙须菜的最佳生长条件位于HLMS处理组,即当光照强度为120 μmol/(m2·s)、盐度为24时,龙须菜的生长和产量达到了最高值。福建临近北回归线,属于暖热湿润的亚热带季风气候,春夏之际梅雨季的到来,引起栽培海域光照强度、盐度的短期变化。近年来,主产地福建龙须菜的栽培年产量不稳定,尤其在梅雨季其产量发生剧烈波动,少数呈增产趋势,多数呈下降趋势。本研究通过研究光照强度、盐度及二者耦合作用对龙须菜生长和光合生理的影响,在一定程度上揭示了梅雨季节龙须菜生长不稳定的原因,也即梅雨季节龙须菜栽培产量潜在地取决于光照强度、海水表层盐度及其耦合作用的变化。降雨引起的海水盐度适当降低对龙须菜的生长具有促进作用,但当盐度过低会导致龙须菜产量急剧下降。降雨过程中,适当地增加光照将有利于龙须菜生长的恢复和产量的提高。这为我们在梅雨季更好地进行龙须菜栽培提供理论思路,如通过将其挂养在靠近海水表层的水层,以接受更多光照,促进龙须菜的生长。
3 结论
在本研究中,光照强度和盐度耦合对龙须菜生长和光合作用产生显著影响,梅雨季节栽培龙须菜产量的增加或减少,一定程度上取决于光照强度与海水盐度的变化及其耦合作用。栽培龙须菜最适生长条件为光照强度120 μmol/(m2·s)、盐度为24。充足的光照耦合盐度的适当降低(HLMS)促进龙须菜的生长,但盐度过低会抑制其生长。这为预判龙须菜栽培产量提供一定的理论依据,同时为梅雨季节更好地开展龙须菜栽培提供科学支撑数据。

