三种圈养金丝猴肠道微生物组差异分析
张媛媛 ,赵素芬 ,王运盛,李祥翔,蒋 鹏,刘 燕,张成林 ,卢 岩
(北京动物园管理处,圈养野生动物技术北京市重点实验室,北京,100044)
金丝猴(snub-nosed monkey 或golden monkey)隶属于灵长目(Primates)猴科(Cercopithecidae)疣猴亚科(Colobinae)仰鼻猴属(Rhinopithecus),因鼻梁凹陷,鼻孔上仰,又名“仰鼻猴”[1],现存5 种,我国有 3 个特有种,分别为川金丝猴(Rh.roxellana)、滇金丝猴(Rh.bieti)和黔金丝猴(Rh.brelichi),均为国家一级重点保护野生动物[2]。鉴于金丝猴的生态位及对人类健康的研究价值,金丝猴的健康研究备受学者关注。金丝猴消化系统的特点表现在消化道较长,胃呈多室且表面积较大,盲肠与结肠发育不全,机械碾碎食物的功能较弱,前胃内寄居大量微生物发酵食物纤维,为典型的食叶动物[3]。圈养环境下不能完全复制野外食物资源,可能引起金丝猴纤维和其他营养元素缺乏,食物组成的改变可能产生负面影响,诱发胃肠道疾病[4]。开展金丝猴胃肠道微生物组特征分析,可为监控其健康及营养需求提供基础数据。目前一些研究者基于圈养环境、健康、腹泻和年龄等因素开展川金丝猴肠道菌群差异分析[5-7],然而,目前鲜见川、滇、黔3 种圈养金丝猴肠道微生物组的比较研究。北京动物园管理处是全国唯一一家饲养川、滇、黔3种金丝猴,且3种金丝猴均能进行繁殖的单位,为本项研究提供了基础。本研究采用16S rDNA测序技术,开展相同圈养环境下3种金丝猴肠道微生物组差异分析,探索相关的微生物组结构,以期为促进金丝猴胃肠道健康及相关疾病防控提供参考数据。
1 材料与方法
1.1 动物
饲养于北京动物园金丝猴馆内的2 只川金丝猴(祥云和大壮)、2只滇金丝猴(花花和阿贵)和3只黔金丝猴(阿静、石头和月月)(表1)。冬季供应食物种类包括苹果、香蕉、鸡蛋、芹菜、白菜、西瓜、梨、沙白瓜、胡萝卜、西红柿、黄瓜、豇豆、莴笋、生菜、油菜、哈密瓜、白萝卜、红薯、玉米、葡萄、圆窝头和干柞树叶 22种,夏季将梨、豇豆、葡萄和干柞树叶更换为芒果、桃、青提和桑叶,种类仍为22种,除冬季和夏季食物结构上略有差异外,饲养环境及食物结构基本一致。采样期间,自由采食和饮水,食物为北京动物园金丝猴饲养标准餐,饮水为清洁饮用水。
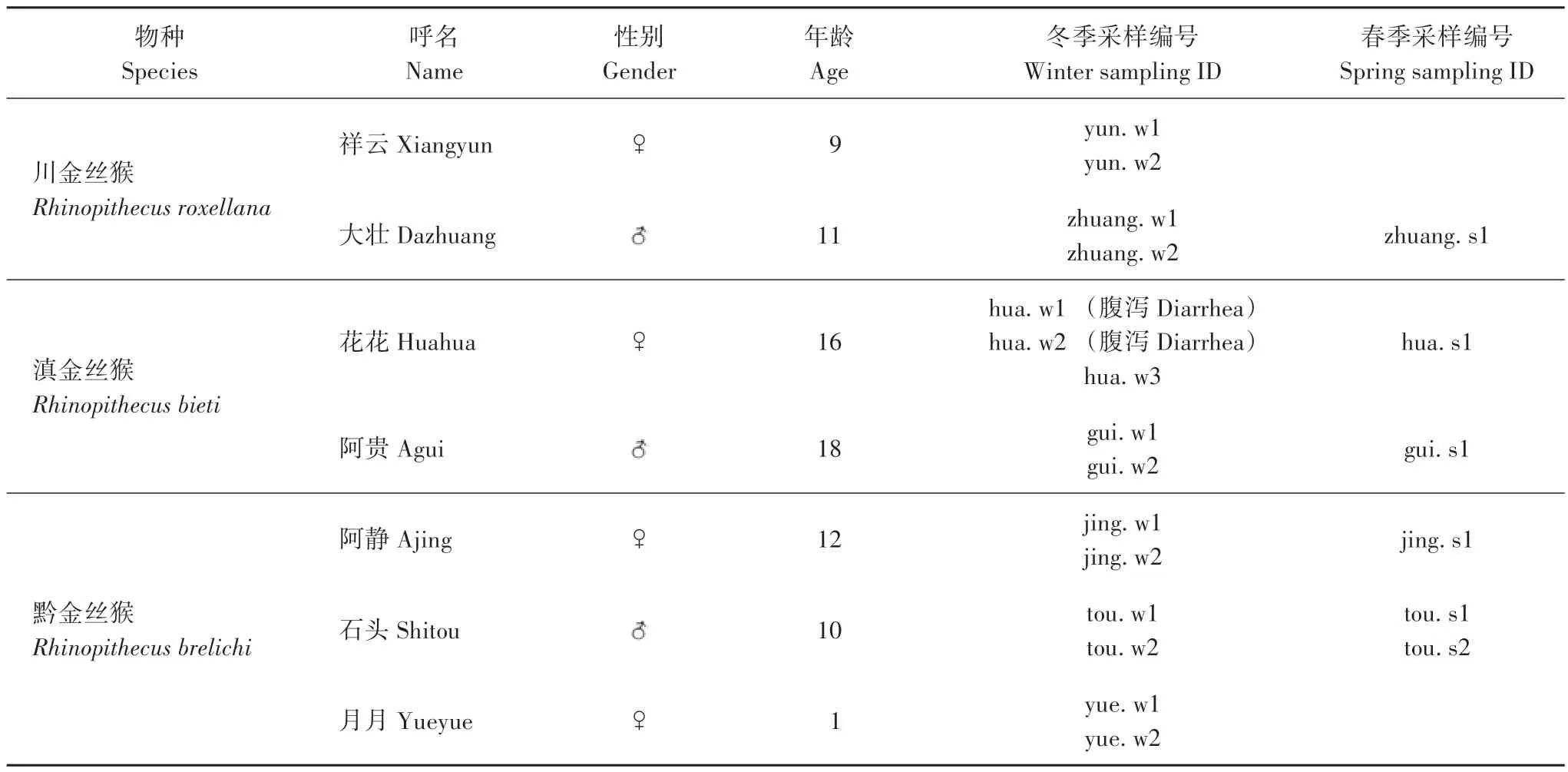
表1 金丝猴样本采集信息Tab.1 Information of experimental golden monkeys and samples
1.2 方法
1.2.1 样本采集与分组
分别于2017 年11 月和2018 年3 月采集金丝猴粪便样品,其中,川金丝猴样本5 份(健康样本),滇金丝猴样本7份(5份健康样本,2份腹泻样本),黔金丝猴样本9 份(健康样本)。采样前1 d 将笼舍彻底清扫,次日清晨投喂食物前进入笼舍内采集新鲜粪便,置于无菌冷冻管内,并依次编号(表1),送至实验室,-80 ℃保存,备用。
1.2.2 DNA提取及Illumina MiSeq测序
使 用E.Z.N.A.®Stool DNA Kit(Omega Bio-Tek,Inc.,Norcross,USA)从粪便样本内部(0.5 g)提取DNA。以基因组DNA 为模板,使用融合引物341F/806R 对 细菌16S rDNA 基因V3—V4 高 变区进 行PCR 扩增,PCR 反应体系:5.0 μL 10×buffer,0.5 μL dNTPs(10 mmol/L),10 ng 基因组DNA,0.5 μL Bar-PCR primer F(50 μmol/L),0.5 μL Primer R(50 μmol/L),0.5 μL FastPfu Polymerase(5 U/μL),超纯水补充体积至50.0 μL。PCR 程序:95 ℃预变性2 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环25 次;72 ℃终延伸5 min。按照DNA 凝胶纯化试剂盒说明书将扩增产物纯化后,由上海凌恩生物科技有限公司(中国,上海)进行Illumina HiSeq PE250测序。
1.2.3 16S rDNA基因序列及生物信息学分析
过滤原始数据,去除嵌合体和适配器污染获得高质量clean reads,通过reads 之间的overlap 关系将reads 拼接成Tags;使用Usearch(version 10,http://drive5.com/uparse/)在97%相似度下将Tags 聚成操作分类单元(operational taxonomic unit,OTU);去除嵌合体序列,然后通过OTU 与Ribosomal Database Project(RDP)Classifier(version 2.2,http://sourceforge.net/projects/rdp-classifier/)数据库比对(置信阈值0.7),对OTU 进行物种注释。使用mothur(version 1.30.1,http://www.mothur.org/wiki/Schloss_SOP #Alpha_diversity)进行物种丰度(Chao1、Richness)和物种丰富度(Shannon、Simpson、ACE 和Evenness)指数分析;使用R 语言进行主坐标分析(PCoA)和作图;使用Qiime 软件的bray crutis、weighted unifrac 算法计算β多样性距离矩阵;用R 语言进行非度量多维尺度分析(NMDS)和作图,构建多样本相似度树状图;使用Qiime 软件分析ANOSIM 相似性;采用LEfSe软件分析在门/科/属等不同分类水平上,与种属或健康状况等生物学指标相关的统计学差异;采用Sigmaplot 12.0软件绘制物种差异柱状图。
1.2.4 统计分析
使用IBM SPSS Statistics 20分别对3种金丝猴和健康/腹泻滇金丝猴样本的α多样性指数(Chao1、Richness、Shannon、Simpson、ACE 和Evenness)进行单因素ANOVA 分析和独立样本t检验;在门和属水平对细菌域相关物种进行Wilcoxon 秩和检验,分析 3 种圈养金丝猴及健康/腹泻滇金丝猴样本间的物种丰富度差异;结果以平均值±标准差(mean±SD)表示,p<0.05或者Sig.<0.05示差异显著。
2 结果
2.1 圈养金丝猴肠道微生物组成
从21 个样本中,共获得1187 088 个高质量reads,每个样品平均获得56 528 个高质量reads,所有样品获得的reads 数量为43 655~68 956 个。获得高质量序列的平均长度为414 bp,基于97%相似度聚成1 782 个OTUs。21 个样品平均Good’s coverage为(99.76±0.06)%。
21 个样本平均有99.29%的OTUs 被注释为细菌域相关物种,涉及16 门29 纲63 目117 科287 属。在门水平,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)为优势菌门,三者平均相对丰度分别为57.63%、29.26%和6.77%;其次为螺旋体门(Spirochaetota)和脱硫杆菌门(Desulfobacterota),平均相对丰度为1.37%和1.32%;其余11 个门平均相对丰度均低于0.80%(图1A、B)。在属水平,平均相对丰度前15 的分别为UCG-005、拟杆菌属(Bacteroides)、Christensenellaceae R-7 group、Muribaculaceae_norank、UCG-002、Rikenellaceae RC9 gut group、瘤胃球菌属(Ruminococcus)、NK4A214 group、[Eubacterium]coprostanoligenes group_norank、Prevotella_9、副杆菌属(Parabacteroides)、UCG-010_norank、不动杆菌属(Acinetobacter)、Clostridia UCG-014_norank和埃希氏-志贺氏菌属(Escherichia-Shigella)(图1C、D)。
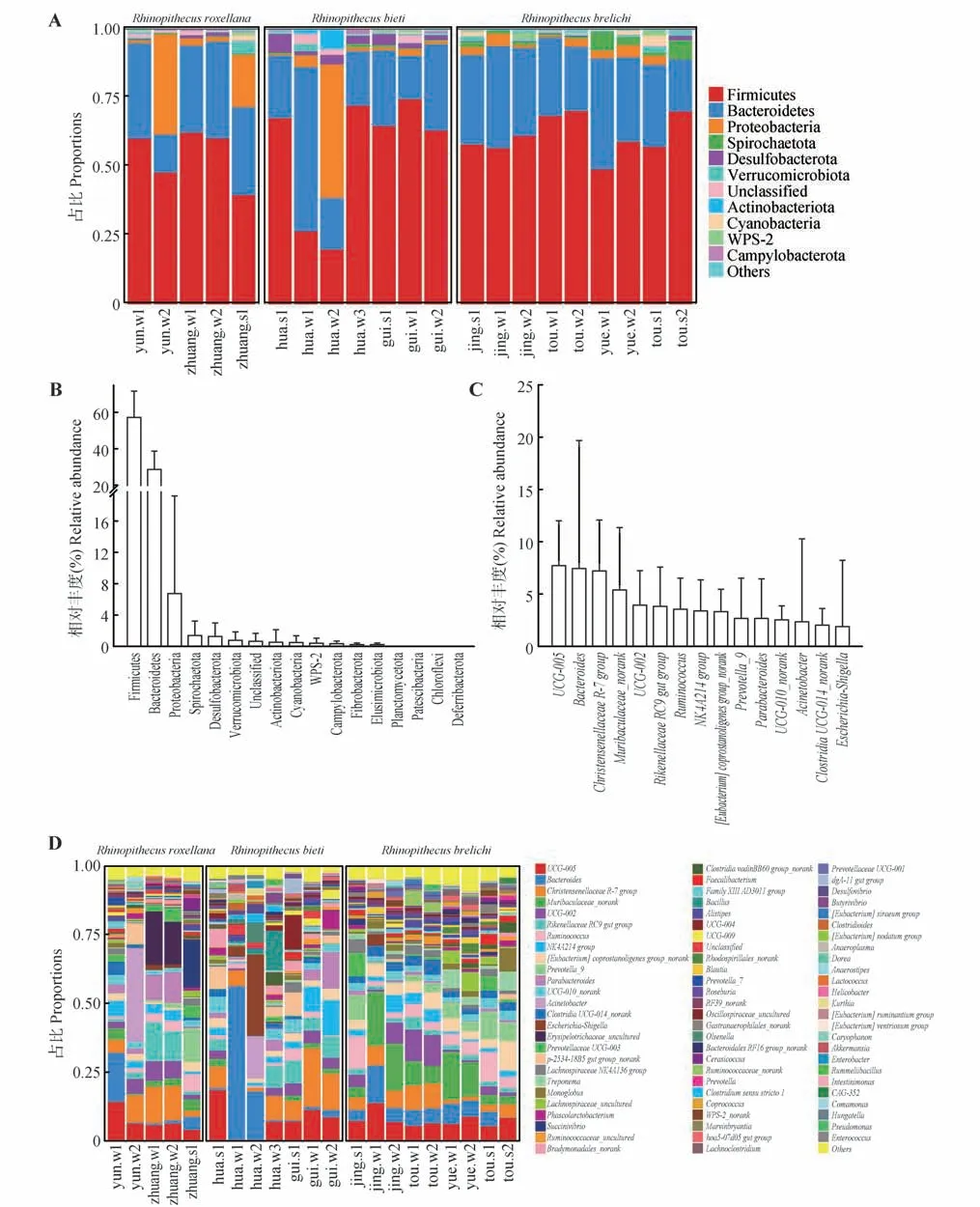
图1 圈养金丝猴肠道微生物组分类学组成Fig.1 Overall taxonomical composition of gastrointestinal tract microbiota in fecal samples collected from captive golden monkeys
2.2 三种圈养健康金丝猴肠道微生物组差异
分析3 种圈养健康金丝猴样本微生物群落的 丰富度和多样性,结果显示,Chao1、Richness 和ACE 3 种指数在3 种金丝猴间无显著差异(p>0.05);川金丝猴的Shannon、Evenness 指数显著低于滇、黔金丝猴(p<0.05),而川金丝猴的Simpson 指数 显著高于滇、黔金丝猴(p<0.05),滇、黔金丝猴的Shannon、Evenness 和Simpson 指数差异不显著(p>0.05)(表2)。

表2 3种圈养健康金丝猴肠道微生物菌群α多样性Tab.2 Difference of alpha diversity index of gut microbiota among the three species of captive healthy golden monkeys
基于Weighted UniFrac 算法的PCoA 和NMDS 分析图(图2A、B)显示,滇金丝猴和黔金丝猴样本各自聚类,川金丝猴样本散布于滇、黔金丝猴样本间;基于Weighted UniFrac 算法的多样本相似度树状图显示,滇金丝猴5 个样本聚类于同一分支,黔金丝猴 8个样本聚类于同一分支,黔金丝猴tou.s2样本聚类于滇金丝猴分支内,川金丝猴大壮和祥云样本散布于滇金丝猴和黔金丝猴分支内(图2C);基于Weighted UniFrac 算法的ANOSIM 分析显示3 种圈养健康金丝猴间差异显著(p=0.001)。
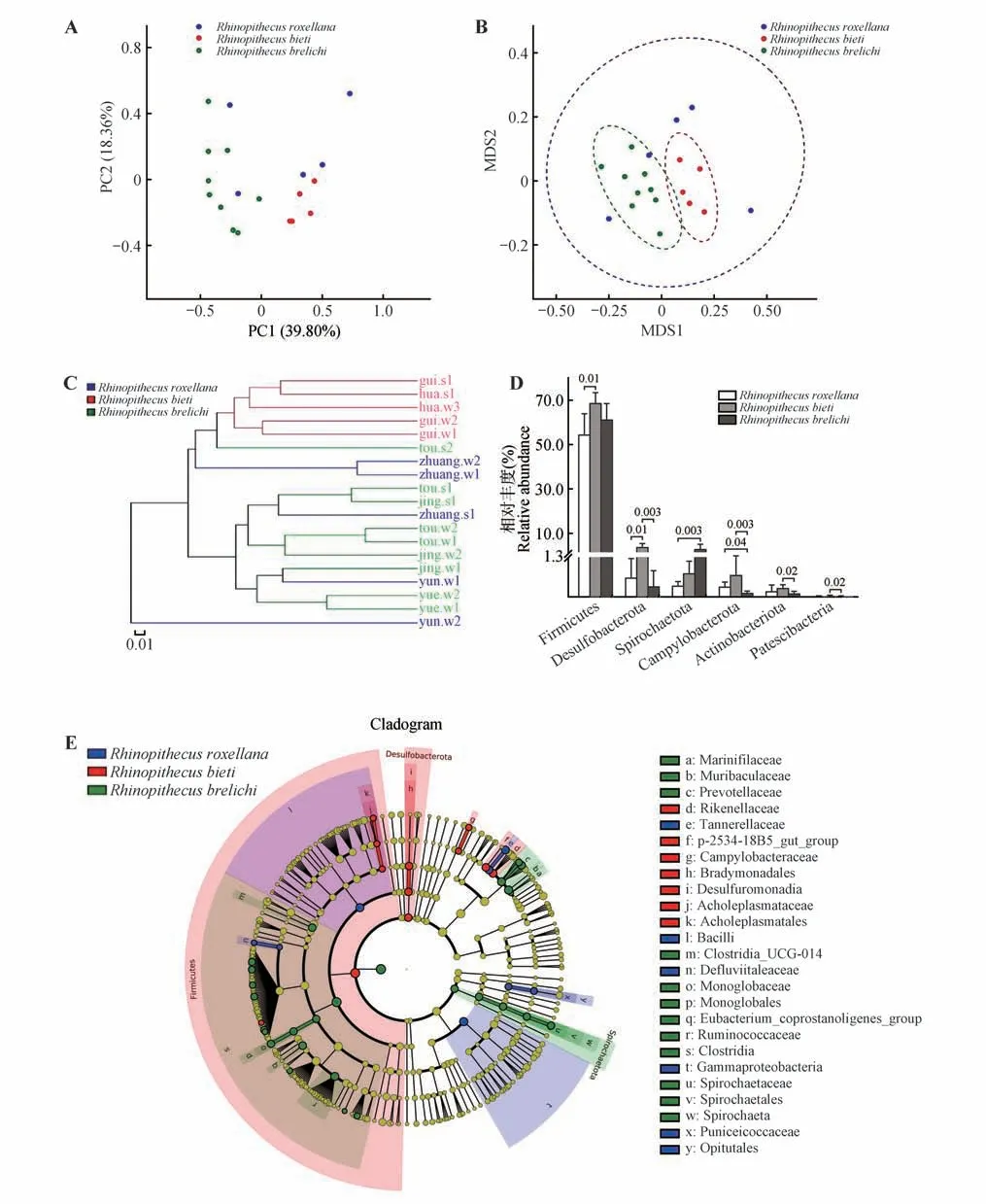
图2 3种圈养健康金丝猴肠道微生物组多样性和分类组成Fig.2 Diversity and taxonomical composition of gastrointestinal tract microbiota in fecal samples collected from the three species of captive healthy golden monkeys
在门水平进行细菌域相关物种的分类学差异分析,川金丝猴样本检测到15 门,而滇、黔金丝猴均检测到16 门;与川金丝猴相比,滇金丝猴多检测到绿弯菌门(Chloroflexi)相关物种,而黔金丝猴多检测到脱铁杆菌门(Deferribacterota)相关物种。川金丝猴样本检测到厚壁菌门、拟杆菌门和变形菌门的平均相对丰度分别为54.13%、29.41% 和12.08%,三者总相对丰度达95.62%;滇金丝猴样本检测到厚壁菌门、拟杆菌门和变形菌门的平均相对丰度分别为68.47%、23.36%和1.29%,三者总相对丰度达93.12%;黔金丝猴样本检测到厚壁菌门、拟杆菌门和变形菌门的平均相对丰度分别为61.18%、30.27% 和2.53%,三者总相对丰度达93.98%。进行差异分析发现,川、滇金丝猴有2 个门的相对丰度存在显著差异,表现为川金丝猴样本内厚壁菌门和脱硫杆菌门相对丰度显著低于滇金丝猴(p=0.01);川、黔金丝猴间有2 个门的相对丰度存在显著差异,表现为川金丝猴样本内螺旋体门相对丰度显著低于滇金丝猴(p=0.003),而弯曲杆菌门(Campylobacterota)相对丰度显著高于黔金丝猴(p=0.04);滇金丝猴样本内脱硫杆菌门、放线菌门(Actinobacteriota)、Patescibacteria 和弯曲杆菌门的相对丰度均显著高于黔金丝猴(p<0.05)(图2D)。
在属水平,川、滇、黔金丝猴分别检测到246、235、243 属,其中川金丝猴样本内相对丰度超过1%的属有19 个,尤其是Christensenellaceae R-7 group、UCG-005、Erysipelotrichaceae_uncultured、Acinetobacter、Rikenellaceae RC9 gut group和Parabacteroides6 属 的相对丰度超过5%;滇金丝猴样本内相对丰度超过1%的属有23 个,其中Christensenellaceae R-7 group、UCG-005、Rikenellaceae RC9 gut group和NK4A214 group4个属的相对丰度超过5%;黔金丝猴样本内相对丰度超过1% 的属有22 个,其中Muribaculaceae_norank、UCG-005、Bacteroides、Ruminococcus和Christensenellaceae R-7 group5 个属的相对丰度超过5%。物种差异分析发现,川金丝猴与滇金丝猴间有10 个属间存在显著差异,包括高丰度属UCG-010_norank、Bradymonadales_norank、dgA-11 gut group(p<0.05);川金丝猴与黔金丝猴间有29个属间存在显著差异,包含高丰度的Erysipelotrichaceae_uncultured、Parabacteroides、Muribaculaceae_norank、[Eubacterium]coprostanoligenes group_norank、Monoglobus、密螺旋体属(Treponema)和布劳特氏菌属(Blautia)(p<0.05);而滇金丝猴与黔金丝猴有53 个属的相对丰度存在显著差异,包含高丰度的Christensenellaceae R-7 group、Rikenellaceae RC9 gut group、Parabacteroides、Bacteroides、Ruminococcus、Prevotella_9、Muribaculaceae_norank、[Eubacterium]coprostanoligenes group_norank、p-2534-18B5 gut group_norank、Clostridia UCG-014_norank、UCG-009、Bradymonadales_norank、Treponema、Blautia和dgA-11 gut group 15 个属(p<0.05),3 种圈养健康金丝猴肠道微生物菌群代表性及差异的高丰度属见表3。
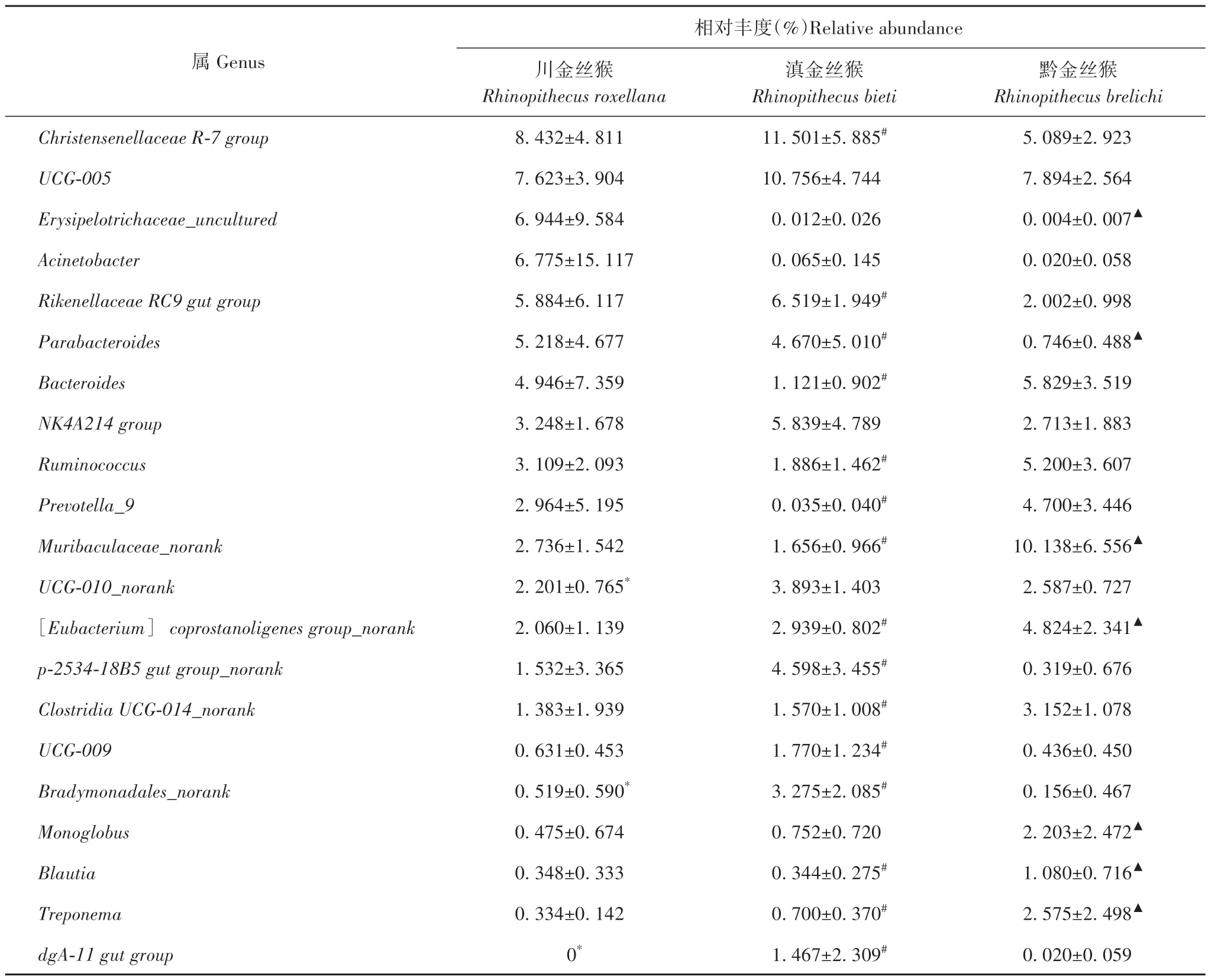
表3 3种圈养健康金丝猴肠道微生物菌群高丰度属Tab.3 The relative abundance of gut microbiota at genus level of the three species of captive healthy golden monkeys
LEfSe 进化分析显示,3 种健康金丝猴OTUs 在不同分类水平共检测到47 个微生物标志物的相对丰度存在显著差异,其中川金丝猴样本内特异性微生物标志物较少,而滇、黔金丝猴标志物相对较多;典型标志物包括黔金丝猴样本内螺旋体门、螺旋体科(Spirochaetaceae)、螺旋体属(Spirochaeta)的物种在各分类层级中的相对丰度均高于川金丝猴和滇金丝猴,滇金丝猴样本内脱硫杆菌门、脱硫弧菌科(Desulfovibrionaceae)的相对丰度均高于川金丝猴和黔金丝猴(图2E)。
2.3 健康与腹泻滇金丝猴肠道微生物组差异
分析健康与腹泻滇金丝猴样本微生物群落的丰度和多样性,结果显示,健康组Chao1、Richness、Shannon、ACE和Evenness 5种指数显著高于腹泻组,而Simpson指数显著低于腹泻组(p<0.05)(表4)。

表4 健康与腹泻滇金丝猴肠道微生物菌群α多样性Tab.4 Difference of alpha diversity index of gut microbiota between health and diarrhea Rhinopithecus brelichi
基于Weighted UniFrac算法的PCoA、NMDS分析图及多样本相似度树状图显示,健康和腹泻样本各自聚类(图3A-C);基于Weighted UniFrac 算法的ANOSIM 分析显示健康与腹泻样本间差异显著(p=0.045)。
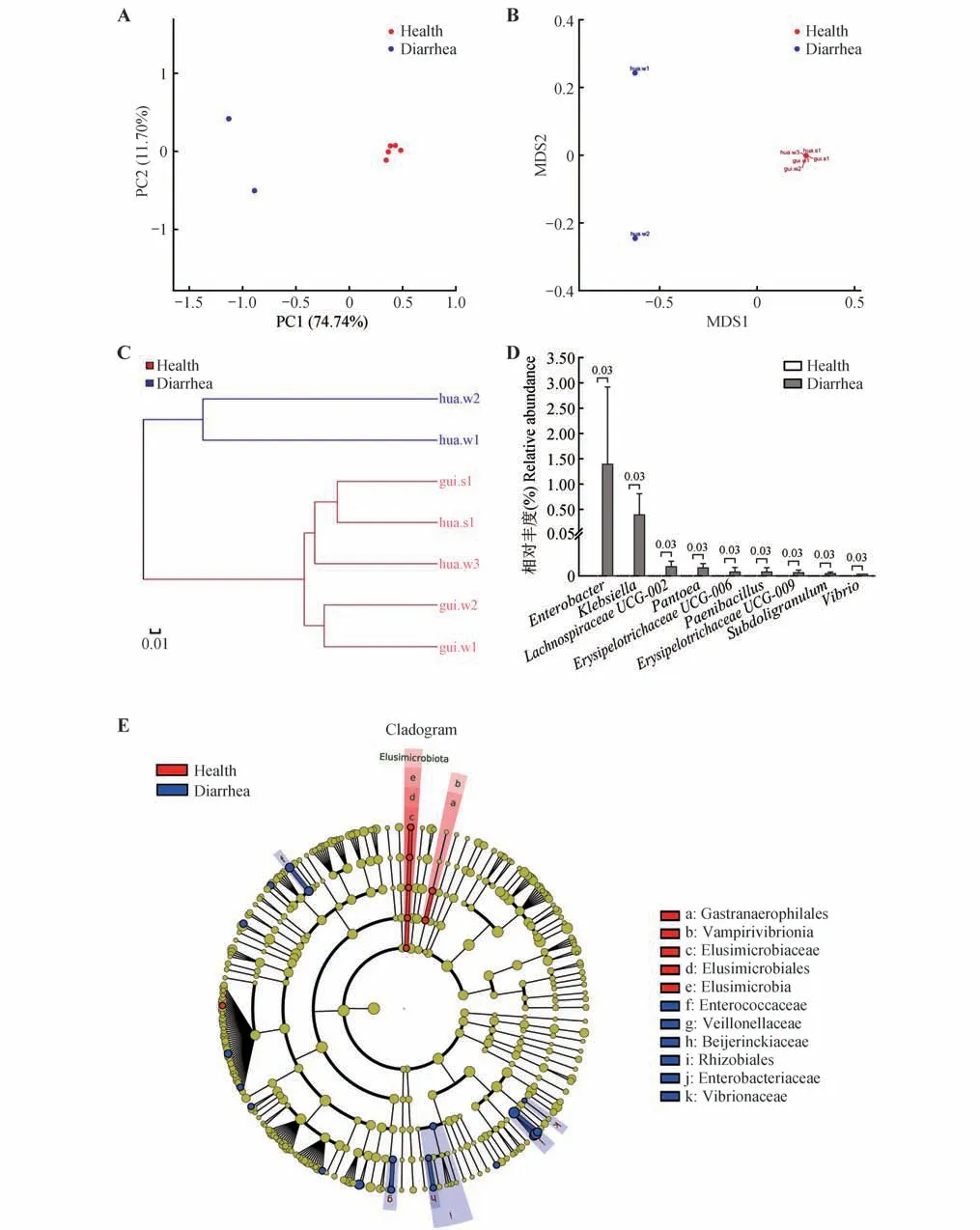
图3 健康与腹泻滇金丝猴肠道微生物组多样性和分类组成Fig.3 Diversity and taxonomical composition of gastrointestinal tract microbiota in fecal samples collected from the health and diarrhea Rhinopithecus brelichi
在门水平进行细菌域相关物种的分类学差异分析,健康组检测到16门,腹泻组仅检测到12门,未检测到迷踪菌门(Elusimicrobiota)、弯曲杆菌门、浮霉菌门(Planctomycetota)和绿弯菌门的相关物种;健康组和腹泻组在门水平无显著差异(p>0.05)。然而,腹泻组检测到厚壁菌门、拟杆菌门和变形菌门的平均相对丰度分别为23.32%、39.10%和26.33%,三者总相对丰度仅为88.75%;进一步分析2 个腹泻样本的优势菌变化,发现hua.w1和hua.w2样本内厚壁菌门相对丰度分别下降至26.63%和20.02%,伴随着hua.w1拟杆菌门相对丰度升高至59.57%和hua.w2 变形菌门相对丰度升高至48.48%。在属水平进行差异分析,健康组共检测到235 个属,而腹泻组仅检测到153 个属,统计学分析结果显示肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、Lachnospiraceae UCG-002、泛菌属(Pantoea)、Erysipelotrichaceae UCG-006、类芽孢杆菌属(Paenibacillus)、Erysipelotrichaceae UCG-009、罕见小球菌属(Subdoligranulum)和弧菌属(Vibrio)9 个属仅在腹泻组被检测到,且相对丰度均显著高于健康组(p<0.05)(图3D)。
LEfSe 进化分析显示:健康与腹泻黔金丝猴OTUs 在不同分类水平共检测到28 个微生物标志物的相对丰度存在显著差异;其中,典型标志物包括健康组样本内Elusimicrobia、Elusimicrobiales、Elusimicrobiaceae 的相对丰度显著高于腹泻组;腹泻组样本内的肠杆菌科(Enterobacteriaceae)、肠球菌科(Enterococcaceae)、弧菌科(Vibrionaceae)、韦荣氏菌科(Veillonellaceae)、拜叶林克氏菌科(Beijerinckiaceae)和根瘤菌目(Rhizobiales)的相对丰度显著高于健康组(图3E)。
3 讨论
近些年,随着分子生物学技术的发展,有研究者从基因组结构、高海拔适应性和进化等多角度开展不同金丝猴物种间的差异分析,如不同种群金丝猴在遗传多样性、近亲繁殖和突变负荷等方面存在差异,且长期近亲繁殖可能导致金丝猴免疫能力下降,对种群的长期生存前景产生巨大影响[8-10]。在临床上也发现,金丝猴对胃肠道寄生虫,尤其是毛尾线虫(Trichurissp.)极为敏感[11-12],常引起间歇性腹泻,甚至排血色水样粪便[13]。采用驱虫药治疗时,阿苯达唑对川、黔金丝猴毛首线虫具有良好的驱虫效果,高龄滇金丝猴可能因机体抵抗力相对较弱出现驱虫效果不佳[14],增强机体抵抗力可能在胃肠道寄生虫病的防控上发挥重要作用,基于物种的肠道微生物组差异分析可能为金丝猴胃肠道健康及疾病防控提供参考数据。
据报道,圈养环境会影响川金丝猴的肠道微生物组,致使圈养与野生种群在肠道微生物组结构和功能上存在显著差异[7]。本研究结果显示,圈养川、滇和黔金丝猴健康个体的肠道微生物组的优势菌门为厚壁菌门、拟杆菌门和变形菌门,这与人类肠道微生物组的组成相似[15],金丝猴暴露于人类影响和圈养环境中可能会引起肠道微生物组人源化,这与Jia等[16]报道的北京动物园圈养北白颊长臂猿(Nomascus leucogenys)肠道微生物组结果也相似;且3 种圈养金丝猴3 种优势菌门的平均相对丰度相近,这提示,相似的圈养环境也可能使灵长类动物肠道微生物组朝着相似的方向发展。本研究中圈养川金丝猴样本内厚壁菌门和拟杆菌门的相对丰度分别为54.13%和29.41%,这与Yao等[3]报道的人工投食的神农架川金丝猴菌群结构相似;而Wang 等[7]采用鸟枪法测序宏基因组关联分析上海野生动物园圈养川金丝猴肠道微生物组厚壁菌门和拟杆菌门相对丰度分别为27.1%和37.6%,这与本研究结果呈现相反的丰度模式,即厚壁菌门相对丰度低于拟杆菌门,且厚壁菌门的相对丰度与本研究结果相差27.0%,这可能与圈养环境及研究方法差异有关,但具体的差异因素仍需更多的数据验证。在相对丰度前10 的优势菌属中,UCG-005、Christensenellaceae R-7 group、UCG-002、Ruminococcus、NK4A214 group和[Eubacterium]coprostanoligenes group_norank隶属于厚壁菌门,Bacteroides、Muribaculaceae_norank、Rikenellaceae RC9 gut group和Prevotella_9隶属于拟杆菌门(图1D),其中,UCG-005、UCG-002隶属于颤螺旋菌科(Oscillospiraceae),UCG-005的丰度在3 种金丝猴中相对稳定。已知颤螺旋菌属(Oscillospira)在消化纤维素中发挥重要作用[17],Ruminococcus在哺乳动物纤维素分解过程中发挥着重要的协同作用[3];Bacteroides在维持肠道健康,发酵有机物产生能量和营养元素,降解果胶和木质素中发挥着重要作用[4,18-19];Christensenellaceae 相关物种广泛分布于人和动物肠道黏膜中,可能与机体的脂质代谢密切相关[20];Prevotella与碳水化合物和单糖的消化相关[21]。这些微生物共同参与机体营养物质代谢,维持着金丝猴健康和食叶的特性。
据报道,野生川金丝猴一般生活在海拔1 500~ 4 100 m 的针阔混交林或阔叶混交林内,食物以芽、叶片、果实和树皮为主,松萝属(Usnea)地衣在川金丝猴食谱中占很大比例,长松萝(U.longissima)是神农架地区常见的树生枝状地衣,是川金丝猴重要的食源地衣之一[22],神农架川金丝猴栖息地内共有31科58属85 种川金丝猴的食源植物,食源植物的无氮浸出物、粗纤维和粗灰分为夏季取食的主要影响因子;而食源植物的粗纤维、粗蛋白和相对丰富度为秋季取食的主要影响因子[23]。滇金丝猴主要栖息于海拔2 600~4 200 m 的针阔混交林和暗针叶林中[24],白马雪山自然保护区内滇金丝猴的食物种类达113种,隶属36科,其中菌类1种,地衣2种,种子植物110种,滇金丝猴对各种植物的喜食程度不一,长松萝是主要采食对象,一年四季都食用,因食物供应的波动性导致食物组成出现明显的季节性[25]。与川金丝猴和滇金丝猴不同,黔金丝猴的生境条件与川金丝猴和滇金丝猴有很大差异,主要生活在700~2 000 m 的常绿、落叶阔叶混交林中,主要食物常年供应相对充足,而地衣类植物分布很少,未观察到黔金丝猴采食地衣;夏季和秋季,作为黔金丝猴食物的叶和果实等种类多,数量充足;在冬季,落叶类树种树叶落尽,常绿树种叶较老,黔金丝猴主要以芽、嫩皮为食,食物量少,丰富度低[26]。圈养条件下,3 种金丝猴肠道微生物群组成和丰度的差异可能反映了它们在物种、饮食、地理位置、温度、降雨、管理和其他圈养条件等固有因素方面的差异。其中,饮食等环境因素作为改变肠道微生物菌群的有效手段,尤其令学者关注[27-28]。
进一步分析健康金丝猴样本,发现川金丝猴的Shannon、Evenness 指数显著低于滇、黔金丝猴(p<0.05),Simpson 指数显著高于滇、黔金丝猴(p<0.05),这提示川金丝猴样本的微生物群落的丰富度和多样性低于滇、黔金丝猴。此外,ANOSIM 分析显示3 种金丝猴样本间差异显著(p=0.001),物种分类学分析显示3 种金丝猴在细菌域不同分类水平上存在多物种的差异,LEfSe 进化分析显示3 种金丝猴OTUs 在不同分类水平共检测到47 个微生物标志物的相对丰度存在显著差异。本研究中3 种金丝猴饲养于同一馆舍内,处于相似的圈养环境,分析北京动物园圈养金丝猴食物组成发现,冬季供应食物种类包括苹果、香蕉等22种,为减少食物改变对动物造成的应激反应,换季时仅将个别水果和树叶做细微调整,且冬、夏季供应食物总质量和食物结构基本平衡。此外,在同一季节,虽然供应给川、滇、黔3 种金丝猴的食物总质量不同,但食物种类和结构基本一致,因此推测,肠道微生物组间的这种差异可能并非源于圈养环境下的食物组成。此外,PCoA、NMDS及多样本相似度树状图分析显示,滇、黔金丝猴样本各自聚类,而川金丝猴样本散分于滇、黔金丝猴样本之间;而彭燕章等[29]根据金丝猴形态特征及地质变迁推测我国3 种特有金丝猴系统发育关系,滇金丝猴是属中进化较完善者,而黔金丝猴是最原始者,在进化分离过程中,川、滇金丝猴最早分离,其次是川、黔金丝猴,最后是滇、黔金丝猴。3 种圈养金丝猴肠道微生物组与物种分离进化并未表现出直接的相关性,这可能与肠道微生物组受诸多影响因素相关,同时限于圈养种群数量,本研究仅对7 只个体的冬、春季肠道微生物组进行分析,未来仍需进一步扩充研究数据进行验证。
与健康滇金丝猴样本相比,腹泻样本肠道微生物组多样性显著降低,表现在α多样性指数的下降、4 个门和82 个属的相关物种的缺失。据报道,肠道微生物组多样性低的个体会表现出应激反应增强(糖皮质激素水平升高)和免疫功能降低(局部的特异性IgA 分泌细胞较少)[30-33],腹泻个体相对较低的肠道微生物组多样性是否意味着应激反应性增加及免疫功能降低有待更多的支持数据验证。此外,腹泻样本优势菌结构发生改变,表现为厚壁菌门平均相对丰度下降至23.32%,而拟杆菌门和变形菌门平均相对丰度分别上升至39.10%和26.33%。已知厚壁菌门消化分解饮食中纤维素[34];拟杆菌门主要促进多糖、蛋白质和脂肪的消化和分解[35];变形菌门内包含大量的病原菌[3]。在变形菌门中,Vibrio在水生生态系统中普遍存在,一小部分物种可以与真核宿主形成致病或共生作用,如霍乱弧菌(V.cholerae)会周期性地引起严重的腹泻疾病,该病通常是由于饮用了被病原体污染的饮用水所致[36]。Klebsiella的成员在过去10年中迅速进化,产生了同时表现出多重耐药和高毒力表型的菌种,它们与严重的医院和社区获得性感染有关,且多重耐药菌株常对碳青霉烯类抗生素耐受,没有最佳的感染治疗方案,对人类健康产生潜在的影响[37]。Enterobacter是一种全球性的重要病原体,是继埃希氏菌和克雷伯氏菌之后,人类肠杆菌科第三大常见致病菌,碳青霉烯类抗生素是治疗严重肠杆菌感染的主要药物,但耐药性的产生也削弱了治疗选择[38];Pantoea通常是引起植物发病的潜在病原菌,近些年的研究证据表明,泛菌属也常从医院环境中被分离出来,它在人类疾病中的作用还存在较大的争议[39],某些泛菌属物种可能是人类机会致病菌,免疫功能低下的个体通过植物材料所致的伤口或在医院获得性感染[40]。本研究中变形菌门Vibrio、Enterobacter、Klebsiella和Pantoea4个属仅在腹泻组样本内检测到,而健康样本未检测到相关基因,且它们的相对丰度均显著高于健康组(p<0.05)。这提示,肠道微生物菌群的紊乱可能促进个体腹泻的发生[4],已知变形菌门内的病原菌可能与金丝猴肠道疾病相关[3],本研究中变形菌门相关菌群的出现可能促进或参与滇金丝猴的腹泻。

