全癌标志物:尿路上皮癌的全程护航使者
董亚萍
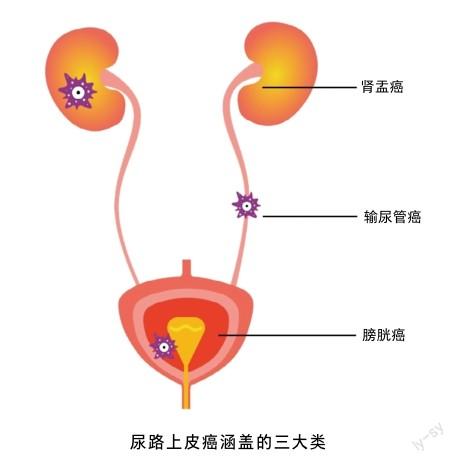
尿路上皮癌作为一种常见的恶性肿瘤,在全球范围内引起了广泛的关注。该疾病主要涵盖膀胱癌(约占90%)、输尿管癌以及肾盂癌(约占5%~10%)等,其发病率和死亡率逐年呈上升趋势,给人们带来了严重的健康威胁。根据2020年全球癌症统计数据所示,膀胱癌是全球排名第十的常见癌症,每年约有57.3万例新发病例和21.3万例死亡病例。男性患膀胱癌的比例高于女性,发病率和死亡率分别为9.5/10万人和3.3/10万人,且是男性第六位最常见的癌症[1]。根据2022年发布的中国癌症报告,2016年中国膀胱癌新发病例数为82 300例,预计死亡病例数为33 700例[2],这些数据凸显了该疾病在全球及中国国内的高发态势。据联合国癌症统计及分析机构预测,到2030年,中国新发膀胱癌患者的数量将达11.8万人。这一数据揭示了膀胱癌在中国不容忽视的流行趋势,进一步的研究和预防措施的制定显得尤为重要,以便有效应对该疾病不断上升的发生率。
尿路上皮癌,通常被称为移行细胞癌,其中以膀胱癌的发病率最高。该疾病分为肌层浸润性膀胱癌(MIBC)和非肌层浸润性膀胱癌(NMIBC),分别约占新诊断膀胱癌患者的25%和75%。MIBC具有浸润性生长和易于扩散的特点,而NMIBC则包括原位癌(CIS)、乳头状非浸润性肿瘤和侵犯固有层的乳头状肿瘤。NMIBC患者因反复接受膀胱镜检查和经尿道膀胱肿瘤电切术(TURBt)治疗,以致其成为治疗成本最高的恶性肿瘤之一,这对于医疗保健系统也是一项沉重的负担[3]。
全癌标志物与肿瘤
人体各器官的癌变过程不仅涉及基因组的改变,多种表观遗传学变化也广泛参与其中。DNA甲基化变化是肿瘤发生的关键因素之一,可导致染色体不稳定和肿瘤相关基因的异常表达。大量的DNA甲基化异常贯穿于正常细胞转变为肿瘤细胞的全过程,且发生于肿瘤超早期,这表明DNA甲基化模式的改变可能与多种肿瘤的发生密切相关[4,5]。在哺乳动物中,DNA甲基化主要发生在CG(CpG)位点,CG位点上的碱基序列以胞嘧啶接着鸟嘌呤出现。人类全基因组中含有大约2800万个CG位点,为了检测全基因组的DNA甲基化状态,测序需要覆盖足够多的CG位点。然而,传统的甲基化检测方法如芯片和简化基因组甲基化测序(RRBS)只能覆盖1%左右的甲基化位点。即使是全基因組甲基化测序(WGBS),对CG位点的覆盖率也仅为50%~60%。尽管肿瘤的早期诊断和治疗已成为共识,由于DNA甲基化测序技术的限制,目前尚未找到被广泛认可的肿瘤超早期DNA甲基化标志物。要找到这样的甲基化标志物,必须具备先进的全基因组甲基化测序技术和完善的研究方案。
2019年,全癌标志物研究联盟在《基因组研究》(Genome Research)上发表了全新的全基因组DNA甲基化检测方法——GPS (guide positioning sequencing),即“导航定位测序”[6]。与WGBS技术相比,GPS技术突破了WGBS技术比对率低的瓶颈,并将CG位点的检测覆盖率提高至96%。基于GPS技术对全基因组DNA的高精度和高覆盖度的甲基化检测,全癌标志物研究联盟团队发现了一类在肿瘤中普遍存在的甲基化位点,并首次提出了“全癌标志物”(universal cancer only marker, UCOM)的概念[7]。2022年,该团队发表了第三个全癌标志物——SIX6,其在尿路上皮癌、肺癌、结直肠癌、胃癌、宫颈癌、肝癌、乳腺癌等多种肿瘤中都可被用来有效区分正常组织和癌组织[8]。进一步的研究发现,全癌标志物有三个重要的特征。第一,具有“全”或“无”的特点,即正常组织不表达全癌标志物,当样本中检测到全癌标志物水平较高,则认为样本中存在恶性细胞。第二,全癌标志物是一个恶性肿瘤标志物,即全癌标志物来自恶性细胞,不易受机体其他因素影响。第三,全癌标志物检出可早于细胞病理形态变化,即其能在肿瘤癌前病变阶段检出异常。
在检测方面,全癌标志物研究联盟创新性地研发出DNA 甲基化检测方法——Me t hy l a t i o n quantitative PCR (Me-qPCR),该方法彻底摆脱了重亚硫酸盐处理的限制,基于荧光定量 PCR 即可完成DNA 甲基化的检测。该技术方法简便、易行、准确,将样本检测的稳定性、可重复性提高到新的高度,为未来全癌标志物甲基化检测的推广奠定了良好的技术基础。
2023年4月28日,全癌标志物研究联盟成员之一——上海奕谱生物科技有限公司研发的基于全癌标志物的尿路上皮癌检测产品“TAGMe DNA Methylation Detection Kit (qPCR) for Urothelial Cancer”(国内商标名:滂奕清)获得美国食品和药物管理局(FDA)授予的“突破性医疗器械认定”。全癌标志物获得FDA认定是走向世界关键的一步,标志着其在国际市场具有强有力的竞争力,为全癌标志物的全球推广打下了坚实的基础。
全癌标志物对尿路上皮癌的全流程监测
尿液作为一种非侵入性样本具有广泛的应用前景,在尿路上皮癌的监测中具有重要意义。随着标志物的发现和检测技术的进步,通过尿液中的全癌标志物甲基化水平进行全流程监测成为一种可行的策略,为尿路上皮癌的早期筛查、治疗效果评估和预后监测提供了新的途径。
揭秘超早隐匿病灶,全癌标志物引路示警
在临床上,尿路上皮癌患者最常出现的症状是间歇性和全程无痛性肉眼血尿,或伴有尿频、尿急等膀胱刺激征。血尿在中国人群中的发病率为5%,但仅有0.5%确诊为尿路上皮癌。其中,结石、感染等疾病也能引起血尿和膀胱刺激征,这些良性病变在一定程度上干扰了尿路上皮癌的临床诊断。此外,癌症早期的血尿间歇周期较长,患者易忽视病情发展,导致大多数患者在尿路上皮癌的诊断中存在一定程度的延后。
目前临床上针对尿路上皮癌的检测方法存在诸多不足:①单用超声、CT 和 MRI 等影像学检查的临床应用价值有限。此外,肾功能不全者对增强 CT和 MRI 等检查不耐受。②膀胱镜下病理活检是膀胱癌诊断的金标准,但是膀胱镜检对于早期影像难以辨别或者扁平状癌的诊断准确性不足;并且膀胱镜属于侵入性检查,其对尿路上皮本身有一定损伤,患者的依从性差。③针对上尿路尿路上皮癌的输尿管镜检查(URS)操作有潜在的肿瘤播散风险[9]。④基于尿液样本的尿脱落细胞学的诊断敏感性与肿瘤分级呈正相关,对于低级别肿瘤的敏感性较低(仅16%),由于灵敏度低,细胞学阴性的患者无法排除尿路上皮癌风险。
尿液与尿路上皮细胞直接接触,可以无创获得尿路上皮癌所脱落下来的肿瘤细胞,因此尿液是检测尿路上皮癌的理想样本来源。目前,尿路上皮癌的早期无创诊断是泌尿系统肿瘤临床转化研究的前沿与热点之一。全癌标志物研究联盟通过Me-qPCR技术检测468 例临床尿液样本的全癌标志物DNA 甲基化水平。在尿路上皮癌患者的尿液样本中,全癌标志物甲基化水平显著高于对照组(非尿路上皮癌患者尿液)。全癌标志物甲基化检测尿路上皮癌的特异性为94.0%,敏感性为85.6%,具有非常好的临床检测性能。全癌标志物有望通过无创的尿液筛查手段来提高尿路上皮癌的早期诊断率,同时降低膀胱镜/输尿管镜带来的有创性伤害及并发症,并及时给予有效的临床干预,从而实现降低肿瘤死亡率及提高患者生存质量的目的。
客观评价准确诊疗,全癌标志物全程守护
在NMIBC的治疗策略中,TURBt是其常用的治療方式。然而,NMIBC 进行TURBt后存在肿瘤残余是术后复发的重要原因之一。单发肿瘤首次进行TURBt的残留率为 22%,多发肿瘤的残留率高达45%。二次TURBt可发现膀胱肿瘤残留病灶,获得更准确的病理分期,改善无复发生存率及患者预后,提高治疗效果。遗憾的是,目前临床对于首次 TURBt是否充分,并没有一个客观的检查指标,切除是否完全依靠医生的个人经验,对于二次TURBt的选择缺乏循证医学依据,导致其在临床实践中存在一定的困惑和争议。因此,需要进一步研究和探索更可靠、准确的评估方法和决策依据,从而提高首次TURBt的效果和准确选择二次手术的策略,最终改善尿路上皮癌患者的治疗结果和预后。
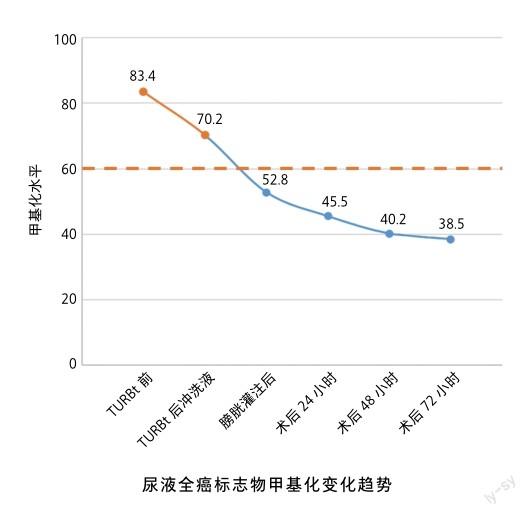
基于全癌标志物在尿路上皮癌诊断中的高敏感性及特异性,全癌标志物对于尿路上皮癌是否需要二次TURBt的评估具有重要的临床意义。假设尿路上皮癌患者接受TURBt后切除完全,此时膀胱内处于无瘤状态,膀胱中的尿液应该不再残存肿瘤细胞及其DNA,患者的尿液从术前的全癌标志物甲基化阳性转为阴性。如果患者首次TURBt后,尿液依然持续性全癌标志物甲基化阳性,此时就应该考虑手术切除不完全,患者需要及早进行治疗。对于TURBt后尿液全癌标志物甲基化阳性的患者,如在膀胱镜下发现可疑的病灶,可在首次TURBt后2~6周进行二次TURBt。全癌标志物甲基化检测可在术后几天内判断TURBt切除是否完全,然而遗憾的是,临床其他检查手段常常无法在该阶段确认是否存在残留病灶或其残留位置。此时,医生可选择对患者进行膀胱灌注维持治疗,通过化疗药物杀灭残留病灶的肿瘤细胞。在此过程中,依然可以使用全癌标志物进行灌注化疗的疗效评估,如果患者灌注后的尿液全癌标志物甲基化水平在逐步下降,则说明灌注化疗对残留病灶有很好的控制效果;假如灌注后的尿液全癌标志物甲基化水平维持阳性状态甚至呈上升趋势,则说明肿瘤细胞对该次灌注化疗药物不敏感,需要更换灌注药物。
诚然,目前全癌标志物在该领域的研究仍处于探索阶段,临床医生做诊疗决策时缺少匹配全癌标志物甲基化监测的标准化方案,并且需要更多临床患者的随访数据来验证术后全癌标志物甲基化结果与二次TURBt的长期预后获益。未来全癌标志物甲基化检测还将探索其在靶向治疗、免疫治疗和基因编辑等新兴治疗方法中的疗效评估应用,结合更多临床数据进行综合分析,以提高全癌标志物在尿路上皮癌治疗中的应用价值,以期为尿路上皮癌患者提供更准确的治疗选择和个体化的诊疗方案。
动态监测肿瘤复发,全癌标志物无懈可击
与常见的恶性肿瘤相比,尿路上皮癌具有易转移、易复发等特点。NMIBC术后5年内复发率高达24%~84%,且约有15%~20%患者最终会发展为MIBC。而MIBC患者行根治性膀胱切除术后约50%出现复发或转移[10]。NMIBC的管理策略强调对疾病的积极监测和早期干预,最大限度地减少其进展为MIBC的风险。膀胱癌术后 24~36 个月内肿瘤复发比例最高,欧洲泌尿外科协会指南建议高危NMIBC患者在5年内接受多达14次膀胱镜检查[11]。然而,密集的诊疗方案不仅对患者身体造成了负担,也对医疗资源和医保系统产生了沉重的压力。因此,为NMIBC患者提供更有效、更经济的治疗策略迫在眉睫,以改善其生活质量并降低医疗费用。
使用尿液全癌标志物甲基化检测代替膀胱镜检查可能是一种既提高复发监测效率又降低医疗保健花费的临床策略。全癌标志物研究联盟对已进行TURBt的NMIBC患者开展每月1次的尿液全癌标志物甲基化监测,基于前瞻性的队列,他们发现,所有在膀胱镜下发现复发灶的患者,其尿液全癌标志物甲基化检测在膀胱镜确诊前3~15个月已经转为阳性。而尿液全癌标志物甲基化监测到随访截止时仍为阴性的患者,其临床膀胱镜随访结果也为阴性。更有意义的是,一部分患者尿液全癌标志物甲基化已经转为阳性,但是膀胱镜下随访仍为阴性,这类患者可能目前处于肿瘤复发早期,膀胱镜下难以发现病灶。这也意味着此时进行干预可以获得较好的治疗效果,医生可给予患者额外的膀胱灌注治疗,并使用尿液全癌标志物甲基化监测灌注治疗的效果。假设通过膀胱灌注治疗对早期癌灶复发进行控制,可以有效延迟肿瘤的复发甚至降低NMIBC的临床复发率。
未来在尿液全癌标志物甲基化检测为阴性的情况下,膀胱镜检查可以安全地推迟,从而有效提高患者的依从性,减轻患者和卫生保健系统的经济负担;在尿液全癌标志物甲基化检测为阳性的情况下,应尽快明确复发灶情况并及早给予有效的治疗。
展望未来肿瘤筛查,全癌标志物造福大众

目前尿路上皮癌还不满足筛查的标准,因为血尿是一种临床非特异性症状,大多数血尿的人群并没有患有尿路上皮癌,使用血尿的阳性预测值仅为8%。因此,研究人员建议,尿路上皮癌的筛查重点应放在高危人群上,血尿检测应与其他诊断标志物结合。一项在暴露于芳香胺的化学工人中评估尿液肿瘤标志物检测性能的研究发现,尿核基质蛋白22(NMP22)检测成本过高且存在大量的假阳性检测(3%)[12]。既有研究认为尿液标志物不适用于尿路上皮癌的筛查,主要是因为这类技术在人群中的检测效能和经济成本尚未得到完全评估。
由于人口老龄化的加剧,世界各地的尿路上皮癌患者数量将呈上升趋势。对尿路上皮癌高危人群开展筛查是可行的,但必须提前平衡利弊,需要更准确更经济的尿液肿瘤标志物。全癌标志物甲基化检测在尿路上皮癌中的诊断特异性可达94%,这大大降低了尿液标志物在肿瘤筛查中的假阳性率,可以避免不必要的膀胱镜检查。任何肿瘤筛查项目是否具有成本效益都是需要重点考量的指标,全癌标志物仅使用一个甲基化位点(SIX6)即可获得非常好的临床检测性能,这显著减少了尿液甲基化检测的成本。此外,全癌标志物的检测是基于无重亚硫酸盐处理的Me-qPCR技术,该技术进一步降低了尿液全癌标志物甲基化检测的成本。并且,近年數字 PCR(digital PCR, dPCR)技术得到了长足的发展,dPCR具有更高的灵敏度、准确度及高耐受性。因此,未来全癌标志物甲基化检测可与dPCR平台进行有机结合,应用于尿路上皮癌高危人群混合尿液样本的检测,这将进一步降低尿路上皮癌尿液筛查的成本,达到筛查效果和经济支出的收益平衡。
结 语
在世界范围内,尿路上皮癌的发病率将持续增加,这对肿瘤的临床诊断流程、治疗效果、疾病进展控制和复发监测都提出了更高的要求。我们需要减少劳动密集型的临床诊疗策略(包括诊断、治疗和随访手段),进行技术创新开发出更加适合居家的简易的监测手段,使尿路上皮癌的管理更科学、更简便、更有效。尿液全癌标志物甲基化检测在尿路上皮癌的筛查、诊断、治疗评估及复发监测中都显示出巨大的应用前景。未来全癌标志物的进一步研究和创新的应用场景开发将有助于为医生提供更多有效的临床检测手段,帮助尿路上皮癌患者及早发现肿瘤、提高生活质量及预后。
[1]Sung H, Ferlay J, Siegel R L. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2021, 71: 209-249.
[2]Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016. J Nat Cancer Center, 2022, 2: 1-9.
[3]Van Hoogstraten LMC, Vrieling A. Global trends in the epidemiology of bladder cancer: challenges for public health and clinical practice. Nat Rev Clin Oncol, 2023, 20: 287-304.
[4]Baylin S B, Jones P A. A decade of exploring the cancer epigenome-biological and translational implications. Nat Rev Cancer, 2011, 11: 726-734.
[5]Irizarry RA, Ladd-Acosta C, Wen B, et al. The human colon cancer methylome shows similar hypo- and hypermethylation at conserved tissue-specific CpG island shores. Nat Genet, 2009, 41: 178-186.
[6]Li J, Li Y, Li W, et al. Guide positioning sequencing identifies aberrant DNA methylation patterns that alter cell identity and tumor-immune surveillance networks. Genome Res, 2019, 29: 270-280.
[7]Dong S, Li W, Wang L, et al. Histone-related genes are hypermethylated in lung cancer and hypermethylated HIST1H4F could serve as a pan-cancer biomarker. Cancer Res, 2019, 79: 6101-6112.
[8]Dong S, Yang Z, Xu P, et al. Mutually exclusive epigenetic modification on SIX6 with hypermethylation for precancerous stage and metastasis emergence tracing. Signal Transduction and Targeted Therapy, 2022, 7:208.
[9]Rouprêt M, Seisen T, Birtle A J, et al. European Association of Urology Guidelines on Upper Urinary Tract Urothelial Carcinoma: 2023 Update. Eur Urol, 2023, 84: 49-64.
[10]Van Rhijn BW, Burger M, Lotan Y, et al. Recurrence and progression of disease in non-muscle-invasive bladder cancer: from epidemiology to treatment strategy. Eur Urol, 2009,56:430-442.
[11]Babjuk M, Burger M, Capoun O, et al. European Association of Urology Guidelines on Non-muscle-invasive Bladder Cancer (Ta, T1, and Carcinoma in Situ). Eur Urol, 2022, 81: 75-94.
[12]Pesch B, Taeger D, Johnen G, et al. Screening for bladder cancer with urinary tumor markers in chemical workers with exposure to aromatic amines. Int Arch Occup Environ Health, 2014, 87: 715-724.
關键词:尿路上皮癌 全癌标志物 SIX6 全流程监控 ■

