中美儿科Ⅰ期临床试验注册现状比较研究
陈卓如 刘雨菁 钱莉玲 朱海涛 施鹏
(复旦大学附属儿科医院临床研究中心 上海 201102)
早期临床试验是临床研究机构开展临床试验创新性的一个重要标志,许多重大的科学发现来源于首次应用于人体的Ⅰ期临床试验[1]。Ⅰ期临床试验是初步的临床药理学及人体安全性评价试验,为进入Ⅱ期临床试验做准备,在创新药物的研发中发挥首要作用[1]。美国国立卫生研究院(National Institutes of Health,NIH)临床研究中心将“成为Ⅰ期临床试验的全球领导者”作为战略规划中的首要目标[2]。然而,Ⅰ期临床试验存在很大的不确定性,且在儿科领域开展风险更高、难度更大。目前,尚缺乏针对儿科领域Ⅰ期临床试验开展情况的调查数据[3-4]。本研究基于ClinicalTrials.gov 注册平台,比较中美两国儿科Ⅰ期临床试验注册现状,为推进我国儿科早期临床试验提供依据。
1 资料与方法
1.1 数据来源
选择ClinicalTrials.gov 为临床试验注册平台,检索儿科临床试验注册现状。
1.2 数据采集与整理
检索起止时间从建库至2022 年8 月16 日,检索年龄范围为儿童(出生~17 岁)。同一注册项目涉及不同地区、试验分期、研究类型时,分别记入不同地区、试验分期、研究类型。招募患儿年龄分期为:≤28 d 为新生儿期;>28 d,<1 周岁为婴儿期;≥1 周岁,<3周岁为幼儿期;≥3 周岁,<7 周岁为学龄前期;≥7周岁,<10 周岁为学龄期;≥10 周岁,<18 周岁为青春期。
发起者特征根据资金来源分为企业发起的临床试验(industry-sponsored trial,IST)和研究者发起的临床试验(investigator-initiated trial,IIT)。临床试验治疗领域按照《疾病和有关健康问题的国际统计分类》[5](简称ICD-10)分类标准进行分类。
1.3 统计学分析
分类资料采用n(%)进行统计描述,其中不同国家儿科Ⅰ期临床试验占比为某国Ⅰ期临床试验注册数占该国临床试验注册总数的比例。分析中美两国临床试验数量和试验分期分布,比较中美儿科Ⅰ期临床试验注册的时间趋势、受试者年龄分布、研究状态、发起者特征、治疗领域分布等。构成比组间比较采用χ2检验。采用R统计学软件进行统计分析,P<0.05 提示差异有统计学意义。
2 结果
2.1 中美儿科临床试验注册数量和试验分期比较
截至2022 年8 月16 日,全球在ClinicalTrials.gov 平台上已注册儿科临床试验84 112 项,其中Ⅰ期临床试验6 170 项(占7.3%)。儿科临床试验注册数量居前十的国家依次为美国、中国、加拿大、法国、英国、德国、意大利、西班牙、埃及、土耳其和比利时。Ⅰ期临床试验占比中国(8.7%)及其他国家均低于美国(12.0%)(表1)。
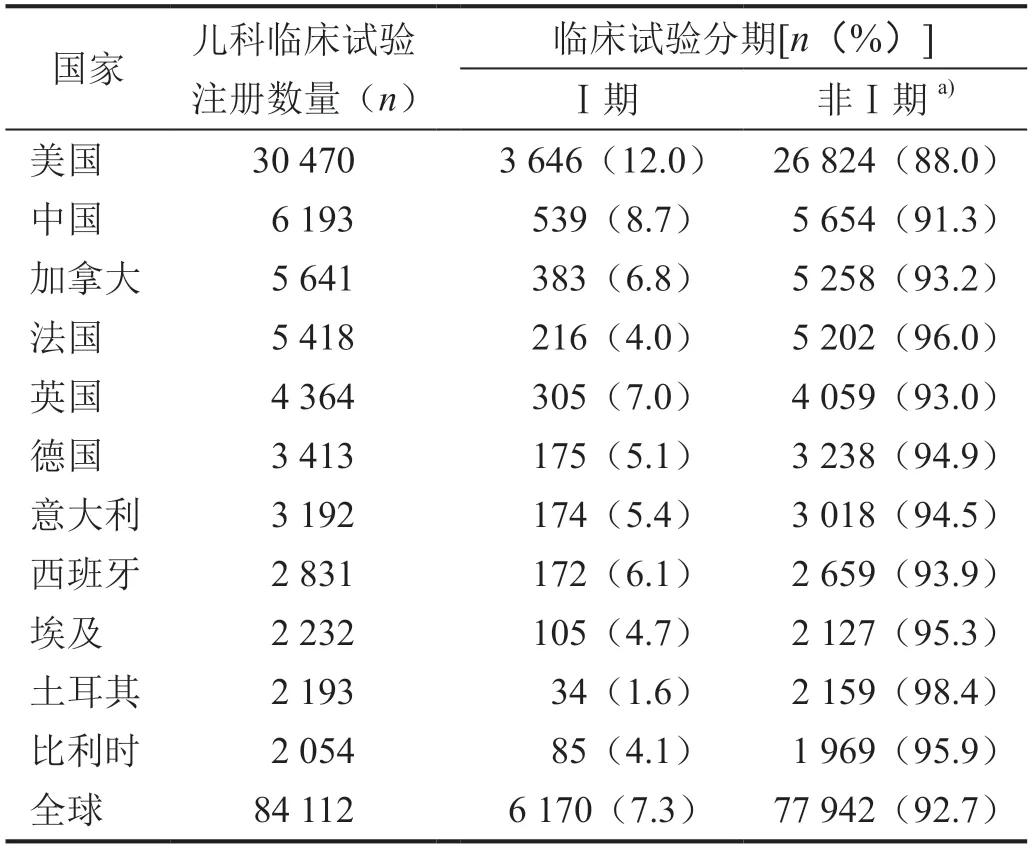
表1 儿科临床试验注册数量前10位国家不同分期临床试验构成
2.2 中美儿科Ⅰ期临床试验注册时间趋势比较
近10 年,美国Ⅰ期儿科临床试验注册数量基本保持稳定,Ⅰ期临床试验占比维持在10%左右。中国Ⅰ期儿科临床试验注册数增长迅速,注册数从2012 年12 项增长到2021 年69 项,占比从5.6%增长到9.0%(图1)。
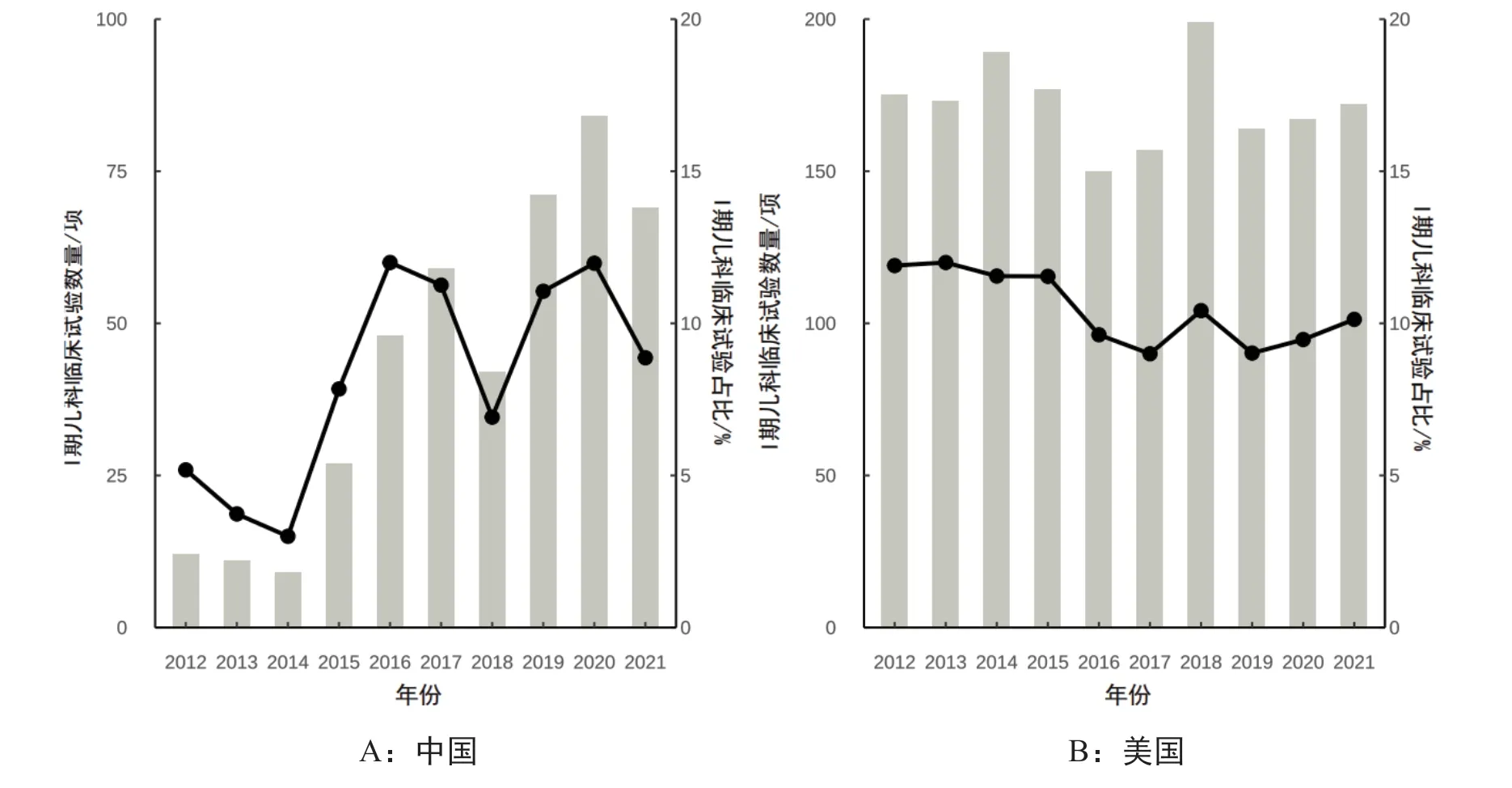
图1 2012—2021年中美Ⅰ期儿科临床试验注册时间趋势
2.3 中美儿科Ⅰ期临床试验招募人数构成比较
中国招募已结束的Ⅰ期临床试验数为102 项(18.9%),远低于美国2 142 项(58.7%)。而中国临床试验处于未知状态的比例为34.0%,高于美国的2.8%;处于招募中的试验比例为33.0%,高于美国的15.1%(表2,P<0.001)。

表2 中美儿科Ⅰ期临床试验特征比较[n(%)]
在招募已结束的临床试验中,中国招募人数在1~50 人的Ⅰ期临床试验比例为53.9%,低于美国的69.6%;而招募人数>400 人的Ⅰ期临床试验占比为3.9%,高于美国的2.2%(表2,P<0.001)。
2.4 中美儿科Ⅰ期临床试验招募人群起始年龄分布比较
在儿科Ⅰ期临床试验招募人群起始年龄分布方面,中国在新生儿期、学龄期的比例低于美国,但婴儿期、幼儿期、学龄前期、青春期的比例高于美国(表2,P<0.001)。
2.5 中美儿科Ⅰ期临床试验研究状态及发起方特征
中国Ⅰ期注册临床试验中IIT 占比为56.6%,低于美国的67.9%(表2,P<0.001)。
2.6 中美儿科Ⅰ期临床试验治疗领域比较
美国Ⅰ期儿科药物临床试验居于前5 位治疗领域分别为肿瘤(26.8%)、传染病和寄生虫病(5.5%)、内分泌、营养和代谢疾病(4.4%)、神经系统疾病(3.1%)、血液系统(2.7%),中国相对应用领域占比分别为17.6%、1.2%、1.2%、0.7%、2.2%,传染病、内分泌、营养和代谢疾病、神经系统疾病远低于美国(表3,P<0.05)。在基因治疗、器械和行为方面,两国治疗领域分布差异无统计学意义(P>0.05)。基因治疗临床试验中美两国治疗领域居首位的均为肿瘤领域;器械方面的Ⅰ期临床试验,美国肿瘤领域有15 项(0.4%),而中国无相关临床试验;行为方面的Ⅰ期临床试验,美国精神和行为障碍领域有101 项(2.7%),中国有3 项(0.5%)。
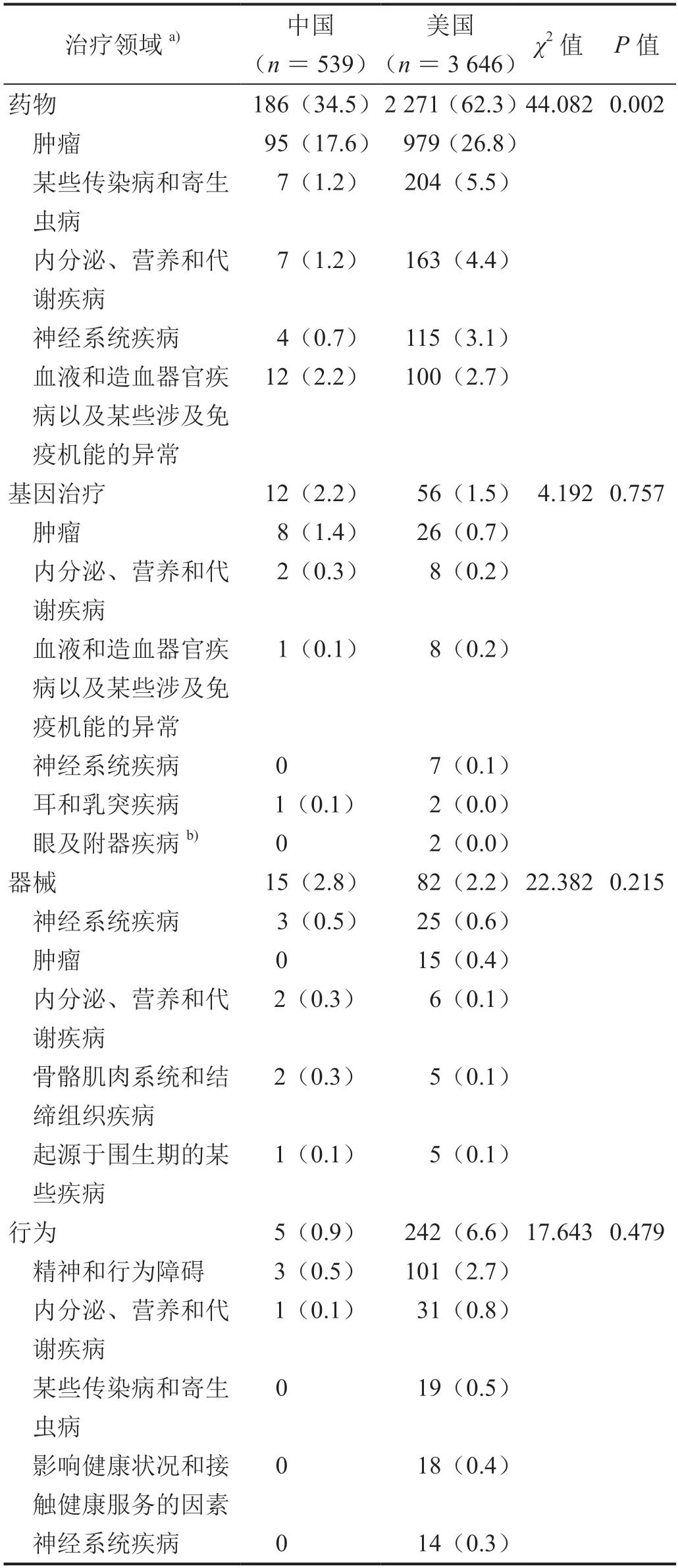
表3 中美儿科Ⅰ期临床试验治疗领域分布[n(%)]
3 讨论
目前,儿童用药短缺、实际处方中超说明书用药情况严重,对临床治疗效果和患者安全带来巨大的隐患。2016 年,李逸云等[6]对我国78 家医院儿童用药的调查分析显示,高达68.96%的药品为非儿童用药,而儿童专用药品仅占0.70%。2017 年,梅枚等[7]对我国436 家医院的儿童超说明书用药情况进行调查,结果显示,63.8%的医生曾开具超说明书用药处方。超说明书用药可能导致不良反应发生率显著增加[8]。临床试验是药品上市前必不可少的环节。儿童的生理、行为、代谢、激素等与成人不同,且处于生长发育阶段,成人临床试验的结果无法简单地应用于儿童,大多儿童药物缺乏临床试验数据。然而,因成本高、利润低、伦理问题、招募困难、试验的复杂程度和风险远高于成人等,儿科临床试验的开展面临巨大的挑战,尤其是作为首次人体试验的Ⅰ期临床试验。
中国儿科Ⅰ期临床试验虽然在近十年发展较快,但注册项目数量和临床试验占比与美国仍存在较大差距。我们研究发现超30%的儿科临床试验在美国开展,且美国Ⅰ期临床试验比例远高于我国。美国早在1997 年就意识到新药研究公开试验信息的必要性,并于2004 年明确提出只有在征集首位患者之前就进行注册,才会考虑发表对应的研究结果[4]。此外,美国对Ⅰ期临床试验关注度较高,NIH 临床研究中心在成立65 周年时的战略报告中指出,其许多重大的科学发现是在Ⅰ期临床试验中探索而得,并将继续引领全球的首次人体试验作为今后目标之一[9]。而我国儿科临床试验起步较晚。2003 年国家药品监督管理局颁布的《药物临床试验质量管理规范》正式将儿童纳入药物临床试验对象[10]。自2011 年开始,我国采取一系列措施鼓励儿童专用药品研发和生产[11-12]。与本研究结果相似,Wu 等[13]的研究显示2009—2019 年,在中国内地开展的儿科药物临床试验数量急速上升,尤其是自2016 年开始,数量显著上升。然而我国内地临床试验开展的地理分布并不均衡。Wu 等[13]的研究显示临床试验的牵头单位主要分布在华东、华北、华中。Song等[14]根据中国临床实验注册中心数据库,发现应用于上市和审批的药物临床试验,其主要研究人员在北京的数量远远高于其他省级行政区。这种地理分布的不均衡很大一部分来源于临床医疗资源分布的不均,尤其是获批开展儿科临床试验的临床机构的分布。
Ⅰ期儿科临床试验适用对象和领域有待进一步提高。本研究发现,美国Ⅰ期儿科临床试验纳入人群的年龄起始于新生儿期的比例远高于中国。儿童在不同生长发育期具有不同的生理特征,对药物的反应也大相径庭。器官不成熟、屏障未建立等因素让新生儿期成为更特殊的一个时期。然而新生儿中超说明书用药情况却非常严峻,高达90%[15]。对药物的迫切需求与不同生长发育阶段的临床试验数据的短缺之间的矛盾是目前Ⅰ期儿科临床试验面临的一大问题。无论中国还是美国,儿科小样本量(1~50 人)的Ⅰ期临床试验的比例较高。儿科早期临床试验,其风险较高,实施的难度较大,所需的成本远高于成人,故往往纳入的患者数量较少。虽然小样本量的研究可行性更高,但可能会导致结果的稳健性较差。此外,中国研究状态处于不明的Ⅰ期临床试验比例远远高于美国。考虑到研究者发起的IIT 的比例较高,而IIT 研究虽然紧贴临床需求,但欠缺规范化的指导、充足的经费、优化的试验方案和企业所拥有的标准操作规程及监查稽查,在设计和管理上相对不足。
我国Ⅰ期儿科临床试验在肿瘤等领域发展较好,但在其他疾病和器械及行为方面的临床试验有所短缺,并且市场成熟的生物药占据了很大比例。以精神和行为障碍疾病为例,相比起美国,我国对此类疾病的临床试验较少,并且关注度不足。而Li 等[16]对5 个省73 992 名6~16 岁学龄儿童进行精神障碍患病调查,结果显示精神疾病的加权患病率高达17.5%。此外,相比起美国,我国行为方面的临床试验近乎空白。
此外,本研究存在一些局限。第一,本研究基于ClinicalTrials.gov 注册平台比较中美临床试验注册情况,未纳入中国临床试验注册中心(Chinese Clinical Trial Registry,ChiCTR)等其他临床试验注册平台数据,可能低估了中国的儿科临床试验数据。第二,本研究中美治疗领域比较,仅根据注册疾病的ICD-10 编码进行治疗领域划分,未进一步分析注册项目的药物及产品,无法对治疗领域的具体研究方向做出提示。
4 结论
近十年来,中国政府一直致力于生物产业的发展,鼓励开展儿科临床试验、推动儿童药物的研发生产,以期促进儿童健康。与美国相比,还应鼓励研究者发起的Ⅰ期儿科临床试验,在新生儿临床试验,以及药物、器械和行为等相关治疗领域研究获得进一步发展。

