牛支原体黏附素及黏附素结合蛋白研究进展
武 琪,张玉娟,刘 桐,辛九庆,徐青元
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,哈尔滨 150069)
牛支原体(Mycoplasmabovis,M.bovis)又称牛霉形体,属于原核生物界软壁菌门柔膜体纲支原体目支原体科支原体属,无细胞壁,基因组大小约为1 080 kb。M.bovis最早于1961年在美国患有乳腺炎奶牛的牛乳中分离到[1],20世纪90年代,在欧洲和北美牛场流行。2008年,辛九庆等[2]首次从我国患肺炎的犊牛肺中分离到M.bovis,随后湖北甘肃等地相继出现M.bovis感染病例[3-4]。易感动物主要通过呼吸道、乳头管或生殖道感染M.bovis,带菌精液的人工授精也是一种常见的传播途经[5]。M.bovis可侵袭牛的肺、乳腺、关节、角膜、生殖道等器官,进而引起感染牛出现肺炎、关节炎、乳房炎、角膜结膜炎和生殖道炎等临床症状,并且不同年龄不同品种牛均可感染[6]。M.bovis与某些病原体还存在协同作用,常导致混合感染,如溶血性曼氏杆菌、多杀性巴氏杆菌、睡眠嗜组织菌、化脓隐秘杆菌[7]以及牛呼吸道合胞病毒、副流感3型病毒、腺病毒、牛病毒性腹泻病毒及牛传染性鼻气管炎病毒[7-8]。从M.bovis首次分离至今虽已过去数十年,但是由于存在缺乏基因组操作方法和昂贵的动物模型等不利因素,导致其诊断、治疗和疫苗的研究进展缓慢,此外,虽然有许多关于M.bovis体内和体外感染研究,但对牛支原体的致病机制仍知之甚少。M.bovis通过黏附素结合于宿主细胞,进而实现对宿主组织的定植和感染,其致病性与其黏附能力密切相关。因此本文主要对M.bovis黏附素和黏附素结合蛋白的研究进展进行综述,以期为M.bovis致病及免疫逃逸机制和今后M.bovis已知未知黏附素的鉴定和应用提供参考。
1 M.bovis与宿主细胞的黏附
M.bovis感染的第一步是在宿主体内定植,而黏附于特定的靶细胞是定植的前提,因此黏附是M.bovis感染的关键步骤。与肺炎支原体和生殖道支原体不同,M.bovis没有行使黏附功能的特殊细胞器,但M.bovis可以表达具有黏附功能的膜蛋白介导其与宿主之间的黏附并在调节宿主防御方面发挥重要作用,包括炎症因子的产生和免疫细胞的凋亡[7,9-10]。此外,M.bovis的一些代谢物如核酸酶、过氧化氢也可诱导宿主产生炎症反应[11]。这些对宿主造成的损伤都与黏附蛋白在病理生理过程中发挥的作用密切相关。M.bovis虽然主要感染牛,但对绵羊[12]、山羊[13]、猪[14]、鹿[15]和人类[16]的感染也有报道,现已从感染牛的呼吸道、乳房、关节、心、大脑等多个器官分离到M.bovis[17-18]。M.bovis还能黏附多种类型的宿主细胞包括胎牛肺细胞(EBL)、牛肾细胞(MDBK)、兔肾细胞(RK)和胚胎牛气管细胞(EBTr)[19],M.bovis对不同细胞的黏附导致病原体向不同定植点传播可能是其多种临床表现的原因,同时也可能与其逃避免疫系统杀伤以及削弱抗生素的治疗效果相关。这种M.bovis感染多种动物、组织和细胞的现象表明,M.bovis的黏附素可能是复杂多样的。当前M.bovis的疫苗产品和M.bovis的检测方法还有很大的改进空间,而且M.bovis非常容易产生耐药性,致使M.bovis疾病的预防、控制和清除均非常困难[20]。考虑到黏附素在M.bovis感染和致病方面的重要作用,理论上可将其做为疫苗的候选成分。此外,许多黏附素具有良好的免疫原性和反应原性,具备建立血清学检测方法的潜力。
2 M.bovis黏附素
迄今为止,已鉴定出16种蛋白参与M.bovis的黏附(表1)。其中7种黏附素具有明确的宿主结合蛋白,3种黏附素可以与两种不同的宿主蛋白相互作用(图1),4种黏附素除了具有结合功能外,还具有酶活性。以下将对这些黏附素的发现过程、以及部分生物学特性进行详细的阐述,以期为M.bovis黏附蛋白的研究与应用提供思路。
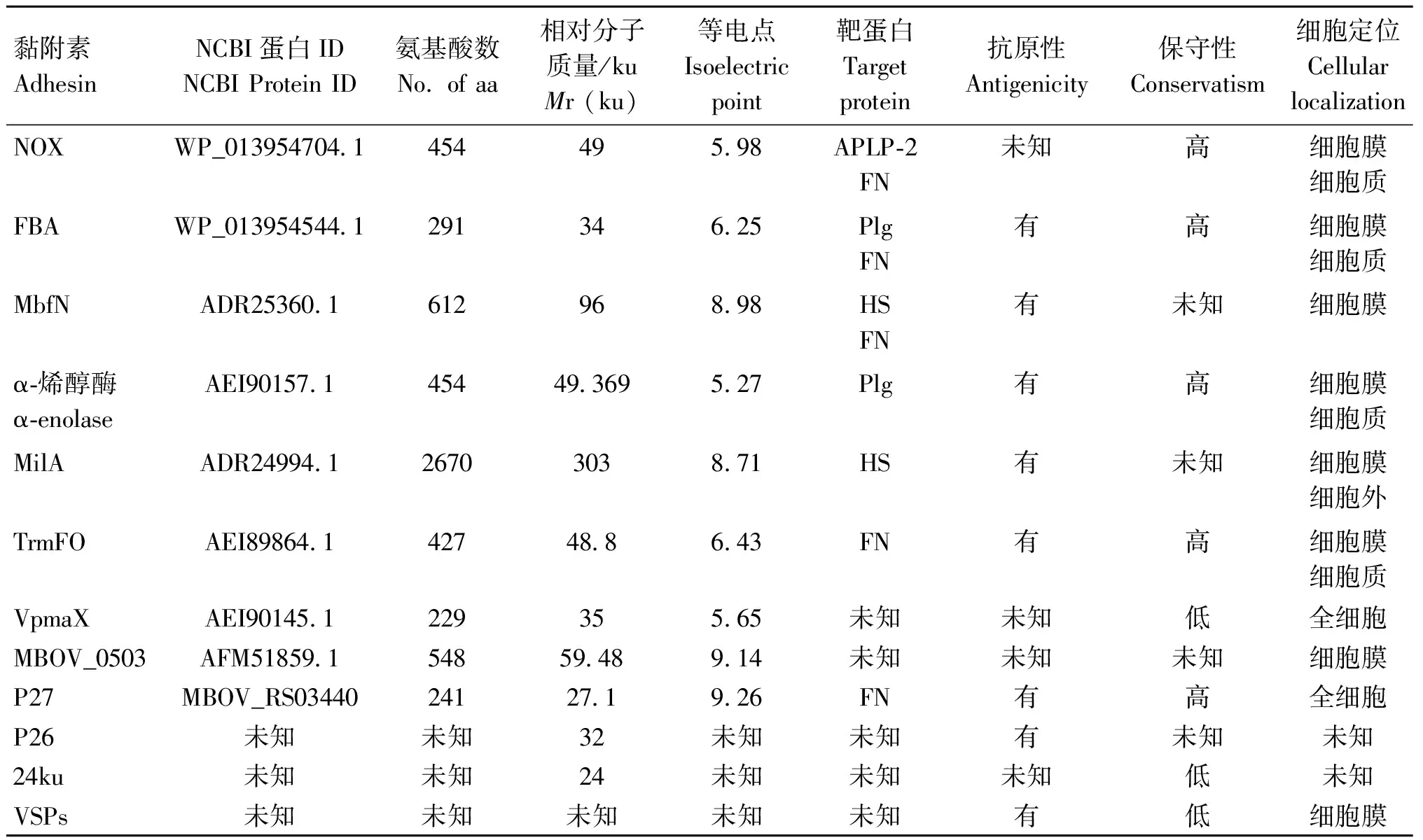
表1 M.bovis黏附素信息汇总
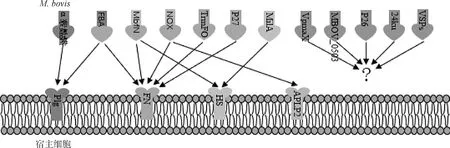
图1 M.bovis黏附素与黏附素结合蛋白互作
2.1 NADH氧化酶
NADH氧化酶(NADH oxidase,NOX)黏附素包含454个氨基酸,相对分子质量(Mr)为49 ku,无信号肽或跨膜区,分布于M.bovis的细胞质和细胞膜。有些细菌如肺炎链球菌的NOX具有黏附活性并且该蛋白高度保守[21]。Zhao等[22]发现M.bovis基因组中存在nox基因的同源物,因此推测该同源物可能是M.bovis的黏附素并且具有酶活性。分析发现M.bovis的nox基因与肺炎链球菌和化脓性链球菌基因相似性分别为39%和42%。研究证实原核重组NOX(rNOX)能与EBL细胞的细胞膜和细胞质蛋白结合,并与膜蛋白的结合强于细胞质蛋白。此外,rNOX能催化NADH为NAD+同时产生H2O2,其催化位点和黏附位点相互独立。rNOX蛋白和抗rNOX血清均能阻断M.bovis对EBL细胞的黏附。与野生型菌株相比,NOX蛋白缺陷菌的黏附性和过氧化氢产量下降。包世俊等[23]还发现在补体存在下NOX黏附素抗体对M.bovis的杀菌率高达57.86%。Zhao等[22]用rNOX包被ELISA板筛选人肺cDNA文库的T7噬菌体证实rNOX可以特异性地黏附在APLP-2和FN上。
2.2 果糖-1,6-二磷酸醛缩酶
果糖-1,6-二磷酸醛缩酶(fructose-1,6-bisphosphate aldolase,FBA)是糖酵解、糖异生和卡尔文循环过程中的关键酶[24],这种酶催化果糖-1,6-二磷酸可逆转化为甘油醛-3-磷酸和磷酸二羟基丙酮。除能量代谢外,FBA还具有许多生物学功能,包括作为Plg结合蛋白、转录调节因子、抗真菌剂的靶标和参与宿主细胞黏附[25-29]。Huang等[30]和Gao等[31]对M.bovis的FBA进行了研究,发现该蛋白是M.bovis的黏附素,并证实了该黏附素的结合蛋白为FN和Plg。M.bovis的FBA黏附素包含291个氨基酸,Mr为34 ku,无信号肽和跨膜区,分布于细胞质和细胞膜中,具有免疫原性。FBA在支原体中高度保守,M.bovis不同菌株中的FBA相似性高达99%,与其它支原体的相似性高达60%。原核表达的重组M.bovisFBA(rMbFBA)能将NADH转化为NAD+,兔抗rMbFBA血清在补体存在下可杀死44.1%的M.bovis,rMbFBA抗体可阻断34.4%的M.bovis对EBL细胞的黏附。
2.3 M.bovis纤维连接蛋白结合脂蛋白
Adamu等[32]在研究支原体脂蛋白的生化作用时,通过生物信息学分析发现一个富含亮氨酸重复(leucine-rich repeat,LRR)的脂蛋白可能具有黏附活性。进一步研究发现该蛋白由mbfN基因编码,该基因位于M.bovisPG45菌株核苷酸654 047和655 885之间。完整的LRR蛋白包含612个氨基酸,Mr为96 ku,等电点为8.98,有信号肽无跨膜区,主要分布于M.bovis细胞膜表面,具有免疫原性。LRR黏附素的226―284残基中存在一个G蛋白偶联受体激酶相互作用蛋白1(GIT1)样结构域,该结构域在真核生物的细胞黏附、运动、细胞骨架重塑和跨膜运输中发挥重要作用。LRR蛋白具有完整蛋白和C端147个氨基酸缺失两种形态,具体表现为蛋白质电泳中呈现出70和48 ku两种条带。由于该LRR蛋白是第一个发现与FN结合的M.bovis脂蛋白,因此被命名为M.bovis纤维连接蛋白结合脂蛋白(M.bovisfibronectin-binding lipoprotein,MbfN)。重组MbfN (rMbfN) 与FN的结合呈剂量依赖性,在一定浓度下可达到饱和黏附,抗rMbfN蛋白抗体可特异性阻断该反应。与野生型菌株PG45相比,被转座子破坏MbfN开放阅读框的突变菌株黏附能力显著降低,且抗rMbfN抗体可显著降低M.bovis对MDBK细胞的黏附。体外结合试验表明该蛋白还可以结合HS。
2.4 α-烯醇酶
Song等[33]发现许多细菌中存在α-烯醇酶(α-enolase),这种酶的存在与细菌和宿主细胞的黏附密切相关,但是这种现象尚未在M.bovis中得到证实。该团队分析发现M.bovis湖北株中存在α-烯醇酶的编码基因,该基因编码454个氨基酸,蛋白Mr为49.369 ku,等电点为5.27,无信号肽和跨膜区。M.bovis湖北株的α-烯醇化酶与其他支原体物种的相似性可超过90%,是一种高度保守的蛋白。该蛋白包含典型的Plg结合基序,包括赖氨酸作为C端残基(FYNIK)和保守的带正电荷富赖氨酸内部基序(LYDENSKKY)。进一步研究证实,α-烯醇化酶分布于M.bovis的细胞膜和可溶性胞质蛋白组分中,具有抗原性。同时他们还发现在对细胞进行Plg预处理后可以使M.bovis对EBL细胞的黏附率提高11.9%,胰蛋白酶对此株菌进行蛋白水解也可以增强M.bovis对EBL细胞的黏附,并且比单独使用Plg处理细胞更有效。兔抗α-烯醇化酶血清可以抑制M.bovis对Plg预处理后的EBL细胞的黏附,而未经过Plg预处理的细胞黏附则不受影响。配体印迹试验和ELISA试验证明该黏附素结合蛋白为Plg,呈剂量依赖式,并且这种结合可以被抗α-烯醇化酶血清所抑制。
2.5 支原体免疫原性脂肪酶A
Sharma等[34]和Lee[35]通过转座子诱变研究M.bovis基因功能时发现milA基因所编码的支原体免疫原性脂肪酶A(Mycoplasmaimmunogenic lipase A protein,MilA)可能在M.bovis中发挥重要作用。Adamu等[36]为了进一步探索该蛋白的生物功能,利用生物信息学技术对该蛋白的功能域和生物学活性进行了识别和预测,并通过试验证实该蛋白具有黏附素活性,能与HS和1-苯胺萘-8-磺酸各种脂质结合。序列分析表明,MilA黏附素包含经典的HS结合基序“XBBXBX”,并且具有与ATP相互作用的残基,在其它支原体物种中也存在MilA的同源物。MilA黏附素编码基因位于M.bovisPG45基因组814 575和822 587之间,包含2 670个氨基酸,Mr为303 ku,等电点为8.71,具有信号肽和跨膜区。该黏附素是一种膜表面蛋白,它的N端(MilA-ab)和C端(MilA-EF)具有免疫原性,而中间部分(MilA-CD)没有明显的免疫反应性。MilA在表达后被水解成226和50 ku的两个片段,226 ku片段可被抗MilA-ab和抗MilA-EF血清识别,而50 ku片段仅被抗MilA-EF血清识别。MilA黏附素的MilA-EF具有ATP酶活性,而MilA-CD不具有该酶活性。他们还发现226 ku 的MilA可以在培养上清中检测到,说明MilA可能会分泌到培养基中或翻译后从细胞表面裂解。MilA-EF抗血清在体外可抑制M.bovis3683株的增殖,针对MilA其他区域的抗血清则不影响该菌株的生长。HS可与MilA-ab和MilA-EF结合,但与MilA-CD不结合,这与MilA的N端和C端存在HS结合基序的序列分析结果相符。
2.6 亚甲基四氢叶酸tRNA-(尿嘧啶-5-)-甲基转移酶
亚甲基四氢叶酸tRNA-(尿嘧啶-5-)-甲基转移酶[methylenetetrahydrofolate tRNA-(uracil-5-)-methyltransferase,TrmFO]包含427个氨基酸,Mr为48.8 ku,等电点为6.43,无信号肽和跨膜区,分布于细胞质和细胞膜中,具有抗原性[37]。该蛋白的保守性较高,在M.bovis不同菌株间的相似性超过98%。同时TrmFO是一种保守的黄素二核苷酸(FAD)结合蛋白,已被鉴定为tRNA修饰酶的成员负责叶酸依赖的m5U-54生物合成[38]。Guo等[37]在开发M.bovis减毒疫苗时发现,体外传代150代的M.bovisHB0801株的TrmFO蛋白表达水平下调,同时NOX以及可变脂蛋白VspX这两种已被鉴定的黏附素表达也发生了下调。在此基础上,该团队对TrmFO的生物学功能开始进一步的验证。研究发现,TrmFO可以黏附于EBL细胞,兔抗TrmFO抗体可显著降低TrmFO和M.bovis对该细胞的黏附,并且该抗体在补体存在下显示出有效的M.bovis杀伤能力。进而证实了TrmFO是一种M.bovis黏附素,该黏附素的结合蛋白FN也在该项研究中通过免疫学试验证实。
2.7 可变表面脂蛋白A
辛九庆团队对M.bovisHubei-1株进行全基因组分析时发现了一个独特的基因vpmaX,该基因被注释为vspA,但是序列比对结果表明该基因编码蛋白与VspA差异很大,因此将其编码蛋白命名为可变表面脂蛋白A(variable surface lipoprotein A,VpmaX)[39]。VpmaX是一种由229个氨基酸组成的大小约为35 ku的膜蛋白。序列分析表明该蛋白具有典型的原核信号肽和两个重复单元,即“KPSEQGSGTNSQQGSG”和“QGSG”,其中大单元重复3次,小单元重复7次,这一结构特征与VSP家族蛋白非常相似。由于M.bovisHubei-1株基因组缺失vsp基因簇,因此他们推测该蛋白可能是一个黏附蛋白。同时他们还发现同样从湖北省分离的M.bovisHB0801中的VspX的蛋白序列与M.bovisHubei-1菌株的VpmaX的具有100%相似性,这与M.bovis标准株差异较大。进一步研究发现,原核生物表达的rVpmaX蛋白可以直接黏附到EBL细胞上,抗rVpmaX血清可以阻断此蛋白的黏附。在鉴定VpmaX的过程中他们发现一个有趣的现象,当rVpmaX的浓度较低时,该蛋白主要黏附于EBL细胞的表面,当rVpmaX的浓度较高时,该蛋白可以进入EBL的细胞质,这表明此蛋白可能与M.bovis入侵细胞有关。该团队在后续研究中发现试验所用的M.bovisHubei-1株在含有抗rVpmaX血清的培养基中传至第5代时会表达一种分子量为55 ku的新蛋白与兔抗rVpmaX血清反应,这表明该蛋白可能与M.bovisHubei-1株的免疫逃逸有关。以上研究表明VpmaX是一种M.bovis黏附素,且这种黏附素可能与M.bovis的细胞入侵和逃逸宿主免疫相关。
2.8 MBOV_0503编码蛋白
Zhu等[40]建立了M.bovisHB0801转座子突变文库,筛选出9株黏附能力下降的菌株,其中MBOV_0503蛋白突变株特性最稳定,该蛋白的突变株对 EBL细胞的黏附减少了近10倍。经分析MBOV_0503黏附蛋白包含548个氨基酸,Mr为59.48 ku,无信号肽,具有跨膜区。研究证实MBOV_0503蛋白是一种膜表面蛋白可直接黏附于EBL细胞表面,与EBL细胞膜蛋白结合并且呈剂量依赖性。此外,该蛋白能在一定程度上影响M.bovis与宿主细胞的黏附。进一步研究发现,MBOV_0503黏附蛋白的缺失导致突变体跨越细胞屏障的能力显著下降,但并没有影响突变体的增殖。以上研究结果表明MBOV_0503蛋白是一种M.bovis黏附素,且该黏附素可能与病原菌入侵细胞能力有关。
2.9 P27蛋白
郭爱珍团队[41]对M.bovisHB0801株进行基因组分析时发现由MBOV_RS03440基因编码的一个27 ku的P27蛋白被注释为一个假定的脂蛋白,该蛋白包含4个富亮氨酸的重复序列(LRRs),有文献证实这种重复序列与细胞黏附、细胞运输、酶抑制和激素受体相互作用有关[42],因此他们推测该蛋白可能是一种M.bovis黏附素,并通过试验证实了这一假设。P27黏附蛋白包含241个氨基酸,有信号肽,无跨膜区,有抗原性。该蛋白分布于整个细胞但大部分暴露在表面,其氨基酸序列高度保守,M.bovis不同菌株间相似性可达100%,与其他支原体物种的同源蛋白也具有高度的同源性。研究表明重组P27可直接黏附于EBL细胞上,抗P27血清可特异性阻断M.bovis黏附。同时他们还证实了P27的靶蛋白为FN,并且二者相互作用具有剂量依赖性。
2.10 P26蛋白
Berthold等[43]使用M.bovisJ282菌株的全菌体蛋白作为免疫原制备单克隆抗体,其中一株识别26 ku蛋白的抗体4F6具有良好的特异性。Sachse等[44]发现M.bovis对EBL细胞的黏附可以被该单克隆抗体4F6特异性的阻断。P26黏附蛋白是一种亲水性的32 ku蛋白,具有抗原性[45]。进一步研究发现,M.bovis120菌株中P26蛋白表达量高于菌株454,在非阻断条件下120菌株对EBL细胞的黏附能力高于454菌株,当使用单克隆抗体4F6阻断时发现120和454株M.bovis对EBL细胞的黏附分别降低46%和70%,这表明 P26蛋白在M.bovis与EBL细胞的黏附过程中可能发挥着重要作用。在他们后期的研究中发现当P26蛋白与M.bovis总蛋白的比例为1∶100时,可阻断20%~50%M.bovis的黏附[45]。这些结果充分证明了P26蛋白是M.bovis的一种黏附蛋白。
2.11 24 ku蛋白
有报道称M.bovis2610 P116(体外传至第116代)菌株比M.bovis2610 P7(体外传至第7代)菌株的黏附率下降2.5倍~6倍[46]。Thomas等[46]利用二维电泳对M.bovis2610 P116菌株和M.bovis2610 P7菌株所表达的蛋白进行分析,发现一个Mr为24 ku的蛋白在高传代菌株中表达量显著降低。对此24 ku蛋白进行质谱分析发现,该蛋白与M.bovis数据库中的已知序列均不匹配。胰酶消化试验结果表明该蛋白是一种膜蛋白。进一步研究发现针对该蛋白的抗血清或单克隆抗体都可降低2610p7株与BBE细胞的黏附。以上研究表明该蛋白是一种M.bovis黏附素。
2.12 膜表面可变脂蛋白家族蛋白(VSPs)
在M.bovis标准株PG45基因组中,编码膜表面可变脂蛋白家族蛋白(membrane surface variable lipoprotein family proteins,VSPs)的基因簇由15个开放阅读框组成,其中13个编码VSPs[47]。所有VSP蛋白的氨基端都有一个相似性超过99%的保守原核信号肽锚定在细胞膜上,并且都具有抗原性。Thomas等[48]通过阻断试验发现识别VspC和VspF的单克隆抗体9F1和2A8能够抑制M.bovis对BBE细胞的黏附,单克隆抗体1E5也具有一定的阻断能力,这表明VspC和VspF可能是一种黏附素。Sachse等[49]在对M.bovis的VspA、VspB、VspE和VspF的免疫原性和黏附性研究中发现并鉴定出这些序列都含有重复序列。用人工合成的重复序列或针对这些序列的特异性抗体进行M.bovis黏附抑制试验,结果表明VspA、VspB、VspE和VspF以及抗VspA、VspB和VspF的单克隆抗体都可降低M.bovis对宿主细胞的黏附。这表明VspA、VspB、VspC、VspE和VspF是M.bovis的黏附素。但是一些抑制M.bovis与EBL细胞黏附的单克隆抗体不能抑制M.bovis对BBE细胞的黏附[48],这一现象表明M.bovis对不同宿主细胞的黏附可能是不同的。
3 M.bovis黏附素结合蛋白
病原体对特定组织或细胞的黏附是一个复杂的过程。细菌黏附素的靶蛋白主要是宿主细胞外基质(ECM)的成分,包括胶原蛋白、弹性蛋白、FN、血小板源性生长因子和层黏连蛋白等[50]。支原体中位于细胞膜上的蛋白也可以结合宿主细胞的ECM成分进而介导支原体的定植或侵袭,如胶原蛋白、层黏连蛋白、FN、Plg和HS[51]。迄今为止,已鉴定出四种类型M.bovis黏附素结合蛋白,即Plg、FN、HS和APLP2。
3.1 纤溶酶原
纤溶酶原(plasminogen,Plg)存在于血管组织和大多数体液中,主要合成部位是肝,是一种Mr为92 ku的单链血浆糖蛋白,经纤溶酶原激活物催化激活后变为双链纤溶酶[52]。纤溶酶可以被许多细菌、真菌、蠕虫、寄生虫和病毒利用来抑制宿主的免疫反应和逃避局部免疫攻击[53]。到目前为止,在共生和致病的细菌中已经报道了超过40种病原微生物以Plg为结合蛋白[53],从而促进其对宿主细胞的黏附和侵袭,如化脓性链球菌与人Plg结合进而促进链激酶切割并提高菌体毒力[54],多杀性巴氏杆菌能够利用宿主Plg来跨越组织屏障和逃避宿主先天免疫[55],结核分枝杆菌与Plg结合后促进其组织重建和对宿主的侵袭[56]。在支原体中已经发现发酵支原体、Leachii支原体、M.bovis、鸡毒支原体、鸡滑液支原体、猪肺炎支原体、肺炎支原体、猪鼻支原体和无乳支原体能够与Plg结合[57-59]。这也提示我们Plg在可能在M.bovis定植过程中起着重要作用,并与M.bovis的发病机制和免疫逃逸密切相关,其结合和激活可能是M.bovis毒力决定因素之一。
3.2 纤连蛋白
纤连蛋白(fibronectin,FN)是一种高分子量的多功能细胞外基质糖蛋白,广泛存在于血液、体液及各种组织中。FN主要有两种形式:血浆纤维连接蛋白和细胞纤维连接蛋白,其主要功能是将细胞与细胞的ECM连接起来[60]。纤维连接蛋白结合蛋白(FnBPs)是多种病原体重要的黏附素,已有研究证实支原体中存在FnBPs,如M.bovis的NOX[22]、FBA[30]、MbfN[32]、TrmFo[37]和P27[41]、猪肺炎支原体的NADH氧化酶[61]、鸡滑液支原体的二氢脂酰胺脱氢酶[62]、无乳支原体的MAG_6130黏附素[59]以及猪鼻支原体的烯醇化酶[63]。FnBPs不仅存在于支原体中,许多细菌真菌以及病毒都可与FN结合,目前已经鉴定出100多种细菌FnBPs[64]。FnBPs在细菌与其宿主的相互作用中起着关键作用,许多研究表明一些FN结合蛋白基因的失活会显著降低细胞的黏附性,如金黄色葡萄球菌的fnbA和fnbB双突变体[65]、化脓性链球菌的prtFI突变体[66]。有证据表明,FN也会参与病原体的入侵以及具有信号传递作用,如金黄色葡萄球菌黏附蛋白与FN结合后招募整合素通过内吞途径入侵靶细胞[67]、猪肺炎支原体通过和FN相互作用后与上皮细胞表面的整合素β1结合,并启动信号事件刺激病原体进入网格蛋白包被的囊泡和小窝体中[68]。由于牛支原体也利用该蛋白作为黏附素结合蛋白,所以应对牛支原体是否利用该蛋白进行细胞入侵进行进一步研究。
3.3 硫酸肝素
硫酸肝素(heparan sulfate,HS)为一种硫酸糖胺聚糖,广泛分布于大多数动物组织的细胞表面和细胞外基质[69]。HS在高尔基体中合成,由重复的N-乙酰氨基葡萄糖和己糖醛酸残基组成[70]。其强大的阴离子特性和高度可变的结构使这种糖胺聚糖能够为许多蛋白质配体(包括免疫系统的许多可溶性介质)提供结合位点,并可能促进或抑制其活性[69]。已证实HS蛋白聚糖是多种病原体黏附和定植的靶蛋白,参与病原体的内化过程,促进黏附、附着和进入细胞,与逃避免疫防御和致病机制密切相关[71],如猪肺炎支原体裂解产物P159结合于HS促进其定植PK15细胞,并且可能与病原体内化有关[72]、产单核细胞李氏杆菌与HS结合以促进其附着和内化,进而穿过肠道黏膜进入体循环引起菌血症和脑膜炎[73]、细胞表面 HS 的失活有效的减少了白色念珠菌和光滑念珠菌对该细胞的黏附[74]。在M.bovis中与HS结合的MbfN[32]和MilA[36]以及有待鉴定的M.bovis黏附素是否也参与了病原菌的内化帮助其入侵还有待学者们进一步的探索。
3.4 淀粉样前体样蛋白2
淀粉样前体样蛋白2(amyloid precursor-like protein-2,APLP2)是淀粉样前体蛋白(APP)的第一个同源物。APP在哺乳动物中具有两种同源物:淀粉样前体样蛋白1(APLP1)和APLP2,三者在进化上高度保守,这三种蛋白每个蛋白都由一个胞外结构域、一个跨膜结构域和一个50个氨基酸长的胞质尾部结构域组成[75]。APLP2对调节机体生存、运动功能、突触发育、髓鞘形成、视网膜发育、葡萄糖和胰岛素稳态、细胞黏附、癌症生长和转移、神经元祖细胞的细胞周期退出和金属稳态至关重要[76]。对基因敲除小鼠的研究已经证实,与APP和APLP1相比,APLP2是APP家族中小鼠存活所需的必要成员[77-78]。APP和APLP-2在基因上相关,但在转录上不同,在每个基因中都有独特的序列基序,具有特殊的、不重叠的功能[75]。虽然APLP-2是细胞黏附的重要组成部分,但是APLP-2作为病原体受体的报道较少,目前已证实APLP-2是M.bovis黏附的靶蛋白[22],对于其在M.bovis致病机制中所扮演角色的相关研究还存在空缺。
4 小结与展望
本文对M.bovis目前已鉴定黏附素的发现过程、部分生物学特性以及宿主结合蛋白进行了综述。其中将生物信息学技术和传统生物学及免疫学试验验证相结合,或者利用不同菌株间的表型和基因型进行差异基因筛选均为M.bovis黏附素筛选可行方案。研究表明M.bovis黏附素在感染、病原体定植入侵和宿主损伤中具有关键作用。目前已鉴定的M.bovis黏附素大部分为膜表面蛋白,部分黏附素具有良好的保守性和免疫原性,并且具备多种生物活性,它们的主要宿主结合蛋白为HS、Plg、FN和APLP2,其中HS、Plg和FN可与多种已鉴定的M.bovis黏附素结合。有些M.bovis黏附素结合蛋白可能与多种病原感染密切相关,如Plg是多种细菌黏附素的靶蛋白,说明这些病原的定植与入侵可能具有相同或相似的机制。此外,鉴于M.bovis可以感染多种动物,可引起多种组织器官感染并导致多种临床症状,而当前鉴定的黏附素主要针对EBL细胞和MDBK细胞,且这两种细胞的黏附素也存在差异,因此不难推测尚有针对不同细胞的重要黏附素还有待验证。
M.bovis已经成为危害养牛产业的重要病原之一,对牛场及养殖户收益影响较大,因此对M.bovis疾病的预防和控制是养牛产业兴旺发展的关键举措。M.bovis无细胞壁特性使其致病性高度依赖于细胞表面的黏附素。黏附素是M.bovis研究的一个重要方向,加强M.bovis黏附素的研究将有助于M.bovis致病机制的阐明,同时对预防性和诊断性生物制品的研发以及小分子靶向抗菌药物的开发均具有重要的理论指导意义。

