过表达UCP3基因对萨湖羊前体脂肪细胞分化的影响
刘林丽,彭雪兰,李 博,程乐凡,次仁拉姆,张恩平*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.西北农林科技大学生命科学学院,杨凌 712100)
肌内脂肪 (IMF) 的分布是羊肉肉质和口感的重要影响因素,与肉的多汁、嫩度和适口性呈正相关[1-2],适当提高肌内脂肪含量有助于改善羊肉品质[3-4]。肌内脂肪的含量主要由肌内脂肪细胞的数量和大小决定,其中肌内脂肪细胞的形成尤为重要,为IMF的沉积提供了场所[5]。脂肪细胞分化则是形成肌内脂肪细胞的重要过程,脂肪细胞来源于间充质干细胞(MSCs),MSCs分化为脂肪母细胞后继续分化为前体脂肪细胞,前体脂肪细胞最终分化为成熟脂肪细胞[6]。脂肪细胞分化是一个复杂的多步骤过程,涉及PPARγ、C/EBPα等一系列转录因子和多种机制的相互作用,还涉及胰岛素敏感性的诱导和细胞分泌能力的变化[7]。RAN-Seq技术的快速发展,为探究脂肪细胞分化的分子机制提供了技术支持[8-10]。谢光杰等[11]通过对简州大耳羊肌内脂肪细胞成脂分化差异表达基因的筛选发现,UCP3基因可作为调控肌内脂肪细胞成脂分化的侯选因子。本实验团队前期通过对萨湖羊脂肪组织进行转录组测序,同样筛选到与脂肪沉积相关的候选基因UCP3,在此基础上本试验旨在探究UCP3对萨湖羊前体脂肪细胞分化的影响。
解偶联蛋白3(UCP3)属于线粒体载体家族基因,主要分布于骨骼肌线粒体膜内边界[12],具有抗氧化功能[13],作为线粒体产生活性氧的调节器和过氧化脂质的转运体[14-15],对体重恒态、代谢率调节和体温调节非常重要[16-17]。UCP3还具有保护心脏和线粒体的功能[18-20],在参与维持线粒体的生物发生和功能方面具有重要意义[21-22],其基因多态性与人类的肥胖和糖尿病密切相关[23-24]。研究表明,不同物种中,UCP3的基因功能不同,且同一物种不同组织中UCP3基因的表达量也不相同。罗成等[25]研究表明,UCP3基因在山羊骨骼肌、脂肪、心肌等各个组织中均有表达,且在背最长肌中表达量显著高于其它组织。彭广南[26]发现,广西三黄鸡胸肌中IMF含量与UCP3基因的表达量呈显著正相关。这些研究表明,UCP3基因可能参与脂肪沉积的过程,但UCP3基因如何调控脂肪细胞分化并参与脂肪沉积的作用机制目前尚不清楚。
为进一步探究UCP3基因在萨湖羊脂肪细胞分化中的作用,本试验通过无缝克隆技术构建了UCP3过表达载体(pcDNA3.1-flag-UCP3),并成功转染至萨湖羊前体脂肪细胞,检测其对脂肪生成相关基因的影响。旨在阐明UCP3基因对萨湖羊前体脂肪细胞分化的影响,为进一步揭示UCP3在绵羊脂肪沉积过程中发挥的功能及调控机理提供理论支持。
1 材料与方法
1.1 材料
1.1.1 试验动物及样品采集 本试验动物为4月龄萨湖羊,选取出生日龄相近、体况和健康状况一致的4月龄萨福克()×湖羊(♀)F1代羔羊3只,屠宰体重(37.45±0.44) kg,样品于甘肃庆环肉羊制种有限公司进行采集。将萨湖羊颈部放血致死后,快速采集心、肝、脾、肺、肾、空肠、回肠、十二指肠、半腱肌、尾部脂肪、皮下脂肪、臀部脂肪、肾周脂肪和背最长肌等组织立即投入液氮,置于-80 ℃保存备用。将1月龄、体重10.8 kg的萨湖F1代羔羊,颈部放血致死,快速取背最长肌组织置于含500 U·mL-1双抗的PBS中,用于萨湖羊前体脂肪细胞的分离培养。
1.1.2 主要试剂 RNAiso Plus 试剂盒、Trizol试剂盒、DEPC水等购自宝生物工程(大连)有限公司;E.Z.N.A Gel Extraction Kit 胶回收试剂盒、质粒小量提取试剂盒、去内毒素质粒提取试剂盒均购自Omega公司;DMEM高糖基础培养基、DMEM/F12培养基、D-PBS缓冲液均购自 Invitrogen公司;OriCell®小鼠MC3T3-E1细胞成脂诱导分化试剂盒购自赛业生物科技有限公司;实时荧光定量试剂盒购自诺唯赞生物科技有限公司。
1.2 方法
1.2.1 萨湖羊UCP3基因克隆 通过Trizol法提取萨湖羊背最长肌组织总RNA,反转录得到cDNA。根据 GenBank 数据库中萨湖羊的UCP3序列(NM_001 308 581.1),利用软件Oligo 7设计萨湖羊UCP3基因克隆引物,引物序列为(F:ATGGTTGGACTGCAACCTTCAGA;R:AGATGCT-ACGAGACTCTCCATTTTGA),由中科羽瞳生物科技有限公司合成。
qPCR反应体系为25 μL:cDNA模板1 μL,正、反向引物各0.4 μL,10×PCR buffer for KOD-Plus-Neo 2.5 μL,2 mmol·L-1dNTPs 2.5 μL,25 mmol·L-1MgSO41.5 μL,KOD-Plus-Neo(1 U·μL-1)0.5 μL,ddH2O补至终体积20 μL。PCR反应条件:95 ℃预变性10 min;98 ℃变性10 s,68 ℃退火20 s,72 ℃延伸5 s,共35个循环。
1.2.2 萨湖羊UCP3基因序列同源性分析 采用NCBI中的BLAST程序(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)进行基因序列比对;运用DNAStar 7.1软件中的MegAlign程序对绵羊(NP_001295510)与山羊(XP_005690021.3)、猪(NP_999214.1)、人(NP_003347.1)、牛(NP_776635.1)、羚羊(XP_040114806.1)、小鼠(AAB87084.1)、鸡(NP_001384581.1)、马(XP_014597360.1)等物种的相似性进行比对。
1.2.3 萨湖羊UCP3基因组织表达分析 提取萨湖羊的心、肝、脾、肺、肾、空肠、回肠、十二指肠、半腱肌、尾部脂肪、皮下脂肪、臀部脂肪、肾周脂肪和背最长肌等14个组织cDNA为模板进行实时定量PCR反应,以GAPDH为内参基因。qPCR反应体系为20 μL:cDNA模板1 μL,正、反向引物各0.4 μL,ChamQ Universal SYBR qPCR Master Mix 10 μL,ddH2O补至终体积20 μL。PCR反应条件:95 ℃预变性10 min;95 ℃变性10 s,退火20 s,72 ℃延伸15 s,共35个循环。采用相对定量法计算各基因表达水平,结果用2-ΔΔCt计算。
1.2.4 萨湖羊UCP3过表达载体的构建 将Pc-DNA3.1-flag进行线性化扩增(F:GTCGACGA-TATCGAATTCCTGC; R:AGATCTCTCGAGT-CTAGAACTAGTGGG),胶回收纯化载体PCR产物,以背最长肌组织cDNA为模板,扩增含有UCP3基因的插入片段,(F:AGGAATTCGATATCGTC-GACATGGTTGGACTGCAACCTTCA;R:TTCT-AGACTCGAGAGATCTTCAAAATGGAGAGT-CTCGTAGCAT),胶回收纯化插入片段。按照ClonExpress Ⅱ试剂盒说明书配制同源重组反应体系。将10 μL重组产物加入含100 μL的DH5α感受态细胞中,冰上静置30 min,42 ℃水浴热激90 s后,涂板,挑取单克隆扩繁,提取质粒进行测序,将测序结果正确的质粒命名为pcDNA3.1-flag-UCP3。
1.2.5 萨湖羊前体脂肪细胞分离培养 将萨湖羊脂肪组织剪碎,用1%的I型胶原酶于37 ℃消化1 h,待组织呈现云絮状时终止消化,细胞滤液经离心后获得细胞沉淀,加入红细胞裂解液去除红细胞,PBS清洗后接种于培养皿,待多数细胞贴壁后立即更换培养基,以获得相对较纯的萨湖羊前体脂肪细胞,此后每2 d更换一次培养基,大约培养7 d左右细胞即汇合至80%~90%,用0.25%胰酶消化细胞,按1∶3的接种密度进行传代培养。
1.2.6 细胞转染 将萨湖羊脂肪细胞接种于6孔板,当细胞达到70%~80% 融合时进行转染。按照脂质体Lipofectamine 2000 (Invitrogen) 使用说明进行操作。将质粒pcDNA3.1-flag-UCP3转染至萨湖羊前体脂肪细胞,以转染空载质粒(pcDNA3.1-flag-NC)的细胞作为阴性对照,每组各3个重复,将5 μL脂质体Lipofectamine 2000 (Invitrogen) 和2.5 μg质粒pcDNA3.1-flag-UCP3或pcDNA3.1-flag-NC分别用125 μL Opti-MEM稀释,室温静置5 min,缓慢混合,静置20 min后转入细胞。
1.2.7 脂肪生成相关基因表达量检测 转染48 h后收集细胞,用Trizol法提取总RNA,按照TaKaRa公司试剂盒Prime ScriptTMRT说明进行反转录。根据NCBI数据中绵羊UCP1、PPARγ、C/EBPα、ADIPOQ、LEP、FAS、CPT1B的基因序列,利用Oligo 7设计实时荧光定量PCR引物,引物序列见表1。

表1 引物信息
1.2.8 萨湖羊前体脂肪细胞诱导分化 传代培养的细胞融合至70%~80%时,用含10%胎牛血清的高糖DMEM/F12再培养2 d以使细胞接触抑制,退出细胞周期,此时换用MDI诱导培养基(含0.5 mmol·L-1IBMX、1 μmol·L-1DEX和2 μg·mL-1Ins),记为第0天;培养2 d后,换用胰岛素培养基 (含2 μg·mL-1Ins) 维持分化2 d,记为第2 天;培养2 d后换为完全培养基(含10% FBS的DMEM/F12),此后一直用完全培养基培养至第8 天,期间每2 d换1次液。到第8 天为止,多数前体脂肪细胞分化为成熟脂肪细胞。
1.2.9 油红O染色及细胞脂质测定 根据小鼠MC3T3-E1细胞成脂诱导分化培养基说明书,诱导分化转染pcDNA3.1-flag-NC和pcDNA3.1-flag-UCP3后的萨湖羊前体脂肪细胞,每组3个重复,8 d后,用改良油红O染色液对脂肪细胞进行染色,并在显微镜下观察染色情况,以此鉴定提取的细胞是否为脂肪细胞。油红O染色观察成像结束后,在细胞中加入2 mL的100%异丙醇用以提取脂质,25 ℃孵育30 min后,收集上清,并在510 nm波长下,用酶标仪分析各组提取液的光密度(OD)值,每组提取液重复3次。
1.3 数据处理
使用Excel 2010对试验数据进行整理,使用SPSS 26.0统计软件中的单因素方差分析(One-way ANOVA),使用2-ΔΔCt法进行数据处理,通过GraphPad Prism软件进行绘图,P<0.05表示差异显著。
2 结 果
2.1 萨湖羊UCP3基因克隆
将PCR扩增产物用1%的琼脂糖凝胶电泳分析,如图1所示,得到一条936 bp左右的条带,与目的产物大小相符。将克隆序列CDS区送至中科羽瞳生物技术公司进行测序,将测序结果与NCBI数据库中绵羊UCP3序列(NM_001 308 581.1)CDS区比对后发现一致性达到99.7%。

M.DNA相对分子质量标准;1、2.UCP3的扩增产物
2.2 萨湖羊UCP3基因序列同源性分析
利用 NCBI BLAST比对得到与绵羊同源性相近的物种的氨基酸序列,将萨湖羊UCP3氨基酸序列与其他物种进行同源性分析(图2)。结果显示,萨湖羊UCP3蛋白与山羊的同源性最高,为98.71%。其次是羚羊和牛,分别为97.75%、95.82%,与鸡的同源性最低,为70.36%,说明该基因在不同物种间具有一定的特异性。

图2 萨湖羊UCP3同源性分析
2.3 萨湖羊UCP3基因组织表达谱构建
为探究萨湖羊UCP3基因的组织表达特性,本研究对萨湖羊UCP3基因在心、肝、脾、肺、肾、空肠、回肠、十二指肠、背最长肌、皮下脂肪等14个组织中的mRNA表达水平进行检测(图3)。结果表明,萨湖羊UCP3基因在14个组织中均有表达,在心、脾、肺等内脏中表达量较高。
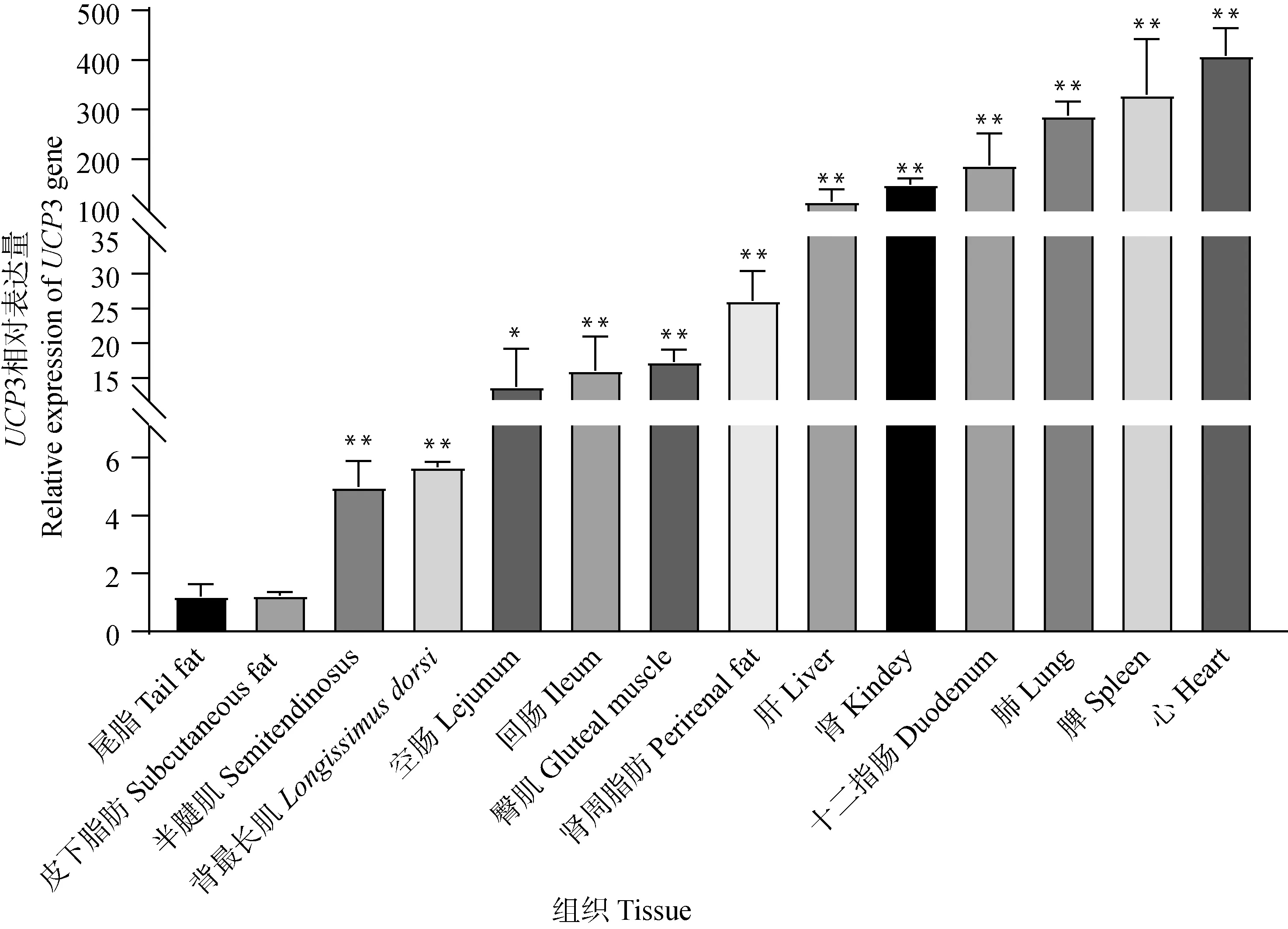
“*”表示差异显著(P<0.05),“**” 表示差异极显著(P<0.01);内参基因为GAPDH,n=3。下同
2.4 UCP3基因在萨湖羊前体脂肪细胞分化中的作用
2.4.1UCP3基因在萨湖羊前体脂肪细胞分化中的时序表达分析 图4为萨湖羊前体脂肪细胞成脂分化过程中第0、4和8天UCP3 mRAN的表达水平。结果显示,萨湖羊UCP3基因在萨湖羊前体脂肪细胞诱导分化时期的表达水平持续升高,诱导分化第4和8天的脂肪细胞中UCP3 mRNA含量分别显著(P<0.05)和极显著(P<0.01)高于第0天诱导分化的脂肪细胞,表明UCP3基因在萨湖羊前体脂肪细胞分化过程中有一定的作用。

图4 UCP3基因在脂肪分化过程中的相对表达水平
2.4.2 萨湖羊UCP3过表达载体的构建 线性化pcDNA3.1-flag-NC琼脂糖凝胶电泳结果如图5A所示,图5B为通过无缝克隆技术构建的重组质粒pcDNA3.1-flag-UCP3,以重组质粒pcDNA3.1-flag-UCP3为模板成功扩增出UCP3基因(图5C),且测序结果与萨湖羊UCP3基因片段一致。表明pcDNA3.1-flag-UCP3重组质粒构建成功。
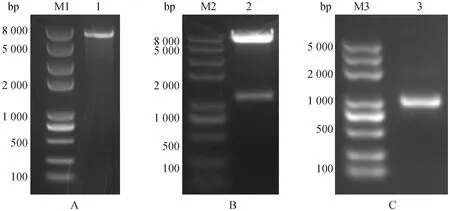
A.pcDNA3.1-flag-NC单酶切鉴定;B.pcDNA3.1-flag-UCP3重组质粒;C.重组质粒UCP3基因PCR扩增结果。M1、M2、M3.DNA 相对分子质量标准;1.线性化pcDNA3.1-flag-NC扩增产物;2.pcDNA3.1-flag-UCP3重组质粒;3.pcDNA3.1-flag-UCP3重组质粒UCP3扩增产物
2.4.3 pcDNA3.1-flag-UCP3的转染效率 如图6A所示,转染pcDNA3.1-flag-UCP3组和pcDNA3.1-flag-NC组相比,UCP3基因mRNA的表达水平显著上升(P<0.01),通过分光光度法测定细胞脂质含量结果显示(图6B),与转染pcDNA3.1-flag-NC组相比,转染pcDNA3.1-flag-UCP3组前体脂肪细胞中脂质含量显著上升(P<0.01)。油红O染色结果表明,过表达UCP3后脂肪细胞中脂滴含量明显增加(图6C)。

A.pcDNA3.1-flag-UCP3转染后萨湖羊前体脂肪细胞中UCP3基因的表达量;B.通过分光光度法测定细胞脂质含量;C.pcDNA3.1-flag-UCP3转染后萨湖羊前体脂肪细胞中脂滴积累的变化。白色箭头所示为脂滴;图中比例尺为200 μm
2.4.4 过表达UCP3基因对脂肪细胞相关基因表达的影响 为了进一步阐明绵羊UCP3基因对脂肪细胞分化的调控机制,本研究检测了过表达UCP3对脂肪细胞相关基因表达水平的影响。结果如图7所示,与pcDNA3.1-flag-NC组相比,pcDNA3.1-flag-UCP3组PPARγ、C/EBPα、LEP的表达均极显著上升(P<0.01),FAS、UCP1的表达量显著上升(P<0.05),CPT1B、ADIPOQ的表达量均有上升但不显著(P>0.05)。

图7 过表达UCP3对萨湖羊脂肪细胞相关基因表达的影响
3 讨 论
UCP3是一种具有高度保守性的蛋白,广泛表达于动物的各个组织。孙斌等[27]研究发现,UCP3基因在延边牛脾脏中表达量最高,在肝脏和肾脏中表达水平较低。罗成等[25]研究表明,UCP3基因在山羊股三头肌、臂三头肌、背最长肌和肺中的表达丰度高于其它组织。谭义洲[28]研究发现,UCP3基因的多态性与盘羊×欧拉羊F1代体重和胸围密切相关。本研究发现,UCP3基因在萨湖羊心、肝、脾、肺、肾、瘤胃、背最长肌、皮下脂肪等14个组织均有表达,UCP3在心脏和脾脏中表达量较高,表明UCP3基因具有组织特异性,同时发现UCP3基因在臀部脂肪和肾周脂肪中也有较高的表达,且目前关于UCP3基因是否参与萨湖羊脂肪沉积的调控尚无相关报道。因此,本试验进一步探究了UCP3基因在萨湖羊脂肪沉积中的作用。
脂肪组织在营养动态平衡中起重要作用,大约三分之一的脂肪组织由脂肪细胞组成[29],脂肪细胞在调节能量和葡萄糖的动态平衡中起核心作用[30]。而前体脂肪细胞是研究脂肪组织发育的重要模型,因此本试验以萨湖羊前体脂肪细胞为模型,探究UCP3基因在脂肪细胞分化过程中的作用。罗成等[25]研究表明,在山羊脂肪细胞中UCP3基因的表达量随着诱导时间的增加呈持续升高的趋势。这与本研究结果一致,因此表明UCP3基因在脂肪细胞分化过程中扮演着一定的作用。
为了进一步研究UCP3基因在脂肪细胞分化过程中扮演的角色,本研究将构建好的过表达UCP3基因载体转染至萨湖羊前体脂肪细胞,经成脂诱导分化试剂诱导后,检测与脂肪沉积相关的标志基因的表达情况,以此深入了解脂肪细胞中的脂质代谢。PPARγ是直接与脂肪形成有关的转录因子,通过增加脂肪细胞的数量促进脂肪的形成[30]。C/EBPα在脂肪细胞的终末分化中起重要作用,缺乏该因子会导致胰岛素抵抗并阻碍体内白色脂肪组织的形成,而棕色脂肪组织的形成则不受其影响[31-32],C/EBPα促进脂肪细胞特定表型,包括胰岛素敏感性和脂质堆积[33]。瘦素和脂联素是脂肪组织合成的最丰富的脂肪因子,在能量平衡和食欲调节中起着关键作用[34]。CPT1B属于CPTs家族一员,是脂肪酸β-氧化的关键限速酶,对脂肪的分解供能具有重要的调控作用[35]。当特异性敲除脂肪细胞中UCP1基因后,会导致脂肪细胞中甘油三脂的生成量显著减少[36],本研究结果显示,过表达UCP3后,脂肪细胞中的UCP1表达量上调了3 872倍,表明UCP3对UCP1的表达产生了极大的影响。Pan等[37]研究发现,UCP3的表达必须依赖于UCP1的存在,若UCP1被敲除则UCP3的丰度会降低,而本研究发现,过表达UCP3后脂肪细胞中UCP1的表达量大幅上升,表明两者的表达相互影响,UCP1表达上调也可能与LEP表达量上升促进瘦素分泌从而上调UCP1的表达有关[38]。研究表明,LEP基因表达上调可通过瘦素抑制Hedgehog信号通路从而促进脂肪细胞分化[39],杨孝良等[40]研究表明,高浓度Leptin处理人前体脂肪细胞,可促进其增殖分化。但谭飞等[41]在瘦素对鸡原代前体脂肪细胞增殖分化的研究中发现,瘦素对鸡前体脂肪细胞增殖分化无显著影响。这表明瘦素对脂肪细胞增殖分化的影响与细胞种类存在相关性。已有研究表明,过表达ADIPOQ可以加速脂肪细胞分化并促使脂肪组织中的脂质积累,其表达量上升可能通过延长转录因子PPARγ和C/EBPα的表达时间,从而促进脂肪细胞分化[42]。本研究结果显示,过表达UCP3后萨湖羊前体脂肪细胞中脂肪分化标志基因PPARγ、C/EBPα、LEP的表达均极显著上升,FAS、UCP1的表达量显著上升,CPT1B、ADIPOQ的表达量均有上升但不显著。推测UCP3基因对萨湖羊前体脂肪细胞分化起正调控作用,可能是通过促进与脂肪生成相关基因的表达量,进而促进萨湖羊前体脂肪细胞脂质的生成。这些结果可能为理解UCP3调控萨湖羊前体脂肪细胞脂质生成的网络调节机制提供理论依据。
4 结 论
本研究成功绘制了萨湖羊UCP3基因在多组织的表达谱及成脂分化过程中的表达规律,发现UCP3基因的多组织广泛表达特性,其在心脏和脾脏中相对表达量较高。在脂肪分化过程中UCP3基因表达呈现上升趋势,在分化后期达到最高。过表达UCP3能够促进脂肪细胞脂质生成。推测其在前体脂肪细胞分化过程中为正调控因子,可能通过调控脂肪分化标志基因PPARγ、C/EBPα、FAS等的表达促进前体脂肪细胞成脂分化。然而,关于进一步阐明UCP3在前体脂肪细胞成脂分化过程中的作用机制还需深入研究。

