养殖迁移对菲律宾蛤仔挥发性有机物质组成变化的影响
杨 玲, 郭 贺, 许智慧, 邵倩文, 冉照收, 周成旭
养殖迁移对菲律宾蛤仔挥发性有机物质组成变化的影响
杨 玲1, 郭 贺2, 许智慧2, 邵倩文3, 冉照收2, 周成旭1
(1. 宁波大学 食品与药学学院, 浙江 宁波 315211; 2. 宁波大学 海洋学院, 浙江 宁波 315211; 3. 宁波海洋研究院 浙江 宁波 315832)
环境条件变化是造成贝类挥发性有机物质(VOCs)组成变化的主要原因。菲律宾蛤仔养殖生产中, 常进行从开放式自然滩涂迁移至人工围塘养殖的活动。本文研究了这一过程前后菲律宾蛤仔()肌肉组织的VOCs组成特征、变化及其与环境因子相关性。结果显示: 基于固相微萃取和气质联用技术, 共鉴定出52种VOCs, 分别属于醛、醇、酯、烃、呋喃、烷烃、烯、芳香烃、含硫和含氮化合物等。迁移前样本中, 检出41种化合物, 迁移至人工围塘养殖20 d后, 检出32种。迁移造成了化合物种类数量降低、种类发生变化。醛、醇类的相对含量最高、迁移前后的变化尤为显著, 呈现由醛高醇低的组成逆转为醇高醛低的特点。溶氧是影响VOCs组成变化及其醇、醛类差别的重要因子。饵料生物量、相对丰度和多样性与VOCs的组成具有显著相关性: 自然滩涂微型真核生物多样性高但生物量和丰度相对低, 人工围塘多样性低但生物量和丰度高, 是VOCs组成差异的关键影响因子。本研究建立了贝类VOCs与关键环境因子的直接联系, 为进一步解析贝类品质的环境关系、优化和调控养殖环境等研究提供了参考。
菲律宾蛤仔; 挥发性有机物; 环境因子; 微型浮游生物; 养殖迁移
我国是水产养殖大国, 南北海域都有不同适养水产品种及其适养水域。菲律宾蛤仔()是典型的滩涂贝类, 环境适应性强, 在我国从南到北沿海滩涂中, 均有广泛的分布[1]。在突破了菲律宾蛤仔人工育苗技术以后, 其人工养殖更是蓬勃发展, 成为滩涂养殖贝类产量最高和养殖规模最大的品种[2], 是人们喜闻乐见的以鲜美风味著称的大宗海鲜品[3]。随着海水养殖科学和产业技术发展, 菲律宾蛤仔的养殖方式也实现了从传统的区域化养殖, 转向育苗、养成、育肥等区块化特征, 并进一步在我国形成了南北方不同水域联动的产业特征。并且, 除了在自然滩涂水域进行养殖以外, 菲律宾蛤仔还在人工围塘中作为适养贝类进行增养殖或育肥。
生物和非生物环境与贝类的生化物质组成和代谢密切相关, 如其营养价值、风味物质特征等, 都因生长和所处环境而不同[4]。挥发性有机物是贝类风味品质构建的重要组成部分。研究表明, 不同微藻对双壳贝类肉质挥发性成分会产生影响[5-6]。不同微藻的营养物质存在差异, 因此贝类摄入不同种类的微藻后, 会对贝类本身的代谢产生影响, 从而在挥发性成分上也造成影响[7]。挥发性成分的产生与贝本身的代谢过程息息相关, 很多醇类、含羰基的化合物由不饱和脂肪酸经某些脂氧化酶作用衍生而来[8], 而酮类化合物是由氨基酸的降解和不饱和脂肪酸的自动氧化所产生[9]。此外, 贝类的生长环境也与贝类的代谢息息相关, 例如, 刘朋超等[10]研究发现, 温度、盐度、溶解氧等是影响生物群落的主要因素, 在分析了两个不同海域的牡蛎后发现, 其脂肪酸、糖原、挥发性成分均具有显著差异, 并且大部分氨基酸成分与硅藻、甲藻呈正相关, 与微球藻属、微胞藻属、鞭毛藻类、共甲藻目等呈负相关。菲律宾蛤仔是典型的滤食性贝类, 通过滤食水体中的微型藻类、有机碎屑、细菌、原生生物等颗粒有机物为生。在贝类的人工围塘养殖中, 也通过调节水质、藻相, 不仅提高贝类食物来源、促进生长或育肥, 其不同的藻相, 也构造了养殖水产品不同的代谢过程, 在风味特征上可能造成差异。
“风味物质”是指一类能为人体感觉器官所感知的水溶性或挥发性的低分子量化合物。前者一般称为呈味物质, 如氨基酸、核苷酸、肽, 种类相对固定, 可刺激人味蕾细胞产生酸、甜、苦、咸、鲜等感觉, 目前对其研究较为透彻; 而后者又可称为香气物质, 通常属于挥发性有机物质(VOCs), 需在一定条件下, 如加热、酶催化等, 由风味前体物质转化而来, 例如萜烯化合物、脂肪族化合物、芳香族化合物[11]。对于贝类风味物质的研究较多地集中于不同区域之间的对比或不同储藏保鲜方式, 而对于养殖迁移形成的生物和非生物环境综合影响下, 养殖贝类的风味构建特征及相关机制的研究尚缺乏。
本研究以解析贝类风味物质组成和特征构成与养殖区域变化的生物和非生物环境因子的综合关联性为目标, 利用典型的养殖活动, 即菲律宾蛤仔增养殖过程中的不同水域迁移, 聚焦贝类挥发性物质的组成变化, 研究其构建风味物质的组成及其与环境中微型浮游生物因子(饵料)和非生物环境因子之间的相关性, 一方面深化养殖生物的生理生态研究, 另一方面, 也为典型养殖方式影响下贝类海鲜品质优化以及养殖环境的人工调控提供参考。
1 材料与方法
1.1 野外采样、养殖迁移及养殖环境因子调查
养殖迁移前菲律宾蛤仔(LA组): 采自福建省连江县定海湾开放式自然滩涂养殖区, 采样点经纬度E119°67′30.09″, N26°23′57.04″。鲜重为20.6 ± 1.7 g, 平均体长26.2 ± 4.4 mm。取现场采样的部分样品于–20 ℃冷藏待测(LA组)。活贝低温冷链转移自浙江宁波横码海水养殖围塘(E 121°46′28.53″, N 29°39′02.45″), 于围塘水质环境中养殖20 d后, 第二次取菲律宾蛤仔样品(HM组), 于–20 ℃冷藏待测备用。
迁移养殖前后非生物环境因子检测: 两处采样点水质参数以多参数水质仪(EXO2, YSI, 美国)测量, 检测的环境参数包括水温、盐度、pH、溶解氧、总溶解固体、电导率和浊度。同时, 以BBE荧光探测器(Moldaenke GmbH, 德国)检测水体中叶绿素(Chl)和蓝绿藻(BGA)的总体水平。
采样地微型真核浮游生物群落调查: 利用18s高通量测序分析研究手段, 对两处水体中微型真核浮游生物群落和差异特征进行了样品采集和分析。在两处采样水域, 使用1 L采水器于水层中下部采集水样。现场用200 µm筛绢对水样进行过滤, 以去除大型浮游动物等生物以后, 以0.45 µm滤膜过滤1 L水样, 滤膜存储于–80 ℃冰箱备用。采样各3次重复。开放式自然滩涂水样(LA)为贝类采样点被潮水淹没后在同一经纬度处的水样; 围塘水样为同一围塘采水水样(HM)。
利用核酸序列(18S)高通量测序和分析方法, 对滤膜上微型真核浮游生物的组成结构进行分析。使用Power Soil® DNA试剂盒(MO BIO Laboratories, Carlsbad, CA, USA)提取DNA。使用连接有barcode的特殊引物扩增18S V4高变区, 引物序列为: 528F(5′-GCGGTAATTCCAGCTCCAA-3′)和706R(5′- AATCCRAGAATTTCACCTCT-3′)。PCR反应体系: 15 µL Phusion®High-Fidelity PCR Master Mix (New England Biolabs, 3 µL引物, 10 µL模板DNA, 2 µL无菌水。反应条件: 98 ℃预变性1 min, 30个循环内98 ℃变性10 s, 50 ℃退火30 s, 72 ℃延伸30 s, 最终72 ℃延伸5 min。PCR产物检测合格及回收纯化后, 使用NEB Next®Ultra™ DNA Library Prep 试剂盒(New England Biolabs)构建文库, 在Qubit@ 2.0 Fluorometer (Thermo Scientific)上检测文库, 合格后通过Ion S5TM XL平台对文库进行高通量测序(北京诺禾致源科技股份有限公司)。
使用Cutadapt 对原始reads进行过滤, 去除嵌合体序列后获得有效reads。基于有效reads进行OTU(操作分类单元)聚类和物种注释分析, 使用Uparse软件对序列进行分析, 相似性>97%的序列作为同一个OTU。基于RDP Classifier分类算法, 与Silva 128数据库比对并结合NCBI更新序列进行物种注释, 去除结果为Unclassified和Metazoa的序列, 使用最少序列样本的序列数作为标准对样本进行抽平处理, 最终得到均一化数据, 形成分析使用的OTU表。
1.2 菲律宾蛤仔挥发性风味物质分析
1.2.1 样品前处理
将冷冻菲律宾蛤仔样品置于冰面上维持低温, 稍解冻以后, 取肌肉样品置于50 mL离心管内, 各样品湿重为17~18 g。配置饱和食盐水, 按照贝肉与食盐水1∶1的比例, 将食盐水倒入离心管中, 增加挥发性成分的盐析效应以提高挥发性成分的提取效果[12]。使用T25高速分散机(德国IKA公司)进行匀浆处理后, 取5 mL匀浆, 倒入15 mL顶空进样瓶中, 进行挥发性物质采样。两处采样点的样品各5个平行处理。
1.2.2 顶空固相微萃取和气相色谱-质谱条件
顶空固相微萃取条件: 利用全自动固相微萃取进样系统(德国Gerstel公司)。样品首先在60 ℃下振荡平衡15 min, 再将预先老化30 min的50/30 μm DVB/CAR/PDMS萃取头(美国Supelco公司)深入到样品顶空处吸附20 min。此过程中, 温度仍为60 ℃并持续振荡。吸附完成后, 将萃取头插入到GC进样口, 在210 ℃温度下解吸7 min。
色谱条件: 利用7890B-7000C气相色谱-质谱联用仪(美国安捷伦科技有限公司), 使用VOCOL 毛细管柱(60 m×0.32 mm×1.8 mm, 德国CNW公司)进行分析。进样采用不分流模式, 柱温箱起始温度35 ℃, 保持2 min, 以15 ℃/min, 升温至125 ℃, 保持1 min, 再以2 ℃/min升温至200 ℃, 保持12 min。载气为高纯氦气, 流速为1.6 mL/min; 进样口温度210 ℃。
质谱条件: EI离子源; 电子能量70 eV; 灯丝发射电流为200 μA, 离子源温度为230 ℃; 扫描质量范围, 50~500 m/z。
将测得的各化合物谱图与计算机谱库(NIST/ Wiley)中的标准物质谱图进行对比, 辅以人工图谱解析, 并结合正构烷烃标准品的保留时间进行定性分析。按面积归一化法进行定性定量分析, 求得各化合物的相对百分含量。
1.3 数据处理
采用Simca软件对各组挥发性风味物质的数据进行主成分分析(PCA); 用Excel绘制百分比堆积图分析挥发性物质含量变化; 微型真核浮游生物群落的Alpha多样性分析使用QIIME进行, Beta多样性分析、组间差异、物种与环境因子的相关性均使用R软件(vegan package)进行分析和可视化。
2 结果
2.1 不同养殖区的水质、叶绿素a及蓝绿藻生物量
利用多参水质仪以及BBE荧光探测器, 对两个养殖水域的水质及叶绿素和蓝绿藻生物量进行了测定, 结果如表1所示。
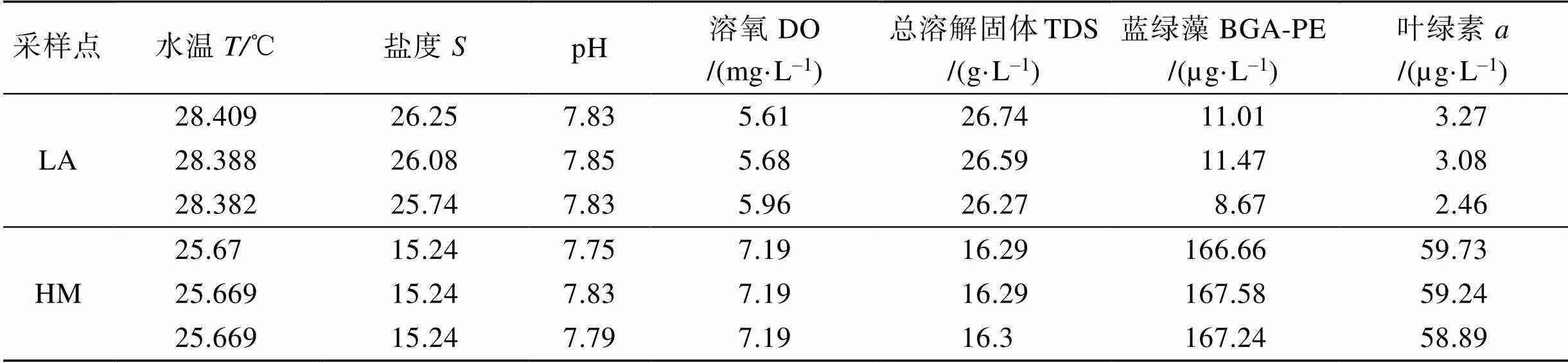
表1 开放式滩涂区(LA)和围塘区(HM)水质及叶绿素a和蓝绿藻生物量
从调查的结果可以看出, 非生物环境因子方面, 开放式滩涂区水温和盐度均较围塘区高, pH水平相近, 溶氧水平在开放式滩涂区较围塘区较低。总溶解固体在开放式滩涂区显著高于围塘区, 说明其水质的矿化程度高于围塘区。微藻生物因子方面可以看出, 围塘区水中的藻类总体水平远大于开放式滩涂区, 其中藻类生物量(Chl含量)是开放式滩涂区的20倍, 蓝绿藻水平是开放式滩涂区的16倍。因此, 围塘区的养殖贝类处于食物生物量相对丰富的水域中。
2.2 不同养殖区的微型真核浮游生物组成结构特征
本研究利用18S高通量测序和分析技术, 重点比较了两个养殖区真核微型浮游生物的群落组成和结构特征及其差异性。开放式滩涂区, 基于连江的三个样本LA1、LA2、LA3的有效数据进行分析, 18S文库经聚类得到1 474个OTU, 分别隶属于32个门, 295个属, 丰度最高的前十个门分别是Diatomea、Ciliophora、Dinoflagellata、Protalveolata、Cryptophyta、Cercozoa、Chlorophyta、Ochrophyta、unidentified_Eukaryota、Chytridiomycota。丰度最高的前十个属分别是(Diatomea)、(Diatomea)、(Ciliophora)、(Dinoflagellata)、(Diatomea)、(Protalveolata)、(Dinoflagellata)、(Protalveolata)、(Diatomea)、(Ciliophora)。
围塘养殖区, 基于横码的HM1、HM2、HM3的有效数据进行分析, 18S文库经聚类得到138个OTU, 分别隶属于24个门, 79个属, 丰度最高的前6个门分别是Ciliophora、Cercozoa、unclassified Eukaryota、Dinoflagellata、Ochrophyta、Stramenopiles。丰度最高的前6个属分别是(Ciliophora)、(Ciliophora)、、unclassified Eukaryota、(Dinoflagellata)、(Ochrophyta)。可见, 围塘水域的微型真核浮游生物物种类数显著低于开放式滩涂水域。
图1为两组样本分别在门和属水平上的相对丰度图。从图中可以看出, 开放式滩涂养殖区中, 硅藻门(Diatomea)相对丰度最高, 约占47%, 其次为甲藻门(Dinoflagellata)和纤毛虫门(Ciliophora), 两者占比都近16%。而围塘养殖区, 纤毛虫门(Ciliophora)占有相对最高丰度(约67%), 其次为丝足虫类(Cercozoa), 占14%, 围塘中, 甲藻和杂色藻(Ochrophyta)占比分别为6%和3%。

图1 基于18S核酸序列检测的微型真核浮游生物物种相对丰度(A为门水平, B为属水平)
对两个水域微型真核浮游生物群落结构的alpha多样性分析结果显示(表2), 围塘区(HM)样本的Goods coverage 指数略高于开放式滩涂区(LA), 说明其测序深度相对高。从分析群落多样性均匀度和稳定性等相关的几种指数来看, Shannon、Simpson、Chao1、ACE、PD等各指数的值, 在开放式滩涂区均大于围塘区。因此, 结果显示了开放式滩涂区较围塘水域具有更高的群落多样性, 物种分布更均匀, 群落内物种的亲缘关系更为复杂。

表2 开放式滩涂区和围塘区的微型真核浮游生物群落的alpha多样性指数
2.3 不同养殖区菲律宾蛤仔VOCs化合物组成及定量特征
经过标准谱库比对和人工手动解谱, 获得了菲律宾蛤仔挥发性风味物质的定性定量结果(表3, 图2)。所有样品中, 共鉴定出52种挥发性物质, 其中醛类11种、醇类7种、烷烃类5种、烯类4种、酯类4种、呋喃类3种、芳香烃3种、含硫化合物2种、含氮化合物2种, 其他11种。醛类中, 开放滩涂区样品苯乙醛占比最高(约10%), 围塘区样品正己醛占比最高(约7%); 醇类中, 蘑菇醇在两个区域的样品中均占比最高(约9%~18%)。
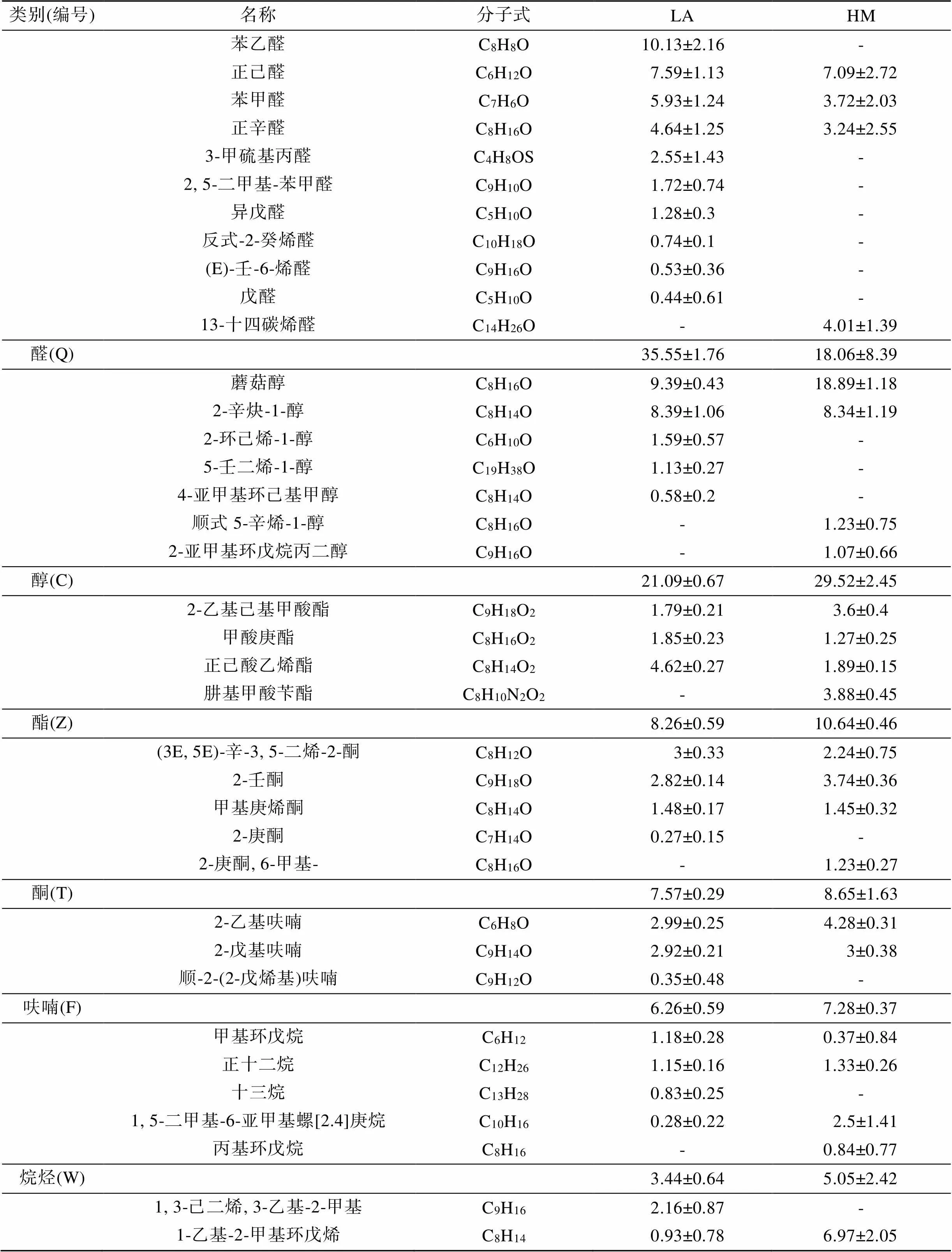
表3 开放式滩涂区(LA)和围塘区(HM)中菲律宾蛤仔VOCs化合物的组成含量(%)
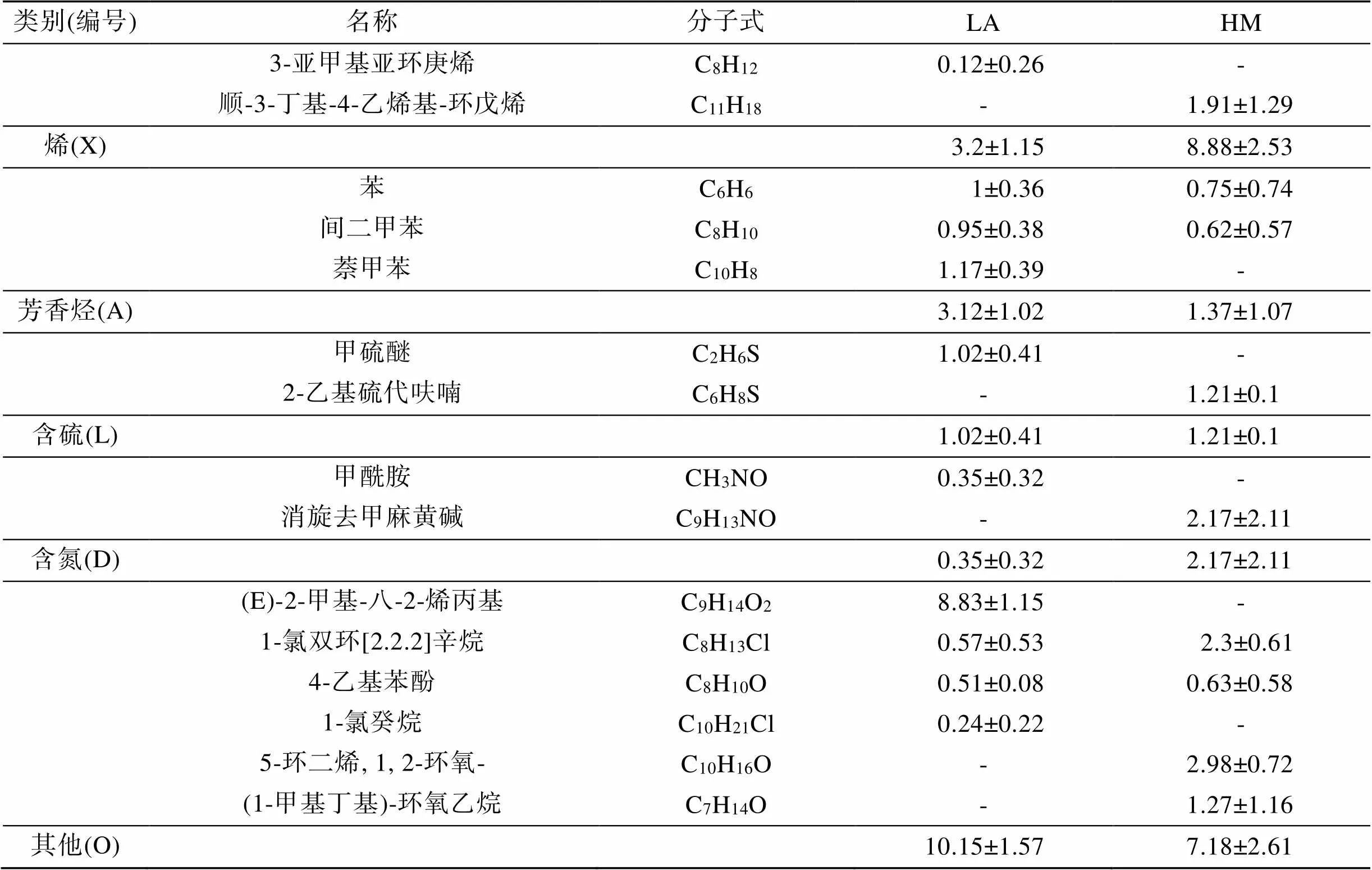
续表
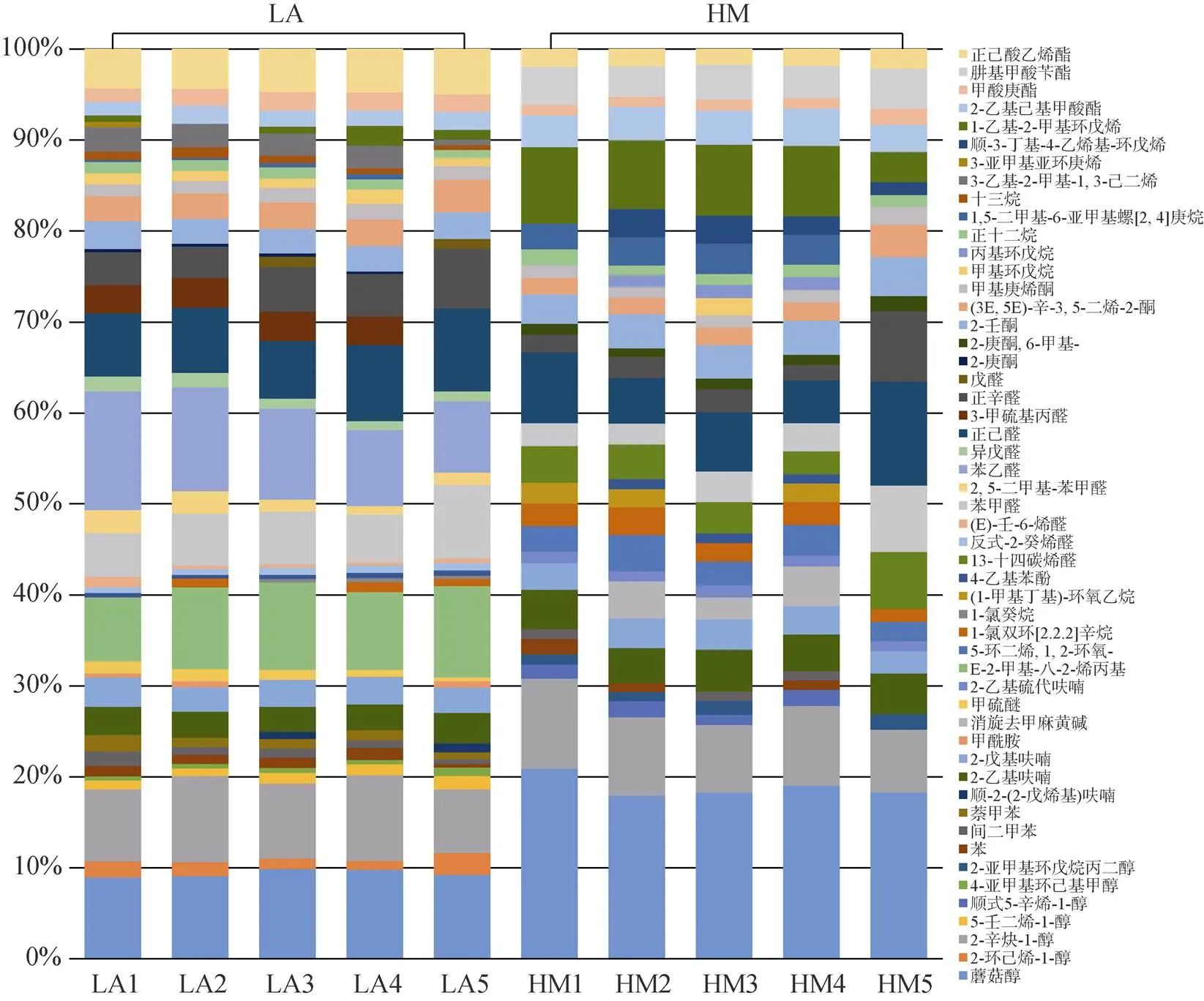
图2 开放式滩涂区(LA)和围塘区(HM)菲律宾蛤仔挥发性风味物质组成变化
对两组挥发性物质组成进行PCA分析结果显示, 从开放式滩涂迁移至围塘区养殖20 d后, VOCs组成结构发生了显著变化(图3): 其中第一主成分的贡献率为62.1%, 第二主成分的贡献率为16.2%, 两者累积贡献率为78.3%, 说明该分析模型形成的主成分可以真实反映样本的整体信息, 两者存在显著差异(<0.05)。
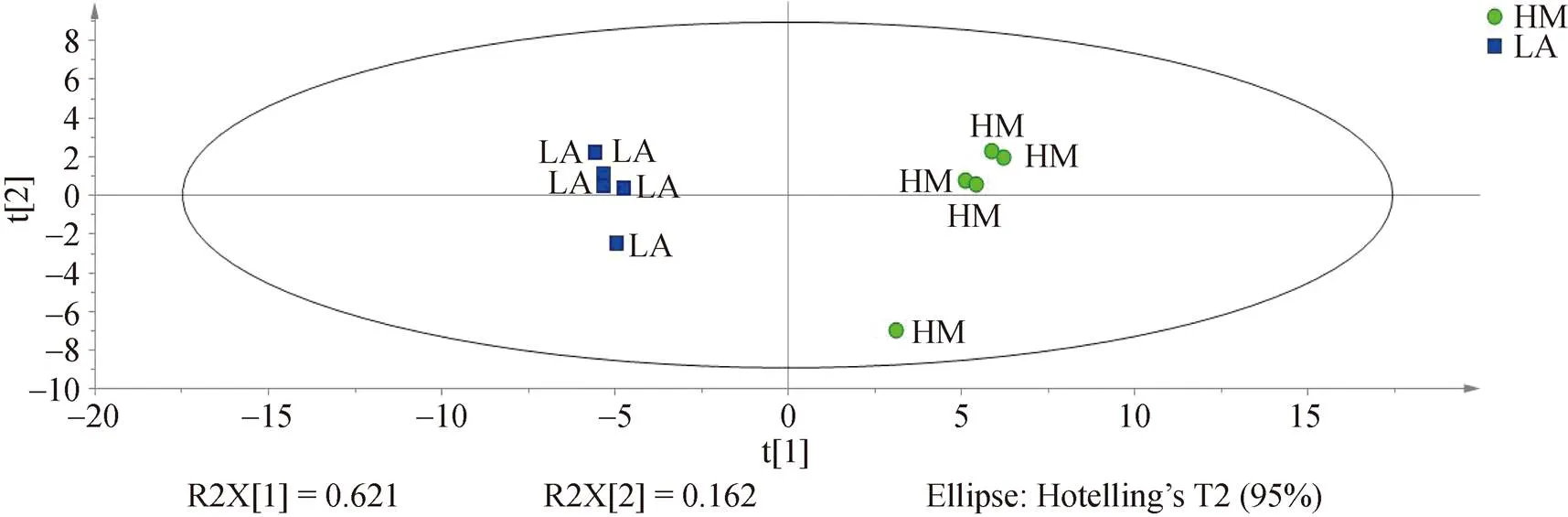
图3 开放式滩涂区(LA)和围塘区(HM)养殖后菲律宾蛤仔VOCs化合物PCA分析
比较VOCs各类化合物的相对含量可以看出(图4), 总体而言, 醛类和醇类物质是菲律宾蛤仔中相对含量最高的VOCs化合物(18%~36%), 芳香烃和含硫、含氮化合物类群相对含量较低(0.35%~3%)。从开放滩涂区迁移至围塘区养殖20 d后, 醛类、醇类、酯类和烯类化合物发生了显著变化(<0.05), 其中, 醛类显著降低, 醇类显著升高, 酯类和烯类化合物也显著升高。开放滩涂区贝类中, 醛类的相对含量最高(35.55%±1.76%), 醇类相对含量为9.39%±0.43%; 围塘区养殖后, 醇类相对含量成为最高(29.52%±2.45%), 而醛类降低为18.06%±8.39%。
对两个区域化合物种类数的统计显示(表4), 开放滩涂区迁移至围塘区养殖20 d后, 检出的化合物种类数总体上降低, 其中醛类物质变化最大, 检出的醛类由10种降低为4种, 其中7种化合物在围塘区未检出, 但相对增加了1种化合物。检出的醇类由5种降低为4种。两组中没有种类数量变化的各类VOCs中, 均存在化合物的变化(表3)。
相对含量发现显著变化的几种化合物来看(表3, 图2), 同为C8化合物, 苯乙醛在LA组相对含量最高, 达10%, 但在围塘区养殖后未被检出; 而蘑菇醇在HM组中含量较LA组显著增加(<0.05), 是HM组中占比最高的一种化合物, 也是构成HM组中醇类显著大于醛类的主要化合物; 烯类物质中, 含量明显变化的是1-乙基-2-甲基环戊烯, LA组中仅占0.93%±0.78%, 而HM组中其含量显著增加(6.97%± 2.05%)。
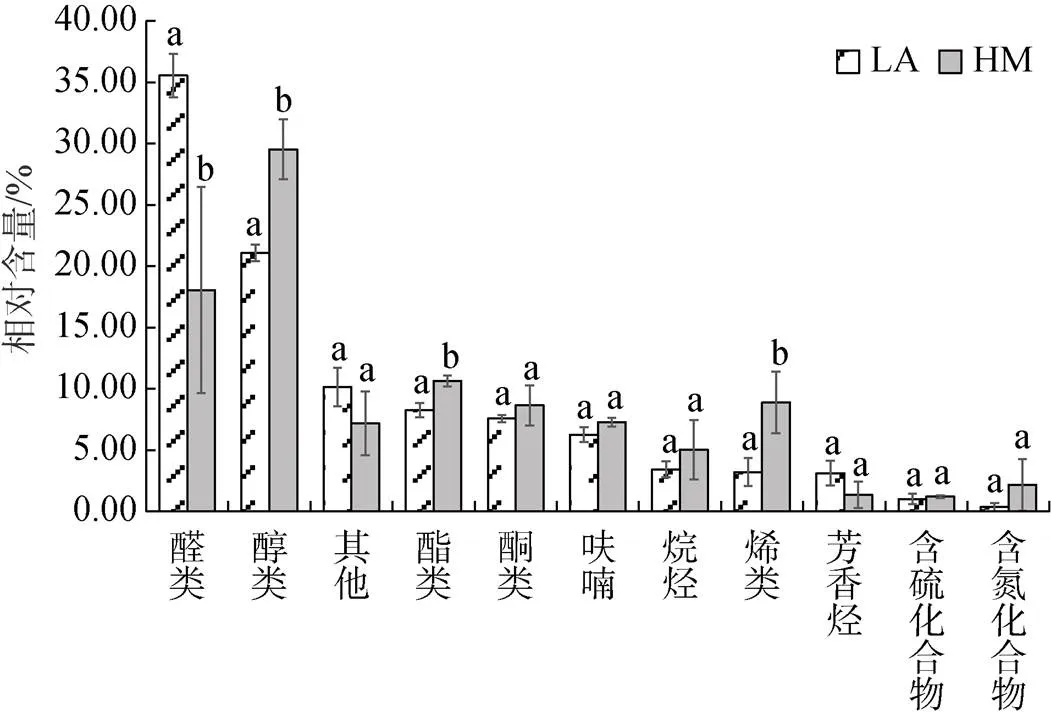
图4 开放式滩涂区(LA)和围塘区(HM)养殖后菲律宾蛤仔VOCs化合物相对含量变化

表4 开放式滩涂区(LA)和围塘区(HM)养殖后菲律宾蛤仔VOCs化合物种类数
2.4 养殖区环境因子与菲律宾蛤仔VOCs组成的相关性
对开放滩涂区(LA)和围塘水域(HM)两组的VOCs与环境因子进行冗余分析(Redundancy Analysis, RDA), 以挖掘影响菲律宾蛤仔VOCs构建的关键环境因子(图5, 表5)。结果显示, LA组VOCs的组成结构与非生物因子中盐度(SAL)、温度(T)、总溶解固体(TDS)及pH等正相关, 与溶氧(DO)负相关(图5a); 与微型浮游生物群落多样性指数正相关, 与藻类生物量(叶绿素和蓝绿藻丰度)负相关(图5b)。与LA组相反, HM组的VOCs的构建与溶氧和藻类生物量指标正相关, 与多样性指数和其他非生物环境因子负相关。从各类化合物与环境因子相关性特征来看, 醛类化合物(Q)与溶氧呈现负相关, 醇类(C)和烯类化合物(X)与溶氧正相关。Mantel检验分析显示, 环境因子中, 饵料总体生物量指标(叶绿素和蓝绿藻)与菲律宾蛤仔VOCs具有显著相关性(<0.05)。
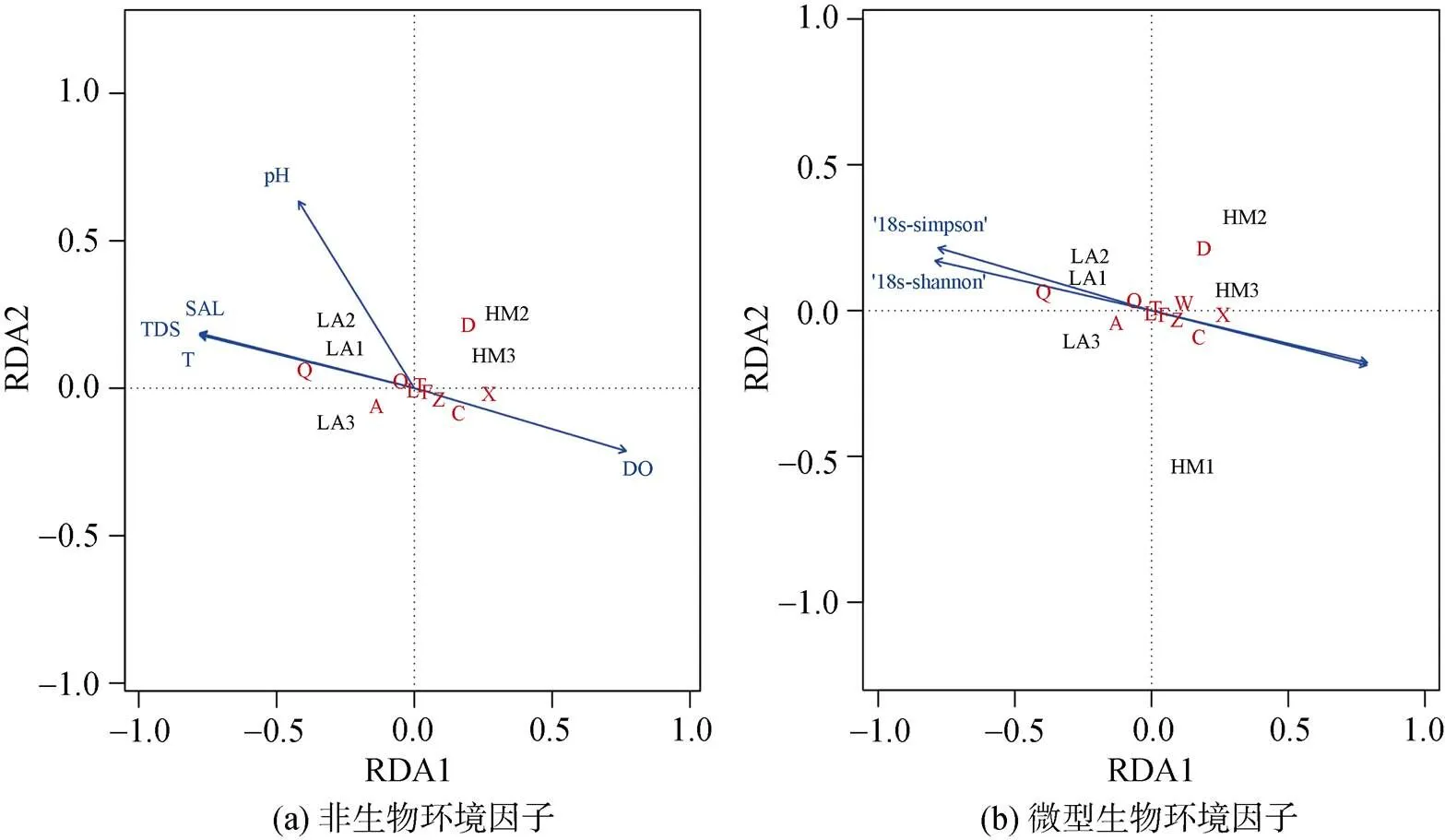
图5 开放滩涂区(LA)和围塘区(HM)养殖后菲律宾蛤仔VOCs各化合物与环境因子RAD分析(各物质代码编号所对应化合物同表3)
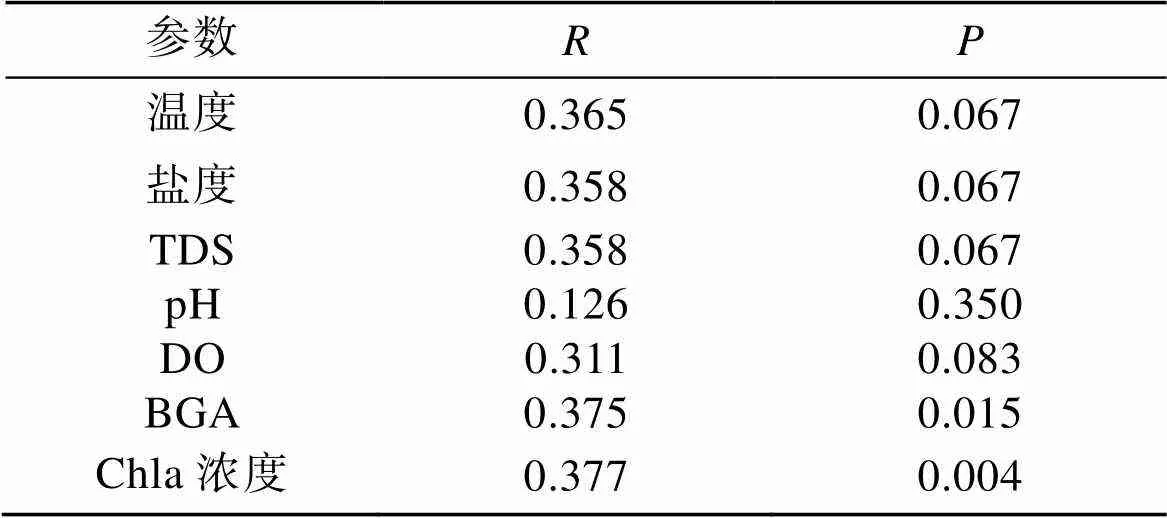
表5 LA和HM环境参数矩阵对VOCs组成矩阵的Mantel分析
3 讨论
菲律宾蛤仔在我国沿海南北海域均有大量养殖, 且生产过程基本形成了自然滩涂与人工围塘相辅相成的格局, 进行养殖区域迁移的现象广泛存在。养殖系统变迁影响下, 贝类的生长及生化代谢响应的不同, 成为了其品质变化的诱因。从多元环境因子中挖掘关键作用因子、解明作用机制, 对贝类的科学养殖、生产和管理以及优化水产品品质具有重要的作用。
利用菲律宾蛤仔养殖生产的典型迁移过程, 对比研究开放滩涂区迁移至围塘区养殖后, VOCs组成结构特征及其环境关系, 可以看出: 养殖迁移会造成菲律宾蛤仔的挥发性风味物质的重构, 其VOCs种类数、物质组成和相对含量均发生显著变化。开放滩涂区生长的菲律宾蛤仔, 其VOCs种类较围塘区丰富。围塘区养殖后, 不仅物质种类数降低, 相对物质比例也发生了变化。尤以醛、醇类产生了显著变化、相对含量出现优势逆转。开放滩涂区迁移至围塘区养殖后, 菲律宾蛤仔的醛类相对含量显著降低, 醇类的相对含量显著增加。从环境因子与VOCs的多元相关性分析结果来看, 溶氧是影响两个区域差别以及醛、醇类优势转换的主要因子。开放滩涂区菲律宾蛤仔醛类物质含量相对高, 说明相对处于低氧化环境, 且环境相关性分析也显示, 开放滩涂区及醛类物质与溶氧呈负相关关系, 说明, 相对于围塘区而言, 开放滩涂区菲律宾蛤仔受到的低氧胁迫压力较大。而围塘区菲律宾蛤仔中, 醇含量显著增加, 醛的种类数和含量均显著下降, 说明在围塘区养殖贝类受到的低氧胁迫压力相对小。这也与两类化合物的氧化还原性质一致。RAD分析结果也显示, 醇类与溶氧正相关。贝类在围塘区养殖, 可能因为养殖过程中维持了曝气增氧, 改变了原来在自然滩涂受到的低氧胁迫。自然滩涂养殖生态环境中, 埋栖性贝类易受到低氧胁迫[13]。菲律宾蛤仔在运输迁移过程中, 也面临对胁迫环境下响应, 但其自身具有快速调节恢复的功能[14]。为了适应低氧环境, 贝类也进化出了在有氧和厌氧呼吸中的相对灵活的转换[15], 具有了相对高效的能量代谢能力, 以产生低毒或更多挥发性有机化合物以利于废物排出[16], 这可能与开放滩涂区养殖的菲律宾蛤仔具有更多的VOCs相关。在围塘区养殖菲律宾蛤仔以增肥过程中, 养殖过程的溶氧条件, 不仅是贝类存活与生长关键因子, 通过对贝类挥发性物质代谢的影响, 在风味特征构建方面也具有重要的作用。
贝类VOCs差异与两个海区的微型浮游生物组成结构具有显著相关性。从生化代谢角度而言, 贝类VOCs的醇和醛类物质, 一般来源于不饱和脂肪酸和氨基酸的代谢分解[17]。贝类脂肪酸的组成结构受到其摄食饵料微藻的重要影响, 环境中不同微藻类群决定了贝类脂肪酸的不同组成结构[18-19]。开放滩涂区中, 微型生物多样性高, 相对生物量低; 而围塘养殖区, 生物多样性低, 但相对生物量高。定海湾滩涂区(LA)的微藻以硅藻和甲藻为优势, 是典型的沿海水域微藻结构特点, 横码围塘养殖区(HM)中, 从真核微型生物结构而言, 缺乏硅藻类群, 但其蓝绿藻生物量和微藻总生物量(Chl)相对高, 反应了围塘区贝类有相对充足的但是相对单一的饵料环境。醛类和醇类是菲律宾蛤仔中相对含量最高的VOCs。溶氧是造成醛、醇类VOCs显著变化的主导因子。溶氧水平影响了菲律宾蛤仔的氨基酸代谢途径, 在低氧胁迫时, 菲律宾蛤仔利用体内各类氨基酸等物质的代谢调控, 实现机体在低氧胁迫时的保护和调节[20]。由此可见, 溶氧和饵料“质量”是菲律宾蛤仔VOCs化合物构建的关键环境因子, 与贝类脂肪酸和氨基酸等重要品质构建环境因子相一致。Ran等[21]对缢蛏在盐度变化影响下挥发性风味物质的分析发现, 随着盐度的升高, 缢蛏鲜肉的VOCs中, 醇类物质相对含量降低, 醛类物质相对含量增加。本研究对菲律宾蛤仔的分析结果也显示, 其VOCs的醇类相对含量与盐度呈负相关, 醛类相对含量与盐度呈正相关, 两个物种具有相同的特征。但是, Ran等[23]的研究中, 将缢蛏蒸煮过以后, 这种规律消失, 说明贝类生长环境因子是构成这种规律的直接因素, 因此反应的是环境因子影响的直接结果。从分析检测技术而言, 基于顶空固相微萃取结合GC-MS技术分析VOCs的样品处理简洁、检出效率相对高效, 利用养殖贝类VOCs组成结构特征、及其与多元环境因子综合关联分析的方法, 可能与利用检测分析VOCs实现对食品品质变化和微生物变化一样[22], 有助于比较和评价养殖环境质量以及贝类水产品品质[23]。
菲律宾蛤仔从开放滩涂区迁移到围塘区养殖后, 蘑菇醇的相对含量显著升高。同时, 苯乙醛在开放滩涂区菲律宾蛤仔中有最高的相对含量, 但迁移至围塘区养殖后未能检出。苯乙醛具有玫瑰香和果香, 被认为是水产品风味品质好的关键物质之一[24], 可能也是自然滩涂水域养殖贝类风味优于围塘水质的原因。蘑菇醇为脂类代谢来源的不饱和醇类, 在多种动植物及海产品中均可检测到[25-27], 具有类似蘑菇的气味特征。相对于其他饱和醇类, 具有较低的风味阈值, 易于被感知。蘑菇醇通过亚油酸或花生四烯酸过氧化而来[28]。在鱼类中肌肉被氧化[29-30]、在豆类产品被水浸泡加工时[31], 蘑菇醇产生量会显著提高[31]。单就分子结构的相关性而言, 两者的增减似乎暗示着某种代谢关联。蘑菇醇的显著增加是否与苯乙醛的显著降低有相关代谢的关联性, 有待进一步开展研究。
4 结论
菲律宾蛤仔在养殖迁移影响下, 其VOCs化合物的种类数、组成和相对含量均发生显著变化。开放滩涂区生长的菲律宾蛤仔, 其VOCs种类比围塘区丰富。围塘区养殖后以醛、醇类产生的变化尤为显著, 相对含量变化明显。开放滩涂区迁移至围塘区养殖后, 菲律宾蛤仔的醛类相对含量显著降低, 醇类的相对含量显著增加。RDA分析结果来看, 溶氧是影响VOCs中醇醛类差别的主要因子, 显示了菲律宾蛤仔对低氧胁迫和增氧措施的响应特征。作为饵料重要来源的微型生物丰度和多样性, 对VOCs的构建具有显著影响, 其多样性和丰度是菲律宾蛤仔VOCs构建的关键环境因子。
[1] MAO Y, LIN F, FANG J, et al. Bivalve Production in China[C]. SMAAL A, FERREIRA J, GRANT J, et al. (eds) Goods and Services of Marine Bivalves. Springer, Cham[A]. https://doi.org/10.1007/978-3-319-96776-9_4.
[2] 肖友翔, 巫旗生, 祁剑飞, 等. 菲律宾蛤仔垦区三联人工育苗技术[J]. 应用海洋学学报, 2020, 39(2): 266-272. XIAO Youxiang, WU Qisheng, QI Jianfei, et al. Technique of triple artificial breeding seedlings inbreeding area[J]. Journal of Applied Oceanography, 2020, 39(2): 266-272.
[3] 周兴. 建设海洋牧场, 点燃海洋经济发展新思路——以青岛鲁海丰海洋牧场为例[J]. 中国水产, 2020, 3: 33-36. ZHOU Xing.Building marine ranching, igniting new ideas of marine economic development -- taking Qingdao luhaifeng marine ranch as an example[J]. China Fisheries, 2020, 3: 33-36.
[4] 肖国强, 柴雪良, 张炯明, 等. 宽壳全海笋稚贝呼吸代谢及其对若干环境因子适应性的研究[J]. 海洋科学, 2007, 9: 24-29. XIAO Guoqiang, CHAI Xueliang, ZHANG Jiongming, et al. Studies on the respiration excretion and adaptiveness to environmental factors of[J]. MarineSciences, 2020, 3: 33-36.
[5] 周率, 冉照收, 徐继林, 等. 不同微藻对缢蛏稚贝肉质风味的影响[J]. 食品科学, 2017, 38(6): 173-178.ZHOU Lv, RAN Zhaoshou, XU Jilin, et al. Effects of different dietary microalgaes on flavor comounds of juvenile[J]. Food Science, 2017, 38(6): 173-178.
[6] HOUCKE J V, MEDIAN I, MAEHRE H, et al. The effect of algae diets (and) on the biochemical composition and sensory characteristics of() during land-based refinement[J]. Food Research International, 2017, 100: 151-160.
[7] PENNARUN A L, PROST C, HAURE J, et al. Comparison of two microalgal diets. 2. Influence on odorant composition and organoleptic qualities of raw oysters ()[J]. Journal of agricultural and food chemistry, 2003, 51(7): 2011-2018.
[8] Shahidi F著, 李洁, 朱国斌译. 肉制品与水产品的风味[M]. 北京: 中国轻工业出版社, 2001: 143-164. SHAHIDI F(compiled), LI Jie, ZHU Guobin(translated). Flavor of Meat and Aquatic Products[M]. Beijing: China Light Industry Press, 2001: 143-164.
[9] 常杰, 牛化欣, 董志航. 香鱼肌肉和鱼籽挥发性风味物质研究[J]. 渔业现代化, 2015, 42(5): 44-47. CHANG Jie, NIU Huaxin, DONG Zhihang, et al.Study on volatile flavor compounds in muscle and caviar of[J]. Fishery Modernization, 2015, 42(5): 44-47.
[10] 刘朋超. 长牡蛎新品系营养品质与风味及浮游动植物饵料相关性研究[D]. 上海: 上海海洋大学, 2019: 37-39.LIU Pengchao. Study on nutrition quality, flavor and plankton correlation of[D]. Shanghai: Shanghai Ocean University, 2019: 37-39.
[11] 吕沛峰, 王迪, 高彦祥, 等. 风味物质传递系统研究进展[J]. 中国食品学报, 2019, 19(12): 284-292. LV Peifeng, WANG Di, GAO Yanxiang, et al. Research progress on flavors delivery systems[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(12): 284-292.
[12] ZHANG Z, LI T, WANG D, et al. Study on the volatile profile characteristics of oysterduring storage by a combination sampling method coupled with GC/MS[J]. Food Chemistry, 2009, 115(3): 1150-1157.
[13] VAQURE-SUNYER R, DUARTE C M. Thresholds of hypoxia for marine biodiversity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(40): 15452-15457.
[14] 王钰, 王文文, 谢深涵, 等. 干露及恢复过程中菲律宾蛤仔免疫指标的变化[J]. 农学学报, 2021, 11(4): 38-43. WANG Yu, WANG Wenwen, XIE Shenhan, et al. The effects of air exposure and recovery on immune parameters of[J]. Journal of Agriculture, 2021, 11(4): 38-43.
[15] YOUNG T, ALFARO A C, VILLAS-BOAS S. Identification of candidate biomarkers for quality assessment of hatchery-reared mussel larvae via GC/MS-based metabolomics[J]. New Zealand Journal of Marine and Freshwater Research, 2015, 49(1): 87-95.
[16] SOKOLOVA I M, FREDERICH M, BAGWE R, et al. Energy homeostasis as an integrative tool for assessing limits of environmental stress tolerance in aquatic invertebrates[J]. Marine Environmental Research, 2012, 79: 1-15.
[17] 冉云, 张思嘉, 陈蓉, 等. 海水暂养过程中缢蛏挥发性成分变化[J]. 食品科学, 2019, 40(10): 206-213. RAN Yun, ZHANG Sijia, CHEN Rong, et al. Change in volatile components ofduring temporary culture in seawater[J]. Food Science, 2019, 40(10): 206-213.
[18] 周率, 冉照收, 于珊珊, 等. 几种微藻饵料对缢蛏稚贝脂质营养组成的影响[J]. 生物学杂志, 2016, 33(3): 52-56. ZHOU Lv, RAN Zhaoshou, YU Shanshan, et al. Effect of several diets on the composition of fatty acids and sterols in juvenile[J]. Journal of Biology, 2016, 33(3): 52-56.
[19] GENG S S, ZHOU C X, CHEN W B, et al. Fatty acid and sterol composition reveal food selectivity of juvenile ark shell Tegillarca granosa Linnaeus after feeding with mixed microalgae[J]. Aquaculture, 2016, 455: 109-117.
[20] SUN X J, TU K, LI L, et al. Integrated transcriptome and metabolome analysis reveal molecular responses of the clams to acute hypoxia[J]. Marine Environmental Research, 2021, 168. https://doi.org/10.1016/j.marenvres.2021.105317.
[21] RAN Z S, ZHANG S J, ZHU Y L, et al. Effect of Salinity on volatiles in the razor clam investigated by head space‑solid phase microextraction/gas chromatography‑ mass spectrometry[J]. Fisheries Science, 2019, 85: 137-146.
[22] BOOTS A W, SMOLINSKA A, VAN BERKEL J J B N, et al. Identification of microorganisms based on headspace analysis of volatile organic compounds by gas chromatography-mass spectrometry[J]. Journal of Breath Research, 2014, 8(2): 027106.
[23] FRATINI G, LOIS S, PAZOS M, et al. Volatile profile of Atlantic shellfish species by HS-SPME GC/MS[J]. Food Research International, 2012, 48: 856-865.
[24] WANG F, ZHU Y J, JIANG S T, et al. Nutritional qualities and sensory characteristics in the hepatopancreas and muscle of female mud crab () in three growth forms: A comparative study[J]. LWT- Food Science and Technology, 2021, 146: 111477.
[25] JOSEPHSON D, LINDSAY R. Enzymatic generation of volatile aroma compounds from fresh fish[J]. Journal of Food Science, 1987, 52(3): 596-600.
[26] ROCHAT S, EGGER J, CHAINTREAU A. Strategy for the identification of key odorants: Application to shrimp aroma[J]. Journal of Chromatography A, 2009, 1216(36): 6424-6432.
[27] MALL V, SCHIEBERLE P. Characterization of Key Aroma Compounds in Raw and Thermally Processed Prawns and Thermally Processed Lobsters by Application of Aroma Extract Dilution Analysis[J]. Journal of agricultural and food chemistry, 2016, 64(33): 6433-6442.
[28] HUNG R, LEE S, BENNETT J W, et al. The effects of low concentrations of the enantiomers of mushroom alcohol (1-octen-3-ol) on.[J]. Mycology, 2014, 5(2): 73-80.
[29] IGLESIAS J, MEDIAN I. Solid-phase microextraction method for the determination of volatile compounds associated to oxidation of fish muscle[J]. Journal of Chromatography A, 2008, 1192(1): 9-16.
[30] IGLESIAS J, GALLARDO J M, MEDINA I. Determination of carbonyl compounds in fish species samples with solid-phase microextraction with on-fibre derivatization[J]. Food Chemistry, 2010, 123(3): 771-778.
[31] BADENHOP A F, WOLKENS W F. The formation of 1-octen-3-ol in soybeans during soaking[J]. Journal of the American Oil Chemists Society, 1969, 46: 179-182.
Effect of aquaculture site transfer on the composition of volatile organic compounds in
YANG Ling1, GUO He2, XU Zhi-hui2, SHAO Qian-wen3, RAN Zhao-shou2, ZHOU Cheng-xu1
(1. College of Food and Pharmaceutical Sciences, Ningbo University, Ningbo 315211, China; 2. College of Marine Science, Ningbo University, Ningbo 315211, China; 3. Ningbo Institute of Oceanography, Ningbo 315832, China)
Environmental factors play critical roles in creating volatile organic compounds (VOCs). In the present study, sampling was conducted during transfer activity at a Manila clam () aquaculture site. The muscle tissue of the clams was used to analyze how VOCs changed and to what extent they were affected by environmental factors. Fifty-two VOCs were identified in the musclesamples by headspace solid-phase micro-extraction/gas chromatography-mass spectrometry. The VOCs were mainly aldehydes, alcohols, ester hydrocarbons, furans, alkanes, alkenes, aromatic hydrocarbons, and sulfur-containing and nitrogen-containing compounds. Forty-one VOCs in the samples were detected from the natural tidal flats. Thirty-two VOCs were detected ~20 d after transferring the clams to an enclosed aquaculture pond. The diversity and types of VOCs changed because of the site transfer. The relative amounts of aldehydes and alcohols were the highest in both groups of samples, and these two compound types varied significantly. The relative amount of aldehydes was higher than that of alcohols in samples from the natural tidal flats. This relationship was reversed after the 20-d culture period (the relative amount of alcohols became higher than that of aldehydes). Dissolved oxygen was the main factor. The abundance and biodiversity of microeukaryotic plankton were significantly correlated with the VOC composition. The biodiversity of the microorganisms was relatively higher in the natural tidal flats, whereas biomass and relative abundance were relatively lower. The abundance was relatively high, but biodiversity was relatively low in the enclosed aquaculture ponds. This study established direct associations between critical environmental factors and the VOC composition of Manila clams. This study provides a reference to further research the mechanism of the correlations and optimize the aquaculture management of Manila clams.
; volatile organic compounds; environmental factors; microeukaryotic plankton; aquaculture site transfer
Feb. 24, 2022
S966
A
1000-3096(2023)6-0079-12
10.11759/hykx20220224002
2022-02-24;
2022-09-05
国家重点研发计划专项课题(2018YFD0900702); 国家贝类产业技术体系(CARS-49)
[Special Fund for National Key Research and Development Project of China, No. 2018YFD0900702; National Shellfish Industry Technology System, No. CARS-49]
杨玲(1996—), 女, 硕士研究生, 研究方向为贝类海鲜品风味构建的环境溯源, E-mail: 17805803137@163.com; 周成旭(1968—), 女,通信作者, 研究员, 研究方向为贝类饵料营养与微藻资源利用, E-mail: zhouchengxu@nbu.edu.cn
(本文编辑: 康亦兼)

