蜂王浆对D-半乳糖致衰老小鼠肾脏的作用
吕国达, 康炜鹏, 魏俏红, 高海娜, 胡 菡,*
(1.中国农业科学院 资源昆虫高效养殖与利用全国重点实验室/蜜蜂研究所,北京 100193;2.北京工商大学 食品与健康学院,北京 100048)
肾脏是维持人体正常生命活动的重要代谢器官之一[1]。随着年龄的增加,肾脏的结构和功能均会发生退行性变化,如体积变小、质量减轻、肾小球硬化、肾小管萎缩等,成为引发急慢性肾脏疾病的重要影响因素[2-3]。近年来,功能性食品和多种营养元素在延缓和改善衰老引起的肾脏疾病方面的作用成为研究热点[4]。
蜂王浆的主要成分为60%~70%的水、12%~15%的粗蛋白、10%~16%的碳水化合物、3%~6%的脂类和一些微量元素[5-7],具有增强免疫力[8]、延缓衰老[9]、抗氧化[10]等多种功能。蜂王浆在辅助治疗肾脏疾病的过程中,能够通过恢复肾小球滤过膜对体内代谢的分辨自控能力,对受损肾脏起到修复的作用,改善肾脏功能障碍[11]。对于乙二醇诱导的氧化肾脏损伤,蜂王浆主要通过减弱脂质过氧化作用,提高系统抗氧化能力发挥保护作用[12]。尽管蜂王浆对肾脏损伤具有显著的保护作用,但蜂王浆对衰老肾脏是否有保护作用以及其调控信号通路仍不清楚。
D-半乳糖(D-gal)致衰老模型是经典的衰老模型之一[13]。该模型可破坏肾脏结构,引起肾小球病变,产生大量自由基,导致肾脏损害。因此,D-gal致衰老模型被广泛应用于肾脏衰老保护作用的研究[14-15]。六味地黄丸是我国的一种传统中药,在临床上对多种肾脏疾病具有一定的改善作用[16-17],主要体现在改善肾脏功能和减轻病理损伤方面。本研究以六味地黄丸为实验的阳性对照组。
基于超高效液相色谱与质谱联用系统(UPLC-MS)的非靶向代谢谱分析已成为一种被广泛肯定的有效方法,可为大范围的小分子化合物提供敏感、准确和可重复性的测量[18-19]。本研究拟通过D-gal注射致使小鼠衰老,同时灌胃蜂王浆,观察衰老小鼠的肾脏组织病理形态和肾脏功能水平,利用非靶标血清代谢组分析衰老小鼠和蜂王浆灌胃衰老小鼠的血液差异代谢物和代谢通路,探讨蜂王浆对肾脏功能的作用及其机制,以期为应用蜂王浆进一步开发功能性食品提供理论基础。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈,色谱纯,美国Thermo Fisher公司;D-半乳糖(纯度≥99%)、乙醇(色谱纯)、多聚甲醛(质量分数>95%)、二甲苯(质量分数>99%)、鼠二抗IgG,美国Sigma公司。尿素氮(blood urea nitrogen,BUN)试剂盒、肌酐(creatinine,Cre)试剂盒,北京九强生物技术股份有限公司;总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒,南京建成生物工程研究所有限公司;苏木精-伊红染色试剂盒,北京索莱宝科技有限公司。单克隆抗体精氨酸琥珀酸合成酶(argininosuccinate synthetase,ASS)、精氨酸琥珀酸裂解酶(argininosuccinate lyase,ASL),武汉三鹰生物技术有限公司;β-actin抗体、ECL Western blotting化学发光基质,美国Thermo Fisher公司。
灌胃用六味地黄丸,北京同仁堂;维生素E(VE,100 mg),浙江制药有限公司;新鲜蜂王浆采集自全国6个主要蜂王浆产地,对采集的新鲜蜂王浆按比例混合后用于灌胃。
1.2 仪器与设备
SCIENTZ08-Ⅲ型非接触超声波细胞粉碎机,宁波Scientz公司;CV200型真空离心浓缩仪,北京市吉艾姆科技有限公司;Milli-Q Q-POD®Element型超纯水仪,德国Merck Millipore公司;Microfuge 22R Centrifuge型台式低温离心机,美国BeckMAN CoulTER公司;Dionex UltiMate 3000型高效液相色谱及四极杆-静电场轨道阱高分辨质谱联用仪(UHPLC-Q Exactive Orbitrap MS),美国Thermo Fisher Scientific公司;KD-BM型生物组织包埋机、KD-BL型冷冻台、KD-P型摊片机,浙江省金华市科迪仪器设备有限公司;DM500型LEICA光学显微镜、LEICA ICC50 W型镜头,德国Leica公司;E-Blot化学发光成像系统,杭州柏奥古科技有限公司。
1.3 实验方法
1.3.1实验动物分组与处理
SPF级昆明小鼠,雌雄各25只,体质量26.0~30.0 g,湖南省SJA实验动物有限公司。小鼠饲喂、注射和灌胃实验在该公司完成,动物生产许可证号:SCXK(湘)2016-0002,伦理编号:IACUC-2020028。
所有小鼠在温度18~21 ℃、相对湿度50%±5%环境下(光、暗12 h循环)适应性喂养2周,在预实验期间,将所有小鼠分为5组,分别为对照组、模型组、阳性对照组(维生素E组和六味地黄丸组)、蜂王浆组,每组雌雄小鼠各5只,所有组自由饮水和进食。除对照组小鼠颈背部皮下注射等体积生理盐水溶液外,其他处理组小鼠颈背部皮下注射D-gal生理盐水溶液(300 mg/kg)进行造模。注射1 h后,对各组小鼠进行灌胃:维生素E组灌胃VE溶液(100 mg/kg),六味地黄丸组灌胃六味地黄丸水溶液(1.36 g/kg),蜂王浆组灌胃新鲜蜂王浆(2 g/kg),对照组和模型组等体积灌胃生理盐水。实验期90 d,每天更换水、饲料并记录小鼠生活状况,每周称量体质量1次。
1.3.2样品采集与预处理
末次灌胃处理后禁食12 h,眼球取血,放入肝素管中,室温静置1 h,于4 ℃、3 000 r/min离心10 min,吸取上层血清,分装后,储存于-80 ℃冰箱备用。取血完毕后,脱颈处死小鼠,取出双侧肾脏组织,用4 ℃生理盐水冲洗表面残血,滤纸吸干表面水分,称取肾脏总质量;称重后左肾用组织固定液固定,用于病理组织学检查;右肾置于冻存管中,液氮速冻后转存-80 ℃冰箱,用于Western blot法检测相关蛋白质含量和抗氧化能力。
1.3.3脏器指数测定
根据小鼠体质量(g)和双侧肾脏总质量(mg),计算肾脏指数,见式(1)。
肾脏指数=m(肾脏)/m(小鼠)。
(1)
1.3.4病理组织学检查
左侧肾脏经质量分数4%的多聚甲醛固定24 h,流水冲洗10 h,乙醇梯度脱水处理,二甲苯对肾脏进行透明处理;经石蜡包埋后,切片,厚度为4 μm,苏木精-伊红(hematoxylin-eosin,HE)染色,制成中性树胶封片,在显微镜下观察并拍照记录。
1.3.5血清和肾脏生化指标测定
参考相应的试剂盒说明书测定血清中的BUN、Cre、T-AOC、SOD和肾脏SOD含量。
1.3.6血清代谢物提取
精密移取100 μL1.3.2节血清样品,加入400 μL体积比为1∶1的乙腈-甲醇,涡旋混匀,低温超声破碎30 min(5 ℃,40 kHz),-20 ℃静置30 min沉淀蛋白质,4 ℃、12 000 r/min离心15 min,移取上清液,将下层沉淀捣碎,用体积比为1∶1的乙腈-水复提1次。将2次上清液混合,冷冻干燥,-80 ℃保存待用。分析时加入体积比为1∶1的乙腈-水复溶,低温超声萃取5 min,4 ℃、12 000 r/min离心15 min,移取上清液至进样小瓶,每个样品取20 μL上清液混合作为质控样品(quality control,QC)。
1.3.7血清代谢物测定
采用UHPLC-Q Exactive Orbitrap MS进行数据采集,使用ACQUITY BEH Amide HILIC色谱柱(150 mm× 2.1 mm,1.7 μm; 美国Waters公司)进行分离。流动相A为体积分数30%的乙腈水溶液(含有体积分数0.1%的甲酸和10 mmol/L的甲酸铵),B相为体积分数95%的乙腈水溶液(含有体积分数为0.1%的甲酸和10 mmol/L的甲酸铵),梯度洗脱程序为0~2.0 min,100% B; 2.0~8.0 min,0~80% A; 8.0~9.0 min,80% A; 9.0~9.5 min,80%~0 A;9.5~13.5 min,100% B。进样量为2 μL,流速为0.3 mL/min。每10个样品进1针QC样品,用于检测系统的稳定性。
采用High Energy Spark-Induced电喷雾离子化方式,喷雾电压大小为正极3.5 kV,负极3.0 kV。毛细管温度为320 ℃,加热器温度为350 ℃,鞘内气体流速为40 arb,在正离子和负离子切换模式下采集数据。采集范围m/z为70~1 000,扫描速率1 s-1。AGC target自动增益控制目标离子数为1×106;最大离子注入时间为50 ms。扫描分辨率为17 500;离子碰撞能量为10、35、60 eV。一级全扫描(full scan),用于定量分析,二级数据依赖性扫描(full MS/dd-MS2),用于化合物的定性分析。MS数据由Xcablibur软件(Thermo Fisher Scientific)收集并保存为Raw格式文件。
1.3.8代谢组数据处理及分析
将采集所得的Raw数据文件导入Compound Discoverer 3.2软件(Thermo Fisher Scientific),以获取匹配和峰值数据,设置参数为最大保留时间偏差0.2 min,质量偏差5×10-6,最小峰响应值1×105,信噪比3。将归一化的数据导入MetaboAnalyst 5.0(https:∥www.metaboanalyst.ca/)进行分析:经帕累托归一化(Pareto-scaling)和对数转换(底数为10)后,进行正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),同时对OPLS-DA模型进行置换检验(permutation test)来确保模型的稳定性和可靠性。根据OPLS-DA模型中VIP>1和单变量统计分析(Student’st-test,P<0.05)筛选差异代谢物,差异代谢物数据通过MetaboAnalyst 5.0 (http:∥www.metaboanalyst.ca)数据库进行KEGG代谢通路富集分析。富集的代谢通路P<0.05和路径影响值>0.1的路径被认为是重要的代谢路径。
1.3.9小鼠肾脏ASS、ASL蛋白质表达水平测定
称取肾脏约80 mg置于离心管中,加入裂解液300 μL,磨碎、匀浆并充分裂解后,4 ℃、13 000 r/min 离心10 min,收集上清液,测蛋白质含量。根据蛋白质含量进行SDS-PAGE凝胶电泳,湿转至PVDF膜,质量分数为5%脱脂奶粉封闭液室温封闭1 h,用含有体积分数为0.1%的吐温水的Tris-HCl缓冲液(TBST)洗涤3次,加入按体积比稀释的β-actin(1∶5 000)、ASL(1∶15 000)、ASS(1∶5 000),一抗4 ℃孵育过夜,TBST洗涤3次,加入按体积比稀释的二抗孵育1 h,洗涤3次,增强型化学发光试剂显影后采用化学发光成像系统进行曝光成像,Image J图像分析软件进行目的条带的灰度光密度分析。每组小鼠任意选择3只作为3个生物学重复,每个生物学样本进行2次技术重复;每个生物学样本目的条带灰度值采用参比蛋白β-actin条带灰度值归一化后再进行统计学分析。
1.4 数据处理
实验数据采用SPSS 16.0软件进行统计分析,结果以平均值±标准偏差表示,通过单因素方差分析比较组间差异,P<0.05为有显著统计学差异,P<0.01为有极显著统计学差异。
2 结果与分析
2.1 蜂王浆对小鼠外观表征和肾脏指数的影响
整个实验期间无小鼠死亡情况,每周对小鼠的日常外观和行为活动进行观察和记录。未观察到拒绝进食或呕吐的情况。对照组小鼠精神状态良好,饮水正常,毛发光泽;模型组小鼠出现了明显的衰老症状,如运动减少、反应迟钝、毛色暗淡和发黄。对照组、维生素E组、六味地黄丸组、蜂王浆组小鼠的精神和行动状态较好。
图1为雌雄小鼠各组肾脏指数的变化。与对照组相比,模型组小鼠肾脏指数显著降低(P<0.05),雄性衰老小鼠的肾脏指数极显著降低(P<0.01)。与模型组相比,雌鼠维生素E组、蜂王浆组小鼠肾脏指数显著升高(P<0.05),六味地黄丸组对小鼠肾脏指数具有一定的改善作用,但效果不显著;雄鼠六味地黄丸组、蜂王浆组小鼠肾脏指数显著升高(P<0.05),维生素E组具有一定的小鼠肾脏指数改善作用,但效果不显著,表明饲喂蜂王浆对小鼠肾脏的保护效果更好。
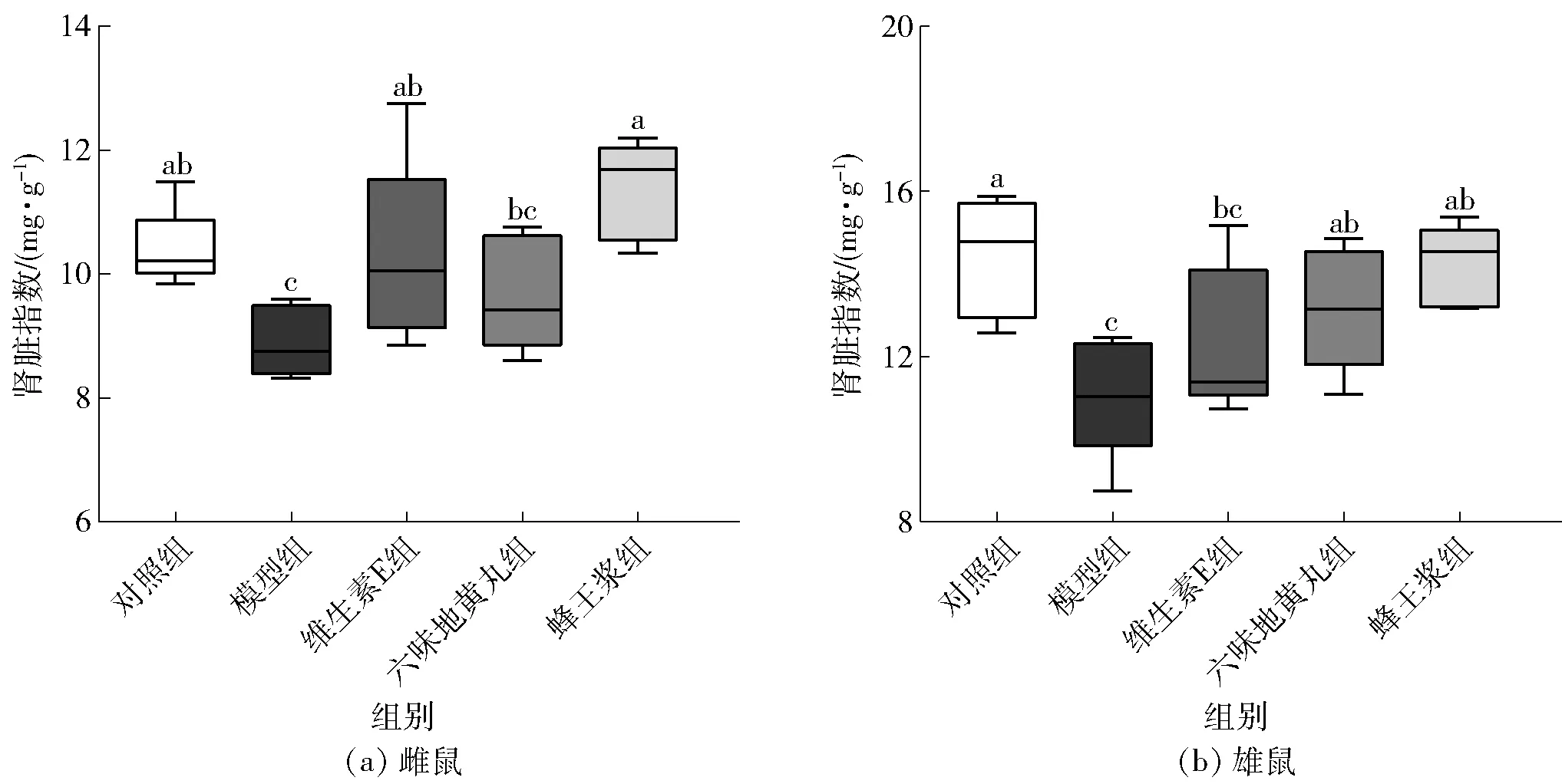
不同小写字母表示组间数据差异显著(P<0.05)。
2.2 蜂王浆对小鼠肾脏组织形态的影响
各组小鼠肾脏形态变化见图2。对照组雌雄小鼠肾脏具有正常的组织形态,肾小球密集分布,结构完整清晰,多呈圆形或椭圆形,肾小囊囊腔和肾小管规则且无明显扩张。模型组组织发生明显变化,肾小囊囊腔明显扩张,肾小球球体萎缩。与模型组相比,维生素E组小鼠肾脏的组织形态没有明显改善,肾小管管腔扩张仍然存在;而六味地黄丸组和蜂王浆组小鼠肾脏中肾小球数量明显增多,且肾小球未见球体萎缩,肾小管规则且无明显扩张。肾脏病理切片结果表明,注射D-gal会导致模型小鼠发生肾脏器质性损伤,六味地黄丸和蜂王浆对D-gal导致的衰老小鼠肾脏损伤起到一定的保护作用。
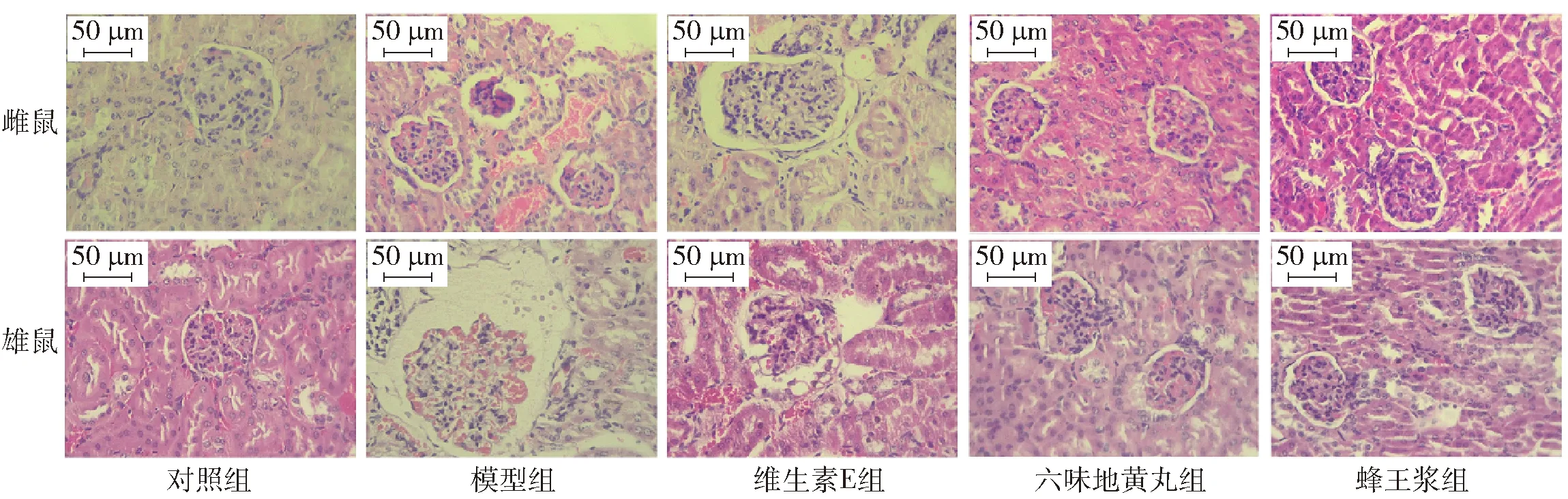
放大倍数为400。
2.3 蜂王浆对小鼠血清BUN、Cre含量的影响
血清BUN和Cre水平是临床上常用的评价肾功能的指标,结果见图3。与对照组相比,模型组雌雄小鼠的血清BUN、Cre含量均显著升高(P<0.05),说明D-gal诱导衰老小鼠发生了肾功能异常或肾功能减退。与模型组相比,除了雌性小鼠维生素E组血清中BUN含量变化不显著,其他各组在饲喂后,雌雄小鼠的血清BUN和Cre含量均显著降低(P<0.05)。
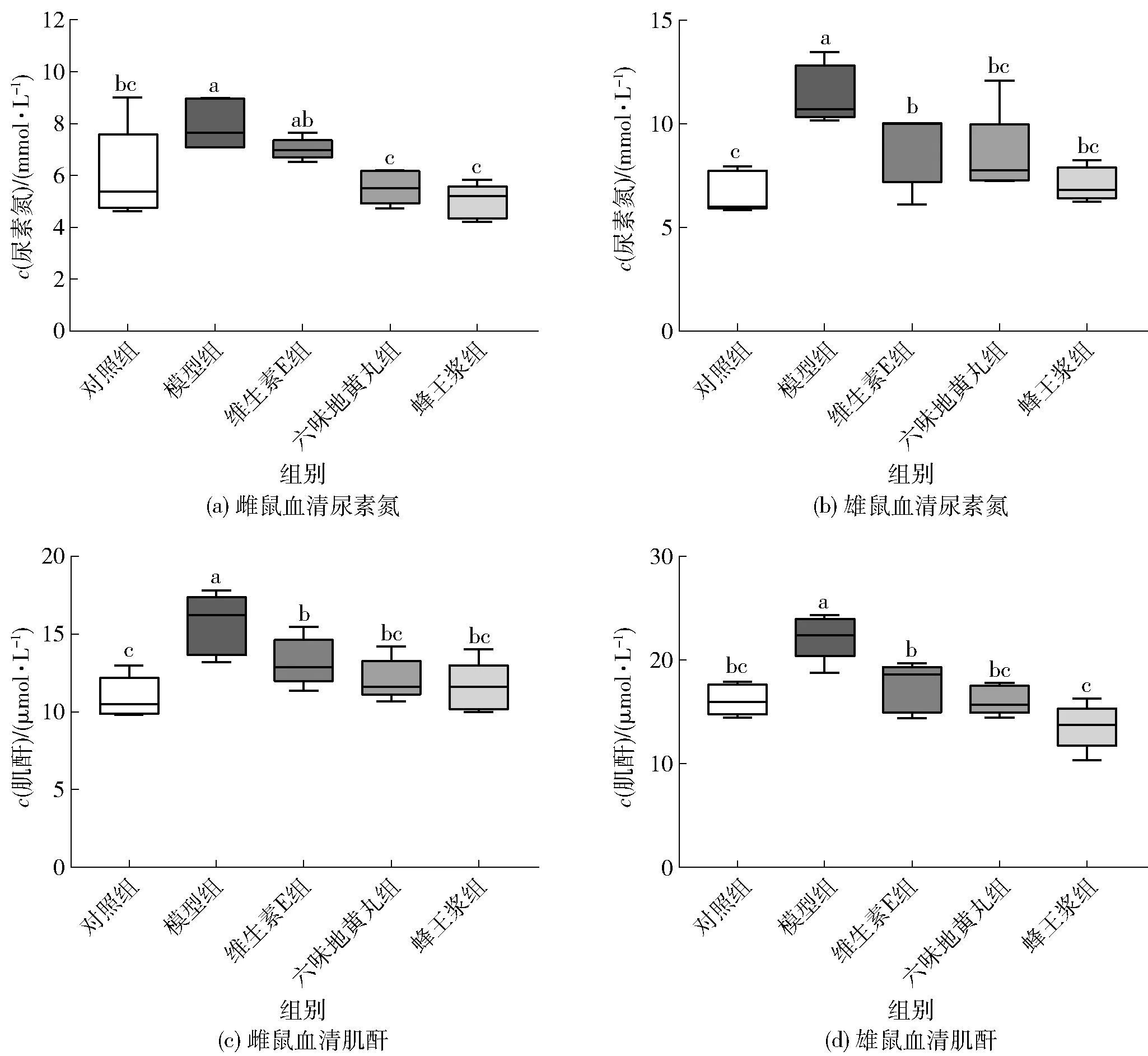
不同小写字母表示组间数据差异显著(P<0.05)。
2.4 蜂王浆对小鼠血清及肾脏氧化应激水平的影响
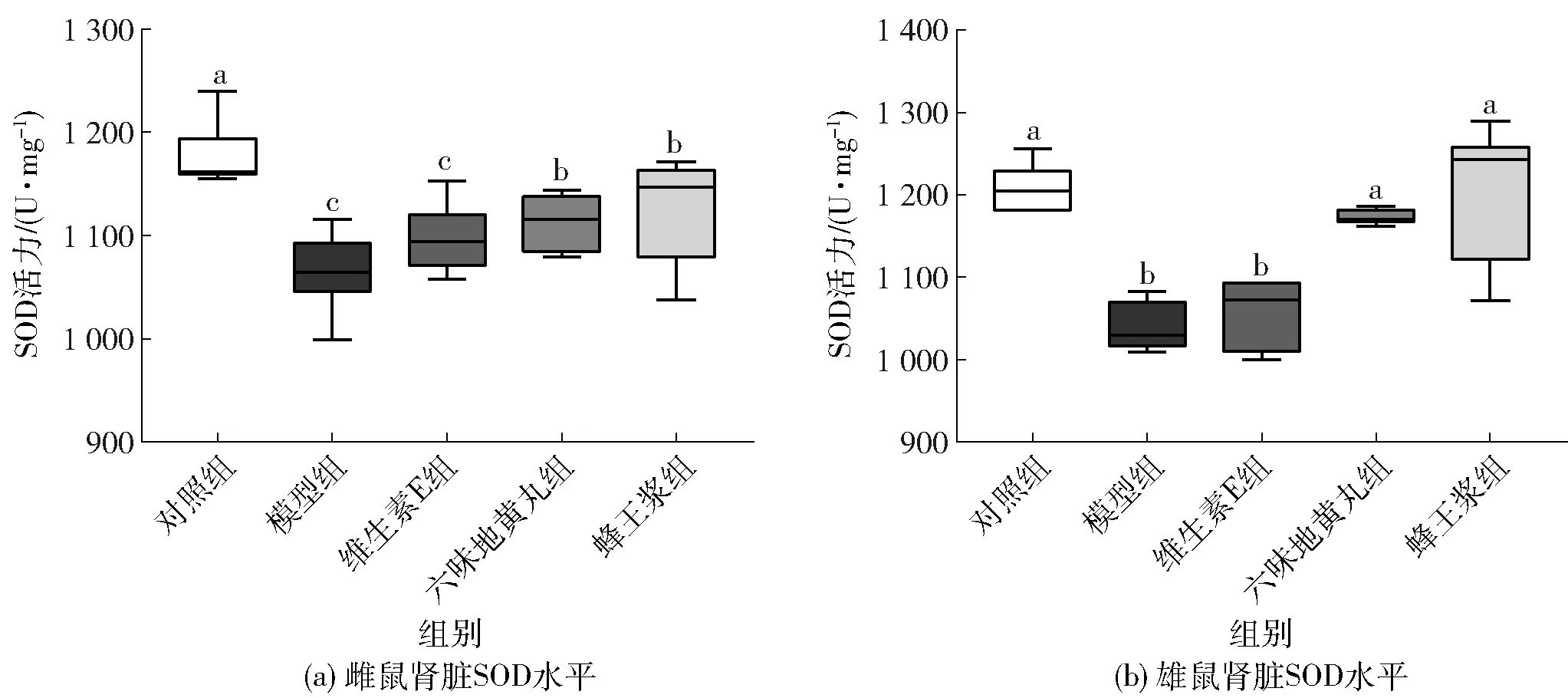
氧化应激是衰老引发肾脏损伤的重要因素之一,而肾脏SOD水平是反映肾脏氧化应激损伤修复能力的重要指标。图4、图5分别显示了不同处理后小鼠血清及肾脏氧化应激水平的变化。由图4可知,与对照组相比,模型组雌雄小鼠血清T-AOC和SOD水平显著下降(P<0.05),D-gal诱导衰老小鼠的抗氧化应激能力显著降低。与模型组相比,维生素E组T-AOC和SOD水平改善效果不显著;六味地黄丸组和蜂王浆组显著提高血清T-AOC和SOD的水平(P<0.05),而蜂王浆组表现出更强的抗氧化能力。由图5可知,肾脏中SOD的变化与血清结果完全一致。与对照组相比,模型组肾脏SOD水平显著下降(P<0.05),饲喂六味地黄丸和蜂王浆后,SOD水平显著升高(P<0.05)。血清和肾脏结果表明,饲喂六味地黄丸和蜂王浆均能够显著改善D-gal引起的衰老小鼠肾脏氧化应激损伤。
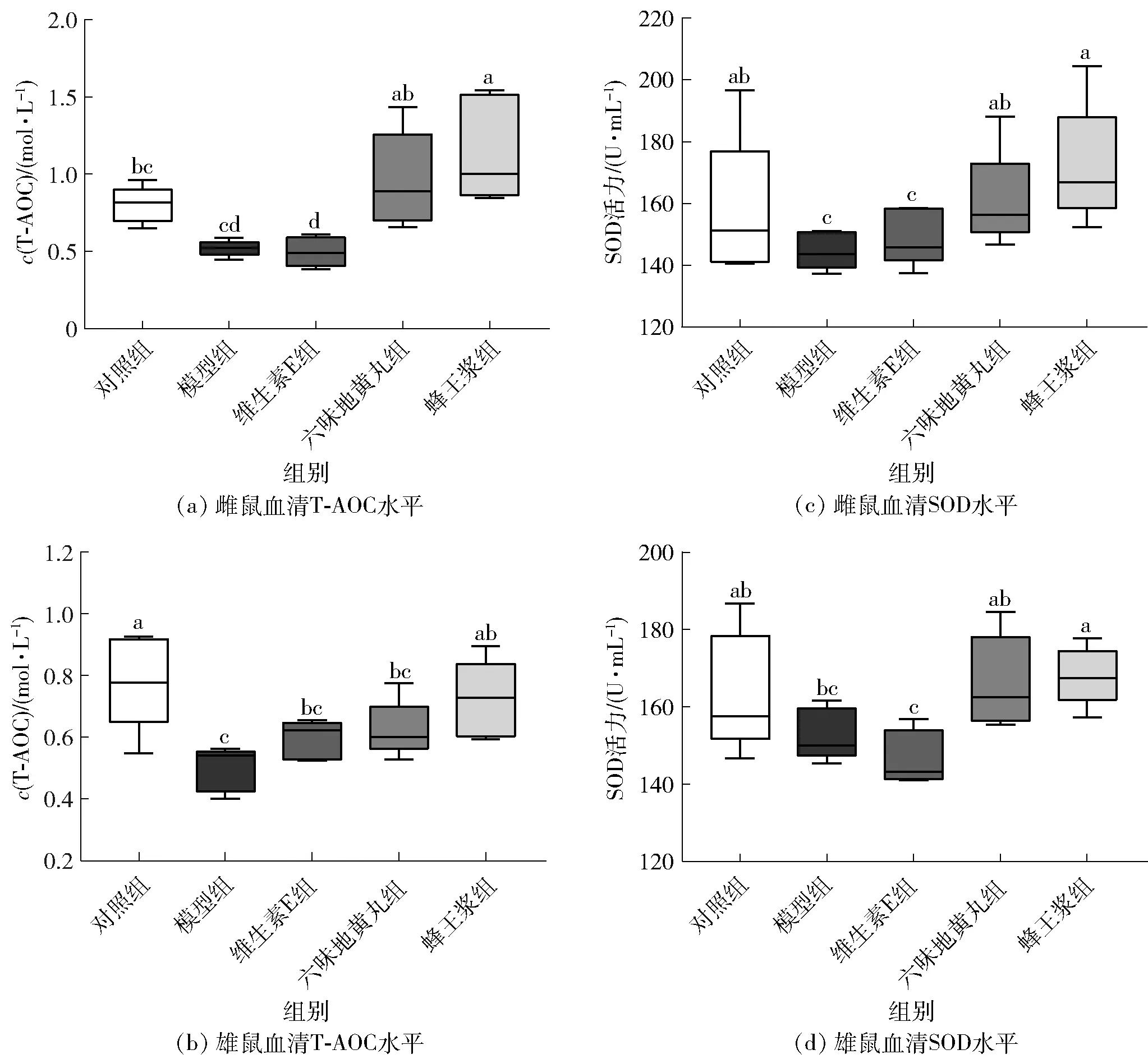
不同小写字母表示组间数据差异显著(P<0.05)。
不同小写字母表示组间数据差异显著(P<0.05)。
2.5 蜂王浆对小鼠血清代谢物的影响
2.5.1多元统计结果

表1 OPLS-DA模型评价参数
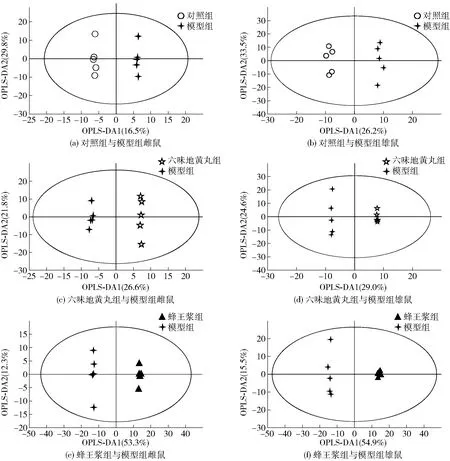
图6 D-gal致衰老小鼠血清代谢的OPLS-DA得分
2.5.2差异代谢物筛选及相关代谢通路分析
根据OPLS-DA模型中VIP>1和单变量统计分析筛选差异代谢物。在模型组与对照组、六味地黄丸组、蜂王浆组中,雌性小鼠分别有99、155和308个显著差异代谢物;雄性小鼠分别有182、167和343个显著差异代谢物。将各组雌雄衰老小鼠血清中差异较显著的代谢物分别导入到MetaboAnalyst 5.0数据库进行KEGG通路富集分析,结果见图7。代谢通路影响值由拓扑分析计算所得,代谢通路影响值和P值分别代表通路的被干扰程度和代谢通路富集分析的显著性水平。将代谢通路影响值大于0.1且P<0.05的代谢通路作为本研究重点关注的代谢通路。

图7 D-gal致衰老小鼠血清差异代谢物相关代谢通路分析
由图7可知,在雌鼠中,与模型组相比,蜂王浆和六味地黄丸对衰老小鼠的精氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,半胱氨酸和蛋氨酸代谢,丙酮酸代谢,糖异生,硫代谢和组氨酸代谢具有显著调控作用,而蜂王浆对衰老小鼠整体的核苷酸代谢、辅助因子和维生素代谢、脂质代谢、能量代谢以及氨基酸代谢都具有更加显著的调控作用。在雄鼠中,与模型组相比,蜂王浆和六味地黄丸对衰老小鼠的精氨酸和脯氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,柠檬酸循环具有显著调控作用,除共有的调控代谢通路以外,蜂王浆对衰老雄鼠的亚油酸代谢、烟酸和烟酰胺代谢、半胱氨酸和蛋氨酸代谢具有显著调控作用。
2.6 蜂王浆对小鼠肾脏精氨酸合成通路的影响
精氨酸合成和代谢与肾脏的炎症、组织修复、近曲小管功能和纤维化形成过程密切相关[20]。精氨酸合成和代谢通路在各实验组雌雄小鼠血清代谢中都发生了显著变化,见图8。其中,雌雄小鼠血清中分别有9和11种代谢物发生了显著变化。与对照组相比,雌性衰老小鼠血清中天冬氨酸、高肌肽、琥珀酸、鸟氨酸、精氨酸、脯氨酸、精氨基琥珀酸、瓜氨酸含量显著降低,乙酰氨基丁酸显著升高;在雄性衰老小鼠中,这8种物质(天冬氨酸盐、高肌肽、琥珀酸盐、鸟氨酸、精氨酸、脯氨酸、精氨基琥珀酸、瓜氨酸)含量的变化与雌性小鼠完全一致,且血清中谷氨酰胺、乙醛酸盐和2-氧化戊二酸盐的含量也显著降低。与模型组相比,雌雄小鼠精氨酸合成和代谢通路中的代谢物在维生素E组中的含量与模型组基本一致;六味地黄丸具有一定的调控作用,且在雄鼠中作用较为明显;而蜂王浆对雌雄小鼠血清中这些代谢物均具有显著的回调作用。
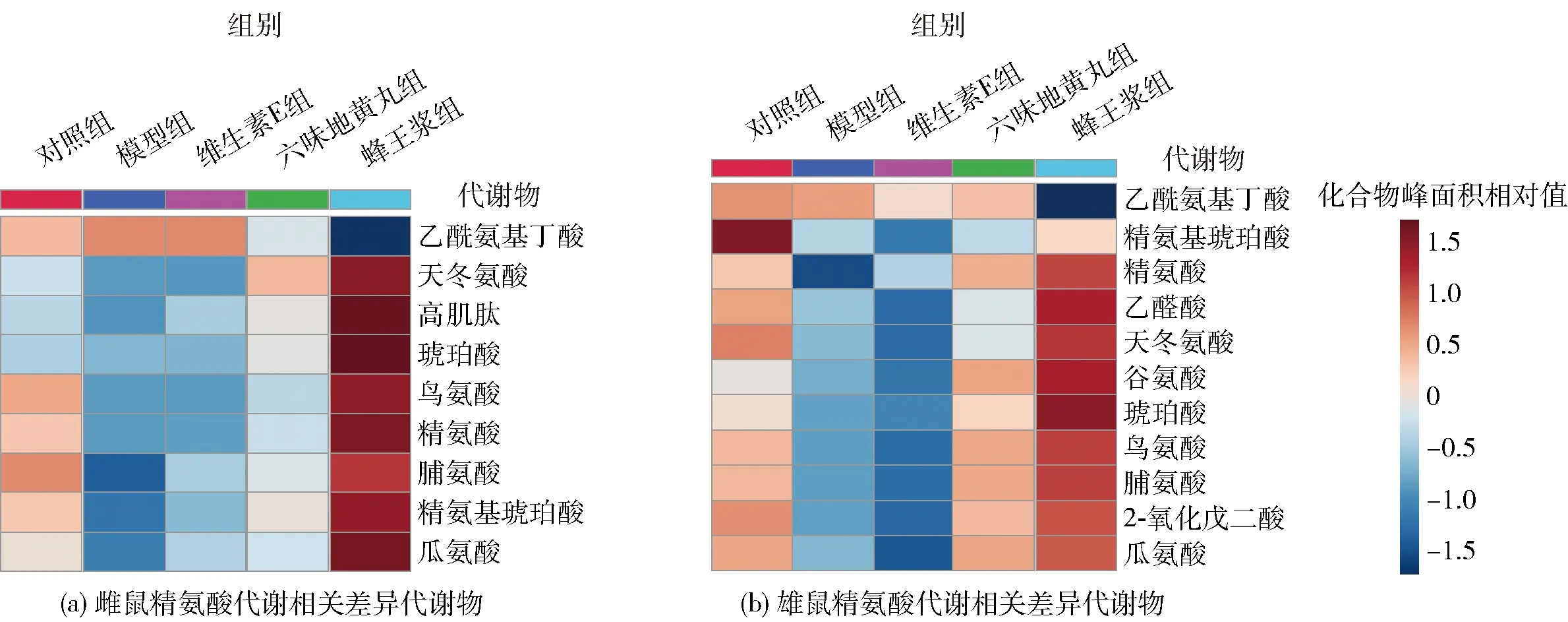
图8 蜂王浆对D-gal致衰老小鼠血清精氨酸合成的影响
同时,实验对肾脏中精氨酸合成和代谢通路涉及的关键酶ASS和ASL的蛋白质表达量进行了测定,见图9。与对照组相比,模型组ASS和ASL蛋白表达水平显著降低(P<0.05),衰老小鼠肾脏合成精氨酸水平下降;与模型组相比,蜂王浆组ASL和ASS的表达显著提高(P<0.05),而与对照组无显著差异,表明蜂王浆能够显著改善D-gal致衰老小鼠肾脏精氨酸合成能力的下降。

不同小写字母表示组间数据差异显著(P<0.05)。
3 讨 论
肾脏是维持机体稳态的重要器官,随着年龄的增长,肾脏的老化、萎缩导致其质量的减少和结构的改变,这是其功能发生变化的主要原因[21]。D-gal在体内醛糖还原酶作用下,生成醛糖醇、H2O2以及超氧阴离子,在体内产生非酶糖基化、氧化应激自由基损伤及诱导醛糖还原酶活性增强等一系列病理和生理性的改变,对肾脏等器官产生损害作用,造成系统功能减退[13]。D-gal对肾脏的损害作用,主要表现为氧化应激损伤、组织病理变化和功能减退,如肾小球体积增大,基底膜增厚,肾脏质量减轻等[14]。研究表明,蜂王浆和六味地黄丸均对肾小管和肾小球损伤、肾功能下降和氧化应激水平上升的相关肾脏损伤模型起到了很好的保护作用,能够有效提高体内抗氧化酶活力和肾脏滤过功能[22-23]。本研究中,根据肾脏指数、血清指标、组织形态、抗氧化能力等分析结果,发现模型组衰老小鼠肾脏氧化应激反应增强、肾脏发生病理性变化,肾脏功能受到损害,而六味地黄丸和蜂王浆对小鼠肾脏这些方面均有不同程度的改善作用,蜂王浆对小鼠肾脏的改善效果更加显著。
不同的组织和器官通过血液运输营养物质和废物,且根据生理或病理变化进行相关调整,而这些变化可通过代谢物水平反映在血清代谢组分析结果中[24]。因此,通过血清代谢组分析,能够建立代谢与衰老和器官病变之间的联系。本研究中,通过血清代谢组分析能够更加清楚蜂王浆对D-gal致衰老小鼠肾脏保护作用的途径。六味地黄丸主要通过影响氨基酸代谢和能量代谢途径来调整衰老引起的代谢紊乱和肾脏功能障碍[25];相较于六味地黄丸的调控途径,饲喂蜂王浆在小鼠氨基酸代谢、能量代谢、脂质代谢和辅助因子和维生素代谢多个途径上起到显著的调控作用,特别是氨基酸代谢。
精氨酸代谢通路在保护肾脏过程中发挥重要作用。研究表明,六味地黄丸通过调控精氨酸和脯氨酸代谢,对自然衰老小鼠发挥肾脏保护作用[25-26]。精氨酸能够通过代谢生成NO,提高SOD活性进而发挥抗氧化作用[27]。同时,精氨酸参与尿素的形成,通过代谢生成天冬氨酸和琥珀酸等代谢产物参与糖异生与能量反应[28];而精氨基琥珀酸通过ASL生成琥珀酸进而促进柠檬酸循环[27]。血清中氨基酸水平与肾脏功能密切相关[29],慢性肾脏疾病患者的血清中瓜氨酸、鸟氨酸和精氨酸的水平逐渐降低[30]。本研究结果显示,模型组衰老小鼠血清中与精氨酸代谢相关的瓜氨酸、天冬氨酸、谷氨酸、鸟氨酸、精氨酸、脯氨酸和谷氨酰胺等的含量显著降低。而蜂王浆中含有丰富的氨基酸[31],蜂王浆的补给显著提高了小鼠血液中这些氨基酸的含量;通过血液运输,这些氨基酸和多肽等小分子物质在小鼠肾脏中不断被过滤和重吸收。因此,推测蜂王浆通过提高血液中氨基酸含量,促进肾脏精氨酸代谢通路中关键酶的表达,从而对小鼠肾脏起到抗氧化、促进能量代谢等作用,有效改善了小鼠衰老伴随的肾脏功能衰退[32]。
4 结 论
本研究通过建立D-gal诱导的衰老小鼠模型,系统地考察了蜂王浆对D-gal致衰老小鼠肾脏的作用。研究结果表明,补给蜂王浆能够显著抑制衰老导致的小鼠肾脏指数降低,下调衰老小鼠血清BUN、Cre水平,提高小鼠机体的抗氧化能力,能够显著改善衰老导致的小鼠肾脏病变。与六味地黄丸组相比,蜂王浆显著调控衰老小鼠的精氨酸和脯氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,亚油酸代谢等代谢途径,这些代谢途径与提高小鼠肾脏组织抗氧化能力、能量供应密切相关。本研究结果表明,蜂王浆对D-gal致衰老小鼠的肾脏具有较好的保护作用,结果旨在为进一步开发蜂王浆作为缓解衰老导致肾脏损害的功能性食品或辅助性药物提供理论基础。

