富营养化高原浅水湖泊持续多年生态修复工程效果分析
——以滇池大泊口为例*
华映肖,潘继征,杜劲松,李 杨,杨 齐,徐 双,黄育红
(1:中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,南京 210008) (2:中国科学院大学,北京 100049) (3:滇池湖泊生态系统云南省野外科学观测研究站,昆明 650228) (4:昆明市滇池高原湖泊研究院,昆明 650228) (5:苏州科技大学环境科学与工程学院,苏州 215009)
滇池是我国著名的高原浅水湖泊,1950s-1960s,其生态环境处于相当健康的状态[1]。然而1970s开始,随着沿岸人类生活废水排放的增加,废水中氮、磷等营养元素逐渐超过了湖泊的自净容量,使滇池初步展现出富营养化的趋势[2]。到了1990s,富营养化程度达到顶点,沉水植物几乎消亡,蓝藻水华大面积暴发,生态系统健康状况不容乐观[3]。2010年左右,滇池外源污染得到控制,水质有所改善,但仍然无法全年稳定维持在Ⅳ类水,湖泊生态系统亟需得到修复。从“七五”“八五”开始,政府注意到了滇池所面临的生态环境问题,制定了相关的保护政策、开展了大量的治理工程措施,2018-2020年水质稳定在Ⅳ类,但是由于缺少科学系统的认知,滇池生态用水量不足、流域面源污染负荷重、水生态受损等问题仍然突出[4]。
“十二五”国家重大水污染防治科技专项示范项目中,大泊口作为滇池草海典型的重度富营养化水域,被设为生态修复工程的示范区,在此开展了两期的生态修复工程[5]。至2019年,大泊口东部及南部水域水质出现明显改善,具有大面积稳定的沉水植物分布,形成稳定的草型湖区,湖泊生态环境得到了良好的恢复[6]。因此,以大泊口水域作为研究对象,通过分析和对比各个湖区水质指标的变化,探究修复成功湖区的水质改善、生态系统企稳向好的原因,对于后续滇池全湖生态修复乃至其他类型富营养化浅水湖泊的生态修复都具有重要意义。
1 研究方法
1.1 研究区域概况
大泊口水域(24.96°~24.97°N,102.64°~102.65°E)位于滇池草海南部,水域面积0.52 km2,约占草海面积的4.8%,平均水深约2 m,全年主导风向为西南风,平均风速2.2~3.0 m/s,其北部有透水堤岸与草海相通,南部与外海仅有海埂相隔,属于半封闭水域[6]。根据昆明市滇池高原湖泊研究院的记载和调查,1980s末以来,大泊口因作为养殖鱼塘,水体开始出现不同程度的富营养化,水质甚至达到劣V类,逢夏秋季节,以蓝藻门和绿藻门为主的浮游植物迅速增殖,水体呈现绿色,透明度较低,转化为重度富营养化的藻型水体。因此,将大泊口作为滇池治理的“缩影”,在大泊口开展生态修复具有现实意义和必要性。
经过工程前期调查发现,大泊口的主要污染来源有3个:草海补给水、内源底泥污染释放以及大泊口西侧生活污水和面源污染排放。草海是大泊口唯一的补给水源,大泊口水质受草海影响很大,重富营养化的草海给大泊口带来了大量的污染负荷,草海每给大泊口补水100万m3,将带来COD负荷55.6 t,总氮负荷6.03 t,总磷负荷0.20 t。大泊口东部底泥淤积厚度约0~50 cm,西部厚度约50~100 cm,氨氮为释放的主要污染物。西侧的生活污水和地表面源污染虽然水量较小,但是污染负荷高,COD负荷约2.63 t/a,TN负荷约0.3 t/a,并且在雨季(5-10月)会对大泊口水质产生较明显的冲击。
大泊口生态修复的主要难点包括生境破坏严重、依靠沉水植物种子库自然恢复困难、水体营养盐浓度过高、水华现象严重和受外草海水质影响大等,同时藻类易进难出,带来了大量污染负荷,主要污染物为总氮、总磷和COD。针对上述生态修复的难点,在大泊口开展了生态修复示范工程的一期和二期工程,具体工程内容详见表1。在两期工程规划以外,根据水生态状况陆续设置了围隔(包括二期工程的围隔),即一期工程开展之后,在大泊口东南部分沉水植物大量生长的水域增设围隔(图1红色围隔)并逐步扩大(至图1蓝色和紫色围隔),二期工程增设围隔(图1绿色围隔),同时将紫色段围隔沉入水中。
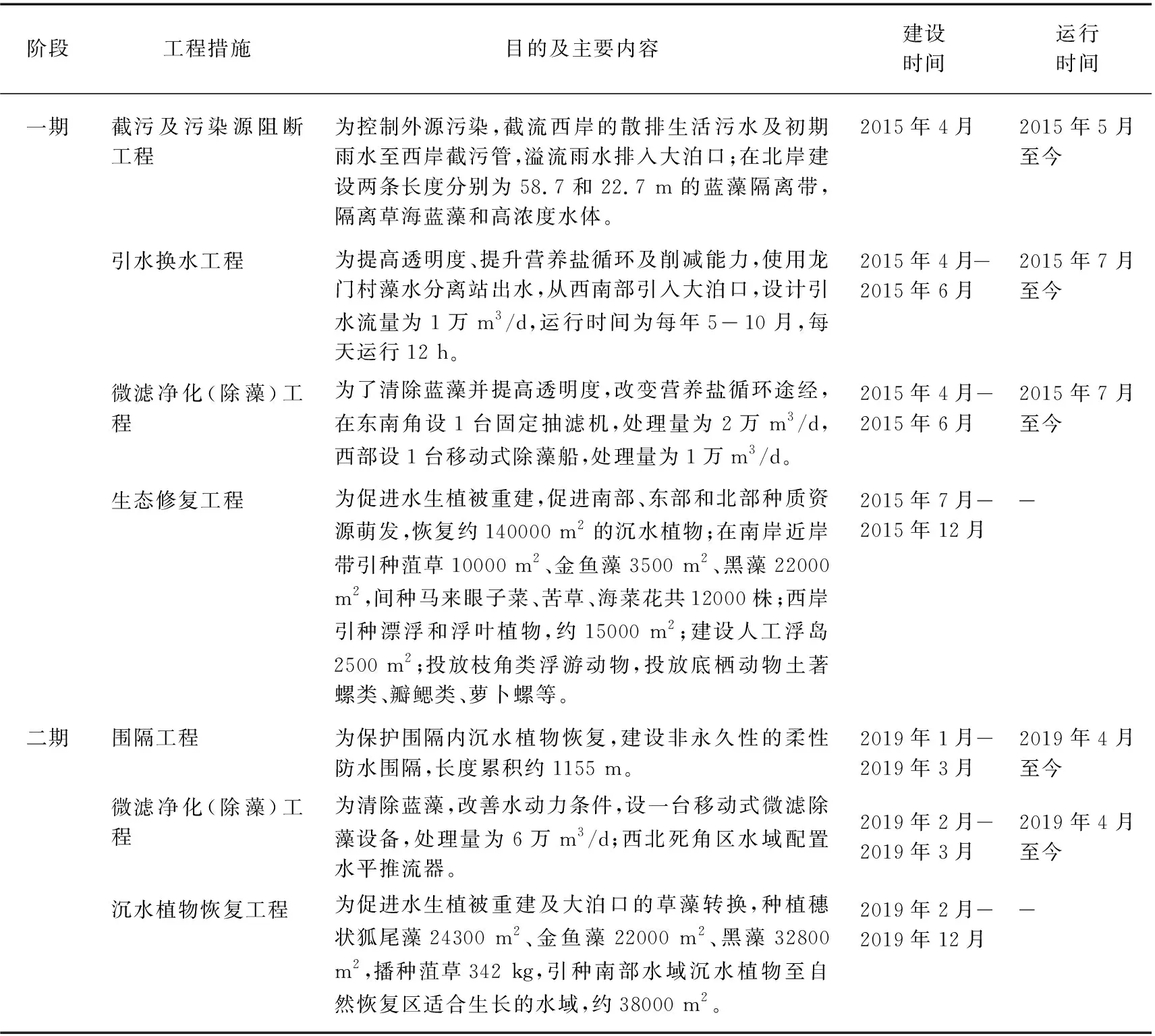
表1 大泊口生态修复工程主要措施及时间节点Tab.1 Main measures and timeline of Dabokou ecological restoration project
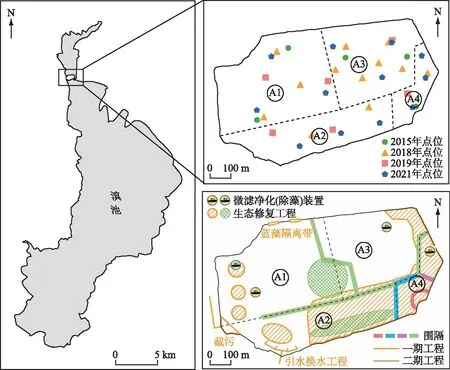
图1 大泊口采样点分布及工程实施示意图Fig.1 Distribution of samplingsites and schematic diagram of restoration projects in Dabokou
1.2 点位设置
大泊口水质数据来源于昆明市滇池高原湖泊研究院。大泊口自2015年实施专项治理工程开始至2021年期间,水质和水生态监测采样点虽发生4次变化,但点位分布均能够反映大泊口水域的总体水质状况。本研究通过大泊口夏季沉水植物分布情况判断是藻型或草型湖区[7],进而以沉水植物现状及演替情况为标准,并结合工程布局(图1)划分了4个水域:分别为A1(藻型湖区)、A2(草藻过度湖区)、A3(草藻过度湖区)和A4(草型湖区)。由于2015年的点位并未覆盖到A2水域,且工程开展前期大泊口水质空间变化较小,因此以A1水域中靠近A2的南部点位代表A2的水质情况。
从2015年2月-2021年12月,持续对大泊口水质进行监测,监测指标包括pH值、透明度(SD)、悬浮物(SS)、生化需氧量(BOD5)、化学需氧量(CODCr)、总磷(TP)、总氮(TN)、氨氮(NH3-N)、叶绿素a(Chl.a)、溶解氧(DO)及水文指标等。由于监测计划变动,在2015-2021年时间尺度上连续完整监测的指标为SS、CODCr、TP、TN和Chl.a,其中,SS浓度采用重量法测定,CODCr浓度采用重铬酸盐法测定,TP浓度采用钼酸铵分光光度法测定,TN浓度采用碱性过硫酸钾消解紫外分光光度法测定,Chl.a浓度采用丙酮-分光光度法测定。
1.3 分析方法
突变分析采用Rodionov等开发出一套自动监测时间序列中多个变化点的工具[8],该方法不需要对稳态转换的时间点进行原假设,待检测的时间尺度主要由截止长度l控制,该工具以Excel宏的形式面向使用者。使用Excel 2016、Origin 2022和ArcMap 10.8对数据进行统计分析及制图。
2 结果与分析
2.1 悬浮物浓度变化及均值突变
大泊口A1、A2和A3水域的SS浓度在研究期间有明显季节性波动,表现出春冬低、夏秋高的特征;A4水域没有明显的季节性变化,总体表现出波动下降的趋势(图2)。大泊口一期工程的实施完毕后,其生态效益逐渐体现,A1~A4水域的SS浓度发生的第一次均值突变均在2017年,均值突变前SS浓度均没有表现出明显的空间差异((28.0±1.0)mg/L),突变后SS浓度均值分别为19.3、18.9、21.0、13.8 mg/L。由于A1水域水位最深,无沉水植物分布,悬浮物不易沉降,水下光照环境恶劣;A2水域有引水工程的入水口,水力冲击会引起一定程度的扰动;A3水域有较多鱼类活动,因此A1~A3水域SS浓度均值第一次突变后未能维持低浓度,其中A1水域SS浓度均值在2020年3月升高至31.9 mg/L,2021年8月再一次升高至44.5 mg/L;A2和A3水域的SS浓度均值分别在2021年8和9月升高至26.2和34.8 mg/L。A4水域的SS浓度均值第一次突变后总体维持在较低浓度。
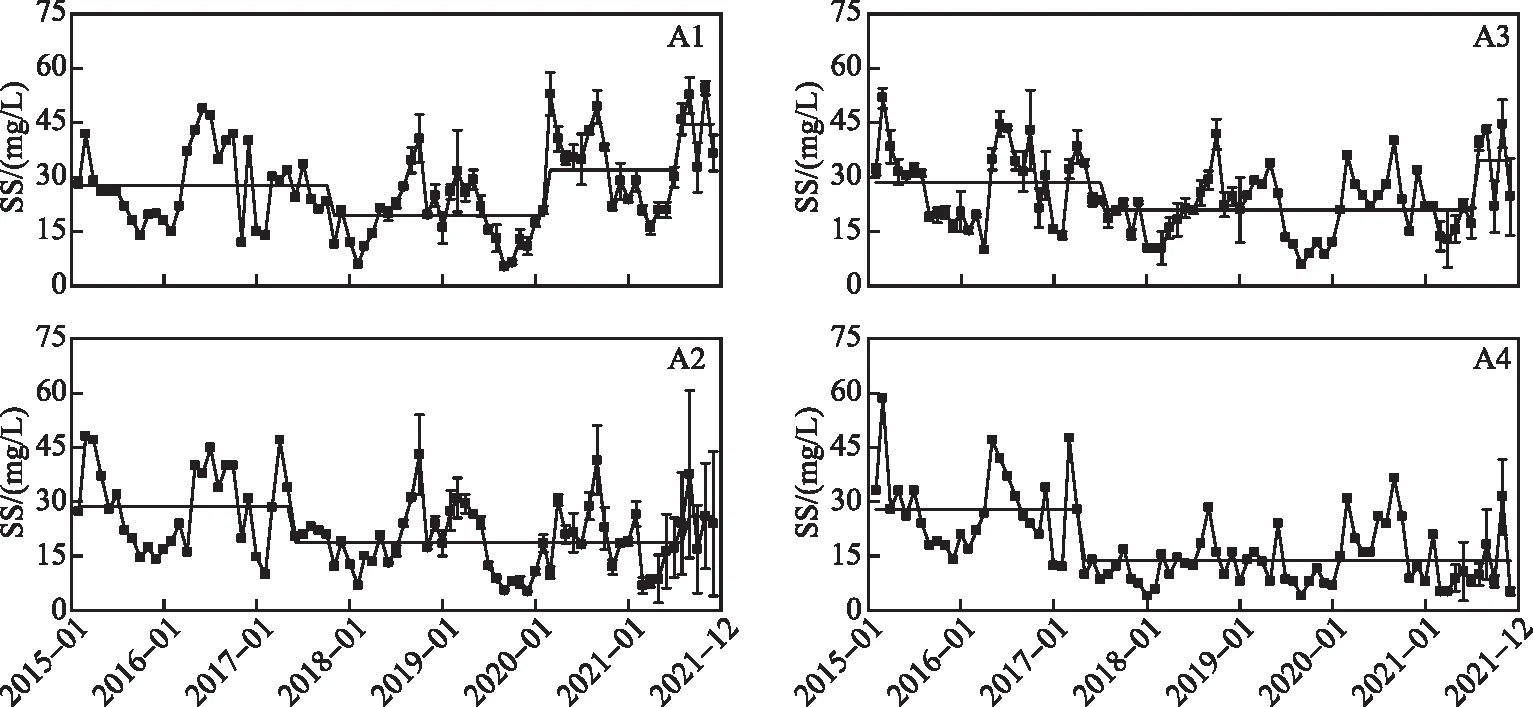
图2 大泊口悬浮物浓度变化及均值突变Fig.2 Concentration change and mean change of suspended solids in Dabokou
2.2 化学需氧量变化及均值突变
大泊口A1~A4水域的CODCr浓度在2015和2016年有明显的季节变化,而2017年6月后较为平稳(图3)。2015年以前,有大量高污染负荷的生活废水经沟渠从大泊口西岸排入水体。一期工程中最先实施的西岸截污工程,有效减少了高CODCr浓度废水的排入,外源污染得到控制。随后4片水域在2016年底发生第1次CODCr浓度均值突变,分别从68.9、68.4、69.2和66.8 mg/L降低至42.3、43.4、46.1和37.2 mg/L,且均在较低浓度保持了4年以上。长久高污染负荷的外源废水使得大泊口水域CODCr不断累积,因此即使在第1次CODCr均值突变发生后,A1~A3水域的CODCr浓度依旧不满足V类水标准。内源CODCr的释放,使后续CODCr削减效果不明显,A1水域的CODCr浓度均值在2021年3月小幅恶化,升高至50.3 mg/L;A2和A3水域的CODCr浓度在2018-2019年发生第2次均值突变,CODCr浓度进一步降低至31.4和35.0 mg/L,虽然在2021年小幅回弹,但CODCr浓度(分别为40.5和43.9 mg/L)并未高于第一次均值突变后的CODCr浓度。A4水域由于其具备稳定沉水植物群落,有机物削减能力远超其余3个水域,其CODCr浓度均值于2018年11月再次突变降低至25.9 mg/L。
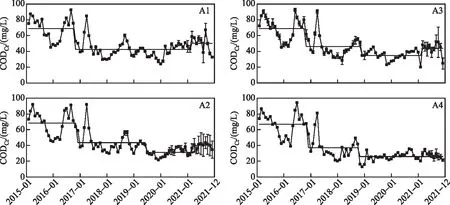
图3 大泊口化学需氧量变化及均值突变Fig.3 Concentration change and mean change of CODCr in Dabokou
2.3 总氮浓度变化及均值突变
大泊口4片水域的TN浓度没有明显的变化趋势,2015年2月的TN浓度均为最大值,且均在2016年6月、2017年4月和2018年秋季出现峰值,其他时间段内波动幅度较小(图4)。4片水域的TN浓度在2016年10月发生第一次均值突变,分别从2.35、2.33、2.39和2.32 mg/L降低至1.66、1.69、1.70和1.36 mg/L。一期工程的实施使大泊口水域逐渐从氮汇转变成为氮源,且沉水植物是影响TN浓度均值突变的重要因素。A1和A2水域维持较低TN浓度均值不足两年,在2018年7月分别升高至2.10和2.21 mg/L,此后A1水域TN浓度继续升高,而A2水域有好转趋势。A3和A4水域维持了第一次均值突变后的TN浓度。在沉水植物生长情况最好的A4水域,水体中的TN浓度削减程度最大,且在高TN浓度的2018年,A4表现出较高的调节能力。在2019年实施的二期工程中,沉水植物加强了A2和A3水域的自净能力,不适宜沉水植物生长的A1水域TN仍然有较大幅度的波动升高。而在2021年8-12月,A1~A3水域的TN浓度均出现恶化,可能与同期草海TN浓度升高有关。
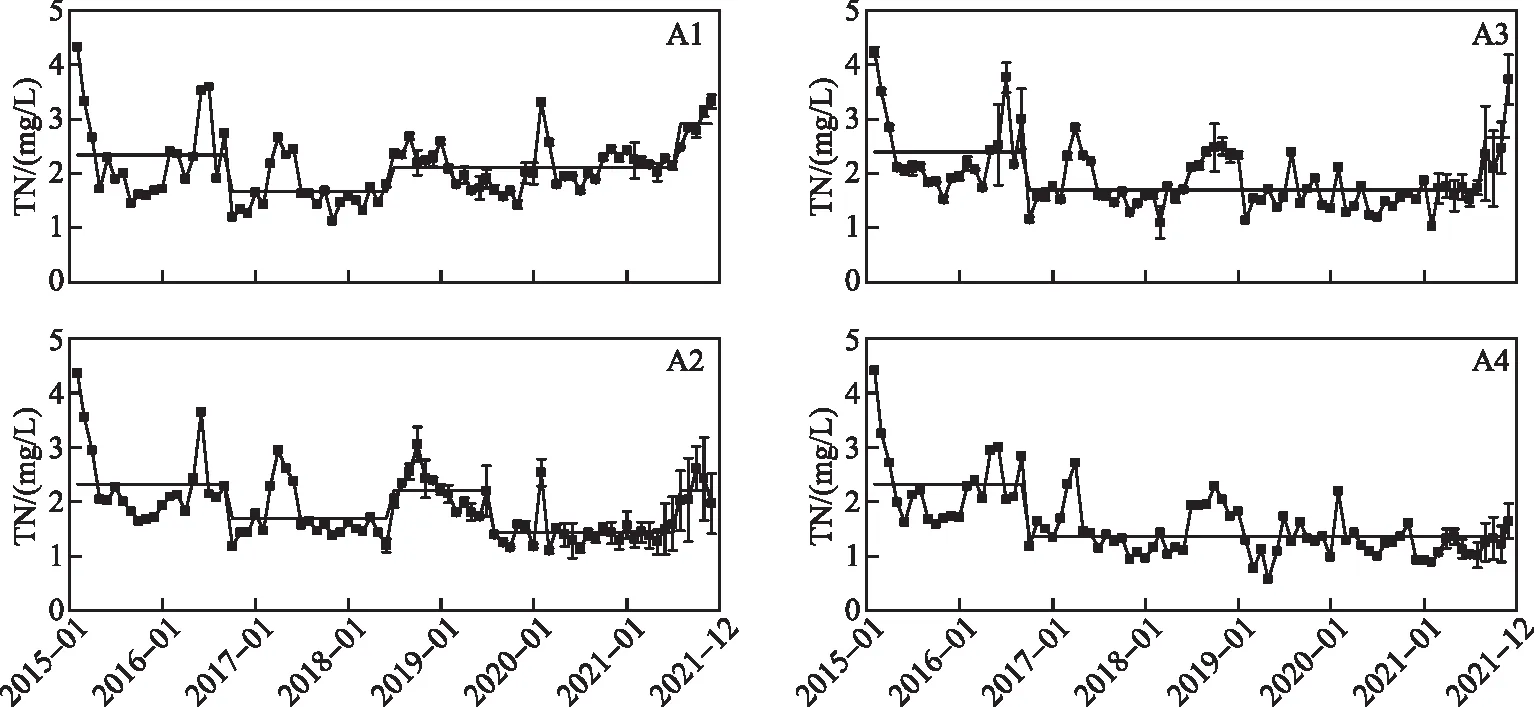
图4 大泊口总氮变化及均值突变Fig.4 Concentration change and mean change of total nitrogen in Dabokou
2.4 总磷浓度变化及均值突变
大泊口4个水域的TP浓度总体呈现波动下降的趋势,并且最大值都出现在2016年7月(图5)。外源污染的控制以及人工引种水生植物能够降低水域的TP浓度,2016年下半年4片水域TP浓度发生第一次均值突变,分别从0.180、0.176、0.182和0.177 mg/L降低至0.096、0.107、0.109和0.117 mg/L。二期工程开展之前,A1、A2和A3水域的TP浓度有上升的趋势,原因可能是重污染底泥中释放的磷以及水生植物残体释放的营养物质,二期工程的开展及时维持并强化了一期工程的成果,围隔工程和人工引种水生植物加强和巩固了大泊口水域的净化能力,TP浓度得以进一步降低。最终各水域的TP浓度均值分别为0.071、0.077、0.075和0.038 mg/L。

图5 大泊口总磷变化及均值突变Fig.5 Concentration change and mean change of total phosphorus in Dabokou
2.5 叶绿素a浓度变化及均值突变
大泊口A1~A4水域的Chl.a浓度变化趋势有明显的区别,其中A1的Chl.a浓度波动幅度较大,在2016年9月和2020年3月出现两个明显的峰值;A2和A3的Chl.a浓度总体呈现出波动下降的趋势;A4水域总体呈现下降趋势(图6)。研究期间,A1水域Chl.a浓度均值仅发生一次突变,从0.112 mg/L降低至0.075 mg/L,Chl.a浓度没有明显的改善;A2和A3水域在2015-2020年连续发生3次均值降低突变,均从0.128 mg/L分别降低至0.028和0.038 mg/L,但在2021年7和8月出现均值升高突变,分别升高至0.060和0.061 mg/L。A4水域的Chl.a浓度发生了4次均值降低突变,从0.113 mg/L降低至0.006 mg/L,且Chl.a浓度波动幅度逐年减小。与环境指标不同,各水域的Chl.a浓度均值突变没有表现出同步性,原因可能是Chl.a浓度与浮游藻类生物量相关,而藻类生物量本身就是各个因素共同作用的结果。滤藻工程的开展及水体营养盐浓度的下降对于浮游植物生物量的影响很大。因此,对于水环境条件改善程度最不明显的A1水域,其Chl.a浓度没有显著的降低,而与之对比明显的A4水域,在工程开始前初始浓度相似的情况下,由于较好的水环境本底条件,各个环境因子企稳向好,Chl.a浓度也稳步降低。

图6 大泊口叶绿素a变化及均值突变Fig.6 Concentration change and mean change of chlorophyll-a in Dabokou
3 讨论
3.1 环境因子间的相关性
对大泊口的各个环境因子进行相关性分析(表2),SS、CODCr、TN和TP与Chl.a浓度呈显著正相关,且4个区域之间SS、CODCr、TP和TN与Chl.a的相关性差异与水质状况有一定关系,水质越好相关性越强。水质较差的藻型湖区A1水域,其各个因子与Chl.a之间的相关性不强,表明藻类的增殖不受单一环境要素的影响,更多的是综合作用,故不能通过单一的控磷或控氮实现Chl.a浓度的大幅降低。水质稍好的A2和A3水域,各个环境因子与Chl.a的相关性较强,尤其是CODCr、TP与Chl.a的相关性,这与先前的研究结论一致[5],即在水质得到一定程度改善时,继续降低水体的CODCr和TP浓度可以较好地控制湖泊中的藻类密度。有稳定沉水植物生长的A4水域则表现出CODCr、TP和Chl.a之间显著的强正相关,此时藻类浓度随营养盐浓度变化而变化,如TP异常升高会直接导致藻类生物量增加。但是由于在水质较好的湖泊中,藻类生物量的初始值较低,所以异常高营养盐负荷的来水不易导致草型生态系统的崩溃。

表2 各水域环境指标间的相关性Tab.2 Correlation between environmental indicators in four water areas
在4个水域中,CODCr、TP与Chl.a的相关性系数均高于SS、TN与Chl.a的相关性系数,表明CODCr和TP是影响藻类最主要的因素,同时各个水域的CODCr与TP之间也表现出较强的相关性。大泊口CODCr、TP和TN浓度第一次均值突变均发生在2016年下半年(图3~5),在此之后仅CODCr和TP持续波动下降,Chl.a浓度发生均值突变的时间点虽然与其不相同(图6),但总体也表现出波动下降的趋势,这可能与藻类生长规律及其对营养盐浓度变化的响应速度有关[9]。
大泊口TN与Chl.a的相关性不强,主要原因是大泊口TN浓度虽较高,但TP是限制浮游植物生长的主要营养盐因子,且研究表明在富营养条件下TP对浮游植物生产力的影响更大[10]。SS与Chl.a的相关性最低,这是由于大泊口SS浓度主要受降水影响表现出明显的季节变化,Chl.a主要受营养盐浓度及温度影响[11],SS浓度的变化不会直接影响Chl.a浓度,控制SS浓度对于降低浮游植物生物量的作用较小。
3.2 大泊口生态修复工程效果
富营养化湖泊生态修复的流程为先减少污染源,后改善生境,再恢复良好的沉水植物群落,最终建立健康的水生生态系统。大泊口水域采用的核心生态修复工程措施包括引水换水工程和微滤净化(除藻)工程,这两项工程显著提高了水体透明度,促进沉水植物的生长,并且沉水植物对于水质改善具有重要作用。同时,各个水域水质净化效果的差异与围隔工程也有关,围隔工程减少了水体交换、降低扰动,能够保护沉水植物的生长,巩固强化有沉水植物分布区域的生态修复成果。开展前后,整个水域的CODCr、TP和Chl.a均有改善,而SS和TN在A1和A2水域的西部改善效果不理想(图7)。由于A2水域西部与A1水域并未完全被围隔分开(图1),有直接水体交换,因此水质改善效果不佳。
3.2.1 引水换水工程对水质改善的影响 引水换水工程一方面能够降低水体营养盐浓度和增加水体交换能力,另一方面可以加速水体交换,但会干扰水-沉积物界面,引起沉积物再悬浮,增加底泥的氮、磷释放通量。此外,引水换水会受到地形、边界和风力条件的影响[12]。王洪铸通过建立引水换水的水生态模型发现,若以稀释污染物为目的,需要大量的清洁水源,若以冲走藻类为目的,换水率须大于优势藻类的特定生长率,每日的换水率高达10%~20%,均适用于较小水体[13]。对于大多数湖泊,引水换水的目的应为修复自由水文联通和自然水位波动,以增强湖泊自净能力。大泊口引水换水工程采用的补给水源为龙门村藻水分离站的出水,每年春季至晚秋运行约9个月,水量及水质稳定,平均CODCr浓度为10.6 mg/L,平均TP浓度约为0.05 mg/L,明显优于大泊口平均水质,而平均TN浓度为3.71 mg/L,与大泊口原本水质相差较小。由于大泊口面积较小,清洁水源的稀释净化效果明显,且能够显著减少水力停留时间,因此大泊口水域的CODCr、TP和Chl.a浓度得到了全面持续降低,且在工程开展一年后营养盐因子近乎同时发生均值突变(图3~5)。然而引水换水出水口所在的A2水域因为较强的水力扰动以及受A1水域水质影响较大,尽管在A2水域西部进行了配套的水生植物种植,但SS净化效果依旧不理想。
3.2.2 微滤净化(除藻)工程对水质改善的影响 蓝藻水华是我国多数富营养化湖泊面临的问题。水华发生期间,受盛行风向的影响,蓝藻会向湖岸带聚积,导致水体溶解氧迅速消耗、水下光强大幅降低,藻体死亡造成藻源性污染物的释放[14]。微滤净化(除藻)工程能够直接降低水体中藻类的生物量,见效快、无二次污染。一期工程配备的固定式微滤设备日处理水量为3万m3,大泊口实现一个周期的水体循环只需33天,加上引水工程的水量,理论上仅需25天即可完成一次大泊口水域的水体循环。同时借助净化装置的出水系统,实现水体循环,将清水扩散至全湖的同时,推动富藻水向固定方向汇聚,提高净化效率。二期工程新增一台除藻船和一台推流设备,有效改善西北死角的水力条件,促进了水质的进一步改善。藻类的生长过程聚集了水体中的营养盐,因此蓝藻捕捞减少藻类生物量的同时也将营养盐带出了水体[15],从而降低了Chl.a、TP浓度,也间接消除季节性、藻源性CODCr释放的途径。并且富藻水经过净化也更有利于沉水植物的生长,由此形成了良性水质改善循环。分离出的藻类也可以用于生产肥料、生物质能源和微生物培养原料等,进行资源化利用[16]。
3.2.3 沉水植物群落分布对水质改善的影响 大泊口作为滇池草海的典型修复区,在小范围水域内表现出了不同的生态修复效果差异,其主要原因可能与沉水植物的分布有关,沉水植物在湖泊生态系统中能直接降低SS[17]、COD[18]、TN[19]和TP[20]浓度。
大泊口整体呈现西北深东南浅的趋势,即A1水域水深最深,研究表明水深对于沉水植物分布具有决定性作用[21],因此A1水域相较于A4水域更不利于沉水植物生长。2012年大泊口仅有篦齿眼子菜一种沉水植物在南部浅水区分布,并于冬季开始人工引种第一批海菜花(图8)。随后沉水植物快速生长,除篦齿眼子菜和海菜花外开始出现穗状狐尾藻、黑藻、菹草等,其分布面积在2013年达到最大,为0.26 km2。2014年夏季,大量外海富藻水通过船闸流入草海,大泊口明显受到影响,沉水植物适宜生长的区域向岸边退缩,海菜花生长状况也不佳。然而一期工程的实施并没有显著提高沉水植物的分布面积,2015年后由于透明度等原因,大部分海菜花死亡或者被水蕴草掩盖后消失,在2016-2018年甚至出现了面积下降的情况。这可能是由于富营养化湖泊存在生态系统恢复的延迟效应,在长期的TP累积的情况下,即使水体外部磷负荷降低,其恢复时间仍需10~20年[22],而大泊口并没有开展过清淤工程,因此这种延迟效应在大泊口是具有存在的可能性的。二期工程的开展使得沉水植物分布面积逐年稳步提高,直至2020年,沉水植物分布面积达0.22 km2,占大泊口总面积的42%,多样性大大提升,出现了水蕴草、菹草、穗状狐尾藻、伊乐藻、苦草、黑藻等沉水植物。

图8 大泊口沉水植物分布变化Fig.8 Distribution changes of submerged macrophytes in Dabokou
A1水域由于光照不足、营养盐浓度过高等因素,沉水植物难以分布;A2~A4水域的沉水植物使根系周围的微生物得到了良好的生存环境,增强了对有机物的降解[18],提高了反硝化和厌氧氨氧化的速率[19],并且通过同化作用,降低了水体的TN和TP浓度[20]。A2水域由于存在引水换水出水口,沉水植物的分布能够通过叶片吸附、降低流速等减少沉积物再悬浮,提高水体透明度[17]。大泊口水域在沉水植物群落构建后,进一步削减了营养盐浓度,Chl.a浓度显著降低,各个环境要素与沉水植物之间的相互作用形成正反馈。研究表明有沉水植物分布的水域,其水-沉积物界面的DO浓度高,能有效抑制沉积物中的磷向上覆水释放[23],且沉水植物生物量较高其沉积物中具有较高比例的好氧微生物和真菌,微生物的存在又有利于沉水植物本身的生长[24]。Chl.a浓度可以表征水体浮游植物生物量,水体营养盐浓度尤其是TP浓度的下降,TP对于浮游植物生物量的影响很大,同时沉水植物对藻类存在化感作用,能抑制浮游植物的生长,降低藻类现存量及多样性[25-26]。沉水植物盖度的增加有利于水质的改善[27],杜劲松等通过回归分析,提出大泊口如要实现稳态转换,沉水植物盖度应大于53%[28],目前这一目标即将实现。
引水换水工程、微滤净化(除藻)工程和沉水植物修复等工程,在大泊口水域生态修复中,其作用不尽相同。综合考虑上述三项工程对大泊口生态修复效果的影响,认为沉水植物修复工程是最为直接、经济和长效的工程手段,但是具有一定局限性,即必须满足一定的生境条件,选择合适的物种才可以构建稳定的草型湖区,然而目前还未明确适合种植沉水植物的生境边界条件,这将是今后工作需要解决的问题。微滤净化(除藻)工程在大泊口水域具有良好的适用性,其原因在于大泊口水域面积较小、蓝藻水华发生时间有规律可循,能够及时、高效排除蓝藻水华暴发带来的生态风险,以滤藻的方式削减水体营养盐的同时,保障了良好的水下光照条件。引水换水工程以稀释污染物的形式降低大泊口营养盐浓度,也是一种直接改善水体营养条件的方式,在工程开展前期大泊口水质较差的情况下效果较好,但是长期来看经济成本较高,会带来一定程度的水体扰动,且受到外海引水站水质影响,后期并不能依赖引水换水工程来提升大泊口水质状况。
目前,在自然本底条件较好的A3和A4水域实现了各项环境指标的改善以及沉水植物群落的恢复,但A1水域整体和A2水域西部,仅CODCr、TP和Chl.a实现了稳定的改善,而SS和TN仍然维持较高浓度,原因是这部分水域自然本底条件较差,如水深较深、污染底泥厚度较大等,未来应充分发挥微滤净化(除藻)工程和沉水植物修复工程的工程效果,选择合适的先锋物种,对A1和A2水域采取进一步的工程措施。
3.3 大泊口生态修复工程的环境效益
滇池自2016年以来进入精准治滇阶段。《滇池流域水环境保护治理“十三五”规划(2016-2020年)》和滇池保护治理“三年攻坚”行动(2018-2020年)开展了众多生态治理工程,对外海和草海的CODCr和TP治理效果明显,这说明早期滇池控磷的手段对湖泊生态环境的改善尤其是浮游植物生物量的控制起到了积极的作用。从滇池的总体分析来看(图9),Chl.a浓度并没有随着TP浓度的降低而降低,反而随着TN浓度的升高而升高,这表明下一阶段,滇池生态环境治理的重点应当逐渐转向对氮的控制。

图9 大泊口、草海和外海水质变化对比Fig.9 Comparison of water quality changes among Dabokou, Caohai and Waihai
大泊口的CODCr浓度在2015年明显高于草海和外海,主要是大泊口开展截污工程前,有大量高负荷生活污水排入大泊口。草海CODCr水平长期保持较低原因是牛栏江-滇池补水工程有效改善了草海的内源污染[29]。大泊口引水工程的源水来自外海,经过两期工程,有稳定沉水植物群落分布的A4水域CODCr浓度持续下降,至2021年已经满足Ⅳ类水标准(30 mg/L),且2019-2021年连续优于外海。
大泊口和外海的TN浓度变化较小,草海的TN浓度常年较高,且在2018年后逐渐升高,这是因为草海长期接受昆明城区的高负荷污水,且后期的治理重点一直放在对TP的控制上。大泊口作为半封闭水域,其TN初始浓度与草海相差巨大的原因,可能与2011-2012年在大泊口开展的“滇池水葫芦治理污染实验性工程”有关,且大泊口北部的半透堤岸能够净化和拦截一部分草海水体中的氮。大泊口生态修复工程实施后,各水域的TN浓度均低于草海的TN浓度,尤其是A4水域2019年后已经能保持在Ⅳ类水(1.5 mg/L),明显优于A1水域。同时在引水换水工程开展前,草海是大泊口唯一的补给水源,草海水质决定了大泊口水质的好坏,而工程开展后,大泊口接受了来自外海的TN浓度相对较低的源水补给,直接缓解了高TN浓度压力。
大泊口与草海的TP浓度有明显的下降趋势,外海TP浓度在2018年后相对保持稳定。相较于TN,草海与大泊口的TP浓度相差不大,由于牛栏江-滇池引水工程,草海的TP浓度得到控制,2018年后稳定在Ⅳ类水标准(0.10 mg/L),大泊口A1水域作为污染程度最严重的水域,其TP浓度也低于其他富营养化湖泊,A4水域TP浓度甚至在2021年达到了Ⅲ类水的标准(0.05 mg/L)。
外海、草海和大泊口A1、A4水域的Chl.a浓度变化趋势差异较大。A4水域的Chl.a表现出明显的稳定下降的趋势,这表明草型湖区A4生态治理效果稳定可持续;A1水域Chl.a浓度总体也表现逐步下降的趋势。这表明,在大泊口开展的微滤净化(除藻)工程效果显著,加速了草型湖区藻类密度的降低。然而微滤净化(除藻)工程在草海和外海这样的大面积水域全面开展的可能性不大,不具有全湖推广可行性。
4 结论与展望
1)大泊口自2015-2021年共开展了两期生态修复工程,开展的工程措施包括了控源截污、引水换水、微滤净化(除藻)、建立围隔和沉水植物恢复等。水环境总体上得到改善,尤其是CODCr、TP和Chl.a浓度改善效果明显,而SS和TN浓度的削减效果较小。截至2021年,除A1水域外,大泊口各个水域均有稳定的沉水植物群落分布,生态修复工程在大泊口水域取得了初步的成功。
2)CODCr和TP是影响大泊口整体水域Chl.a浓度相关性最强的环境因子,其中不同水域的Chl.a浓度与环境因子相关性存在差异,水质较好的A4水域CODCr、TP与Chl.a的相关性最大,水质较差的A1水域CODCr、TP与Chl.a的相关性最小;SS和TN与Chl.a的相关性较弱。
3)大泊口水质表现出明显的空间差异,水环境治理效果由好至差依次为A4>A2≈A3>A1,治理效果产生差异的主要原因是其环境本底条件具有一定差异,包括了水深、底泥厚度、沉水植物初始分布等自然条件,沉水植物修复工程在大泊口总体生态修复过程中发挥相对重要的作用,微滤净化(除藻)工程次之,而引水换水工程在大泊口总体水质条件较差时发挥过重要作用,但在后期,其重要性逐渐降低。
4)与草海和外海同期水质进行比较,A4水域实现稳态转换、形成稳定的草型稳态湖区,其成功经验具有推广价值,而A1水域目前仍然保持藻型湖区,其原因及后续将如何加强治理需要进一步探讨。
5)大泊口后续的生态修复工程应当将重点放在西北A1水域,通过微滤净化(除藻)工程和引种耐高营养负荷及耐低光照环境的沉水植物,利用先锋物种改善A1生境条件,逐步恢复到健康的湖泊生态系统。
——以武汉紫阳湖为例

