菌核净对烟草靶斑病菌的抑制作用及对烟叶叶际微生物群落结构的影响
郭沫言, 熊 晶, 汪汉成, 张 艺,蔡刘体, 陈兴江, 史彩华
(1.长江大学 农学院,湖北 荆州 434025;2.贵州省烟草科学研究院,贵阳 550081;3.贵州省烟草公司 毕节市公司,贵州 毕节 551700;4.贵州大学 农学院,贵阳 550025)
烟草靶斑病(tobacco target spot)是烟草生产上一种严重影响烟叶质量的真菌性病害,其病原菌无性世代为立枯丝核菌Rhizoctonia solani,有性世代为亡革菌Thanatephorus cucumeris,在烟草苗期至大田成熟期均可发生,可侵染叶片与茎秆[1],常对烟叶生产造成严重损失。目前,施用化学药剂是烟草靶斑病防治最经济有效的技术措施[2]。我国已登记用于防控由丝核菌引起的植物病害的药剂主要有百菌清、多菌灵、嘧菌酯、吡唑醚菌酯等,然而,登记用于防控烟草靶斑病的药剂种类很少,仅有8%井岗霉素水剂1 种[3]。亚胺类杀菌剂菌核净 (dimetachlone) 是防治烟草叶斑类病害的常用药剂,具有广谱、高效、内吸、持效期长等特点,对油菜菌核病[4-6]、烟草赤星病[7-8]、黄瓜灰霉病[9]等均有较好的防控效果。长期以来,菌核净作为烟草赤星病的主要防控药剂在烟叶生产中被广泛应用,然而,关于其对发生期较赤星病早的烟草靶斑病的防控效果却不甚清楚。
叶际微生物与植物的生长发育和代谢活动紧密相关[10-13],其与宿主植物长期处于动态平衡过程中[14-16]。已有研究发现,烟草赤星病和由Didymella segeticola引起的叶斑病发生时,随着叶际病原菌的大量增殖,叶际微生物的群落结构也会发生显著改变[17-18];烟草白粉病发生时,叶际微生物中高氏白粉菌属 (Golovinomyces) 相对丰度显著增加,曲霉属 (Aspergillus) 和链格孢属 (Alternaria) 的相对丰度也有所增加[19]。与此同时,杀菌剂在防治植物病害的过程中,也会引起植物叶际微生物群落结构与多样性的变化。比如,吡虫啉的施用使得桃树叶际微生物的种类和相对含量均显著增加[20];施用烯酰吗啉后,葡萄叶际真菌群落之间的差异显著增大,而细菌群落之间的差异减小[21];敌敌畏的施用会导致草莓叶际微生物群落结构发生改变[22];于烟草赤星病发生期施用菌核净,可显著影响烟叶叶际寡养单胞菌属、鞘脂单胞菌属、黄杆菌属和沙雷氏菌属等有益细菌群落结构的改变[23]等。相比较而言,作为烟叶生产上的常用药剂菌核净,关于其对烟草靶斑病发生期烟叶叶际微生物的调控规律却缺乏研究和认识。
为评价菌核净防控烟草靶斑病的潜力,并从微生态角度揭示菌核净在烟草靶斑病发生期应用时,其对包括病原菌在内的叶际微生物群落结构的调控规律,本研究采用菌丝生长速率法,测定了菌核净对烟草靶斑病菌菌丝生长的抑制活性,并于施药后不同时期采集烟叶组织,通过 Illumina Hiseq 高通量测序技术对烟叶叶际真菌和细菌的群落结构和多样性进行了分析,旨在从微观层面揭示菌核净对烟草靶斑病的防治效果及作用机制。
1 材料和方法
1.1 供试材料
1.1.1 菌株及培养基 烟草靶斑病致病菌 (立枯丝核菌Rhizoctonia solani) 菌株 (J136、B8-31、B1-40、1B-3、1B-4、B5-19、B1-42、IB-1、B9-33、J206、BMT6、TMB23、BYB6、J144 和BYB5),保藏于贵州省烟草研究院真菌实验室。
马铃薯葡萄糖琼脂培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,用蒸馏水定容至1000 mL,120℃高温灭菌,备用。
1.1.2 药剂 90%菌核净 (dimetachlone) 原药及40%菌核净可湿性粉剂 (dimetachlone 40% WP),浙江禾益农化有限公司生产。用丙酮作为溶剂将90%菌核净原药配制为1 × 104μg/mL 的母液,于4 ℃保存,备用。
1.1.3 试验地点及烟草品种 供试烟草品种为 ‘云烟87’,为贵州省烟叶产区主栽品种。试验于2020 年7 月14 日至8 月11 日在贵州省毕节市黔西县高坡乡村开展。
1.1.4 其他供试材料 DNA 提取试剂盒(Fast DNA® Spin Kit for Soil),由MP Biomedicals 生物医学公司生产;DNA 回收试剂盒,由Qiagen 公司生产;TruSeq® DNA PCR-Free Sample Preparation Kit 建库试剂盒,由 Illumina 公司生产。DSF01A-20-100 多功能喷雾施肥器,购自贵州黔丰源农业科技开发有限公司。
1.2 菌核净对烟草靶斑病菌菌丝的抑制效果测定
采用菌丝生长速率法[24]测定。在菌落边缘打制直径6 mm 的菌碟,分别接种于含不同质量浓度菌核净的PDA 平板上,以不加药的PDA 平板为对照。菌核净最终试验质量浓度分别为0、0.1875、0.375、0.75、1.5、3 和6 μg/mL,每处理设4 个重复。接菌后将PDA 平板置于28℃恒温培养箱中培养,待对照组菌落长至2/3 平皿时,采用“十字交叉”法量取菌落直径,计算药剂不同剂量下的抑制率。以药剂浓度对数为横坐标、抑制率几率值为纵坐标,建立毒力回归方程[25],计算EC50及EC90值。
1.3 施药后不同时期叶际微生物群落结构与多样性分析
1.3.1 试验方法 选取烟株长势一致的烟田划分试验小区,每小区20 株,小区四周设保护行,每处理3 次重复,待靶斑病病叶率达10%时开始试验。参照药剂施用说明,40% 菌核净WP 有效成分用量约为4200 g/hm2,用水量900 L/hm2。采用多功能喷雾器对烟株正、反叶面均匀喷施至药液开始流失。
1.3.2 样品采集 分别于施药前及施药后1、3、9 和18 d 随机进行采样。选取同一小区不同烟草植株,采用经无菌消毒处理的剪刀剪取中下部成熟叶片 (同一叶片上取健康组织和感病组织),10 g为一个样本,装入50 mL 无菌离心管中,于 - 80 ℃保存,备用。样品采集信息具体如表1 所示,每处理3 次重复。试验后期因部分标记烟叶被采烤,可供采集样品的叶片数量有限,故施药后9 d和18 d 的感病组织样品为混合样品。
1.3.3 烟叶叶际微生物群落结构与代谢功能分析
运用CTAB 法提取所采集烟叶样本的基因组DNA,取适量样本DNA 加无菌水稀释至1 ng/μL,以稀释后的基因组DNA 为模板,使用特异性引物ITS5-1F-F (5′-CTTGGTCATTTAGAGGAAGTAA-3′)、ITS1-1F-R (5′-GCTGCGTTCTTCATCGATGC-3′) 和515F (5′-GTGCCAGCMGCCGCGGTAA-3′)、806R (5′-GGACTACHVGGGTWTCTAAT-3′)分别对叶际真菌和细菌进行扩增。PCR 产物经凝胶电泳检测,目的条带采用Qiagen 公司提供的回收试剂盒回收。使用TruSeq® DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,构建好的文库经过Qubit 和Q-PCR 定量,采用NovaSeq6000 进行上机测序,真菌和细菌分别通过UNITE (7.2) 数据库和SSUrRNA 数据库进行注释。全过程在北京诺禾致源科技股份有限公司完成。
1.4 数据分析处理
采用数据库注释后的初始数据对OTU 序列进行物种注释,利用Uparse v7.0.1001 软件对所有样本有效序列进行聚类分析,通过Qiime 软件(Version 1.9.1) 进行各水平 (门、纲、目、科、属)物种注释分析和Alpha 多样性分析、Beta 多样性分析以及多样本组间分析。使用Excel 2019 对数据进行统计处理、通过DPS (V9.01) 软件对数据进行差异显著性分析,采用Adobe Photoshop CS5 进行图片处理。
2 结果与分析
2.1 菌核净对烟草靶斑病菌的抑制效果
结果 (表2) 表明,菌核净对15 株不同烟草靶斑病菌菌丝生长均具有较强的抑制活性,且随药剂质量浓度增加,抑制效果逐渐增强,6.47 μg/mL下可完全抑制菌丝生长。不同菌株间对菌核净的敏感性不同,其平均EC50与EC90值分别为1.20 和6.47 μg/mL。

表2 菌核净对烟草靶斑病菌菌丝生长的抑制活性Table 2 Inhibition activity of dimetachlone to the mycelial growth of Rhizoctonia solani
2.2 施药后不同时期健康与感病组织叶际微生物群落结构
2.2.1 烟叶叶际微生物测序深度 从样本中随机抽取一定测序量的数据,统计其所代表的物种数目 (即OTU 数目),构建稀释曲线 (图1)。当真菌测序深度达到500、细菌测序深度达到1400 时,稀释曲线趋于平缓,表明其测序深度已涵盖样品中绝大多数真菌和细菌,测序结果可信度较高,可对其进行下一步分析。
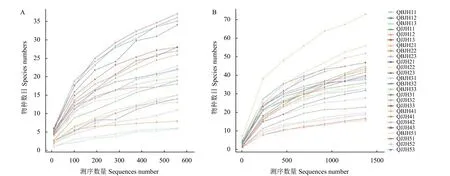
图1 烟叶叶际真菌(A)和细菌(B)物种数目 (OTU) 稀释曲线Fig.1 Rarefaction curves of specie number (OTU) of tobacco phyllosphere fungi (A) and bacteria (B)
2.2.2 健康与感病组织叶际微生物OTU 聚类 花瓣图 (图2) 分析表明:在可操作分类单元水平下,所有样本的真菌与细菌共有OTU 数分别为6 种和18 种。施药前及施药后1、3、9 和18 d,健康组织的真菌OTU 数均高于感病组织,施药前健康与感病组织真菌独有OTU 数分别为12 种和2 种,且均在施药后9 d 下降至最低值;施药前健康与感病组织细菌独有OTU 数分别为11 种和18 种,且均在施药后1 d 显著下降,在施药后3 d开始上升,健康组织细菌独有OTU 数在施药后9 d 达到最大值,而感病组织细菌独有OTU 数在施药后3 d 达到最大值,健康组织细菌OTU 数高于感病组织。
2.2.3 健康与感病组织叶际微生物Alpha 多样性
Alpha 多样性分析结果 (表3、表4) 表明,真菌群落和细菌群落的覆盖度均达到0.99 以上,表明本研究对群落结构的测序数据可以充分合理地反映微生物群落的多样性和丰富度。表中Shannon指数和Simpson 指数反映群落的多样性,ACE 指数和Chao1 指数反映群落的丰富度。
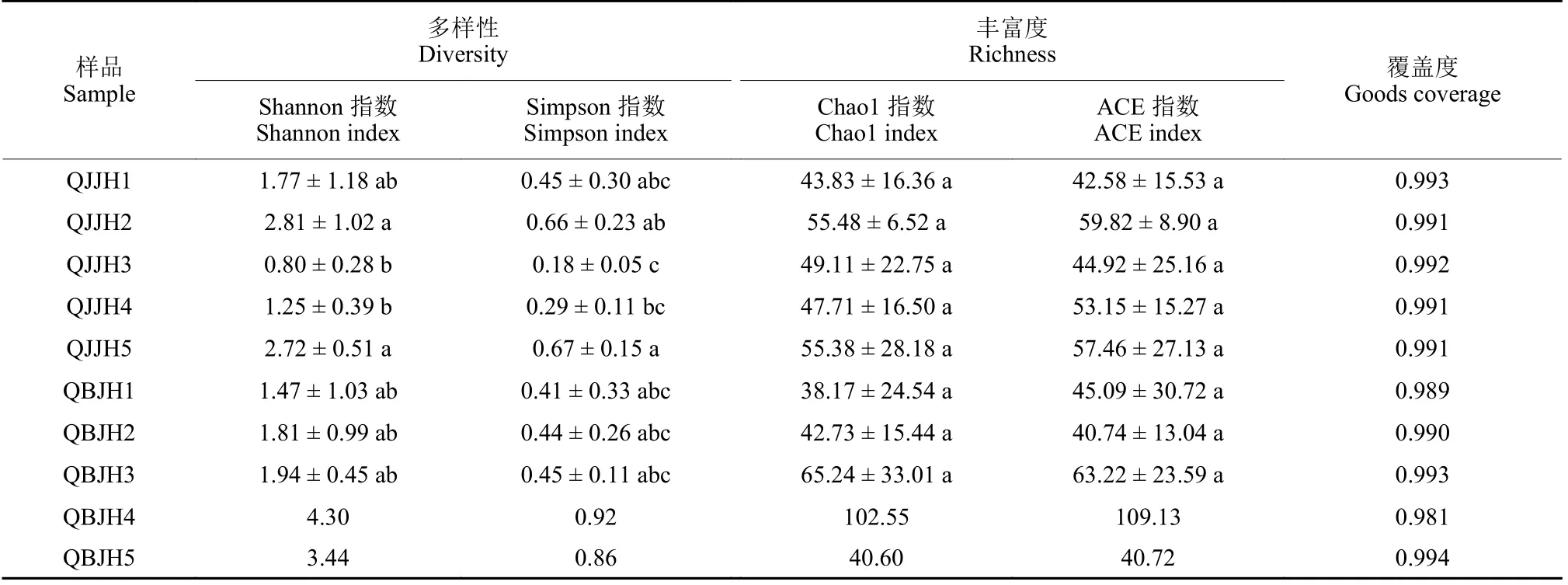
表3 烟叶叶际真菌Alpha 多样性变化Table 3 The variety of Alpha diversity of phyllosphere fungi in tobacco

表4 烟叶叶际细菌Alpha 多样性变化Table 4 The variety of Alpha diversity of phyllosphere bacterial in tobacco
从 表3 中可看出:施药后3 d,健康组织样本(QJJH3) 的真菌群落多样性指数(Shannon 指数和Simpson 指数) 分别达到最低值0.80 和0.18;施药后9 d,感病组织样本的真菌群落多样性指数分别上升至最大值(4.30 和0.92);施药后18 d,健康组织样本 (QJJH5) 的真菌群落多样性指数较施药前呈上升状态,而感病组织样本的真菌群落多样性指数则有所下降。施药前后,真菌群落的丰富度指数 (Chao1 指数和ACE 指数) 无显著性差异。
从 表4 中可看出:健康组织样本 (QJJH2) 的细菌群落多样性指数均在施药后1 d 达到最大值,后随施药时间延长而下降,感病组织样本 (QBJH3)的细菌群落多样性指数在施药后3 d 达到最大值;而施药前后细菌群落的丰富度指数并无显著性差异,健康组织与感病组织样本的细菌群落丰富度指数亦无显著性差异,施药后18 d,其物种丰富度均呈上升趋势。
2.2.4 健康与感病组织叶际微生物群落组成 经不同浓度菌核净处理后,不同时期内烟叶健康与感病组织的叶际真菌和细菌群落组成均存在差异。其中,真菌类的优势菌门为担子菌门(Basidiomycota)、子囊菌门 (Ascomycota) 和被孢霉门 (Mortierellomycota) (图3A),优势属为亡革菌属 (Thanatephorus)、链格孢属、镰刀菌属(Fusarium)、小布整球壳属 (Plectosphaerella)、尾孢属 (Cercospora)、茎点霉属 (Phoma)、Hannaella属、亚隔孢壳属 (Didymella)、枝孢霉属 (Cladosporium)和Boeremia属 (图3B)。药剂处理前,健康和感病组织上均存在大量亡革菌属真菌,且感病组织亡革菌属的相对丰度 (88.31%) 高于健康组织 (54.86%),药剂处理后3、9 和18 d,健康与感病组织亡革菌属的相对丰度变化趋势为下降-上升-下降,健康组织亡革菌属相对丰度在施药后18 d达到最低值(5.93%),感病组织亡革菌属相对丰度在施药后3 d 达到最低值 (22.00%);健康与感病组织链格孢属相对丰度变化趋势为上升-下降-上升,其相对丰度在施药前最低,均为0.12%,施药后18 d 达到最大值,分别为26.56%和3.06%;健康组织镰刀菌属相对丰度变化趋势为上升-下降-上升-下降,在施药后9 d达到最大值(13.85%),在施药前相对丰度最低 (0),感病组织镰刀菌属相对丰度变化趋势为上升-下降,施药后1 d 相对丰度达到最高(0.06%)。

图3 烟叶叶际真菌 (A、B) 和细菌 (C、D) 门和属水平群落组成Fig.3 Phyllosphere fungal (A, B) and bacterial (C, D) community composition in tobacco based on phyla and genus level
菌核净处理前后,烟叶叶际细菌类的优势菌门均为变形菌门 (Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门 (Actinobacteria)、拟杆菌门(Bacteroidetes) 和梭杆菌门 (Fusobacteria),其中健康组织与感病组织共有的优势菌门为变形菌门、厚壁菌门和放线菌门 (图3C)。细菌优势属为假单胞菌属 (Pseudomonas)、葡萄球菌属 (Staphylococcus)、鞘氨醇单胞菌属 (Sphingomonas)、甲基杆菌属 (Methylobacterium)、马赛菌属 (Massilia)、梭杆菌属 (Fusobacterium)、土地杆菌属 (Pedobacter)、根瘤菌属 (Rhizobiaceae)、黄单胞菌属(Xanthomonas) 和奥雷单胞菌属 (Aureimonas)(图3D)。药剂处理前,感病组织的假单胞菌属相对丰度 (15.07%) 高于健康组织 (0.59%),药剂处理3、9 和18 d 后,其相对丰度变化趋势为上升-下降-上升,健康与感病组织假单胞菌属均在施药后1 d 达到最大值,分别为60.16%和21.75%;健康与感病组织葡萄球菌属在施药前相对丰度均为0,施药后总体变化趋势为先上升再下降,感病组织葡萄球菌属相对丰度在施药后3 d 达到最大值(24.85%),健康组织葡萄球菌属相对丰度在施药后1 d 达到最大值 (4.63%);健康组织鞘氨醇单胞菌属相对丰度变化趋势为上升-下降-上升,施药前相对丰度为1.07%,在施药后1 d 相对丰度达到最大值 (8.46%),感病组织鞘氨醇单胞菌属相对丰度变化趋势为下降-上升-下降-上升,施药前相对丰度为1.88%,施药后1 d 相对丰度达到最低值(0.5 4%),施药后3 d 相对丰度达到最高值(15.34%)。
2.2.5 烟叶叶际微生物种群相关性 对药剂处理后的叶际微生物进行属水平TOP 50 的相关系数计算。结果表明:施药后,烟叶叶际真菌属之间主要呈现正相关性,仅部分菌群之间呈负相关,如亡革菌属与Stagonosporopsis属、Boeremia属、茎点霉属 、链格孢属、亚隔孢壳属、枝孢属(Cladosporium)、Symmetrospora属、Strelitziana属和Golovinomyces属呈负相关关系 (图4A)。细菌各属之间绝大部分也呈现明显的正相关性,仅葡萄球菌属与黄杆菌属、鞘氨醇单胞菌属 与Ruminococcaceae属、黄杆菌属与Blautia属、奥雷单胞菌属与Agathobacter属、新鞘氨醇杆菌属(Novosphingobium) 与乳酸杆菌属 (Lactobacillus)之间呈负相关关系 (图4B)。

图4 烟叶叶际真菌(A)和细菌(B)属水平TOP 50 相关性网络分析Fig.4 Analysis of the TOP 50 correlation network between phyllosphere fungal (A) and bacterial (B) in tobacco
2.2.6 烟叶叶际微生物功能组成分析 真菌群落FUNGuild 功能预测结果 (图5A) 显示:菌核净处理前,烟叶健康和感病组织叶际真菌优势功能群均为植物病原菌类群 (plant pathogen) 和动物病原菌-内生菌-植物病原菌-木质腐生菌类群(animal pathogen-endophyte-plant pathogen-wood saprotroph),且感病组织的植物病原菌类群相对丰度高于健康组织;施药后1、3 和9 d,健康和感病组织植物病原菌类群相对丰度均逐渐下降;施药后18 d,健康和感病组织的植物病原菌类群相对丰度均达到最低。

图5 FUNGuild 叶际真菌(A)和细菌(B)功能注释聚类热图Fig.5 FUNGuild heatmap of functional prediction of phyllosphere fungi(A) and bacteria(B) in tobacco
细菌群落FUNGuild 功能预测结果 (图5B) 显示:烟叶健康和感病组织叶际细菌优势功能群在药剂处理前后并未发生明显变化,其优势功能群为新陈代谢类群 (metabolism)、遗传信息处理类群(genetic information processing)、未分类类群(unclassified)、环境信息处理类群 (environmental information processing)、细胞过程类群 (cellular processes)、人类疾病类群(human diseases)和有机体系统类群 (organismal systems);菌核净处理后18 d,感病组织细胞过程类群和遗传信息处理类群的相对丰度均呈上升趋势。
3 结论与讨论
本研究测定了不同浓度菌核净对烟草靶斑病菌菌丝生长的抑制活性,其EC50值为1.20 μg/mL,在质量浓度为6.47 μg/mL 下即可完全抑制菌丝生长。该结果与汪汉成等[26]和孙美丽等[27]报道的菌核净对烟草立枯丝核菌的抑制活性结果相似,其EC50值分别在1.15~1.46 μg/mL 之间和1.57~2.00 μg/mL 之间。在较低的剂量下,菌核净对靶斑病菌菌丝生长的抑制活性较强,据此推测菌核净对烟草靶斑病应具有较好的治疗作用活性。除此之外,靶斑病菌还可产生大量的担孢子进行传播,且传播速度快,但菌核净对其担孢子产生与萌发的活性尚不清楚,有待下一步深入研究,以明确菌核净对烟草靶斑病的预防作用活性。
本研究表明,靶斑病发生时,烟叶健康与感病组织的叶际优势真菌属均为亡革菌属、链格孢属与镰刀菌属,这与孙美丽等[28]报道的烟草靶斑病不同病级烟叶叶际微生物优势真菌属为亡革菌属和链格孢属的研究结果类似,尽管两者取样的时间和地点各不相同,但均发现感病组织的亡革菌属相对丰度高于健康组织,而健康组织链格孢属与镰刀菌属相对丰度高于感病组织,据此可推测烟草靶斑病发生时期,亡革菌属、链格孢属及镰刀菌属为烟叶叶际优势真菌。同时,本研究还发现,烟草靶斑病叶际微生物中有尾孢属和亚格孢壳属等叶际常见真菌的存在,而前人的研究结果表明,尾孢属为烟草蛙眼病病原菌[29],亚格孢壳属则可造成烟草叶斑病的发生[30]。施用菌核净后3 d,健康与感病组织亡革菌属相对丰度显著下降,镰刀菌属和链格孢属相对丰度升高,表明菌核净对烟草靶斑病病原菌亡革菌属具有较好的速效性,可迅速抑制其种群数量;施药后9 d,感病组织亡革菌属相对丰度升高,而链格孢属相对丰度下降,推测菌核净的持效期有限,当药剂降解后病原菌仍有增殖的风险。
叶际菌属相关性分析表明,亡革菌属与链格孢属呈负相关。在功能类群上二者均属于烟叶致病菌,而预测分析却并未表现出相加的致病性结果,据此推测烟草上的病原真菌共存时可能存在营养、空间等竞争关系而表现出负相关作用,但这一相关性假设还有待通过活体试验进一步验证。而亡革菌属与镰刀菌属、尾孢属和亚格孢壳属等致病菌在相关性分析中显示无互作关系,这可能与各病原菌的种群丰度有关,这些病原菌共存时的竞争性、适合度及环境适应力等值得深入研究。
高通量测序结果发现,烟叶健康与感病组织叶际优势细菌均为假单胞菌属、葡萄球菌属和鞘氨醇单胞菌属,与孙美丽等[28]报道的烟草靶斑病叶际优势细菌为假单胞属、泛菌属、寡养单胞菌属和Lelliottia属的结果存在些许差异,与徐慧等[31]报道的烟草健康叶片叶际优势细菌为假单胞菌属、葡萄球菌属和芽孢杆菌属的结果同样存在少许差异。说明烟叶叶际细菌的种类相对稳定,假单胞菌属和葡萄球菌属等细菌为烟叶叶际习居菌,但少量差异细菌的存在可能与烟叶品种、采集地点、环境及烟草生育期等不同有关。已有的研究发现,植物叶际微生物来源复杂且呈动态变化,同时受到植物内在因素和环境条件的影响[32]。菌核净施用后3 d,健康与感病组织假单胞菌属、葡萄球菌属与鞘氨醇单孢菌属相对丰度均上升;施药后9 d,其相对丰度均下降;而在施药后18 d,假单胞菌属和鞘氨醇单胞菌属相对丰度上升,葡萄球菌属相对丰度则下降。尽管菌核净属于防控真菌性病害的药剂,但其应用同时可显著改变叶际细菌的种群结构,该结果与孙美丽等[33]报道的醚菌酯引起烟叶叶际细菌种群结构变化的结果类似。这一方面可能是由于菌核净等杀菌剂对细菌的直接作用,另一方面也有可能是由于杀菌剂在改变叶际真菌种群结构时所产生的间接作用。在对烟叶叶际细菌相关性的分析中发现,假单胞菌属和鞘氨醇单胞菌属之间存在正相关关系,这可能与其功能类群相同有关。至于叶际优势细菌与烟草靶斑病病原菌亡革菌属之间是否存在互作关系目前尚不清楚。
本研究所用的扩增子高通量测序技术尚不能对真菌与细菌间的互作关系进行预测分析,还有待通过致病性表型试验等进一步深入研究。假单胞菌属是一类广泛存在于环境、植物及空气中的细菌,其丁香假单胞杆菌烟草致病变种Pseudomonas syringanpv.tabaci和丁香假单胞杆菌角斑专化型P.syringaepv.angula分别为烟草野火病和细菌性角斑病的致病菌,可引起烟草细菌性病害的发生[34-36];而泛菌属与鞘氨醇单胞菌属等非致病菌与植物的抗逆性息息相关。本研究发现,烟叶叶际假单胞菌属细菌为烟草靶斑病为害期的优势细菌,该类细菌与烟草上同属的上述2 种致病型丁香假单胞菌在烟叶上的定植规律、致病力差异等有待继续开展研究。
此外,本研究还发现了烟叶叶际鞘氨醇单胞菌属及泛菌属等优势细菌。Li 等[37]的研究表明,鞘氨醇单胞菌属细菌对柑橘黑点病间座壳菌Diaporthe citri表现出强烈的拮抗作用,而泛菌属细菌能有效抑制柑橘黑点病菌孢子萌发与菌丝生长。推测这些叶际细菌为烟叶叶际益生菌,然而其具体种类尚不清楚,有待通过分离鉴定明确其准确种类,以便开展深入的功能研究。本研究发现菌核净同时对假单胞菌属和鞘氨醇单胞菌属的种群结构存在影响,结果与Chen 等[38]研究菌核菌对烟草赤星病防控作用时发现其对这两种菌属的影响结果类似,推测菌核净可能对烟草叶际益生菌具有调控作用,进而影响烟草靶斑病的发生。

