巨菌草对不同浓度镉铜复合重金属污染土壤的修复效果
蒲苏红,王惜文,彭慧玲,唐珠海,方 强,代 雨,宋思梦,廖文菊
(四川民族学院横断山脉生态修复与特色产业培育研究中心,四川 康定,626001)
随着我国的工业、农业生产和城市现代化的发展,我国土壤重金属复合污染问题日益严重,特别是镉与其他重金属复合污染最为严重[1]。对植物而言,高浓度的铜会对植物产生毒害作用,使植物根系生长受到抑制[2]。植物受到镉胁迫后代谢会受到严重影响,导致作物品质下降甚至死亡[3]。近些年,国内外不少学者开始对重金属在土壤-植物系统中吸收迁移等进行了研究[4]。
植物修复技术是一种新兴的修复方法,其原理是利用植物自身的生理特性与根际微生物的联合作用,对土壤中的污染物进行吸收、降解和转化,从而达到去除土壤中污染物的目的。巨菌草作为一种多年生草本能源植物,具有生物量巨大、生长速度快、热值高、可以用来提供能源等优点[5]。
本试验以巨菌草为研究对象,通过对土壤、根系的重金属含量以及生物量进行观测,研究巨菌草对铜镉复合重金属污染土壤的修复能力。为四川甘孜州地区利用菌草修复重金属土壤实验提供范例。
1 材料与方法
1.1 研究地概况
实验区位于四川省甘孜州姑咱镇,地理位置E102°17′,N30°12′,海拔1400 m,该地区属于干旱河谷气候。研究选择来自泸定德威村的典型黄壤,在甘孜州康定市姑咱镇四川民族学院农学实验楼3 楼温室大棚(控制重金属含量为唯一变量)中进行盆栽实验。
1.2 供试材料
于2022 年6 月从福建农林大学菌草综合开发利用技术国家地方联合工程研究中心引进6 月龄健康、成熟、无病虫害的饱满巨菌草,将其砍切为15~20 cm 左右的种节。黄壤取自四川甘孜泸定德威。
1.3 试验设计
采用室内盆栽实验。2022 年6 月采回土壤样后,平铺晾晒待用。采用统一规格的口径40 cm,高25 cm的花盆作为栽培容器,每盆装土22.5 kg。
1.3.1 育苗
将巨菌草种节处理成大小基本一致的种节并用高锰酸钾消毒,后用浓度为2/1000 的尿素溶液浸泡24 h,其后更换成清水再次浸泡,对种节进行催芽3 天。放置于温室大棚中自然育苗。3 周后选择长势相近、健壮无病虫害的巨菌草幼苗50 株进行Cd-Cu 复合重金属实验。
1.3.2 Cd-Cu 复合重金属实验
为了解巨菌草在不同程度的Cd-Cu 污染条件下的生长特性和Cd-Cu 富集特性,本实验共设置5 个Cd-Cu 处理水平(即向土壤中分别添加一定浓度的镉和铜溶液),即对照组CK(0 mg/kg)、T1(50 mg/kg)、T2(100 mg/kg)、T3(150 mg/kg),T4(200 mg/kg)。CK 组14 个重复,其余组每个处理9 个重复,共50 盆。将土壤进行重金属污染处理陈化(保持土壤湿润)两周后,选取长势大致相同的巨菌草50 株,移栽至盆内。
1.4 样品采集及测定
2022 年12 月上旬进行样品采集,对巨菌草进行根、茎、叶全株收割与土壤的样品采集,根、茎和叶用去离子水清洗、滤纸吸干表面水分,装入档案袋,于烘箱中用105 ℃杀青30 min 后65 ℃烘干至恒重,计算出巨菌草根、茎、叶及植株总生物量。将根样品粉碎研磨后过60 目筛混匀,花盆中的土壤混合均匀后采用四分法取土,将土壤样品放置于室内自然风干后过60 目筛,以备Cd-Cu 元素含量的测定。
土样中镉和铜含量的测定:将土样风干压碎过60 目筛,经HNO3-HClO4混合酸(5:1)消化后,使用火焰原子吸收光谱仪测定Cd 和Cu 含量。
总生物量(g)=根生物量(g)+茎生物量(g)+叶生物量(g)
富集系数(BioacCumulation factor)=植物体内重金属含量(mg/kg)/土壤中重金属含量(mg/kg)
根系累积量=根系重金属含量*根系生物量
土壤修复率=(土壤修复前重金属含量-土壤修复后重金属含量)/土壤修复前重金属含量
1.5 数据处理
使用Excel 2010 进行数据统计与绘图,SPSS 20.0 进行单因素方差分析 (Oneway ANOVB),并采用Duncan 检验方法进行多重比较。
2 结果与分析
2.1 不同浓度Cd-Cu 复合胁迫下巨菌草生物量的变化
由图1 可以看出,CK 组的巨菌草根、茎、叶、地上部分和总生物量都大致高于其他处理组的巨菌草,说明了Cd-Cu 复合胁迫对巨菌草的根、茎、叶都有抑制作用,而T4 处理的巨菌草各部位生物量跟其他3 个处理组相比受到的影响最大;由图2 可知,随着重金属的浓度增加,根生物量逐渐减少,地上部分平均生物量要高于地下部分,受到的重金属影响T1 与CK 组差异显著降低(P<0.05),T2 与T3 处理组与CK 组差异不显著(P>0.05),T4 处理组与其余处理组均差异显著下降(P<0.05)。由图3 可知,无论何种浓度的胁迫处理对巨菌草的总生物量都造成显著影响(P<0.05),使总生物量降低,浓度越高,抑制作用越强。
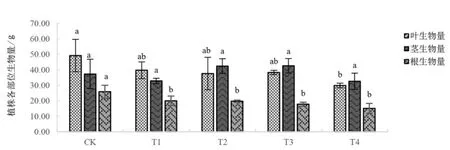
图1 不同浓度Cd-Cu 处理巨菌草根、茎、叶的生物量变化

图2 地上部分生物量的变化

图3 总生物量的变化
2.2 Cd-Cu 复合胁迫对巨菌草根系中Cd、Cu 变化
在重金属胁迫条件下,植物通常采取排斥或者积累两种方式[6]。如下图4 和图5 所示,巨菌草的根系Cd-Cu 含量随着Cd-Cu 处理水平的增加呈先上升再下降趋势(P<0.05)。如下图4 所示,当对照组巨菌草根系Cd 含量为0.41 mg/kg 时,其余处理组巨菌草根系中含量分别为对照组的14.47 倍、28.15 倍、18.79 倍、13.05 倍。当土壤中的Cd 浓度达到100 mg/kg 时,巨菌草根系中Cd 含量达到最大值11.57 mg/kg。

图4 巨菌草根系中Cd 的含量
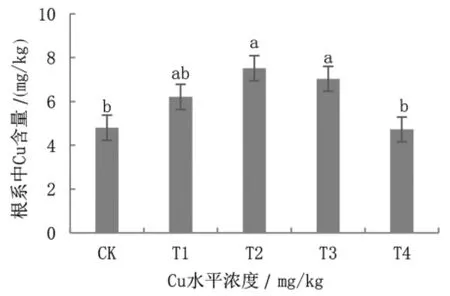
图5 巨菌草根系中Cu 的含量
如下图5 所示,当对照组巨菌草根系Cu 含量为4.80 mg/kg 时,随着土壤中Cu 浓度的增加,其余处理组巨菌草根系中含量分别为对照组的1.29 倍,1.57 倍,1.47 倍,0.98 倍。当土壤中的Cu 浓度达到100 mg/kg时,巨菌草根系中Cu 含量达到最大值7.52 mg/kg。
2.3 巨菌草对Cd-Cu 污染土壤的富集特征
如表1 所示,巨菌草对不同浓度的Cd、Cu 均有一定的吸收和富集能力,巨菌草根系的富集系数随Cd、Cu 胁迫的程度增大而降低,各处理之间CK 组与其他处理组差异显著(P<0.05), 在不同浓度Cd 的处理组T1、T2、T3 差异不显著(P>0.05。), T3 与T4差异显著(P<0.05),各处理组与对照组均差异显著(P<0.05)。在不同浓度Cu 的处理组T1、T2、T3 差异不显著 (P>0.05),T3 与T4 差异不显著(P>0.05),各处理组与对照组均差异显著(P<0.05); 巨菌草根系累积量随着浓度的增加先升高后降低。
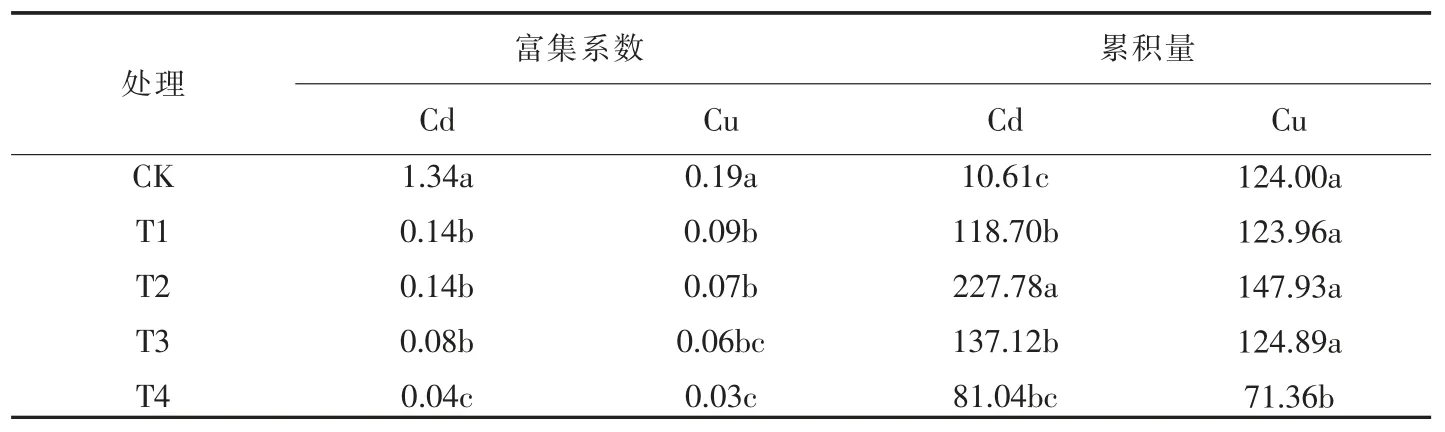
表1 巨菌草根系中Cd 和Cu 的富集系数和累积量

表2 土壤中镉铜含量及巨菌草对土壤的修复率
2.4 修复后土壤中的重金属含量
盆栽实验土壤修复后Cd、Cu 含量如下表所见。以CK 组为对照实验,在Cd 含量为0.31mg/kg 的背景下,四个处理组修复后土壤中Cd 含量分别为43.11、83.41、94.08、150.16mg/kg,较修复前分别降低了7.20、16.90、56.23、50.17?mg/kg。修复率分别达到了14.31%、16.85%、37.40%、25.04%。
在Cu 含量为25.24mg/kg 的背景下,四个处理组修复后土壤中Cu 含量分别为71.02、102.35、116.60、172.59mg/kg,较修复前分别降低了4.22、22.89、58.64、52.65 mg/kg。修复率达到5.61%、18.28%、33.46%、23.38%。土壤中镉和铜含量的减少,表明巨菌草对镉和铜污染的土壤具有一定的修复能力。
3 讨论
在Cd-Cu 复合胁迫下,植株的生长发育受到影响,过量的重金属对植物造成毒害效应,使得植株的总生物量显著下降(P<0.05),而生物量的变化能够直接反应出植物的耐性[7-10]。大多数研究表明,一定程度的重金属污染会直接导致生物量下降,且土壤环境中重金属离子的浓度越高,对植物的毒害越大,干扰植物生物量的能力就越强[11]。本研究中,随着处理浓度的逐渐增加,巨菌草根和叶的生物量均较对照组减少,原因是镉铜重金属离子的胁迫较大,植株生长缓慢。随着重金属胁迫浓度的升高,Cd 和Cu 的抑制效应逐渐表现出来,胁迫的时间越长,生物量的累积受到抑制加强,生物量累积出现降低趋势。此现象与谌金吾[12]的实验结果相似。重金属的抑制效应对茎的生物量差异不显著(P>0.05),说明该浓度下的重金属污染土壤对巨菌草茎的生物量影响不大。表明Cd-Cu 复合重金属污染土壤植株对巨菌草的毒害作用较大,特别是会影响到植株的叶和根。
有研究表明,植株不同的器官对重金属的吸收能力不同,植物的根系对重金属具有较强的富集累积能力[13-15]。巨菌草通过根系大量吸收土壤中的有效态Cd 和Cu 并积累于根部,阻止Cd 和Cu 进一步向地上部运输,以减少重金属对地上部分的毒害,进而提高植物对Cd 和Cu 的耐性,同时也减轻了土壤重金属通过植物向生态系统迁移的风险[9]。当土壤中镉铜含量为100 mg/kg 时,Cd 的累积量达到227.78,Cu 的累积量达到147.93,说明巨菌草对Cd 和Cu 具有较强的吸收能力,此结论与孙婷婷等[16]人的巨菌草对Cd-Cu 复合土壤修复的结果一致。
土壤的修复率是体现巨菌草吸收重金属的重要依据,它是由土壤中重金属的含量与初始未栽种巨菌草的土壤的比值(本实验用0 mg/kg 的处理组为对照)。当150 mg/kg 处理时,Cd 的修复率达到37.40 %,Cu 的修复率达到33.46 %,巨菌草吸收重金属含量在一定浓度范围内升高,当重金属浓度超过一定范围,吸收重金属的能力又下降,植株土壤中残留的重金属浓度更高。推测巨菌草的根系能够吸收重金属,具有截留作用,多数带正电的重金属离子易与植物组织中带负电的化合物结合,使重金属富集在根部,形成稳定的螯合物起到解毒作用[17]。本研究中,猜测低浓度的胁迫会将Cd 和Cu 协同富集于根系中,阻碍了Cd2+和Cu2+对光合作用和新陈代谢酶造成的伤害,减少了土壤中Cd 和Cu 的含量。但较高浓度的镉铜复合胁迫就会毒害巨菌草。
巨菌草对重金属Cd 和Cu 具有一定的吸收富集能力,在低浓度时,吸收重金属富集于植物器官中但重金属浓度超过一定浓度,高浓度的就会毒害植株在本研究当中,巨菌草对镉铜重金属均具有修复能力,但在150 mg/kg 时对镉和铜都达到最大修复率,巨菌草根系吸收土壤中的重金属离子,运输到巨菌草各部位,从而达到降低土壤中重金属离子的作用。
巨菌草作为重金属污染修复植物的研究较多,但作为Cd 和Cu 复合修复植物的研究较少,不同浓度的土壤重金属污染物对巨菌草的富集能力有决定性作用。当Cd 浓度约为100 mg/kg 时,巨菌草对Cd 的累积量(227.78 mg)比美洲狼尾草(119.51 mg)和杂交狼尾草(66.90 mg)[18]高47.53 %和70.6 %;当Cd 浓度约为100 mg/kg 时,巨菌草根系的富集系数(0.14)比狗尾草(0.09)和龙牙草(0.04)[19]高35.71%和71.43%。当Cu 浓度约为100 mg/kg 时,巨菌草根系的富集系数(0.07)比狗尾草(0.03)[19]高57.14%。尽管巨菌草的富集系数小于1,但巨菌草的生长特性和强大的根系使得富集能力较强,在本研究中,其对Cd 和Cu 具有较高的累积效应,在一定程度上具有修复Cd、Cu 复合污染土壤的潜力。
4 结论
(1)从盆栽实验结果表明,巨菌草在受到重金属的情况下能够正常的生长,未出现萎焉和失绿的现象。巨菌草根部对镉的富集系数为0.04~1.34,对铜的富集系数为0.03~0.19,表明巨菌草对重金属镉和铜有较强的富集能力。
(2)巨菌草的生物量在本研究范围内总生物量随着镉铜浓度的升高而降低。
(3)巨菌草对镉铜污染土壤的修复率在一定浓度下能够随着镉铜浓度的升高而增加,在镉铜浓度为150 mg/kg时,修复率达到最大的镉修复率37.40%和铜修复率33.46%。但当土壤中镉铜浓度超过一定值后,巨菌草的修复率开始下降。
综上所述,尽管巨菌草在Cd-Cu 污染土壤下的富集系数小于1,但对Cd 和Cu 具有较强的耐性,且Cd和Cu 的累积量在100 mg/kg 处理下达到最高227.78 mg/kg 和147.93 mg/kg。本研究表明巨菌草在Cd-Cu 污染土壤的植物修复方面具有一定的修复潜能。

