瓶插液添加硫酸铝对牡丹切花瓶插品质的影响
成雪峰朱书君赵文慧张凤云
(1. 菏泽学院农业与生物工程学院,山东菏泽 274000;2. 菏泽学院牡丹研究院,山东菏泽 274000)
牡丹(PaeoniaSect. Moutan)花大、色艳、型美、香浓,符合世界人民的审美需求,已成为深受国内外鲜切花市场欢迎的高档花材,具有巨大的市场潜力[1-2]。 菏泽作为世界上最大的牡丹生产区,仅牡丹芍药鲜切花可采摘量就在3 000 万支/年以上[3]。 但市场上牡丹切花产品短期季节性供应问题突出,切花离开母体后仍进行着一系列旺盛的生理活动,比在母体上衰败更快[4],导致牡丹切花观赏期极短,性价比较低[5]。 研究证实,鲜切花脱离母体后,由微生物繁殖引起的输导组织物理性堵塞和花枝代谢产物、生理状态改变引起的生理性堵塞所造成的花枝吸水受阻是影响鲜切花瓶插寿命和观赏价值的主要因素[6-7]。
硫酸铝作为一种无毒无污染且价格低廉的杀菌剂,不但可以杀灭多种细菌防止花枝维管束堵塞,还因其有较强的缓冲性能而起到稳定瓶插液pH 值的作用。 大量研究表明,硫酸铝有效浓度在50~200 mg/L 之间会对菊花[8]、非洲菊[9-10]、月季[11-12]和其它[13-16]大量切花的瓶插产生积极效果。 当前,已有关于硫酸铝可以延长牡丹瓶插期和提高切花品质的报道[17],但大部分是在特定浓度下进行,且研究结果并不一致[18],而关于不同浓度硫酸铝对切花牡丹观赏价值的研究还比较薄弱。 为此,本试验以晚花品种“海黄”和“花王”为材料,研究分析不同保鲜液对其瓶插期花枝鲜重、水分吸收、可溶性糖含量、细胞膜透性、花的形态特征及观赏性状的影响,以期为开发牡丹切花简便高效瓶插液、延长牡丹瓶插期、提升牡丹瓶插品质提供理论和技术支持。
1 材料与方法
1.1 试验材料与处理
试验于2021年4—5月在菏泽学院山东省牡丹遗传育种及应用技术工程实验室进行。 试验以菏泽浩森花木有限公司基地的四年生“海黄”(Paeonia suffruticosa‘High Noon’)和“花王”牡丹(Paeonia suffruticosa‘Huawang’)为材料(表1),所有材料已于前一年秋天(2020年11月17日)平茬至地面并封土。 各品种均选取长势一致且处于绽口期的花枝,于清晨7 时采收后置于事先放有冰袋的泡沫箱中并立即带回实验室。 将花枝置于蒸馏水中,重新斜切,花茎长度保持在40 cm,保留3 片复叶。 单枝瓶插,每个品种插36瓶,随机分为3 组。

表1 试验材料基本情况
试验设保鲜液A 和保鲜液B 两个处理,以蒸馏水为对照(CK),见表2。 将准备好的牡丹切花分别置入装有200 mL 上述瓶插液的花瓶中,基部浸泡2~3 cm,塑料薄膜封口,每天更换瓶插液。每个处理选取其中6 枝用于每天测定花枝鲜重和水分平衡值,其余用于测定瓶插过程中的花枝生理指标。 试验过程中,培养室温度控制在20 ~22 ℃,相对湿度为50%~60%,室内光照强度控制在80 μmol/(m2·s),昼夜光照周期为12 h/12 h[19]。

表2 试验处理
1.2 测定指标及方法
牡丹瓶插特征变化:从瓶插之日起,每天定时测定花朵直径大小、花朵开放程度和衰老进程,确定最佳观赏期(从半开期到50%花枝进入始衰期的天数)[20]。 花朵瓶插寿命按照郭闻文等[21]的方法判断。
牡丹瓶插期吸水规律:在处理好牡丹花茎长度之后,每天在同一时间称量并分别记录瓶+瓶插液+花枝的重量、瓶+瓶插液的重量和花枝鲜重。 按照王依等[20]的方法,统计花枝吸水量、失水量和水分平衡值。 其中,鲜枝重变化率(%)=(瓶插期花枝鲜重-初始花枝鲜重)/初始花枝鲜重×100;花径变化率(%)=(瓶插期花径-初始花径)/初始花径×100;花枝水分平衡值=吸水量-失水量,其中,吸水量=(花瓶重+当天溶液重)-(花瓶重+后一天溶液重),失水量=(花瓶重+当天溶液重+当天花枝重)-(花瓶重+后一天溶液重+后一天花枝重)。
其它指标测定:从瓶插第1 天至观赏期结束,每天采倒数第1 片复叶的顶端小叶,用蒽酮比色法测定叶片和花瓣中可溶性糖含量[22],用电导率法测定叶片和花瓣细胞膜相对透性[23]。
1.3 数据处理与分析
使用Microsoft Excel 2016 和SPSS Statistics 20 软件进行数据分析及作图,并用t测验进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 不同处理瓶插期牡丹花枝鲜重和水分状况
牡丹瓶插后,前期花枝迅速吸水,花枝鲜重快速升高,而后由于吸水减缓和失水速率明显增大,花枝鲜重逐步下降,且保鲜液处理明显提高花枝鲜重,不同处理间差异明显(图1)。 “海黄”瓶插后,对照(蒸馏水)鲜枝重变化率在24 h 时达到峰值,之后不断下降;保鲜液A 和保鲜液B 处理鲜枝重变化率则在72 h 时达到峰值(图1A)。 “花王”瓶插后,对照花枝鲜重不断下降,鲜枝重变化率一直小于0,保鲜液A 和保鲜液B 处理的表现与“海黄”相似,分别于96 h 和120 h 时达到峰值(图1B)。 说明保鲜液A 和保鲜液B 均通过促进花枝吸水而保持较高的花枝鲜重,且延迟花枝鲜重达到峰值的时间。 保鲜液B 处理瓶插前期刺激花枝迅速吸水,后期快速下降,导致其虽在整个瓶插过程中保持最大的花枝鲜重,但花枝吸水变化趋势较其它处理剧烈,这也可能是保鲜液B 处理观赏期反而较对照低的原因之一。

图1 甁插期牡丹鲜枝重变化率(A:海黄;B:花王,下同。)
牡丹瓶插之后,花枝迅速吸水导致水分平衡值先迅速升高,随着瓶插时间延长,蒸腾耗水量逐渐大于吸水量,水分平衡值不断下降(图2)。 “海黄”瓶插后,对照水分平衡值不断下降,49.5 h 时即达到0 值,而保鲜液A 和保鲜液B 处理均在瓶插48 h 达到峰值,恢复至0 值的时间分别为92.3 h 和87.5 h(图2A)。 “花王”瓶插后,对照、保鲜液A 和保鲜液B 处理花枝水分平衡值分别在瓶插48、144 h 和96 h 达到峰值,恢复至0 值的时间分别为52.4、171.9 h 和127.5 h(图2B)。 与对照相比,保鲜液A 和保鲜液B 处理花枝水分平衡值恢复至0 值的时间延长228.1%和143.3%(P<0.05)。说明保鲜液不仅能够促进切花牡丹水分吸收,还能协调花枝水分利用而延缓衰老,且保鲜液A 效果优于保鲜液B。

图2 甁插期牡丹花枝水分平衡值
2.2 不同处理瓶插期牡丹可溶性糖含量的变化
可溶性糖作为植物代谢活动的物质基础,其含量高低与切花的品质特性之间存在着直接联系[24-25]。 保鲜液提高切花组织中可溶性糖含量,为切花吸水扩张和生命活动的延续提供物质和能量保障。 牡丹瓶插后,两个品种叶片和花瓣可溶性糖含量呈现先升高后降低趋势,保鲜液处理显著提高整个瓶插期切花组织中可溶性糖含量,保鲜液A 效果更明显(图3、图4)。

图3 甁插期牡丹叶片可溶性糖含量的变化
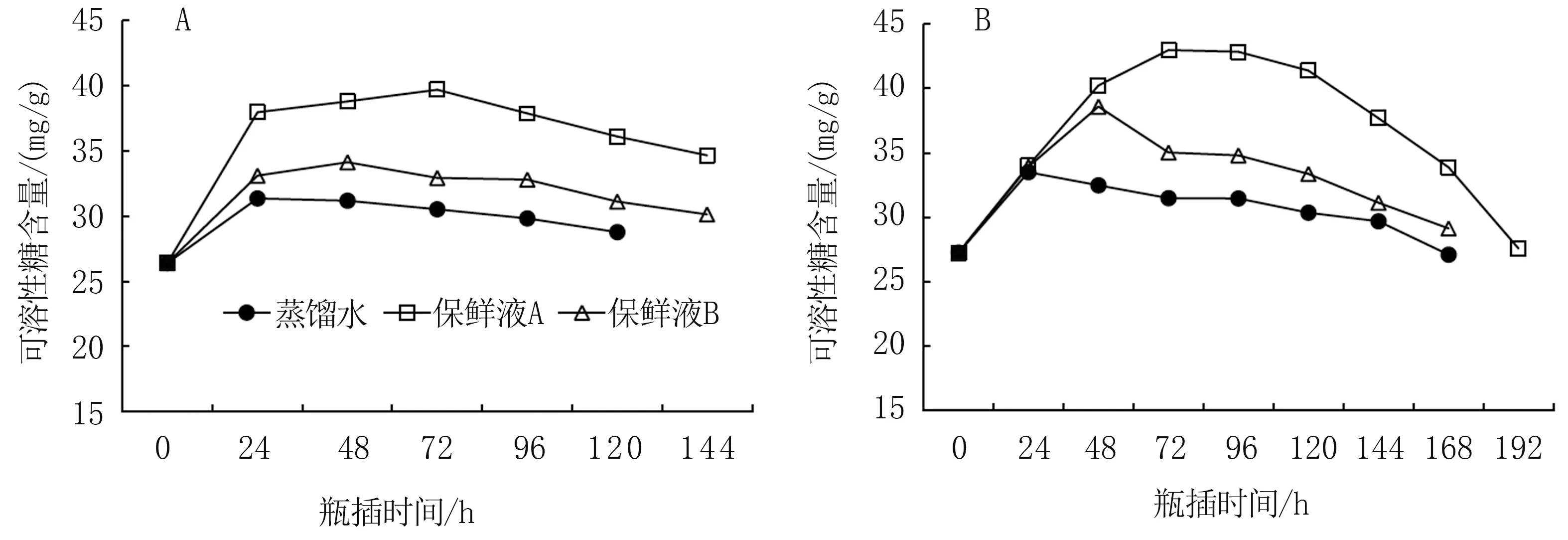
图4 甁插期牡丹花瓣可溶性糖含量的变化
“海黄”瓶插后,保鲜液A 和保鲜液B 处理整个甁插期的叶片平均可溶性糖含量较对照分别提高7.02%和4.75%,且其可溶性糖含量达到峰值的时间由对照的72 h 均延迟至96 h,其峰值分别提高9.65%和6.10%(图3A)。 “花王”瓶插后,保鲜液A 和保鲜液B 处理整个甁插期的叶片平均可溶性糖含量较对照分别提高12.77%和5.09%,可溶性糖含量达到峰值的时间由对照的24 h 分别推迟到72 h 和48 h,且较对照峰值分别提高22.68%和5.71%(图3B)。
花瓣可溶性糖含量较叶片明显提高,但保鲜液对不同品种牡丹花瓣可溶性糖含量的影响与叶片一致,且处理间差异更明显(图4)。 切花瓶插后,两个牡丹品种各自对照的花瓣可溶性糖含量峰值均出现在24 h,而保鲜液A 和保鲜液B 处理峰值分别出现在72 h 和48 h。 保鲜液A 和保鲜液B 处理下,“海黄”整个瓶插期的花瓣平均可溶性糖含量较对照分别提高21.07%和6.22%,峰值较对照分别提高26.60%和8.90%;“花王”整个瓶插期的花瓣平均可溶性糖含量较对照分别提高19.75%和8.18%,峰值分别提高28.24%和15.20%。
以上可以看出,离体对牡丹花瓣可溶性糖含量的影响较叶片大,保鲜液对花瓣可溶性糖含量变化的影响较叶片更具有积极意义。
2.3 不同处理瓶插期牡丹细胞膜相对透性的变化
不良环境对细胞的影响往往先作用于细胞膜,改变其透性,细胞膜透性大小可以反映细胞质膜受伤害程度[26]。 随瓶插时间延长,牡丹叶片细胞膜相对透性呈现不断增大趋势,保鲜液处理明显降低叶片细胞膜相对透性(图5)。 “海黄”瓶插结束时,保鲜液A、保鲜液B 处理和对照的叶片细胞膜相对透性较初插时分别提高86.75%、76.32%和98.95%(P<0.05),整个甁插期保鲜液A 和保鲜液B 处理的叶片细胞膜相对透性分别较对照平均降低14.21%和13.54%(P<0.05);“花王”瓶插结束时,保鲜液A、保鲜液B 处理和对照的叶片细胞膜相对透性较初插时分别增加73.12%、61.30%和137.35%(P<0.05),整个甁插期保鲜液A和保鲜液B 处理的叶片细胞膜相对透性分别较对照平均降低19.73%和16.49%(P<0.05)。

图5 甁插期牡丹叶片细胞膜相对透性的变化
牡丹花瓣细胞膜相对透性明显大于叶片,但变化趋势与叶片相似(图6)。 “海黄”瓶插结束时,保鲜液A、保鲜液B 处理和对照的花瓣细胞膜相对透性较初插时分别提高37.29%、43.34%和48.55%(P<0.05),整个甁插期保鲜液A 和保鲜液B 处理的花瓣细胞膜相对透性分别较对照平均降低9.02%和8.90%(P<0.05);“花王”瓶插结束时,保鲜液A、保鲜液B 处理和对照的花瓣细胞膜相对透性较初插时分别增加47.96%、53.47%和104.02%(P<0.05),整个甁插期保鲜液A 和保鲜液B 处理的花瓣细胞膜相对透性分别较对照平均降低23.72%和17.32%(P<0.05)。

图6 甁插期牡丹花瓣细胞膜透性的变化
因此,保鲜液可以在一定程度上降低瓶插牡丹叶片和花瓣的细胞膜透性,增强其抗逆性,最终表现在牡丹观赏品质的提升上。
2.4 不同处理甁插期牡丹形态特征和观赏性状
不同保鲜液对瓶插牡丹寿命和开花进程的影响依品种而不同(表3)。 “海黄”瓶插后,不同处理均于22 h 左右进入盛开期,其中对照、保鲜液A 处理瓶插寿命相近,均在144 h 左右花瓣开始失水掉落,保鲜液B 处理瓶插寿命则只有120 h左右。 “花王”瓶插寿命较长,但前期开放速度较慢,保鲜液处理明显缩短其进入盛开期的时间且延长瓶插寿命:与对照相比,保鲜液A 处理进入盛开期的时间提前24.4 h,瓶插寿命和最佳观赏期分别延长23.8 h 和48.2 h;保鲜液B 处理虽不能较对照延长瓶插寿命,但由于明显缩短进入盛开期的时间,最终其最佳观赏期延长25.3 h。

表3 不同处理瓶插期牡丹观赏性状
由图7 可以看出,保鲜液在增大最大花径的同时推迟花径达到最大值的时间。 保鲜液A 和保鲜液B 处理下,“海黄”最大花径较对照分别增加3.0 cm 和2.0 cm,“花王”最大花径分别增加9.3 cm 和8.3 cm。 整个瓶插过程中,保鲜液对“花王”瓶插期最大花径的影响更明显,保鲜液A 的作用更明显。瓶插后,两个品种花径早期迅速上升,盛开后变化率较小,达到峰值之后又平缓下降。 “海黄”瓶插后,对照和保鲜液B 处理均于72 h 达到最大花径,保鲜液A 处理于96 h 达到最大花径;“花王”对照和保鲜液处理则分别在72 h 和120 h 达到最大花径。 可以看出,保鲜液在促进花朵持续开放、提高瓶插品质方面效果明显,保鲜液A 效果更好。

图7 甁插期牡丹花径变化率
3 讨论与结论
3.1 保鲜液对瓶插牡丹水分状况的影响
瓶插保鲜是切花生产的终端环节,瓶插液在切花采后保鲜过程中占有极为重要的地位[27-28]。切花采后水分状况是影响其瓶插寿命和观赏价值的一项重要指标[29]。 水分平衡值则是表征切花瓶插之后吸水和失水过程的平衡关系,切花只有在吸水大于失水时才能保持较好的新鲜程度,表现出良好的观赏价值[4]。 史国安等[4]研究表明,保鲜液可以维持牡丹切花体内的水分平衡,延长切花的瓶插寿命,提高瓶插品质。 本研究也发现,牡丹甁插后,保鲜液改变了吸水规律,不但有利于促进花枝吸水、增加花枝鲜重,还推迟花枝鲜重峰值、水分平衡值峰值和0 值出现的时间,能通过协调花枝吸水和蒸腾耗水来更好地维持花枝水分平衡,而这也是保鲜液能够延长牡丹瓶插寿命的主要原因之一[27]。 同时,本试验结果也表明,两个品种牡丹在整个瓶插过程中,保鲜液B 处理花枝鲜重均明显提高,但其在牡丹瓶插寿命、最大花径和最佳观赏期等方面的表现较保鲜液A 差。 产生这一结果的原因可能是保鲜液促进花枝吸水的同时也改变其蒸腾和呼吸耗水状况,保鲜液B 在协调花枝水分利用方面的效果不如保鲜液A。
3.2 保鲜液对瓶插牡丹叶片和花瓣可溶性糖含量的影响
可溶性糖是植物主要的呼吸代谢底物,充足的糖分供应对切花瓶插有积极的作用[30]。 本研究表明,瓶插牡丹花瓣可溶性糖含量明显高于叶片,两种保鲜液处理对于保持牡丹瓶插期叶片和花瓣中较高水平的可溶性糖含量具有积极作用,同时还可以延迟组织中可溶性糖含量达到峰值的时间。 原因可能是较高浓度的Al2(SO4)3引起叶片气孔、蒸腾作用等方面较大程度的改变,保鲜液B 在保持切花组织中可溶性糖含量的效果不如保鲜液A。 但保鲜液A 处理前期花瓣可溶性糖含量迅速升高,后期迅速下降,这也可能是“花王”在瓶插后期忽然落瓣的重要原因。
3.3 保鲜液对瓶插牡丹叶片和花瓣细胞膜相对透性的影响
细胞膜是植物细胞对外界不良环境最敏感的部位。 当衰老发生时,细胞膜透性增加、稳定性遭到破坏。 细胞渗出液的电导率是衡量细胞膜稳定性和逆境受损程度的重要指标[31]。 大量研究表明,在不良环境下,植物膜脂过氧化程度不断加剧,叶片相对电导率呈逐渐上升趋势[32-34]。 本研究也发现,离体对花枝造成的伤害不可逆,且随着离体时间的延长组织受损程度加深,切花牡丹叶片和花瓣相对电导率总体呈上升趋势。 保鲜液通过在一定程度上减缓离体对花枝的伤害而明显延缓这一趋势的发生,这也是保鲜液延长切花牡丹观赏期、协调开花进程的重要原因。 这与章志红等[35]关于保鲜液对“百园红霞”观赏品质和生理指标影响的研究结果相似。
3.4 保鲜液对瓶插牡丹观赏性状的影响
适宜的瓶插液对延长切花寿命、提高观赏价值具有重要作用。 “花王”牡丹开放进程慢、瓶插时间长,适合长距离运输和贮藏。 与对照相比,保鲜液显著增大其最大花径,且推迟最大花径出现的时间,延长瓶插寿命和最佳观赏期,这一研究结果与王凯轩等[19]和年林可等[28]在“洛阳红”上的研究结果一致;保鲜液还缩短“花王”进入盛开期的时间,明显改善其开放能力,有利于促进切花向着商品化方向发展。 “海黄”具有较长的最佳观赏期,说明“海黄”更适宜作为鲜切牡丹品种进行当季销售。 保鲜液对其瓶插寿命和最佳观赏期的影响不大,甚至保鲜液B 还缩短其瓶插寿命和最佳观赏期。 这与罗浩[18]关于不同保鲜液对牡丹切花观赏性状的影响随牡丹品种不同而存在差异性的研究结果相一致,这为牡丹切花产业化发展增加了难度。
综上所述,保鲜液可以通过促进瓶插期牡丹吸水来改善组织的水分状况、增加组织的可溶性糖含量,继而降低离体对花枝的伤害,延长切花瓶插期,显著提升观赏效果。 瓶插期牡丹叶片在可溶性糖和细胞膜相对透性方面的表现优于花瓣,因此,为进一步提升观赏品质,在牡丹瓶插液开发方面应注意在瓶插液中加入一些促进相应营养向花瓣中转移的物质。

