基于Cyt b基因序列的江淮下游湖泊鲢群体遗传多样性分析
李大命,刘燕山,唐晟凯,殷稼雯,谷先坤,蒋琦辰,蔡永久,张彤晴
(1.江苏省淡水水产研究所,江苏省内陆水域渔业资源重点实验室,南京 210017;2.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,南京 210008)
遗传多样性即基因多样性,存在于生物个体内、单个物种内及物种间,是生物生存和进化的基础,种内的遗传多样性与该物种对环境的适应能力呈正向线性关系[1]。遗传多样性是评价自然生物资源的重要依据,认识物种的遗传多样性对于科学制定物种管理和保护措施具有重要指导意义[2]。线粒体DNA(mitochondrial DNA,mtDNA)是细胞核外具自主复制、转录和翻译能力的遗传因子,具有分子小、结构简单、母系遗传、不易发生基因重组且进化速度快等特点,因此成为研究动物系统发育和群体遗传学的理想分子标记[3-4]。其中,Cytb基因是线粒体DNA的13个蛋白质编码基因之一,其结构和功能较为清楚,进化速度适中,且有通用引物便于扩增和测序,目前已广泛应用于水生动物尤其是鱼类的遗传多样性和遗传结构研究,研究结果可为鱼类资源管理和保护提供参考[5-7]。
鲢(Hypophthalmichthysmolitrix)是我国“四大家鱼”之一,属于鲤形目(Cypriniformes),鲤科(Cyprinidae),鲢亚科(Hypothalmichthyinae),鲢属,广泛分布于我国各大水系和湖泊[8]。鲢生长速度快,抗病能力强,养殖成本低,经济价值高,是我国淡水池塘养殖的主要种类。鲢是典型的滤食性鱼类,终生以浮游生物为食,能够有效抑制蓝藻水华发生,改善水体环境质量,因而在水域生态系统中发挥着重要作用[9-10]。鲢属于江湖洄游型鱼类,受过度捕捞、环境污染、江湖阻隔等不利因素的影响,湖泊鲢资源衰退严重,个体低龄化、小型化趋势加剧[11-12]。为增加湖泊鲢资源量,近几十年来开展了大规模人工增殖放流,这对恢复湖泊渔业资源和修复生态环境起到了重要作用[13]。然而,盲目的人工放流可能会导致物种野生群体遗传多样性降低,改变野生群体的遗传结构,甚至造成遗传污染[14-15]。因此,应在了解湖泊鲢资源遗传背景的基础上科学开展增殖放流[16]。
迄今,有关鲢野生种质资源遗传多样性的研究主要集中在长江干流[17-19],而对湖泊鲢群体的遗传资源状况尚缺乏系统认识。长江、淮河下游是我国湖泊集中分布区,也是开展增殖放流的热点水域,其中鲢是最常见的增殖放流物种之一[13]。本研究选择线粒体Cytb基因序列作为分子标记,探究长江下游湖泊(太湖、滆湖、长荡湖和淀山湖)及淮河下游湖泊(高邮湖、洪泽湖、骆马湖和金沙湖)鲢群体遗传多样性和遗传结构,以期了解相关水域鲢种质资源遗传多样性现状,并为鲢增殖放流、资源管理和保护提供科学依据。
1 材料和方法
1.1 样品采集和处理
2019—2020年,采用三重刺网在长江下游流域的太湖(TH)、滆湖(GH)、长荡湖(CDH)、淀山湖(DSH)及淮河下游流域的高邮湖(GYH)、洪泽湖(HZH)、骆马湖(LMH)、金沙湖(JSH)共采集鲢样本239尾,采样水域及各群体样本数量见图1和表1。剪取鲢肌肉组织装入1.5 mL离心管,加入无水乙醇置于4℃保存备用。
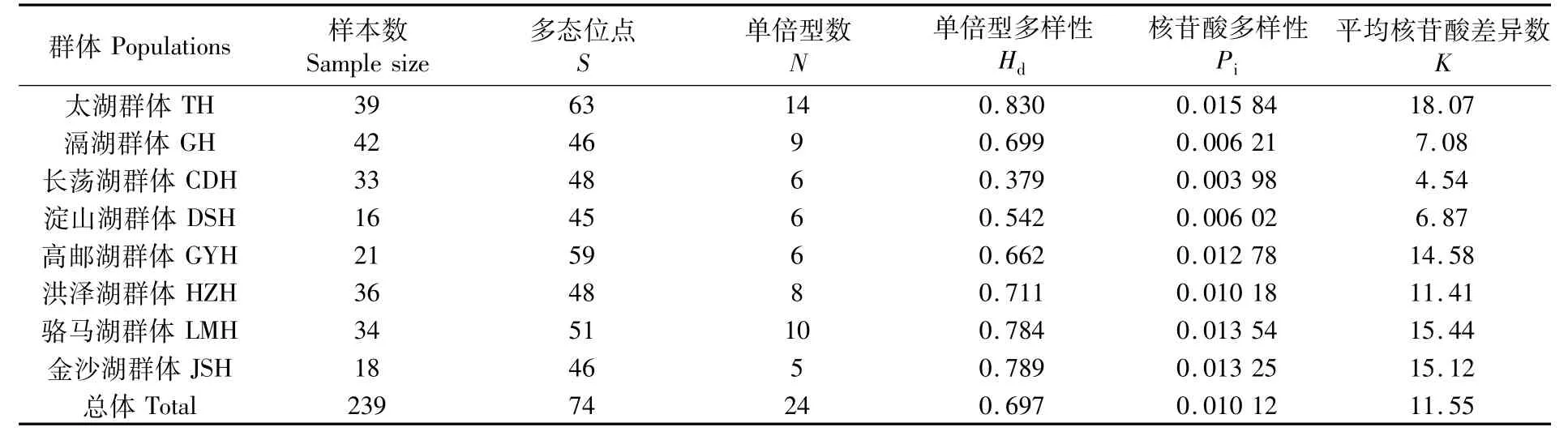
表1 8个鲢群体遗传多样性参数Tab.1 Genetic diversity parameters of eight H.molitrix populations

图1 采样水域Fig.1 Sam pling water area
1.2 DNA提取、PCR扩增和测序
取肌肉组织,用吸水纸将乙醇吸干。采用广谱型基因试剂盒(TaKaRa公司)提取基因组DNA,将DNA溶于去离子水,采用1%琼脂糖凝胶电泳检测DNA完整性,测定DNA溶液浓度,将DNA置于-20℃保存备用。采用Cytb基因序列的通用引物L14724(5′-CGTCAGTCCTTTACTT CGCA-3′)和H15915(5′-AGGGCATACTCACGGG GTTG-3′)进行PCR扩增[20]。PCR反应体系总体积为50μL,其中包括2×TaqPCR Master Mix 25 μL,正、反向引物各2μL(10μmol·L-1),DNA模板2μL,ddH2O 19μL。PCR条件为:94℃4 min;94℃40 s,55℃40 s,72℃90 s,循环30次;72℃10 min。
采用琼脂糖凝胶电泳对PCR产物进行检测,检测合格的PCR产物送上海生工生物工程技术有限公司进行双向测序,测序引物与扩增引物一致。
1.3 数据处理和分析
采用BioEdit7.0软件和Clustal X 1.83软件对序列进行编辑、校对和多重比对,获得Cytb基因序列。利用DnaSP 5.0软件计算鲢群体的遗传多样性参数:变异位点(variable sites,S)、单倍型数目(haplotype number,N)、单倍型多样性(haplotype diversity,Hd)、核苷酸多样性(nucleotide diversity,Pi)、平均核苷酸差异数(average number of nucleotide differences,K)。应用MEGA 7.0软件统计序列碱基组成,计算群体间的Kimura双参数遗传距离,基于邻接法(neighbor-joiningmethod,NJ)构建单倍型系统进化树,经1 000次自展检验获得分支树节点的支持率,其余参数均为软件默认值。采用Network 5.0软件构建单倍型最小网络图。应用Arlequin 3.5软件进行分子方差分析(AMOVA),计算群体遗传变异来源、变异方差和遗传分化指数;开展Tajima’sD和Fu’Fs中性检验和核苷酸错配分布分析,推测鲢群体历史动态。
2 结果与分析
2.1 Cyt b基因序列组成
本研究获得8个鲢群体的239条Cytb基因序列,其长度为1 141 bp。分析结果显示,Cytb序列碱基A、T、G和C的平均含量分别为29.9%、28.4%、13.8%和27.9%,碱基A+T的含量(58.3%)大于G+C的含量(41.7%),表现出明显的碱基组成偏倚性。239条Cytb序列共检出变异位点74个,其中单一信息位点13个,简约信息位点61个,转换颠换比为13.2,没有插入和缺失位点。
2.2 群体遗传多样性和单倍型组成
8个鲢群体的单倍型多样性为0.379~0.830,核苷酸多样性为0.003 98~0.015 84,平均核苷酸差异数为4.54~18.07,其中太湖群体的遗传多样性最大,长荡湖群体的遗传多样性最小。8个鲢群平均单倍型多样性为0.697,核苷酸多样性为0.010 12,平均核苷酸差异数为11.55(表1)。
239尾鲢个体共定义24种单倍型(Hap1~Hap24),其中太湖群体的单倍型类型最多,有14种,金沙湖群体的单倍型类型最少,仅有5种(表2)。单倍型中Hap3和Hap22为8个群体的共享单倍型,也是优势单倍型,其个体数量占群体的比例分别为52.3%和10.5%。单倍型Hap1、Hap3、Hap6、Hap9、Hap12、Hap14、Hap18 和Hap19至少为2个群体所有。单倍型Hap2为滆湖群体独有,单倍型Hap5、Hap7为洪泽湖群体独有,单倍型Hap8为骆马湖群体独有,单倍型Hap10、Hap11、Hap13、Hap15、Hap20、Hap21和Hap23为太湖群体独有,单倍型Hap24为高邮湖群体独有(表2)。

表2 单倍型类型及其在8个鲢群体中的分布Tab.2 Hap lotype types and its distribution in eight H.molitrix populations
2.3 群体遗传结构
分析结果显示,8个鲢群体间的遗传距离变化为0.005~0.015,其中太湖群体与金沙湖群体之间的遗传距离最大,滆湖群体与长荡湖群体之间的遗传距离最小。长江流域的4个鲢群体遗传距离为0.005~0.010,淮河流域的4个鲢群体遗传距离为0.011~0.014(表3),表明群体间遗传差异较小。

表3 鲢群体间的遗传间距离(对角线下)和遗传分化系数(对角线上)Tab.3 Genetic distance(below diagonal)and genetic differentiation index(above diagonal)among H.molitrix populations
对不同湖泊鲢群体进行分子方差分析,结果显示,群体间遗传变异占总变异的2.00%,群体内遗传变异占总变异的98.00%,遗传变异主要来自于群体内个体间。将8个群体分为长江流域组群和淮河流域组群,组间遗传变异占比为1.69%,组内群体间遗传变异占比为1.01%,群体内遗传变异占比为97.30%,两组群遗传变异主要来自于群体内个体间(表4)。两两群体间的遗传分化指数Fst值为-0.029 23~0.174 33,Fst值统计表明,滆湖群体与骆马湖和金沙湖群体间有中等和高度遗传分化(P<0.05),长荡湖群体与骆马湖和金沙湖间有中等和极大遗传分化(P<0.05),淀山湖和金沙湖群体间有中等遗传分化(P<0.05)(表3),其他群体间无显著分化(P>0.05)。

表4 鲢群体内和群体间的分子方差分析结果Tab.4 Results of analysis ofmolecular variance of H.molitrix populations
2.4 单倍型系统树和最小网络结构图
以鳙(Hypophthalmichthysnobilis,HM162839.1)作为外类群,采用邻接法构建鲢单倍型系统发育树(图2)。结果显示,单倍型被划分为2个分支,其中单倍型Hap1至Hap21形成一支,单倍型Hap22至Hap24形成一支,这与单倍型最小网络结构图相一致(图3)。最小网络结构进化关系表明,单倍型Hap1至Hap21之间的步长大多为1,步长最多不超过5,分支单倍型Hap22至Hap24之间的步长最大值为16,最小值为8,而两个分支相连接的单倍型Hap11和Hap22之间的步长为37,表明单倍型两个分支之间有较大遗传差异。单倍型系统树和网络结构图均显示,鲢各群体的单倍型交叉分布,没有形成特定的地理遗传结构。
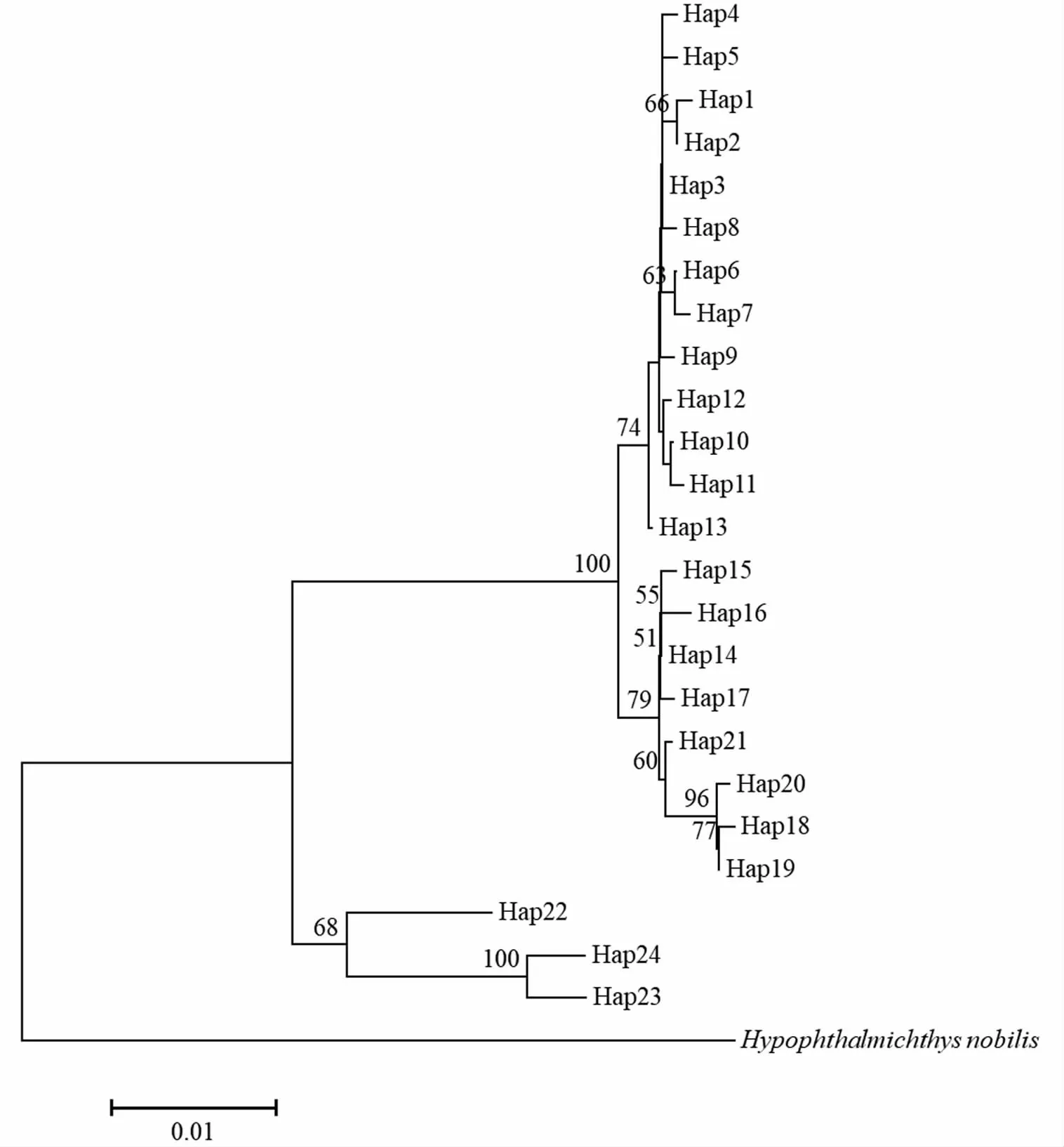
图2 基于Cyt b基因的鲢单倍型NJ系统树Fig.2 Neighbor-joining phylogenetic tree of H.molitrix haplotypes based on Cyt b gene

图3 鲢Cyt b基因单倍型网路结构图Fig.3 Haplotype network of H.molitrix based on Cyt b gene
2.5 鲢群体历史动态
中性检验结果表明,8个鲢群体的Tajima’sD值为-2.255 64~1.441 97,Fu’Fs值为3.141 17~12.042 16,除长荡湖和淀山湖群体的Tajima’sD检验具有显著性差异外,其他群体的中性检验差异均不显著(P>0.05)。将8个群体作为一个整体进行中性检验,其Tajima’sD值和Fu’Fs值分别为-0.167 54(P>0.05)和5.532 78(P>0.05)(表5),歧点分布曲线呈现为多峰型(图4),表明鲢群体近期未经历过群体扩张事件,符合中性进化。

表5 8个湖泊鲢群体的中性检验结果Tab.5 Neutral tests of H.molitrix populations in eight freshwater lakes
3 讨论
3.1 鲢群体遗传多样性
物种的遗传多样性是生物长期进化的产物,是其生存适应和发展进化的前提。遗传多样性的高低与物种的生存能力和进化潜力密切相关,也反映物种对外界环境因素变化适应能力的强弱。单倍型多样性和核苷酸多样性是衡量物种遗传多样性的两个重要指标,其值越大,表明群体的遗传多样性越丰富[21-22]。本研究结果显示,8个鲢群体单倍型多样性为0.379~0.830,核苷酸多样性为0.003 98~0.015 84。依据GRANT和BOWEN[23]提出的鱼类遗传多样性大小标准,除长荡湖群体外,其他鲢群体遗传多样性表现出高Hd、高Pi的遗传多样性模式,表明鲢资源遗传多样性较为丰富。相比较而言,太湖、洪泽湖、骆马湖及金沙湖群体的遗传多样性较高,而长荡湖、淀山湖、滆湖及高邮湖群体的遗传多样性较低,群体间遗传多样性表现出明显差异,这可能受湖泊的生态环境、生产模式及增殖放流等因素影响。近几十年来,增殖放流已成为恢复渔业资源的重要手段,有关增殖放流对野生群体遗传多样性产生的影响一直是国内外学者探讨的热点。研究认为,增殖放流群体比野生群体更容易发生瓶颈效应和近交衰退,进而造成一些稀有等位基因的丢失,导致增殖放流群体平均等位基因数下降,增殖放流群体的遗传多样性明显低于天然群体[14-15,24]。由于增殖放流对象亲本来源及遗传多样性差异,导致增殖放流对野生群体遗传多样性产生较大影响,因此应开展增殖放流对象遗传多样性评价,避免增殖放流可能带来的不利影响[25-27]。整体来看,8个鲢群体的平均单倍型多样性和核苷酸多样性分别为0.697和0.010 12,明显低于长江上游鲢群体遗传多样性(Hd:0.849,Pi:0.014 38)[28],且已有研究表明,长江鲢群体目前仍保持较高的遗传多样性水平[17-19,29-30]。因此,实现江湖连通是恢复湖泊鲢资源和提高其遗传多样性的重要措施。
鱼类遗传多样性和群体历史动态有密切联系,发生过瓶颈效应的群体,遗传多样性较低。GRANT和BOWEN[23]提出一个简化的模式,利用Hd、Pi来估计群体的进化历史:当Hd≥0.5、Pi≥0.5%时,表示群体稳定,具有较悠久的进化历史;当Hd≥0.5、Pi<0.5%时,表示群体是经历瓶颈效应后迅速扩张而来;当Hd<0.5、Pi≥0.5%时,表明群体经历了轻微的瓶颈效应,几乎没有影响到核苷酸变异;当Hd<0.5、Pi<0.5%时,表明群体近期经历了瓶颈效应[23]。本研究结果显示,长荡湖群体表现出低Hd、低Pi的遗传模式,显示群体经历了严重的瓶颈效应;其他群体则表现出高Hd、高Pi的遗传模式,显示群体较稳定且具有较长的进化历史。从中性检验结果来看,仅有长荡湖和淀山湖群体的Tajima’sD检验结果具有显著性负值,其他群体的Tajima’sD和Fu’Fs检验结果均没有显著性差异。通常认为,Fu’sFs检验比Tajima’sD检验对群体历史扩增事件的准确度更高,当Fu’sFs检验为不显著而Tajima’sD为负值时符合中性进化[31-32],表明鲢群体没有发生过群扩增历史事件。另外,错配分析图呈多峰分布,也表明群体没有经历过种群扩张,较为稳定[33-34],这也是鲢群体遗传多样性较高的重要原因。
3.2 鲢群体遗传结构分析
了解群体遗传结构可以用于评价物种群体的变异水平和不同地理群体之间的关系,确定群体中的进化显著单元和管理单元,科学制定资源的保护和管理策略[35]。遗传分化指数Fst是表征群体间遗传分化程度的重要参数,其值越大,表明各群体间的遗传差异越大:若Fst小于0.05,表明群体间遗传分化较弱;若Fst为0.05~0.15,表明群体间存在中等分化;若Fst为0.15~0.25,表明群体间遗传分化较大;若Fst大于0.25,表明群体间分化极大[36]。分子方差分析结果显示,群体间的分子变异占比较小,而群体内个体间的分子变异占比较大,遗传分化指数较小,且统计检验不具有显著性差异(Fst=0.019 97,P>0.05),表明群体间遗传分化较弱。从群体的单倍型组成、单倍型发育树及网络结构图可以看出,不同群体间存在广泛的基因交流,没有形成特定的地理遗传结构。鲢群体的遗传结构现状可能由以下几个方面的原因造成:1)增殖放流活动可引起野生群体与养殖群体基因参渗,缩小不同地理种群间的遗传差异,增加群体间的基因交流,从而导致各群体间遗传结构同质化[19,37];2)各群体间的地理距离较近,且有河道相连通,群体间没有形成明显的地理隔离,南水北调及生产活动则加速了群体扩散和基因交流[38];3)鲢的游泳能力和适应环境能力较强,可以长距离迁移,适应不同的生态环境[39];两两群体间的Fst值显示,长江下游4个鲢群体Fst为-0.038 57~0.047 85(P<0.05),淮河下游4个鲢群体Fst为-0.029 23~0.014 45(P<0.05),表明长江、淮河流域内群体间遗传分化极小。两流域部分群体间呈现出显著性遗传分化,比如,滆湖群体与骆马湖和金沙湖群体间有中等遗传分化(P<0.05),长荡湖群体与骆马湖群体间也有中等遗传分化(P<0.05),而长荡湖群体与金沙湖群体间有较大遗传分化(P<0.01)。因此,应将长江流域和淮河流域鲢群体作为不同的管理单元进行保护。
3.3 湖泊鲢资源管理和保护建议
从群体遗传多样性和单倍型组成角度来看,长荡湖群体遗传多样性最低,太湖群体遗传多样性最高,单倍型种类最多,且多数单倍型为太湖群体独有,应对长荡湖、太湖群体给予重点保护。从群体遗传结构来看,长江、淮河流域内群体间遗传分化极弱,而两流域的部分群体间出现显著性遗传分化,因此应将长江流域、淮河流域群体分别作为独立单元进行管理。增殖放流会对湖泊鲢群体遗传多样性和遗传结构产生重要影响,应开展放流群体和野生群体遗传多样性评估,避免增殖放流对自然群体遗传多样性和遗传结构产生不利影响。鲢是典型的江湖洄游型鱼类,在长江繁殖产卵,应打通江湖通道,恢复江湖有效连通,将有利于恢复湖泊鲢资源量及提高鲢遗传多样性。

