不同浸泡条件对杜仲叶茶活性成分的影响
蒋碧伟 , 罗蓓蓓 , 张立攀 , 张亚勋 , 孙茜茜 , 任 钊
(河南省商业科学研究所有限责任公司 ,河南 郑州 450000)
杜仲(Eucommiae Cortex)又名思仲、扯丝皮,为杜仲科杜仲属植物,是我国独有的经济树种,广泛分布于河南、安徽、山东等地,杜仲常以皮入药,具有滋补肝肾、强筋壮骨、保胎安胎等功效[1]。杜仲的成熟干制叶片,研究表明,杜仲叶与皮化学组成近似,具有极高的药用价值。2019年经卫健委批准将杜仲叶、山茱萸等作为药食同源试点物质开展生产,从此杜仲叶可以作为食品原料使用,其在功能食品领域具有巨大的潜在发展前景[2]。
杜仲叶被认为是天然的降压、降糖药物,效果显著,但杜仲叶茶的活性物质只有溶于水,才能被人体吸收利用,杜仲叶茶功效发挥的关键在于泡制方式,科学的泡茶方式不仅能够使茶香浓郁纯正,口感醇和更佳,还能使活性成分得到高效利用[3]。因此,为了探讨浸泡条件对杜仲叶茶功效成分溶出量及抗氧化、降糖效果的影响,本研究以浸泡温度、时间、次数为考察因素,以黄酮、绿原酸、总多酚溶出量、DPPH·清除率、OH·清除率、葡萄糖苷酶抑制率为考察指标,分析评价其抗氧化作用及降糖功效,从而为杜仲叶茶的科学泡制提供理论依据。
1 材料与方法
1.1 材料与试剂
杜仲叶茶,河南芳捷农业发展有限公司;绿原酸标准品(纯度≥99%)、芦丁标准品(纯度≥99%)、没食子酸标准品(纯度≥99%)、京尼平苷酸(纯度≥99%)、α-葡萄糖苷酶(25 U)、1,1-二苯基苦基苯肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH)(纯度≥95%)、Folin-Ciocalteu 试剂(1 moL/L)、阿卡波糖、VC标准品,上海源叶生物科技有限公司;水杨酸、FeSO4、过氧化氢、对硝基苯酚葡萄糖苷(PNPG)、乙腈、甲酸、甲醇、乙醇、Na2CO3,分析纯,国药集团试剂化学有限公司;硝酸铝、亚硝酸钠、氢氧化钠,分析纯,天津市瑞金特化学品有限公司。
1.2 仪器与设备
101-1AB型恒温干燥箱,天津市泰斯特仪器有限公司;TU-1901双光束紫外可见光分光光度计,北京普析通用仪器有限责任公司;FA2004电子天平,上海衡际科学仪器有限公司;KQ-7000DE型数控超声清洗器,昆山市超声仪器有限公司;Agilent TC-C18,150 mm×4.6 mm,3.0 μm,1290高效液相色谱仪,安捷伦科技有限公司。
1.3 实验方法
准确称取杜仲叶茶1 g,置于烧杯,按照1∶30的茶水比加入热水,恒温水浴锅中保温一定时间,放凉、过滤,测定黄酮、多酚、绿原酸、京尼平苷酸等含量,并进行相关活性实验研究。
1.3.1实验过程
①准确称取1 g杜仲叶茶,放入到烧杯中,按照1∶30茶水比,加入一定温度(60、70、80、90、100 ℃)的纯净水,浸泡30 min后,放凉、过滤,检测黄酮、绿原酸、京尼平苷酸含量。②准确称取1 g杜仲叶茶,放入到烧杯中,按照1∶30茶水比,加入90 ℃热水,浸泡一定时间(15、30、45、60、90 min)后,放凉、过滤,检测黄酮、绿原酸、京尼平苷酸含量。③准确称取1 g杜仲叶茶,放入到烧杯中,按照1∶30茶水比,加入90 ℃热水,浸泡45 min后,重复操作,进行第2次浸泡和第3次浸泡,放凉、过滤,检测黄酮、绿原酸、京尼平苷酸、含量。④根据上述得出的最佳浸泡条件,研究对DPPH·、OH·的清除作用及对葡萄糖苷酶的抑制效果。
1.3.2黄酮检测方法
参考文献[4]采用NaNO2-Al(NO3)3-NaOH方法,准确称量芦丁标准品15 mg,以60%乙醇定容至25 mL容量瓶中,制备0.6 mg/mL标准液。分别吸取0、0.25、0.50、1.00、1.50、1.75 mL标准液加至10 mL容量瓶中,依次加入5% 亚硝酸钠溶液0.5 mL,摇匀静置6 min,加入10% 硝酸铝溶液0.5 mL,摇匀静置6 min,加入10% 氢氧化钠溶液2 mL,最后用60%乙醇定容至刻度线,采用分光光度法,在510 nm波长下,测定吸光值,以芦丁浓度(mg/L)为横坐标,以吸光值为纵坐标绘制标准曲线。
1.3.3总多酚含量测定
参考文献[5]精确称量22 mg没食子酸标准品,用纯净水定容至100 mL容量瓶中,得到0.22g/L标准液,分别吸取0、0.5、1、1.5、2、2.5、3 mL标准液于具塞比色管,依次加入福林酚试剂1 mL,摇匀,加入12 mL 12%的Na2CO3溶液,以纯净水定容至25 mL,在25 ℃下避光保温2 h,于765 nm波长下测定吸光度,以没食子酸浓度为横坐标,吸光值为纵坐标绘制标准曲线。
1.3.4绿原酸、京尼平苷酸检测
1.3.4.1色谱条件
以Agilent TC-C18(150 mm×4.6 mm,3.0 μm)为实验柱,绿原酸和京尼平苷酸色谱条件:以100%甲醇、1.5%醋酸水溶液分别为流动相A和B,检测波长分别为327、254 nm,柱温40 ℃,梯度洗脱程序为0~2 min,5%A;2~10 min,5%~100%A,流速为0.5 mL/min,检测时长10 min,进样量20 μL。上述操作条件下,杜仲叶供试品及标准品色谱图见图1。京尼平苷酸、绿原酸保留时间分别为5.043、5.816 min。

图1 杜仲叶供试品及标准品色谱图
1.3.4.2标准曲线制备
分别精确称取绿原酸(12.4 mg)、京尼平苷酸(11.3 mg)标准品于10 mL棕色容量瓶,加入甲醇溶液定容至刻度线,摇匀,得到绿原酸、京尼平苷酸混合标准液。分别吸取一定体积的标准液制备20、50、100、200、500 mg/L标准液,按照1.3.2.1色谱条件上样检测,以峰面积为纵坐标,标准品浓度为横坐标绘制标准曲线。
1.3.5DPPH·自由基清除率实验
参考文献方法[6],分别吸取2 mL杜仲叶提取液,0.2 mmol/L的DPPH·乙醇溶液2 mL,混合均匀,25 ℃下避光保温30 min,以蒸馏水代替样品为空白组,在517 nm波长下测定吸光值A空白,以2 mL DPPH·乙醇溶液和2 mL样品为实验组测定吸光值为A样品,DPPH·清除率见式(1):
(1)
1.3.6OH·自由基清除实验
参考文献方法[7],将提取液2 mL,6 mmol/L硫酸亚铁,8.8 mmol/L 双氧水各2 mL混合后静置10 min,分成两部分,一部分加入2 mL 6 mmol/L水杨酸乙醇溶液混合静置3 min,在510 nm处测定吸光度值Ci,一部分加2 mL水,在510 nm处测吸光度值Cj,空白组吸光度记为C0,清除率见式(2):
(2)
1.3.7α-葡萄糖苷酶抑制率实验
参考文献方法[8],准确吸取100 μL提取液,加入0.01 g/Lα-葡萄糖苷酶100 μL,混匀。37 ℃下水浴加热15 min,加入2.5 mmol/L PNPG 100 μL,混匀;37 ℃水浴10 min,然后加入0.1 mol/L Na2CO35 mL终止反应,405 nm波长下测定吸光值(A实验)。蒸馏水代替提取液组作为空白组(A空白),蒸馏水代替α-葡萄糖苷酶组为空白对照组(A空白对照),抑制率公式见式(3):
抑制率/%=
(3)
2 结果与分析
2.1 不同浸泡温度对杜仲叶茶活性成分的影响
如图1所示,随着温度的升高,杜仲叶茶活性成分溶出量呈现一定的递增趋势。

图1 不同温度对杜仲叶茶活性成分的影响
总黄酮是杜仲叶的主要活性成分,黄酮含量高低被认为是判断杜仲叶品质的基本指标,研究表明,植物黄酮具有抗氧化、抗衰老、降血压、提升免疫力等作用[9]。杜仲叶茶总黄酮含量在90 ℃时为(69.13±2.77) mg/g,是60 ℃时含量的1.2倍,100 ℃时的黄酮含量与90 ℃时黄酮含量差异较小。多酚被称为“第八大营养素”,植物多酚具有抗氧化、抑菌、抗肿瘤、增强免疫力等功能[10]。由图1可知,在90 ℃时,杜仲叶茶总多酚溶出量为(37.2±2.11) mg/g,是60 ℃时含量的1.15倍,在100 ℃时,总多酚溶出量增长幅度较小,但整体为增长趋势。绿原酸是《中国药典》(2020版)中关于杜仲叶质量控制的唯一指标,绿原酸具有较强的抗衰老、清除自由基、抑菌、抗肿瘤、降血压、保护心血管等作用[11]。绿原酸在60~90 ℃时增幅明显,90 ℃时绿原酸溶出量是60 ℃时含量的1.15倍,90~100 ℃溶出量增长较缓慢。京尼平苷酸是杜仲叶环烯醚萜类化合物之一,具有保肝利胆、修复损伤脊髓、提高记忆力、抗炎等多种生物活性[12]。京尼平苷酸含量在90 ℃时溶出量最大,在60~90 ℃,其溶出量逐渐增加,当温度超过90 ℃时,其溶出量呈现降低趋势,可能是京尼平苷酸受温度影响,出现了一定量的损失,与邓佑林等[13]研究结果相似。因此,当水温在90 ℃以上时,杜仲叶茶活性成分的溶出量比较大,适合饮用。
2.2 不同浸泡时间对杜仲叶茶活性成分的影响
不同浸泡时间对杜仲叶茶活性成分溶出的影响见图2。

图2 不同浸泡时间对杜仲叶活性成分的影响
由图2可知,随着浸泡温度的升高,黄酮在45 min时溶出量最高,45 min后溶出量逐步降低,多酚在15~45 min时溶出量逐渐升高,45 min时含量最高,绿原酸溶出量随时间变化规律和黄酮、多酚相一致,在45 min时达到最大值,京尼平苷酸溶出量在15~60 min时,随浸泡时间呈现递增趋势,在60 min时含量最高,60 min后含量有一定范围的缓慢降低。因此,当浸泡时间在45 min时,活性成分整体含量较高,适合饮用。
2.3 不同浸泡次数对杜仲叶茶活性成分的影响
不同浸泡次数对杜仲叶茶活性成分的影响见图3。
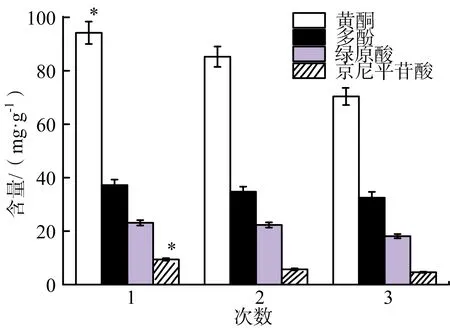
图3 浸泡次数对杜仲叶茶活性成分的影响
由图3可知,随着浸泡次数的增加,活性成分的溶出量均出现逐渐降低趋势,黄酮含量明显降低,统计学数据显示差异性显著(P<0.05)。多酚含量随着浸泡次数的增加略有降低,绿原酸含量第1次浸泡和第2次浸泡之间差异不大,第3次浸泡有一定程度降低。京尼平苷酸含量随着浸泡次数增加呈现显著降低趋势(P<0.05)。因此,第1次浸泡是最佳的浸泡方式,活性成分溶出量最高,最利于功效的发挥。
2.4 DPPH·自由基清除率实验
利用SPSS 22.0软件对VC溶液及杜仲叶茶浸泡液清除DPPH·自由基能力进行分析,经过非线性曲线拟合(DOSERESP),各参数及方程见图4。VC溶液对DPPH清除作用拟合非线性关系良好,R2=0.999 2,其对DPPH·自由基清除率的IC50为0.007 88 g/L,杜仲叶茶浸提液清除DPPH·自由基的IC50为0.231 92 g/L,因此,研究表明,VC抗氧化能力较强,杜仲叶茶具有一定的抗氧化能力。
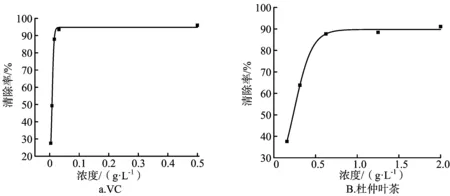
图4 VC及杜仲叶茶对DPPH·自由基的清除能力
2.5 对OH·自由基的清除作用
VC及杜仲叶茶浸泡液对OH自由基的清除能力见图5。由图5可知,利用SPSS 22.0软件对VC溶液及杜仲叶茶浸泡液清除OH·自由基能力进行分析,发现VC溶液OH·自由基清除率的IC50为0.140 04 g/L,拟合方程的R2=0.940 4,拟合关系良好。杜仲叶茶浸提液对OH·自由基具有明显的清除作用,其IC50为7.443 69 g/L,表明杜仲叶茶具有良好的抗氧化能力。

图5 VC及杜仲叶茶浸泡液对OH·自由基的清除能力
2.6 对α-葡萄糖苷酶的清除作用
阿卡波糖及杜仲叶茶浸泡液对α-葡萄糖苷酶的抑制作用见图6。

图6 阿卡波糖及杜仲叶茶对葡萄糖苷酶的抑制作用
由图6可知,随着浓度升高,阿卡波糖对α-葡萄糖苷酶的抑制率几乎不变,达到100%。杜仲叶茶浸泡液对葡萄糖苷酶的抑制作用随着浓度升高呈现递增趋势,通过非线性方程拟合,拟合度较高,R2=0.994 51,得到其IC50为1.941 63 g/L,表明杜仲叶茶具有一定的降糖作用。
3 结论
通过研究不同浸泡因素对杜仲叶茶活性成分溶出量的影响,得到最佳的泡制方式,为其科学饮用奠定了理论基础,研究表明,当条件为水温90 ℃以上,浸泡时间45 min,首次浸泡时杜仲叶茶中黄酮类化合物、多酚、绿原酸及京尼平苷酸溶出量较高,能够发挥最大功效。在最佳浸泡条件的基础上,评价了杜仲叶茶浸泡液对DPPH·、OH·的清除作用及对葡萄糖苷酶的抑制效果,利用SPSS 22软件进行非线性拟合得到其IC50,分别为0.231 92、7.443 69、1.941 63 g/L,结果表明,杜仲叶茶具有一定的抗氧化能力及降糖作用。

