短期饥饿胁迫对摄入红枣提取物的虹鳟非特异性免疫相关基因表达的影响
刘旭昊, 汪小将, 刘 飞
(洛阳师范学院, 河南洛阳 471934)
虹鳟是我国重要的高端冷水鱼之一,广受大众欢迎,近年来一直保持高速增长,即使2018年遭遇了“改名危机”,虹鳟产量依然保持了正增长,与2015年相比,2019年鳟鱼产量几乎翻了一倍,达39373 t[1]。水产动物基本上无法避开致病菌和寄生虫,一旦发病往往会造成较大损失,所以提高非特异性免疫能力对于水产养殖业来说是至关重要的[2]。目前虹鳟对各种疾病尚无特效药物,其抗性主要源于非特异性免疫[3]。而中草药常被用于提高水产的非特异性免疫能力和抗氧化能力,研究表明多种中草药可提高虹鳟的抗氧化能力、白细胞吞噬能力以及其它多种非特异性免疫指标[4]。
虹鳟渔场多建于高山峡谷之间,生长阶段、饲料的时空分布、暂养、转场乃至后勤保障等种种原因导致虹鳟短期饥饿胁迫很难避免,所以提高虹鳟的饥饿耐受性及其非特异性免疫能力、减少因而造成的损失是虹鳟养殖面临的新课题。虹鳟是冷水鱼研究模式鱼种,故了解中草药在虹鳟面临饥饿胁迫下对免疫相关指标的影响就显得尤为必要,可为以虹鳟为代表的冷水鱼在饥饿胁迫下采取何种预防性对策提供理论依据。
红枣是我国传统的药食两用食物,具有抗衰老、补血、抗氧化、抗肿瘤、保肝、调节免疫力等作用,其活性成分被不同机构进行了深入细致的研究[5,6]。另有研究表明,适量添加红枣提取物可以促进虹鳟抗氧化能力,提高虹鳟的非特异性免疫能力[7]。故本文深入研究短期饥饿胁迫对摄入红枣提取物后虹鳟幼鱼非特异性免疫相关基因表达的影响,以评价红枣提取物摄入对虹鳟非特异性免疫能力促进的持续性和耐饥饿胁迫能力的影响。
1 材料与方法
1.1 实验材料
试验用虹鳟幼鱼自四川省眉山市东坡区天贵养殖场采购,于本院冷水鱼养殖工程研究中心循环养殖系统饲养缸(1 m×1m)暂养驯化14 d后,选取体型大小一致(7.2~8.4 cm)、游动迅捷灵活、无病无伤的虹鳟幼鱼备用。
1.2 实验用饲料
红枣提取物(20:1)购自陕西森弗天然制品有限公司。以豆粕、鱼粉为N源,豆油加鱼油为脂肪源配制基础饲料,配方见表1;饲料原料购自中粮饲料(新沂)有限公司。根据前期试验结果,分别添加质量百分比为0%、0.25%、0.5%的红枣提取物,配制成等氮等脂试验用饲料(粗蛋白46.2%;粗脂肪13.7%)并制粒,粒径1.5~2.5 mm,阴干后于-20℃冰箱保存备用,用前自然升温至室温。

表1 虹鳟基础饲料配方(%)

表2 实时荧光定量PCR引物序列
1.3 虹鳟养殖
1.3.1 红枣提取物摄入试验处理
取备用虹鳟幼鱼,随机分为三组,每组3个平行缸,每缸30尾;分别投喂红枣提取物添加比为0%、0.25%、0.50%的试验用饲料,连续饲养8周,期间24h充气泵运行,每日适度换水,水体循环过滤,并保持水温在13±2℃、pH7.2±0.2,DO>8 mg/L。每日早中晚三次定点定时投喂(投喂量:2-5%体重饱食),投喂后及时清理残饵和粪便。
1.3.2 饥饿试验处理
前处理饲养阶段完成后,所有各试验缸留下10尾在饥饿胁迫条件下饲养2周,除禁食外,其它条件不变。
1.4 采样
饥饿试验后所有各实验组随机选取虹鳟幼鱼各6尾,用70%乙醇脱脂棉球消毒,于冰盘上解剖,分别取头肾、脾脏于冻存管中暂存,并尽快转移至-80℃冰箱中冻存。
1.5 抗氧化基因表达情况测定
从-80℃冰箱中取出备用样品,进行总RNA提取(上海飞捷总RNA极速提取试剂盒);然后进行反转录(东洋纺生物科技有限公司试剂盒)得到cDNA,然后用超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX1)、谷胱甘肽巯基转移酶(GSTA)、溶菌酶(LZM)、补体C3(C3)、肿瘤坏死因子(TNF-α)目的基因和内参基因的上下游引物,按照Bestar SybrGreen qPCR mastermix (德国DBI公司)说明书进行实时荧光定量PCR,反应程序设置如下:95℃2 min;95℃10 s,55℃30 s,72℃30 s,40 cycles;95℃1 min,55℃1 min,55-98℃(10s/cycle,0.5℃/cycle,共86cycles)。循环结束后提取各基因Cq值,用2—ΔΔt法计算各目的基因的相对表达值。
1.6 数据统计与分析
数据分析采用Excel 2013进行处理,使用平均值±标准差表达计算结果精度;使用SPSS13.0进行单因素方差分析,用Duncan′s法进行处理组和对照组之间的平均数比较,在α=0.05水平检验。
2 结果与分析
2.1 红枣提取物对饥饿条件下脾脏非特异性免疫基因表达的影响
不同饥饿试验组虹鳟脾脏非特异性免疫相关基因(含抗氧化基因和免疫基因)的相对表达量结果见图1。从图中可看出,进行14天饥饿后,SOD,GPX1,GSTA,LZM,C3均在0.25%组与对照组相比表现为表达量增加,其中除LZM外均在0.50%组转为下降。经单因素方差分析结果表明:GPX1、GSTA和C3基因表达在0.50%组显著或极显著下调,但LZM基因表达在0.50%组显著上调,C3基因表达在0.25%组极显著上调;其他各红枣提取物组的这些基因的表达量均与对照组相比无显著变化。

图1 不同饥饿组虹鳟脾脏非特异性免疫相关基因相对表达量
2.2 红枣提取物对饥饿条件下头肾非特异性免疫基因表达的影响
不同饥饿试验组虹鳟头肾非特异性免疫相关基因(含抗氧化基因和免疫基因)的相对表达量结果见图2。从图中可看出,相对于对照组,两个红枣提取物添加组各基因表现的表达情况无统一的趋势,但所测定的三个免疫直接相关基因0.25%组表达量要高于对照组和0.50%组。经单因素方差分析结果表明:GPX1基因表达在0.25%组极显著下调,在0.50%组显著上调;C3基因表达在0.25%组极显著上调;其他各红枣提取物添加组在这几个基因的表达量上均与对照组之间无显著差异。
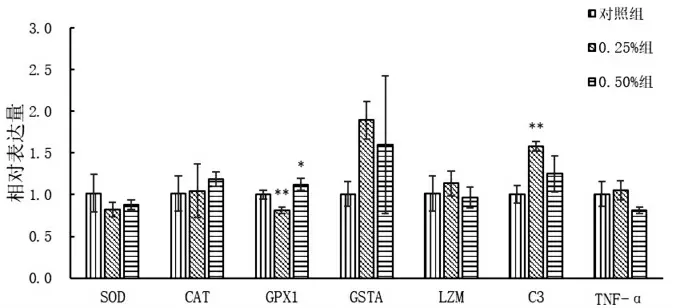
图2 不同饥饿组虹鳟头肾非特异性免疫相关基因相对表达量
3 讨论
从本研究结果来看,投喂添加红枣提取物的虹鳟短期饥饿胁迫后脾脏受到的影响更大,7组非特异性免疫相关基因表达中GPX1、GSTA、LZM、C3出现了显著或极显著波动,而头肾受到的影响相对小一些,仅GPX1和C3出现了极显著波动。另外有研究表明虹鳟饲料添加物可以增强头肾SOD、C3[8]、CAT[7]基因的表达和脾脏SOD、GPX1、GSTA基因的表达[7],本研究中在短期饥饿胁迫后相对于对照组虹鳟两种组织的响应能力均出现下降,其中头肾SOD、CAT基因表达差异丧失、脾脏SOD基因表达差异丧失,表明不同非特异性免疫基因在不同组织的作用持续时间有一定差异。头肾是鱼类主要的造血和免疫器官,脾脏是虹鳟最主要的免疫器官之一。脾脏和头肾的结构、功能存在显著差异,提示其对红枣提取物的器官反应也可能有所不同,也反映了中草药在配伍应用上应当注意器官效应。
动物细胞的抗氧化酶系主要包括CAT、SOD、GPX、GSTA等,饥饿胁迫下通常会降低抗氧化基因的表达或其酶活性。从本研究看,相对于对照组,主要受影响的脾脏中GPX1、GSTA基因表达在低浓度组(0.25%)还均表现为一定程度的上升趋势,而高浓度组(0.5%)则均表现为进一步的显著或极显著下降。已有研究表明一定浓度红枣提取物添加能提高虹鳟机体的抗氧化能力,显著提升虹鳟脾脏GSTA基因表达[7]。这表明饲料添加一定浓度红枣提取物对虹鳟促抗氧化能力持续效应不明显,而且过高浓度(0.5%)添加反而在抗饥饿胁迫时降低机体抗氧化能力。
鱼类的非特异性免疫机制包括溶菌酶、补体、干扰素、吞噬细胞等,其中溶菌酶(LZM)在抵抗病原入侵中起重要作用;补体系统介导溶裂反应来促进吞噬、溶解靶细胞,是机体内重要的非特异性免疫调节系统,因三条激活途径均包含C3,所以C3是非特异性免疫的重要标志。储辛伊等研究结果表明饥饿胁迫也会导致补体含量下降,同时认为补体C3在饥饿胁迫下活化可以清除机体中可溶性免疫复合物,抑制炎症反应[9]。饥饿胁迫可导致鱼类各种非特异性免疫指标下降[7,10]。本试验中添加红枣提取物后短期饥饿胁迫下虹鳟脾脏LZM基因表达呈上升趋势,在高浓度(0.5%)下表达显著增强;低浓度组(0.25%)C3基因无论在脾脏还是头肾均极显著上调表达,但在高浓度组(0.5%)仍然显著下调。这表明饲料添加一定浓度红枣提取物对虹鳟促免疫能力具有一定的持续效应,也一定程度增强了机体的抗胁迫能力。
综上,一定浓度的红枣提取物摄入后,对虹鳟非特异性免疫能力促进具有一定的持续性,主要表现在对脾脏组织和非特性免疫直接相关基因(如LZM、C3)上,一定程度上也表明其摄入能提升机体的抗饥饿胁迫能力。同时结合上述对非特异性免疫直接基因表达及相关的抗氧化基因的表达影响结果的综合分析来看,在虹鳟饲料中添加较低浓度(0.25%)红枣提取物为宜。

