局域尺度麦田土壤微生物群落构建过程及其驱动因素①
陈鲜妮,米 倩,徐晓峰
局域尺度麦田土壤微生物群落构建过程及其驱动因素①
陈鲜妮,米 倩,徐晓峰*
(河南科技大学农学院,河南洛阳 471000)
为探究局域尺度麦田土壤微生物群落构建过程,本研究采集河南省济源市小麦种植户麦田土壤,应用高通量测序技术,研究局域尺度下麦田土壤细菌群落结构、群落构建过程及其影响因素。结果表明:①土壤细菌群落中优势菌门是酸杆菌门(Acidobacteria)和变形菌门(Proteobacteria)。通过曼特尔检验以及冗余分析发现有机质和全氮对细菌群落结构影响显著(<0.05)。②细菌分子生态网络中不同细菌类群之间以合作关系为主,关键物种来自拟杆菌门(Bacteroidetes)、酸杆菌门和变形菌门。③细菌群落在系统发育上聚类,有机质和有效磷对细菌群落系统发育影响显著(<0.05)。④确定性过程和随机性过程在细菌群落构建中的贡献率分别为74.59% 和25.41%。⑤曼特尔检验发现最近物种指数(βNTI)值与有机质、全氮、全磷含量变化呈显著正相关(<0.05)。有机质、全氮、全磷含量差异的增大导致细菌群落从同质性选择以及均质扩散向异质性选择过程的转变。综上所述,本研究发现确定性过程在局域尺度麦田土壤细菌群落构建中占主导地位,土壤有机质、全氮、全磷是影响细菌群落构建的关键环境因素。有机质和全氮还对细菌群落结构有显著影响。本研究有利于对局域尺度下麦田生态系统土壤微生物多样性形成机制的认识。
小麦;土壤细菌;群落构建过程;群落结构;影响因素
土壤微生物在促进养分循环、维持土壤生态系统功能方面发挥着重要作用[1]。群落构建研究对解释微生物多样性的形成和维持机制十分重要,是生态学研究的重要议题[2]。群落构建存在两个生态过程:确定性过程和随机性过程[3]。确定性过程涉及生物因素和非生物因素,如物种特征、种间关系(竞争、捕食、互利共生等)以及环境因素(pH、温度和水分等)[4-5];相反,随机性过程涉及物种随机的出生、死亡、定殖和扩散事件[6]。目前普遍认为在群落构建过程中确定性过程和随机性过程共同发挥作用[7],但是,由于研究尺度、生境以及物种差异[8],确定性过程和随机性过程对微生物群落构建的相对重要性仍存在争议[9]。
目前学者们对微生物群落构建的研究涉及森林、草原、湖泊、湿地、农田等生态系统[10-14],其中农田生态系统作为典型的人类管理的生态系统,对保障全球粮食安全起着重要作用[15]。研究农田生态系统土壤微生物群落构建过程,有助于明确土壤微生物对人为干扰响应的生态机制,维持生态系统稳定。小麦作为农田生态系统的重要成员,是全球重要的粮食作物,小麦产量提高对满足日益增长的粮食需求至关重要[16]。细菌作为土壤中最丰富的微生物类群,对土壤结构形成、营养元素循环(有机质分解、固氮)、作物生长等十分重要[17],因此本文主要探索麦田土壤细菌群落构建过程。目前已有学者对麦田生态系统土壤细菌群落构建进行了相关研究,Shi等[14]发现空间距离在150 ~ 900 km范围内华北平原麦田土壤细菌群落构建由随机性过程主导,大于900 km由确定性过程主导,细菌群落受到地理距离和环境因素的影响;Fan等[18]研究表明确定性过程控制大尺度空间范围内华北平原小麦根际与非根际土壤细菌群落构建;Liu等[19]发现连续8 a施用氮肥小麦根际细菌群落构建倾向于由确定性过程主导。空间尺度是影响群落构建的主要因素之一[20],以往研究大多集中在大空间尺度麦田土壤细菌群落构建过程或者在局域尺度采用田间实验探究麦田土壤细菌群落构建过程[14, 18-19]。我国的农业生产主要依靠农民,目前对局域尺度农户麦田土壤细菌群落构建过程的研究较少。由于在大空间尺度下气候条件、环境因素、地理距离等因素都会对细菌群落产生影响[21],而在局域尺度下细菌群落变化主要受环境因素的影响[22],已有研究发现有机质、pH等是驱动土壤细菌群落构建的关键因子[9, 23]。研究局域尺度农户麦田土壤细菌群落构建过程及其环境驱动因素更有利于服务农业生产,而且有助于对农田生态系统土壤微生物群落构建机制的理解。
河南省是中国重要的小麦种植地区,本研究选取河南省济源市小麦种植户麦田土壤为研究对象,利用高通量测序技术,探讨局域尺度下麦田土壤细菌群落结构和群落构建过程,以及它们的影响因素,以期为阐释局域尺度下麦田土壤微生物多样性的形成机制提供理论基础。
1 材料与方法
1.1 研究区概况和样品采集
土壤样品于2021年4月在河南省济源市五龙口镇(112°42'26.97"E,35°09'56.03"N)和梨林镇(113°14'54.77"E,35°13'15.47"N)采集。该地属暖温带季风气候,年平均气温14.5 ℃,年平均降水量567.9 mm,土壤类型按地理发生分类为褐土。本研究取样工作在征得小麦种植户同意下进行,于小麦扬花期进行取样。扬花期是决定冬小麦产量的关键时期,小麦植株新陈代谢旺盛,土壤微生物活跃,土壤酶活性高。因此于扬花期在每个田块随机选取3个样方,采集0 ~ 20 cm非根际土壤样品。土壤样品带回实验室去除植物根、石子等杂质后,将3个样方土壤样品混合均匀后作为该田块土壤分析样本,保存于–20 ℃冰箱备用。表1为各田块样点位置信息,共20个样点,样点之间地理距离在124 ~ 9 282 m。
1.2 土壤理化性质分析
土壤全氮(TN)采用硫酸铜催化剂–浓H2SO4消煮,全磷(TP)采用H2SO4-HClO4消煮,铵态氮(NH4+-N)采用2 mol/L的KCl提取,消煮和提取液采用流动分析仪(AA3,SEAL)测定全氮、全磷和NH4+-N含量;有机质(SOM)含量采用重铬酸钾–外加热法测定;硝态氮(NO3–-N)含量采用0.01 mol/L的CaCl2提取,紫外可见分光光度计测定;有效磷(AP)含量采用0.5 mol/L的NaHCO3提取,钼蓝比色法测定;速效钾(AK)含量采用1 mol/L的NH4OAc浸提,火焰光度计法测定;土壤pH采用土水质量比1︰2.5浸提,pH计测定。将土壤样品在105 ℃下烘至恒重后通过称量烘干前后样品重量差计算土壤含水率(MC)。电导率(EC)采用0.01 mol/L的KCl浸提,电导率仪测定。土壤理化性质测定结果见表2。
1.3 DNA提取和测序
使用磁珠法对土壤样品基因组DNA进行提取,并将提取好的DNA于适当条件保存。利用引物扩增细菌16S rRNA基因V3 ~ V4区,引物序列为338F (5'-ACTCCTACGGGAGGCAGCA-3')和806R (5'-GG ACTACHVGGGTWTCTAAT-3')。PCR扩增反应体系为KOD FX Neo Buffer 5 μL,2 mmol/L dNTPs 2 μL,正向引物(10 μmol/L) 0.3 μL,反向引物(10 μmol/L) 0.3 μL,KOD FX Neo 0.2 μL,基因组DNA 5 ~ 50 ng,补ddH2O至10 μL。反应体系如下,95℃预变性5 min、95℃变性30 s、50℃退火30 s、72℃延伸40 s,25个循环后,72℃延伸7 min,4℃直到反应完成。获得PCR产物后,使用Monarch DNA凝胶回收试剂盒切胶纯化,用1.8% 琼脂糖凝胶电泳检测PCR产物纯化效果。纯化后的PCR产物使用Illumina NovaSeq 6000进行测序分析,该测序平台由北京百迈客生物科技有限公司提供。
1.4 微生物分子生态网络、群落构建分析
微生物生态网络构建:剔除OTU丰度低于0.1% 的低丰度类群,用R软件cor.test函数计算OTU之间的Spearman相关系数,Spearman相关系数和值阈值分别设定为0.7和0.05。采用中国科学院生态环境研究中心开发的生态网络在线分析平台iNAP进行网络分析(http://mem.rcees.ac.cn:8081),通过Gephi软件构建关系网络。网络中每一个节点代表一个OTU,各节点间的连接线代表各OTU之间的相关性。通过计算生态网络节点的模块内连通度()和模块间连通度(),识别关键物种。将网络节点划分为模块中心点(>2.5且<0.62)、连接节点(<2.5且>0.62)、网络中心点(>2.5且>0.62)以及外围节点(<2.5且<0.62)[24]。
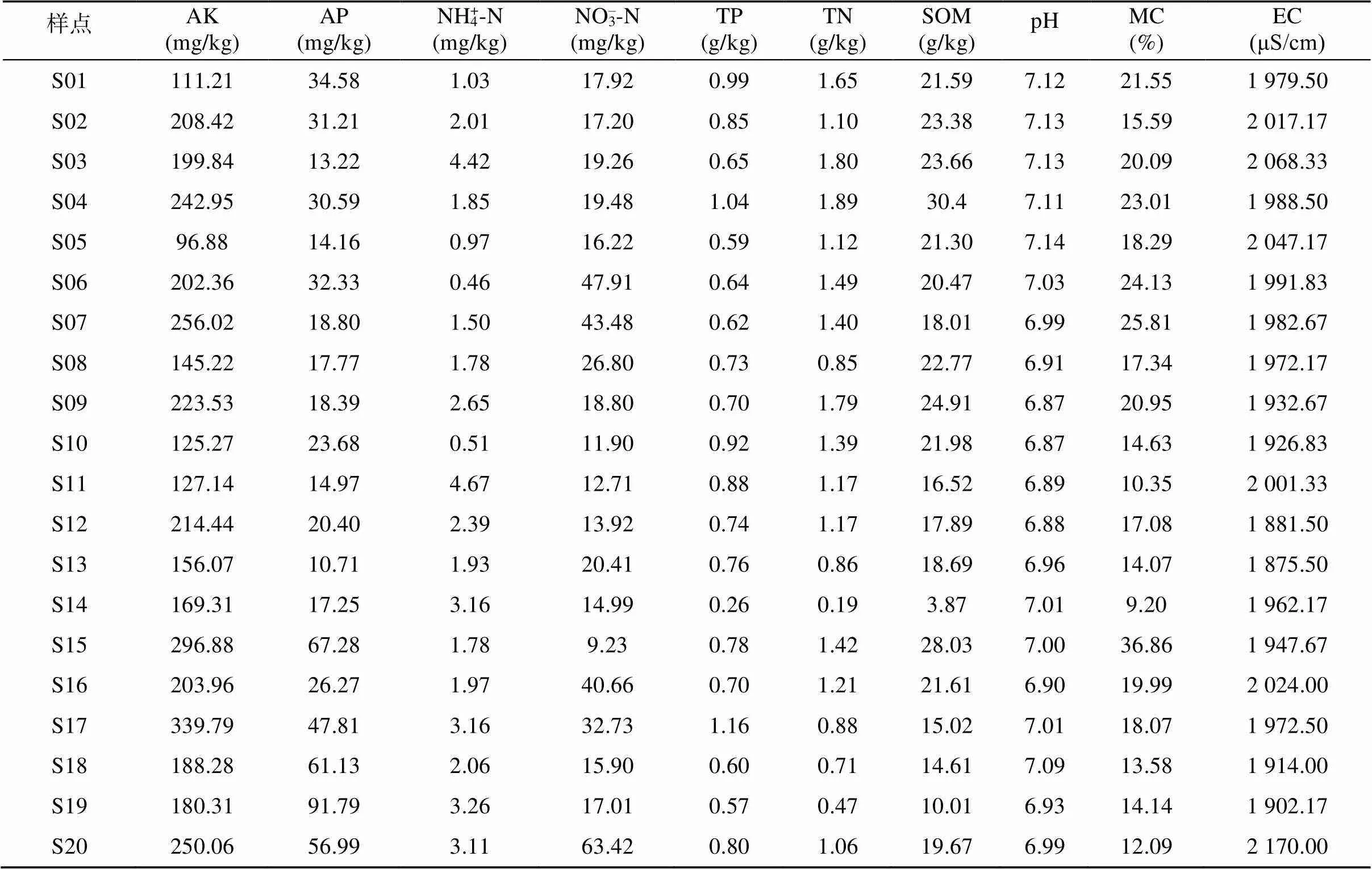
表2 各样点土壤理化性质
微生物群落建构过程:使用R软件“picante”包进行MNTD分析计算最近分类单元距离(MNTD)、最近分类单元指数(NTI)、平均最近物种距离(βMNTD)和最近物种指数(βNTI)。单个样本群落的系统发育用NTI来量化,NTI为零模型中观察到的MNTD与零分布均值的标准差(999个随机)。在所有的群落中获得的平均NTI与零值有显著差异,表示群落系统发育存在平均聚类(NTI>0)或过度分散(NTI<0)[25]。通过βMNTD和βNTI量化样品间的群落系统发育。βNTI是βMNTD的观测值和基于零模型计算的随机值(999个随机)之间的差。当βNTI<–2和βNTI>2时,分别表示群落构建受确定性过程的同质性选择过程和异质性选择过程控制;而|βNTI|<2表示群落构建受随机性过程控制[26]。用Raup-Crick矩阵(RCbray)区分不同随机性过程的相对贡献。RCbray<–0.95、|RCbray|<0.95以及RCbray>0.95分别表示均质扩散、生态漂变和扩散限制[3]。然后根据样品间的βNTI和RCbray值计算每个生态过程在所有样品群落构建中所占百分比。
1.5 统计分析
使用R软件“vegan”包中的vegdist函数计算不同样点细菌群落之间Bray-Curtis距离;使用pcoa函数基于Bray-Curtis距离对细菌群落进行主坐标分析(Principal Coordinate Analysis,PCoA),揭示样点间土壤细菌群落结构差异;使用rda函数对细菌群落结构和环境因子进行冗余分析(Redundancy Analysis,RDA);使用mantel函数进行曼特尔检验(Mantel test),计算群落相似性距离矩阵(Bray-Curtis distance)和环境变量距离矩阵之间的相关性。同时使用mantel函数进行地理距离(通过地理坐标计算)和样点之间的细菌群落相似性(Bray-Curtis距离)衰减曲线计算[27],明确群落相似性随地理距离的变化规律。使用R软件cor函数计算NTI值以及|βNTI|值与环境因子的相关性。使用mantel函数计算βNTI值与环境因子之间的相关性。
2 结果
2.1 土壤细菌群落组成
图1A结果表明,酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、Rokubacteria、硝化螺旋菌门(Nitrospirae)和浮霉菌门(Planctomycetes)为土壤细菌群落的主要菌门,其中酸杆菌门和变形菌门为第一、第二优势门,相对丰度分别达到21.89% ~ 43.82%、24.12% ~ 34.91%。通过主坐标分析发现各样点间土壤细菌群落结构存在差异(图1B)。

图1 土壤细菌门水平相对丰度(A)及主坐标分析(B)
2.2 土壤细菌群落结构的影响因素
图2冗余分析结果显示,第一轴(RDA1)和第二轴(RDA2)分别解释了土壤细菌群落总变异的36.45% 和18.03%,两者共解释了总变异的54.48%,其中有机质含量、全氮含量、含水率、pH对细菌群落结构具有极显著影响(<0.01)。另外,曼特尔检验发现(表3),细菌群落相似性(Bray-Curtis距离)与有机质、全氮、全磷、有效磷含量呈显著正相关(<0.05)。综合冗余分析以及曼特尔检验结果,表明有机质、全氮含量是影响土壤细菌群落结构的关键因素,其中有机质含量的影响最大。

(**、***分别表示P<0.01和P<0.001显著水平)
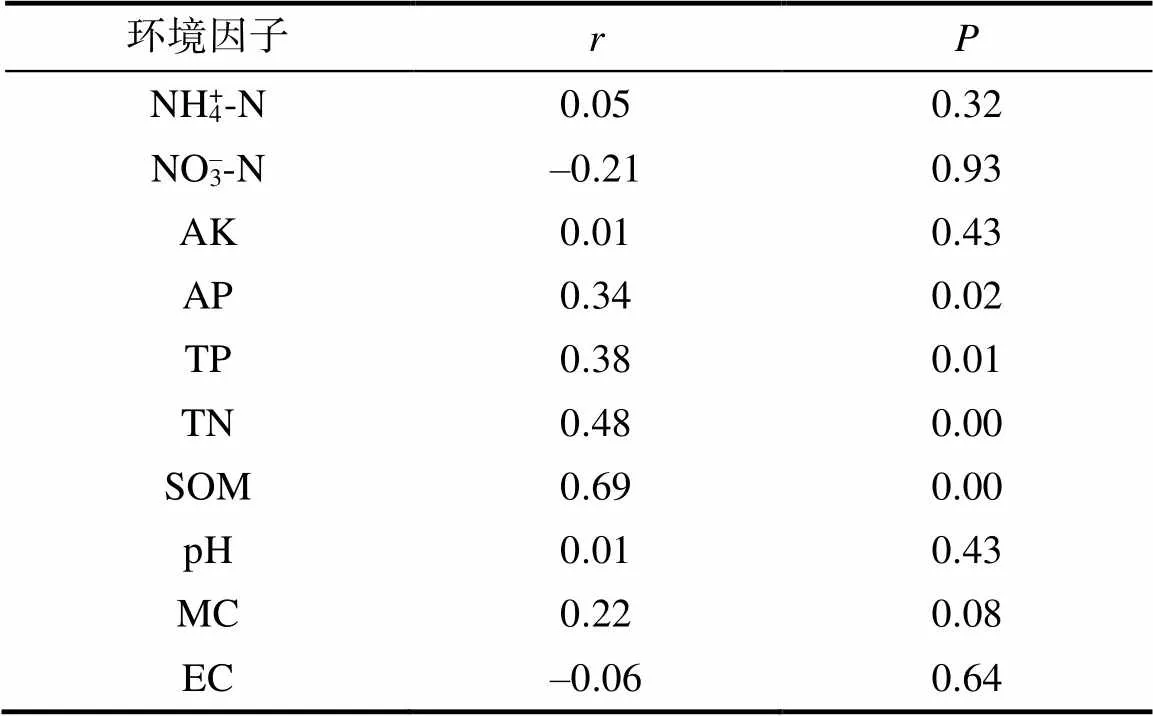
表3 细菌群落结构与环境因子的曼特尔检验
2.3 土壤细菌生态网络特征
基于16S rRNA基因分类单元(OTUs)构建分子生态网络,如图3A所示,本研究土壤细菌生态网络包含176个节点和615条边,其中正向关联网络有458条(74.47%),负向关联网络有157条(25.53%),表明整体上不同细菌类群之间共存作用大于排斥作用[28]。共线性网络中存在5个模块,网络的拓扑结构参数为:平均度9.38,平均路径长度2.57,网络直径6,平均聚类系数0.46,模块化指数0.39。网络节点拓扑性质分析结果表明(图3B),在整个网络结构中没有网络中心点;具有1个模块中心点,来自拟杆菌门(Bacteroidetes);两个连接节点,来自酸杆菌门和变形菌门。
2.4 细菌群落构建过程及驱动因素
系统发育可通过共存物种之间的进化关系来探索群落构建机制[29]。本研究发现所有样点的细菌群落平均NTI与零值都存在显著差异(<0.05),且平均NTI都大于0,表明各样点内细菌群落系统发育结构聚集[25]。通过对NTI值与环境因子进行相关性分析(图4A和4B),发现NTI值与土壤有机质含量呈显著正相关(<0.05),与有效磷含量呈显著负相关(<0.05),说明土壤有机质、有效磷含量影响细菌群落系统发育。通过计算样点之间细菌群落的βNTI值(图5A),发现|βNTI|大多大于2,说明确定性过程在局域尺度农户麦田土壤细菌群落构建中占主导地位,确定性过程和随机性过程在群落构建中的贡献率分别为74.59% 和25.41%。具体到单一生态过程,确定性过程中同质性选择和异质性选择分别贡献了36.47% 和38.12%,随机性过程中均质扩散和生态漂变分别贡献了24.86% 和0.55%(图5B)。
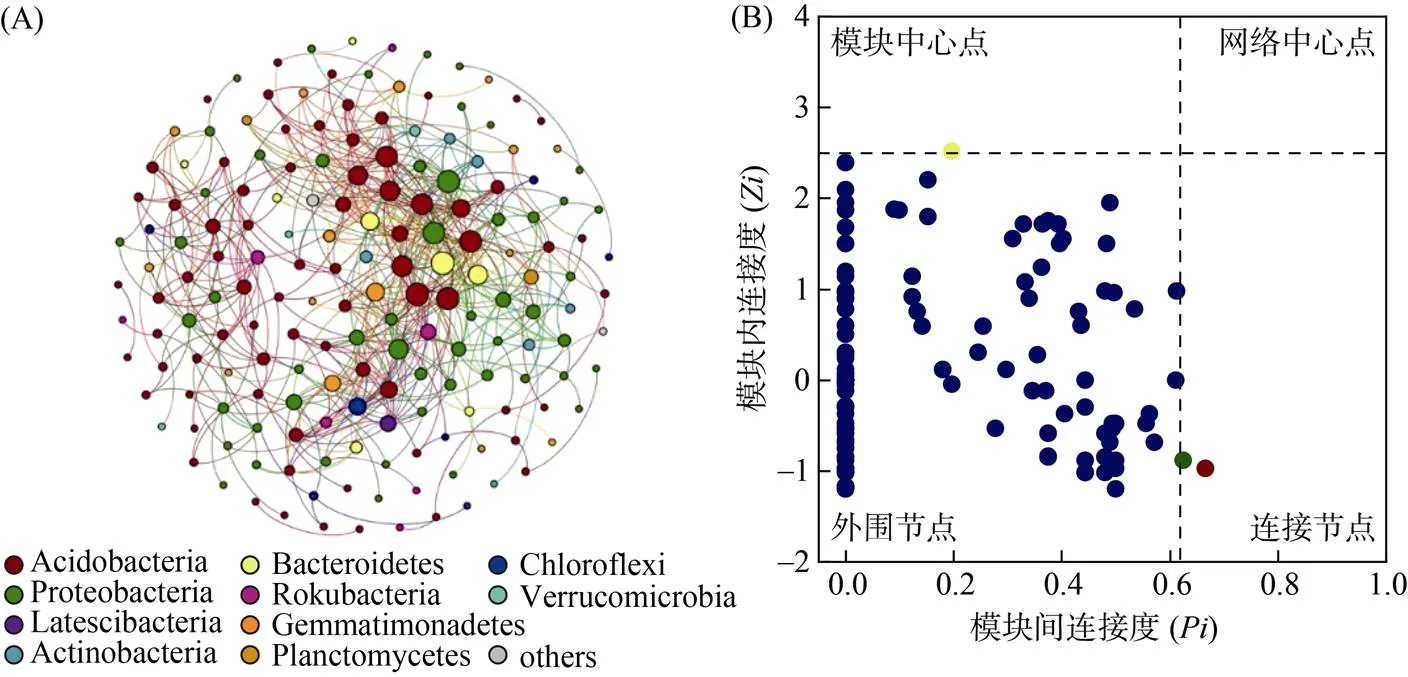
(只有Spearman相关系数r>0.7、P<0.05或r<−0.7、P<0.05的边被展示。节点代表单个OTUs,边代表显著的Spearman相关。以细菌门水平对节点进行着色。节点大小与物种相对丰度成正比)

图4 NTI、|βNTI|与环境因子的相关性分析
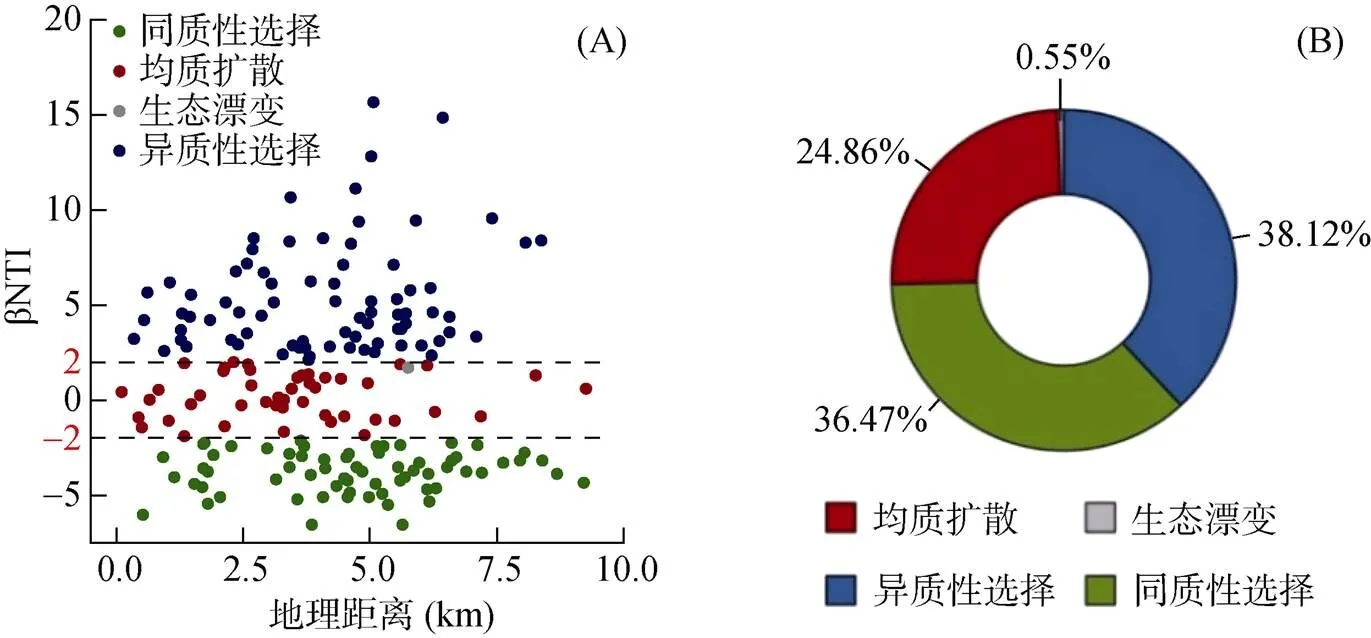
图5 土壤细菌群落构建过程(A)以及各过程贡献率(B)
图4C表明,|βNTI|与有机质含量呈显著负相关(<0.05),说明土壤有机质含量越高,细菌群落构建越趋向于随机性过程。图6发现βNTI值与有机质、全氮、全磷含量变化呈显著正相关(<0.05),其中有机质含量和βNTI的相关性最强。有机质、全氮含量差异的增大导致细菌群落从同质性选择向随机性过程(均质扩散主导)再向异质性选择过程的转变(βNTI值变化趋势为:<–2到–2 ~ 2到>2)。全磷含量差异的增大导致了细菌群落从随机性过程(均质扩散主导)到异质性选择过程的转变(βNTI值变化趋势为:–2 ~ 2到>2)。
3 讨论
3.1 土壤细菌群落结构及其影响因素
本研究发现酸杆菌门和变形菌门在土壤细菌群落中占主导地位,与陈重军等[30]研究结果一致。土壤微生物群落结构受到与微生物生长有关的土壤养分的影响[31],本研究发现有机质、全氮含量是影响土壤细菌群落结构的重要因素,与Tian等[10]和刘文静等[32]研究结果类似。由于大多数土壤细菌依靠有机物质分解获取营养和能量[10],在适当的碳氮化学计量比下快速生长繁殖[33],因此土壤碳和氮对细菌群落形成十分重要[34]。此外,地理距离对土壤微生物群落结构也存在影响,即存在距离衰减模式(微生物群落相似性随着地理距离的增加而减小)[35]。Zhao等[36]发现水稻土壤真菌群落在3.4 ~ 39 km内具有显著的距离衰减分布格局。Gao等[37]研究表明长江流域稻田土壤细菌群落在局部尺度上(1 ~ 113 m)存在显著的距离衰减关系,在中尺度上(3.4 ~ 39 km)不显著。本研究观察到样点之间细菌群落不存在显著的距离衰减关系(图7),可能是由于旱地生态系统频繁的施肥、翻耕等导致麦田土壤环境相对均匀;而且由于各样点地理距离较近,农户的管理措施等整体上差异不大,也可能造成土壤环境相对均匀,进而减弱距离衰减效应。

图6 βNTI值与有机质(A)、全氮(B)、全磷(C)含量变化的关系
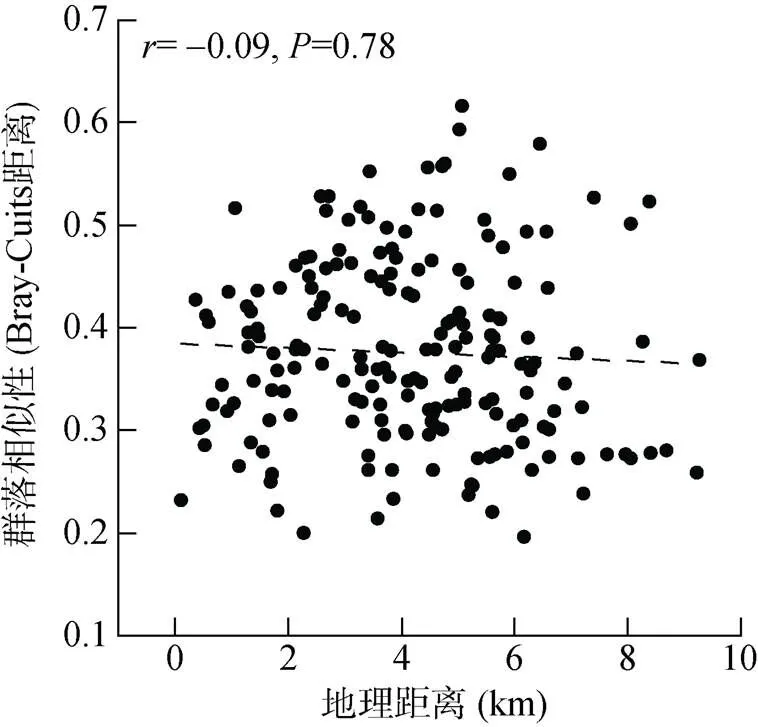
图7 细菌群落的距离衰减分布格局
3.2 细菌共生网络
分子生态网络可以解释细菌群落之间复杂的相互作用。本研究发现生态网络中不同细菌类群之间的共存作用大于排斥作用,可能是由于资源丰富,细菌群落之间竞争较少,导致细菌群落之间具有较高的协同性[29]。关键物种是微生物群落中高度连接的类群,它们的消失会引起微生物群落组成和功能发生剧烈变化[38],而且关键物种也是群落结构的重要驱动因素[39]。本研究通过网络节点拓扑分析发现关键物种来源于拟杆菌门、酸杆菌门和变形菌门,它们可能在维持细菌群落结构与功能方面发挥重要作用。拟杆菌门可降解高分子有机化合物,如蛋白质和碳水化合物[40];酸杆菌门可以降解多糖,具有光合能力[41],在土壤碳循环和铁循环中发挥重要作用[42];变形菌门可以分解有机物质,促进土壤碳、氮循环[43]。这些证明本研究发现的关键物种可能与农田生态系统的碳、氮循环等密切相关。
3.3 麦田土壤细菌群落构建
本研究通过零模型发现确定性过程在局域尺度麦田土壤细菌群落构建中占主导作用。Green等[44]研究表明,环境选择是小空间尺度(1 ~ 10 km)微生物地理分布格局的重要驱动因素。刘文静等[32]发现旱作生态系统中(果树种植)确定性过程主导土壤细菌群落构建;Feng等[45]发现确定性过程驱动连续施肥20 a的玉米田土壤细菌群落构建,这些研究都证明了确定性过程在农田生态系统细菌群落构建中的重要性。由于在农田生态系统中,频繁的人为干扰(如施肥、灌溉等)使土壤理化性质发生变化[45],环境过滤作用选择谱系关系很近或者功能性状相似的物种共存,导致物种系统发育结构聚集[46],这些在一定程度上解释了确定性过程对农田土壤细菌群落构建的主导作用。但是,Feng等[47]发现局域尺度下(10 km内)均质扩散在东北玉米田细菌群落构建中占主导地位,可能是由于东北地区人均耕地面积大[48],较近样点的土壤环境相似性高,土壤微生物扩散速率高,导致均质扩散过程控制细菌群落构建。此外,本研究中异质性选择(38.12%)、同质性选择(36.46%)和均质扩散(24.86%)都对群落构建具有较高的贡献。刘文静等[32]的旱作生态系统土壤样品采集于同一片果园,土壤环境具有同质性,同质性选择主导群落构建;Feng等[45]田间试验的各个处理内由于施肥方式相同导致土壤环境同质,同质性选择控制群落构建。本研究采集的样品来自农户农田土壤,各个农户的田间管理措施存在差异,差异程度的大小可能影响土壤环境的差异进而影响群落构建。管理措施差异较大可能导致土壤环境差异大进而群落构建受异质性选择控制;差异较小可能导致土壤环境相似,同质性选择和均质扩散过程控制群落构建。另外,确定性过程和随机性过程在麦田土壤细菌群落构建中共同发挥作用。确定性过程可以强化土壤微生物的特定功能,随机性过程可以使微生物对于环境剧烈变化带来的扰动有一定缓冲作用[32]。
3.4 土壤细菌群落构建关键驱动因子
本研究发现NTI值与有机质、有效磷含量呈显著相关,表明环境过滤影响细菌群落系统发育聚集[26]。此外,|βNTI|与有机质含量呈显著负相关,说明土壤有机质含量越高,群落构建越趋向于随机性过程,这个结果验证了Feng等[49]提出的概念模型。造成此结果的原因可能是当土壤有机质资源丰富时,微生物可利用的养分增加,使其摆脱资源限制,提高了微生物的分散能力,导致随机性过程增加[49]。本研究还发现有机质、全氮、全磷含量对βNTI值存在显著影响。Dini-Andreotea等[9]和Feng等[49]也证明了有机质对土壤微生物群落构建的重要性,但其潜在机制尚不清楚,有研究推测可能与有机质的组成有关[9]。有机质组成复杂(包含木质素、纤维素、腐殖酸等),其分解会影响有机质组分的变化导致土壤环境的变化[50],进而影响土壤微生物。Feng等[49]还发现全氮、全磷在微生物群落构建过程中扮演着重要角色;Peng等[51]发现全磷介导了土壤丰富和稀有细菌随机和确定性过程之间的平衡。已有研究表明全氮、全磷与有机质密切相关[51],但全氮、全磷对微生物群落构建影响的潜在机制需进一步研究。另外,同质性选择源于环境同质性,均质扩散源于高扩散率,两者都会导致微生物群落结构趋同;异质性选择源于环境异质性,导致群落结构高度变异[9, 52]。本研究表明当有机质、全氮、全磷含量差异较小时,土壤环境趋同,同质性选择以及均质扩散过程主导细菌群落构建,细菌群落结构相似;当有机质、全氮、全磷含量差异较大时,土壤环境趋异,异质性选择过程主导,资源含量的差异造成了微生物的差异,群落差异性增加。本研究结果说明有机质、全氮、全磷含量的差异会影响细菌群落构建过程中随机性和确定性过程的相对贡献,控制随机性–确定性过程的平衡。
4 结论
麦田土壤细菌群落中优势菌门为酸杆菌门和变形菌门。关键物种来源于拟杆菌门、酸杆菌门和变形菌门,它们可能与农田生态系统的碳、氮循环等密切相关。通过零模型计算发现确定性过程在局域尺度麦田土壤细菌群落构建中占主导地位。土壤有机质、全氮、全磷含量是细菌群落构建的关键影响因素,控制着随机性过程–确定性过程的平衡。土壤有机质和全氮含量还对土壤细菌群落结构具有显著影响。本研究有利于对局域尺度下麦田生态系统土壤微生物多样性形成机制的认识。
[1] Delgado-Baquerizo M, Bardgett R D, Vitousek P M, et al. Changes in belowground biodiversity during ecosystem development[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(14): 6891–6896.
[2] 马转转, 乔沙沙, 曹苗文, 等. 环境选择和扩散限制驱动温带森林土壤细菌群落的构建[J]. 应用生态学报, 2018, 29(4): 1179–1189.
[3] Stegen J C, Lin X J, Fredrickson J K, et al. Quantifying community assembly processes and identifying features that impose them[J]. The ISME Journal, 2013, 7(11): 2069–2079.
[4] Chesson P. Mechanisms of maintenance of species diversity[J]. Annual Review of Ecology and Systematics, 2000, 31: 343–366.
[5] Fargione J, Brown C S, Tilman D. Community assembly and invasion: An experimental test of neutral versus niche processes[J]. PNAS, 2003, 100(15): 8916–8920.
[6] Chave J. Neutral theory and community ecology[J]. Ecology Letters, 2004, 7(3): 241–253.
[7] Chase J M, Myers J A. Disentangling the importance of ecological niches from stochastic processes across scales[J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2011, 366(1576): 2351–2363.
[8] 赵鹏宇. 山西亚高山华北落叶松林土壤微生物群落构建机制[D]. 太原: 山西大学, 2019.
[9] Dini-Andreote F, Stegen J C, van Elsas J D, et al. Disentangling mechanisms that mediate the balance between stochastic and deterministic processes in microbial succession[J]. PNAS, 2015, 112(11): E1326–E1332.
[10] Tian J, He N P, Hale L, et al. Soil organic matter availability and climate drive latitudinal patterns in bacterial diversity from tropical to cold temperate forests[J]. Functional Ecology, 2018, 32(1): 61–70.
[11] 王好才, 夏敏, 刘圣恩, 等. 若尔盖高原泥炭沼泽湿地土壤细菌群落空间分布及其驱动机制[J]. 生态学报, 2021, 41(7): 2663–2675.
[12] 白承荣. 长江中下游湖泊浮游细菌群落结构的空间差异及影响因素[D]. 北京: 中国科学院大学, 2020.
[13] 涂波. 中国草原不同空间尺度土壤微生物的群落构建及驱动因子[D]. 北京: 中国科学院大学, 2017.
[14] Shi Y, Li Y T, Xiang X J, et al. Spatial scale affects the relative role of stochasticity versus determinism in soil bacterial communities in wheat fields across the North China Plain[J]. Microbiome, 2018, 6(1): 27.
[15] Jiao S, Yang Y F, Xu Y Q, et al. Balance between community assembly processes mediates species coexistence in agricultural soil microbiomes across Eastern China[J]. The ISME Journal, 2020, 14(1): 202–216.
[16] 李浩然, 李雁鸣, 李瑞奇. 灌溉和施氮对小麦产量形成及土壤肥力影响的研究进展[J]. 麦类作物学报, 2022, 42(2): 196–210.
[17] Kennedy A C. Bacterial diversity in agroecosystems[J]. Agriculture, Ecosystems & Environment, 1999, 74(1/2/3): 65–76.
[18] Fan K K, Cardona C, Li Y T, et al. Rhizosphere-associated bacterial network structure and spatial distribution differ significantly from bulk soil in wheat crop fields[J]. Soil Biology and Biochemistry, 2017, 113: 275–284.
[19] Liu W B, Ling N, Guo J J, et al. Legacy effects of 8-year nitrogen inputs on bacterial assemblage in wheat rhizosphere[J]. Biology and Fertility of Soils, 2020, 56(5): 583–596.
[20] 贺纪正, 王军涛. 土壤微生物群落构建理论与时空演变特征[J]. 生态学报, 2015, 35(20): 6575–6583.
[21] Zeng Q C, An S S, Liu Y, et al. Biogeography and the driving factors affecting forest soil bacteria in an arid area[J]. The Science of the Total Environment, 2019, 680: 124–131.
[22] Malard L A, Anwar M Z, Jacobsen C S, et al. Influence of spatial scale on structure of soil bacterial communities across an Arctic landscape[J]. Applied and Environmental Microbiology, 2021, 87(5): e2220.
[23] Tripathi B M, Stegen J C, Kim M, et al. Soil pH mediates the balance between stochastic and deterministic assembly of bacteria[J]. The ISME Journal, 2018, 12(4): 1072–1083.
[24] Liu C, Cui Y M, Li X Z, et al. Microeco: An R package for data mining in microbial community ecology[J]. FEMS Microbiology Ecology, 2021, 97(2): fiaa255.
[25] Kembel S W, Eisen J A, Pollard K S, et al. The phylogenetic diversity of metagenomes[J]. PLoS One, 2011, 6(8): e23214.
[26] Stegen J C, Lin X J, Konopka A E, et al. Stochastic and deterministic assembly processes in subsurface microbial communities[J]. The ISME Journal, 2012, 6(9): 1653–1664.
[27] Nekola J C, White P S. The distance decay of similarity in biogeography and ecology[J]. Journal of Biogeography, 1999, 26(4): 867–878.
[28] Faust K, Raes J. Microbial interactions: From networks to models[J]. Nature Reviews Microbiology, 2012, 10(8): 538–550.
[29] Coyle J R, Halliday F W, Lopez B E, et al. Using trait and phylogenetic diversity to evaluate the generality of the stress-dominance hypothesis in eastern North American tree communities[J]. Ecography, 2014, 37(9): 814–826.
[30] 陈重军, 凌学林, 邢龙, 等. 减肥条件下生物质炭施用对水稻田土壤细菌多样性的影响[J]. 农业资源与环境学报, 2021, 38(3): 385–392.
[31] 赵帆, 赵密珍, 王钰, 等. 基于高通量测序研究草莓根际微生物群落结构和多样性[J]. 土壤, 2019, 51(1): 51–60.
[32] 刘文静, 张建伟, 邱崇文, 等. 水旱轮作对土壤微生物群落构建过程的影响机制[J]. 土壤, 2020, 52(4): 710–717.
[33] Li F, Chen L, Zhang J B, et al. Bacterial community structure after long-term organic and inorganic fertilization reveals important associations between soil nutrients and specific taxa involved in nutrient transformations[J]. Frontiers in Microbiology, 2017, 8: 187.
[34] Zhao F Z, Bai L, Wang J Y, et al. Change in soil bacterial community during secondary succession depend on plant and soil characteristics[J]. CATENA, 2019, 173: 246–252.
[35] Chu H Y, Sun H B, Tripathi B M, et al. Bacterial community dissimilarity between the surface and subsurface soils equals horizontal differences over several kilometers in the western Tibetan Plateau[J]. Environmental Microbiology, 2016, 18(5): 1523–1533.
[36] Zhao J S, Gao Q, Zhou J Z, et al. The scale dependence of fungal community distribution in paddy soil driven by stochastic and deterministic processes[J]. Fungal Ecology, 2019, 42: 100856.
[37] Gao Q, Yang Y F, Feng J J, et al. The spatial scale dependence of diazotrophic and bacterial community assembly in paddy soil[J]. Global Ecology and Biogeography, 2019, 28(8): 1093–1105.
[38] 马泊泊, 黄瑞林, 张娜, 等. 秸秆生物质炭对根际土壤细菌-真菌群落分子生态网络的影响[J]. 土壤学报, 2019, 56(4): 964–974.
[39] Banerjee S, Schlaeppi K, van der Heijden M G A. Keystone taxa as drivers of microbiome structure and functioning[J]. Nature Reviews Microbiology, 2018, 16(9): 567–576.
[40] Yuan Z S, Liu F, Liu Z Y, et al. Structural variability and differentiation of niches in the rhizosphere and endosphere bacterial microbiome of moso bamboo ()[J]. Scientific Reports, 2021, 11(1): 1574.
[41] 王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14–20.
[42] Gao X N, Wu Z L, Liu R, et al. Rhizosphere bacterial community characteristics over different years of sugarcane ratooning in consecutive monoculture[J]. BioMed Research International, 2019, 2019: 4943150.
[43] 徐扬, 张冠初, 丁红, 等. 土壤类型对花生根际土壤细菌群落多样性和产量的影响[J]. 生物技术通报, 2022, 38(6): 221–234.
[44] Green J L, Holmes A J, Westoby M, et al. Spatial scaling of microbial eukaryote diversity[J]. Nature, 2004, 432(7018): 747–750.
[45] Feng Y Z, Guo Z Y, Zhong L H, et al. Balanced fertilization decreases environmental filtering on soil bacterial community assemblage in North China[J]. Frontiers in Microbiology, 2017, 8: 2376.
[46] Zhao Y H, Dunn R R, Zhou H N, et al. Island area, not isolation, drives taxonomic, phylogenetic and functional diversity of ants on land-bridge islands[J]. Journal of Biogeography, 2020, 47(8): 1627–1637.
[47] Feng M M, Tripathi B M, Shi Y, et al. Interpreting distance-decay pattern of soil bacteria via quantifying the assembly processes at multiple spatial scales[J]. MicrobiologyOpen, 2019, 8(9): e00851.
[48] 东北地区现代农业发展态势与对策[C]//中国地理学会2007年学术年会论文摘要集. 南京, 2007: 213.
[49] Feng Y Z, Chen R R, Stegen J C, et al. Two key features influencing community assembly processes at regional scale: Initial state and degree of change in environmental conditions[J]. Molecular Ecology, 2018, 27(24): 5238–5251.
[50] Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60–68.
[51] Peng Z H, Wang Z F, Liu Y, et al. Soil phosphorus determines the distinct assembly strategies for abundant and rare bacterial communities during successional reforestation[J]. Soil Ecology Letters, 2021, 3(4): 342–355.
[52] Zhou J Z, Ning D L. Stochastic community assembly: Does it matter in microbial ecology?[J]. Microbiology and Molecular Biology Reviews: MMBR, 2017, 81(4): e2–e17.
Soil Microbial Community Construction Processes and Its Driving Factors in Wheat Field at Local-scale
CHEN Xianni, MI Qian, XU Xiaofeng*
(College of Agriculture, Henan University of Science and Technology, Luoyang, Henan 471000, China)
In order to explore soil microbial community construction processes in wheat field at local-scale, soil samples were collected from wheat fields in Jiyuan City, Henan Province, and high-throughput sequencing technology was used to study soil bacterial community structure, community construction process and its influencing factors. The results showed that: 1) The dominant phyla were Acidobacteria and Proteobacteria in soil bacterial community. Mantel test and redundancy analysis found that organic matter and total nitrogen had significant effects on bacterial community structure (<0.05). 2) The different bacterial groups in the bacterial molecular ecological network were dominated by cooperative relationship. The key species were from Bacteroidetes, Acidobacteria and Proteobacteria. 3) Bacterial communities were clustered phylogenetically, and organic matter and available phosphorus had significant effects on bacterial community phylogeny (<0.05). 4) The contribution rates of deterministic process and stochastic process in bacterial community construction were 74.59% and 25.41%, respectively. 5) Mantel test found that the βNTI value was significantly positively correlated with the changes of organic matter, total nitrogen and total phosphorus contents (<0.05). The increases in the differences of organic matter, total nitrogen and total phosphorus contents led to the transformation of bacterial communities from homogeneous selection and homogeneous diffusion to heterogeneous selection. Conclusively, this study found that deterministic processes dominated the construction of soil bacterial communities in local-scale wheat fields, and organic matter, total nitrogen and total phosphorus were the key environmental factors affecting bacterial community construction. Organic matter and total nitrogen also had significant effects on bacterial community structure. This study contributes to the understanding of the formation mechanism of soil microbial diversity in wheat field ecosystems at the local scale.
Wheat; Soil bacteria; Community construction processes; Community structure; Influencing factors
S154.3
A
10.13758/j.cnki.tr.2023.04.015
陈鲜妮, 米倩, 徐晓峰. 局域尺度麦田土壤微生物群落构建过程及其驱动因素. 土壤, 2023, 55(4): 812–820.
国家重点研发计划项目(2017YFD0201700)资助。
(Xiaofnong07@haust.edu.cn)
陈鲜妮(1986—),女,博士,讲师,主要从事土壤肥力与养分循环相关研究。E-mail: xnchen0701@126.com

