瑞芬太尼通过上调lncRNA DGCR5表达影响卵巢癌细胞增殖和转移的机制研究
邱卫华, 郭晴晴, 罗建喜
(1. 湖北省武汉市新洲区人民医院 麻醉科, 湖北 武汉, 430400;2. 湖北省武汉市第四医院 疼痛科, 湖北 武汉, 430033)
在所有妇科癌症中,恶性卵巢肿瘤的致死率最高[1]。晚期卵巢癌的一线化疗药物是顺铂,但耐药性会导致顺铂和许多其他化疗药物的有效性显著降低[2]。瑞芬太尼是一种作用于阿片类药物受体的合成阿片类药物,具有起效和抵消时间短的特点[3]。瑞芬太尼在全身麻醉和镇静期间广泛用作辅助镇痛药[4]。既往研究[5]报告了瑞芬太尼对肿瘤细胞的作用,例如瑞芬太尼以剂量依赖的方式减轻肺癌A549细胞增殖,加速其凋亡。瑞芬太尼可抑制胃癌细胞的生长,机制与上调微小RNA-206(miRNA-206)靶向高尔基磷蛋白3(GOLPH3)有关[6]。但是,瑞芬太尼对卵巢癌细胞恶性生物行为的影响与机制尚未见报道。长链非编码RNA(lncRNA)是长度大于200个核苷酸的RNA转录物,无蛋白质编码能力[7-8], 被确定为癌症生物学的关键参与者[9]。lncRNA DiGeorge综合征关键区域基因5(DGCR5)与多种类型的癌症有关,在卵巢癌中表达下调,其低表达与卵巢癌患者的肿瘤直径大、淋巴结转移多、临床分期晚和总生存期短有关,可能是预测卵巢癌患者临床进展和预后的新的生物标记物[10]。异丙酚通过提高lncRNA DGCR5对肝癌细胞发挥抗癌活性[11]。然而, lncRNA DGCR5是否介导瑞芬太尼调节卵巢癌细胞功能的过程尚不清楚。本研究探讨瑞芬太尼对卵巢癌细胞SKOV3、OVCAR3细胞增殖、迁移、侵袭和凋亡的影响,通过分析lncRNA DGCR5的表达来研究瑞芬太尼影响卵巢癌发生发展的分子机制,现将结果报告如下。
1 材料与方法
1.1 一般材料
卵巢癌细胞SKOV3、OVCAR3(美国典藏培养物保存中心),瑞芬太尼(宜昌人福药业),小干扰RNA(siRNA)阴性对照(si-NC)、lncRNA DGCR5 siRNA(si-lncRNA DGCR5)(上海Gene Pharma), 细胞计数试剂盒8(CCK-8, 目录号KGA317)、蛋白酶抑制剂(目录号KGP603)、磷酸酶抑制剂(KGP602)、全细胞裂解测定缓冲液(KGP250)(江苏KeyGen BioTECH), 8 μm Transwell 小室(目录351158, 美国Corning), PrimeScript RT试剂盒(日本TaKaRa), Taq qPCR Master Mix(美国Promega)。
1.2 方法
1.2.1 细胞培养与分组处理: 将SKOV3、OVCAR3细胞置于含有10%胎牛血清的RPMI-1640培养基中,在37 ℃、5% CO2的环境中培养。分别将细胞SKOV3、OVCAR3分为0、0.5、5.0、50.0、500.0 ng/mL瑞芬太尼组、si-NC组、si-lncRNA DGCR5组、si-NC+500 ng/mL瑞芬太尼组、si-lncRNA DGCR5+500 ng/mL瑞芬太尼组。其中,不同浓度瑞芬太尼组以终浓度为0、0.5、5.0、50.0、500.0 ng/mL瑞芬太尼[12]的培养基分别作用于细胞SKOV3、OVCAR3 48 h。lncRNA DGCR5低表达时,根据商购Lipofectamine 2000转染试剂的操作说明,在融合率为60%~70%的SKOV3、OVCAR3细胞中分别转染si-NC、si-lncRNA DGCR5(5′-GACATCACACAAATATGCAAGAGAA-3′), 5~6 h后,转染基质替换为新鲜培养基或终浓度为500 ng/mL瑞芬太尼的培养基,并保持48 h。
1.2.2 CCK-8法检测细胞增殖: 根据制造商的说明,将2×104个卵巢癌SKOV3、OVCAR3细胞接种在装有100 μL培养基的96孔板中, 24 h后参照1.2.1标题中的分组,与终浓度为0、0.5、5.0、50.0、500.0 ng/mL瑞芬太尼的培养基或终浓度为75.0 μmol/L顺铂(阳性对照)的培养基一起培养,或进行细胞转染。48 h后,与CCK-8试剂孵育2 h后,使用BioTek酶标仪在450 nm处测量吸光度(A)值(A450)来评估2种细胞的增殖活性。
1.2.3 流式细胞仪检测细胞凋亡: 收集SKOV3、OVCAR3细胞,在黑暗中于37 ℃孵育膜联蛋白V(Annexin V)-FITC和碘化丙啶(PI), 孵育15 min, 通过Becton-Dickinson流式细胞仪定量凋亡细胞。
1.2.4 Transwell法检测细胞迁移和侵袭: 为了进行2种细胞迁移和侵袭分析,将不含血清的150 μL RPMI-1640培养基中的1×105个卵巢癌SKOV3、OVCAR3细胞分别培养于24孔板上的8 μm Transwell上部隔室中,上部隔室带有基质胶(侵袭)或不带有基质胶(迁移)。诱导2种细胞通过膜主动侵袭或迁移到含有10%胎牛血清的600 μL RPMI-1640培养基的下部隔室中。37 ℃孵育48 h后,轻轻去除残留在Transwell上部的细胞。固定后使用结晶紫将附着在膜下表面的SKOV3、OVCAR3细胞染色。在倒置显微镜下以200倍放大率拍摄侵袭或迁移的细胞,并在5个随机选择的区域中计算侵袭或迁移细胞的数量。
1.2.5 免疫印迹试验(Western blot)检测蛋白表达: 来自2种细胞的总蛋白在含有蛋白酶抑制剂和磷酸酶抑制剂的全细胞裂解测定缓冲液中裂解。通过Bio-Rad蛋白质测定试剂盒检测蛋白浓度。将每个样品30 μg蛋白溶解在10% SDS-PAGE凝胶上,电泳分离并转移到PVDF膜上。在室温下,用脱脂奶粉在缓冲液中封闭PVDF膜60 min, 并在4 ℃与下述一抗孵育过夜: 细胞周期蛋白D1(CyclinD1)兔多克隆抗体、基质金属蛋白酶(MMP)2兔多克隆抗体、MMP9兔多克隆抗体(1∶1 000, 美国Proteintech), 活化的天冬氨酸特异性半胱氨酸蛋白酶-3(Cleaved-caspase-3)兔多克隆抗体(1∶500, 美国abcam)。与辣根过氧化物酶偶联的二抗温育60 min, 使用ECL试剂检测免疫反应蛋白,并通过Syngene Bio Imaging进行可视化。以β-肌动蛋白(β-Actin)为对照,使用Quantity One软件定量蛋白水平。
1.2.6 RNA提取和定量逆转录聚合酶链反应(qRT-PCR)检测lncRNA DGCR5表达[9]: 按照Invitrogen制造商的说明,使用TRIzol试剂从SKOV3、OVCAR3细胞中提取总RNA, NanoDrop 2000c分光光度计测量提取的RNA的浓度。确定提取的RNA仅在A260/A280比率为1.8~2.1时使用。此后,将RNA储存在-80 ℃进行进一步实验。在PrimeScript RT试剂盒的标准规程下,使用随机引物将总RNA(1 μg)反转录为互补DNA。在下述PCR条件下,通过ABI Prism 7300序列检测系统在Taq qPCR Master Mix上进行qRT-PCR反应扩增lncRNA DGCR5: 95 ℃ 20 min, 95 ℃ 10 s, 随后进行40个循环,分别为98 ℃ 30 s, 55 ℃ 30 s和72 ℃ 30 s。lncRNA DGCR5和甘油醛-3-磷酸脱氢酶(GAPDH)的引物如下: lncRNA DGCR5正向引物为5′-CCAAGCCTGTCTGTGTGTGTGTTC-3′,反向引物为5′-GGGAGACACAGACCACAAGA-3′;GAPDH正向引物为5′-ACCCACTCCTCCACCTTTGAC-3′, 反向引物为5′-TGTTGCTGTAGCCAAATTCGTT-3′。lncRNA DGCR5的相对表达通过2-△△Ct公式计算,被标准化为内源基因GAPDH。
1.3 统计学方法
采用SPSS 22.0软件进行统计与分析,结果表示为平均值±标准差。多组数据间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.01定义为差异有统计学意义。
2 结 果
2.1 不同浓度瑞芬太尼对卵巢癌细胞增殖的抑制作用
CCK-8法结果显示,与0 ng/mL瑞芬太尼组比较, 0.5、5.0、50.0、500.0 ng/mL瑞芬太尼组或顺铂作用于卵巢癌细胞SKOV3、OVCAR3后,细胞的增殖活性依次降低,并以500.0 ng/mL瑞芬太尼组增殖活性最低,差异有统计学意义(P<0.01)。见图1。

与0 ng/mL瑞芬太尼比较, **P<0.01。图1 不同浓度瑞芬太尼对卵巢癌细胞增殖的抑制作用(n=9)
2.2 不同浓度瑞芬太尼对卵巢癌细胞凋亡的诱导作用
流式细胞仪结果显示,与0 ng/mL瑞芬太尼组比较, 0.5、5.0、50.0、500.0 ng/mL瑞芬太尼组作用于卵巢癌细胞SKOV3、OVCAR3后,细胞的凋亡率依次增加,且SKOV3、OVCAR3细胞的凋亡率均以500 ng/mL瑞芬太尼组最高,差异有统计学意义(P<0.01)。见图2。

A: SKOV3细胞凋亡的流式细胞图; B: OVCAR3细胞凋亡的流式细胞图; C: SKOV3、OVCAR3细胞凋亡率的柱状图。与0 ng/mL瑞芬太尼比较, **P<0.01。图2 流式细胞术检测不同浓度瑞芬太尼对卵巢癌细胞凋亡的诱导作用(n=9)
2.3 不同浓度瑞芬太尼对卵巢癌细胞迁移和侵袭的抑制作用
Transwell法结果显示,与0 ng/mL瑞芬太尼组比较, 0.5、5.0、50.0、500.0 ng/mL瑞芬太尼组卵巢癌细胞SKOV3、OVCAR3的迁移和侵袭数量依次减少,且迁移和侵袭数量均以500 ng/mL瑞芬太尼最少,差异有统计学意义(P<0.01)。见图3。
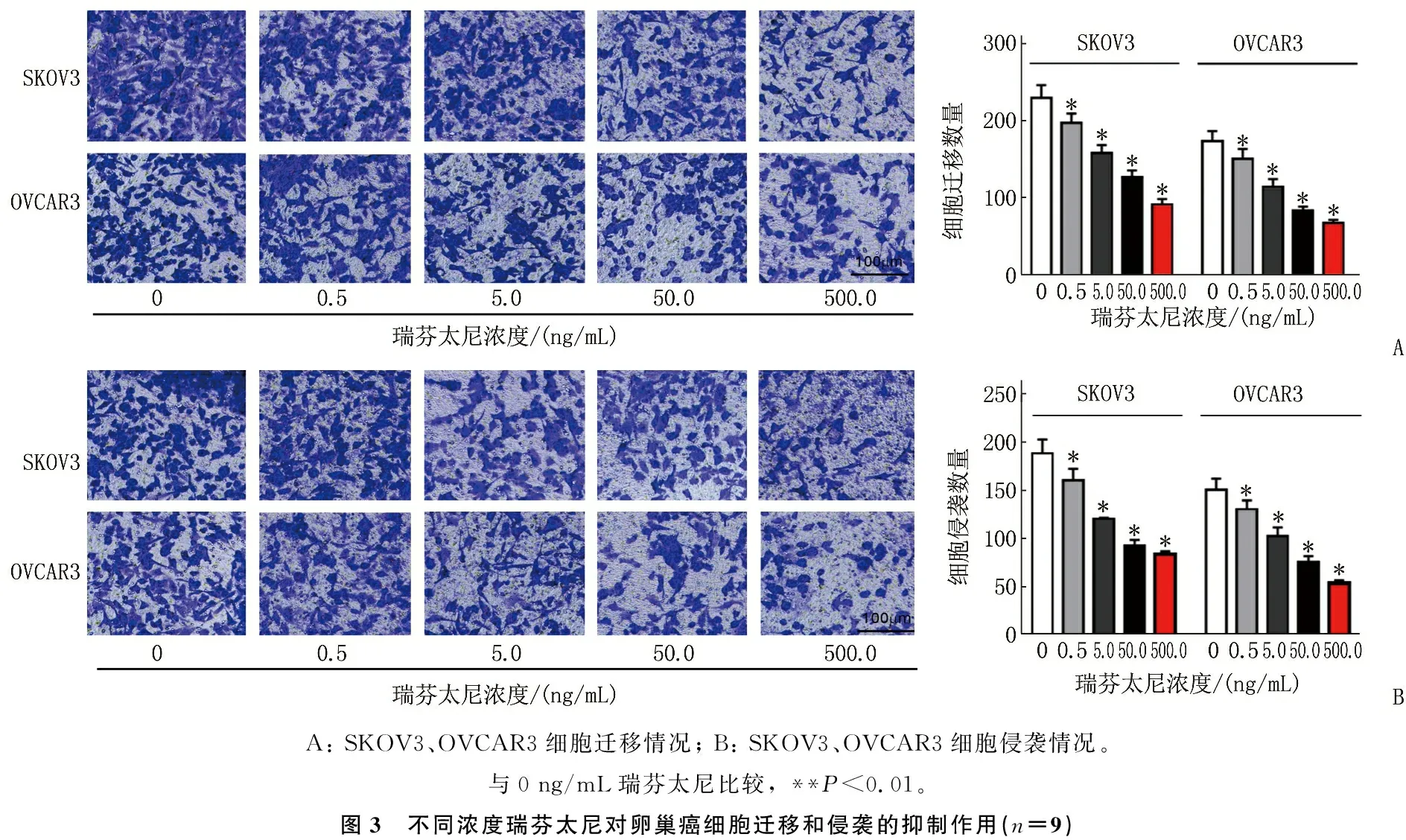
A: SKOV3、OVCAR3细胞迁移情况; B: SKOV3、OVCAR3细胞侵袭情况。与0 ng/mL瑞芬太尼比较, **P<0.01。图3 不同浓度瑞芬太尼对卵巢癌细胞迁移和侵袭的抑制作用(n=9)
2.4 不同浓度瑞芬太尼对卵巢癌细胞中CyclinD1、Cleaved-caspase-3、MMP2、MMP9的影响
Western blot结果显示, 0.5、5.0、50.0、500.0 ng/mL瑞芬太尼组卵巢癌细胞SKOV3、OVCAR3中CyclinD1、MMP2、MMP9蛋白表达水平均比0 ng/mL瑞芬太尼组低, Cleaved-caspase-3蛋白表达水平均比0 ng/mL瑞芬太尼组高,其中SKOV3、OVCAR3细胞中CyclinD1、MMP2、MMP9蛋白表达以500 ng/mL瑞芬太尼组最低,而Cleaved-caspase-3蛋白表达则以500 ng/mL瑞芬太尼组最高,差异有统计学意义(P<0.01)。见图4。
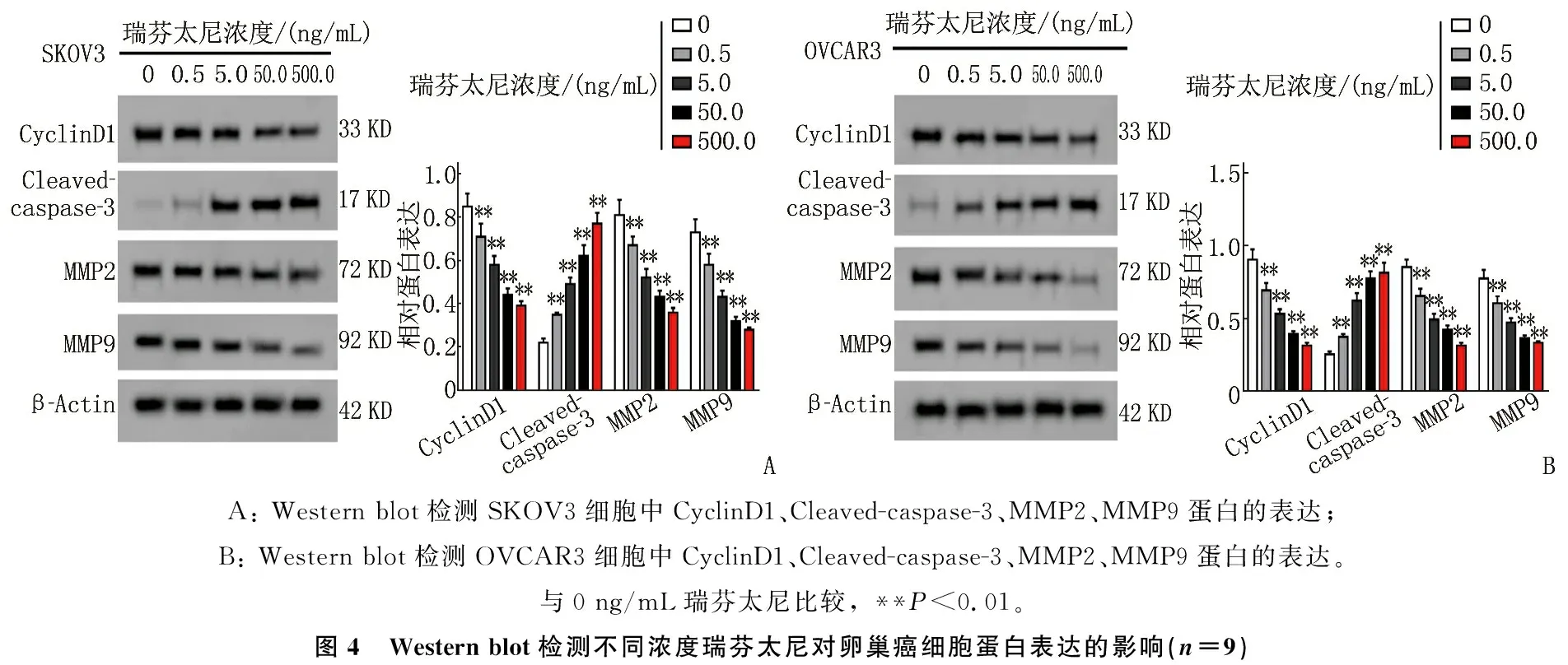
A: Western blot检测SKOV3细胞中CyclinD1、Cleaved-caspase-3、MMP2、MMP9蛋白的表达; B: Western blot检测OVCAR3细胞中CyclinD1、Cleaved-caspase-3、MMP2、MMP9蛋白的表达。与0 ng/mL瑞芬太尼比较, **P<0.01。图4 Western blot检测不同浓度瑞芬太尼对卵巢癌细胞蛋白表达的影响(n=9)
2.5 不同浓度瑞芬太尼对卵巢癌细胞中lncRNADGCR5表达的影响
qRT-PCR结果显示, 0.5、5.0、50.0、500.0 ng/mL瑞芬太尼组卵巢癌细胞SKOV3中lncRNA DGCR5表达水平依次为(1.54±0.07)、(1.98±0.13)、(2.34±0.18)、(2.71±0.24), OVCAR3中依次为(1.32±0.09)、(1.72±0.14)、(2.07±0.13)、(2.49±0.20), 高于0 ng/mL瑞芬太尼组卵巢癌细胞SKOV3中lncRNA DGCR5表达水平(1.00±0.06)和OVCAR3中(1.00±0.08), 并以500 ng/mL瑞芬太尼组lncRNA DGCR5表达水平最高,差异有统计学意义(P<0.01)。见图5。

与0 ng/mL瑞芬太尼比较, **P<0.01。图5 不同浓度瑞芬太尼对卵巢癌细胞lncRNA DGCR5表达的影响(n=9)
2.6 lncRNA DGCR5低表达可逆转瑞芬太尼对卵巢癌细胞增殖、迁移、侵袭及凋亡的影响
si-lncRNA DGCR5组卵巢癌细胞SKOV3和OVCAR3的lncRNA DGCR5表达水平、凋亡率、Cleaved-caspase-3蛋白表达水平低于si-NC组,细胞增殖活性、迁移数量、侵袭数量、CyclinD1、MMP2、MMP9蛋白表达水平高于si-NC组,差异有统计学意义(P<0.01)。si-lncRNA DGCR5+500 ng/mL瑞芬太尼组卵巢癌细胞SKOV3和OVCAR3的lncRNA DGCR5表达水平、凋亡率、Cleaved-caspase-3蛋白表达水平低于si-NC+500 ng/mL瑞芬太尼组,细胞增殖活性、迁移数量、侵袭数量、CyclinD1、MMP2、MMP9蛋白表达水平高于si-NC+500 ng/mL瑞芬太尼组,差异有统计学意义(P<0.01)。见图6、图7、图8。
3 讨 论
SKOV3和OVCAR3是研究细胞行为时常用的卵巢癌细胞[13]。瑞芬太尼是一种短效的阿片受体激动剂,可被血浆和组织中的非特异性酯酶迅速水解[14]。瑞芬太尼具有抑制破骨细胞分化和成熟并降低骨吸收[15],改善心肌[16]、肝脏[17]和脑缺血再灌注损伤[18],减轻炎症[19]等药理活性。近年来,瑞芬太尼在肿瘤方面的潜在作用引起了人们的极大关注。研究[20]报道,瑞芬太尼在胃癌中显示出抗肿瘤活性,可通过上调miR-519d-3p靶向STAT3, 抑制胃癌细胞增殖和促进其凋亡。在骨肉瘤MG63细胞中,瑞芬太尼促进miR-148a表达来减少细胞增殖和加速细胞凋亡,这与Cyclin D1的下调相符[21]。在结肠癌[22]和胰腺癌[23]细胞中,瑞芬太尼同样显示出抗增殖和促凋亡的功能。本研究结果与此相符,0.5、5.0、50.0、500.0 ng/mL瑞芬太尼减少卵巢癌SKOV3、OVCAR3细胞的增殖活性,并增加2种细胞的凋亡率。另外,瑞芬太尼还可降低卵巢癌SKOV3、OVCAR3细胞的迁移和侵袭活性,这与既往研究吻合。吴远波等[24]证实2、4、6 ng/mL瑞芬太尼使肺腺癌细胞迁移和侵袭能力显著下降,周成茂[25]证明瑞芬太尼和Ly294002联用可使肝癌细胞迁移能力明显减弱。上述结果说明,瑞芬太尼可以抑制卵巢癌细胞的恶性生物学行为,可能成为潜在的卵巢癌抑制剂。

A: SKOV3细胞凋亡的流式细胞图; B: OVCAR3细胞凋亡的流式细胞图; C: SKOV3、OVCAR3细胞凋亡率的柱状图。与si-NC比较, **P<0.01; 与si-NC+500 ng/mL瑞芬太尼比较, ##P<0.01。图6 lncRNA DGCR5低表达可逆转瑞芬太尼对卵巢癌细胞凋亡的影响(n=9)

A: SKOV3、OVCAR3细胞迁移情况; B: SKOV3、OVCAR3细胞侵袭情况。与si-NC比较, **P<0.01; 与si-NC+500 ng/mL瑞芬太尼比较, ##P<0.01。图7 lncRNA DGCR5低表达可逆转瑞芬太尼对卵巢癌细胞迁移及侵袭的影响(n=9)

A: Western blot检测SKOV3细胞中CyclinD1、Cleaved-caspase-3、MMP2、MMP9蛋白的表达; B: Western blot检测OVCAR3细胞中CyclinD1、Cleaved-caspase-3、MMP2、MMP9蛋白的表达。与si-NC比较, **P<0.01; 与si-NC+500 ng/mL瑞芬太尼比较, ##P<0.01。图8 lncRNA DGCR5低表达可逆转瑞芬太尼对卵巢癌细胞蛋白表达的影响(n=9)
lncRNA DGCR5也称为Linc00037,位于人类染色体22q11.21上[10]。lncRNA DGCR5在不同类型的癌症中具有相反的功能,在某些类型的癌症(包括肺腺癌[26]和食管鳞状细胞癌[27])中起到癌基因的作用,但在其他类型的癌症中发挥抑癌作用。在甲状腺乳头状癌中, lncRNA DGCR5通过海绵化miR-2861抑制肿瘤细胞的生长和侵袭[28]。在大肠癌中, lncRNA DGCR5通过下调miR-21抑制RKO和CR4细胞的增殖[29]。在非小细胞肺癌中, lncRNA DGCR5的过表达通过调节miR-211-5p/EPHB6轴来抑制细胞生长和转移[30]。卵巢癌组织中lncRNA DGCR5表达下调,并与晚期肿瘤进展密切相关[10]。本研究中, lncRNA DGCR5低表达降低了卵巢癌细胞SKOV3和OVCAR3的体外凋亡,并提高其增殖、迁移、侵袭能力,这揭示了lncRNA DGCR5在卵巢癌中起抑癌作用。
一些lncRNA可能充当阿片样物质独特生物学功能的调节剂,涉及阿片样物质信号传递的lncRNA也可能对药物行为和功效产生深远影响[31]。例如,lncRNA MEG3参与阿片类药物吗啡介导的小鼠海马神经元HT22细胞自噬[32]。阿片类药物芬太尼通过MALAT1下调发挥保护作用,并在体外和遭受心肌缺血再灌注的小鼠中负调节miR-145-5p/BNIP3途径[33]。本研究检测到卵巢癌SKOV3、OVCAR3细胞内lncRNA DGCR5表达被瑞芬太尼上调,而lncRNA DGCR5低表达可以逆转瑞芬太尼对SKOV3、OVCAR3细胞恶性行为的抑制作用,提示lncRNA DGCR5的上调是瑞芬太尼发挥抗卵巢癌作用的重要分子途径之一。
综上所述,本研究发现瑞芬太尼上调了卵巢癌细胞SKOV3、OVCAR3中lncRNA DGCR5的表达,并确定了瑞芬太尼抗卵巢癌进展的作用机制。

