急性A型主动脉夹层合并下肢缺血的处理策略
陈 瑞, 陈 涛, 邵 俊, 叶敬霆, 朱继高, 唐程斌
(江苏省苏北人民医院 心脏大血管中心, 江苏 扬州, 225001)
急性A型主动脉夹层(AAD)是心血管外科最为凶险的急症,近年来发病率逐年升高。AAD累及重要分支血管可出现相应脏器灌注不良综合征,若累及髂动脉或股动脉则可出现下肢灌注不良。下肢灌注不良主要是由于AAD假腔压力增加压迫真腔或血管撕裂内膜片直接堵塞血管,造成远端血管血流减少甚至完全闭塞,进而引起远端肢体灌注不良,该并发症的临床发病率并不低[1-2], 且常合并胃、肠、肾脏等其他脏器缺血。国内外研究[3-4]通过主动脉腔内修复术(EVAR)、开窗、股股转流等办法救治该类患者,均取得了不错的临床效果。本研究回顾性分析318例AAD患者的临床资料,其中34例患者合并下肢缺血,基于不同临床表现及CT特点采取不同处理策略后,临床效果良好,现报告如下。
1 资料与方法
1.1 一般资料
江苏省苏北人民医院心脏大血管中心2019年7月—2023年6月共完成318例AAD手术,其中34例患者合并下肢缺血,均接受外科手术治疗,且术前通过症状、体征和主动脉CT血管造影(CTA)检查结果明确诊断。下肢缺血诊断依据: 有下肢麻木、疼痛、感觉减弱或消失、肌力下降症状; 下肢皮温降低,足背动脉搏动减弱或消失、皮肤花斑,可能会有下肢肿胀,皮肤张力增高; CTA检查提示患肢动脉狭窄、血栓形成或闭塞。排除标准: 病程超过2周的慢性患者; 主动脉穿透性溃疡、主动脉壁间血肿、外伤性主动脉夹层患者; 既往有大动脉炎或周围血管病者。34例患者中,男25例,女9例,平均年龄(52.2±4.5)岁; 单侧下肢缺血29例,双侧下肢缺血5例; 发病至手术时间为(5.2±1.3) h; 合并高血压29例,糖尿病19例; 肠系膜上动脉血管受累5例,肾动脉受累7例,头壁干血管受累4例,左锁骨下动脉受累2例; 吸烟史24例,饮酒史22例。
1.2 方法
所有患者一经确诊立即绝对卧床,接受镇痛、降压、控制心率等对症处理,在急诊室完成术前心电图检查和常规实验室检查,进行急诊手术。常规正中开胸,全身肝素化(3 mg/kg)。18例患者游离患侧股动脉及右侧腋动脉,根据股动脉直径选择8~10 mm人工血管与股动脉进行端侧吻合,通过人工血管插管和右侧腋动脉双插管恢复患肢血流; 另外16例患者选择健侧股动脉单插管,同时游离患侧股动脉,向患侧股动脉远端插入深静脉置管,利用股动脉插管侧支与深静脉置管近端连接恢复缺血肢体远端血供。静脉插管根据术中食道超声结果选择插管方式,如果患者二尖瓣、三尖瓣无明显病变则选择右房插管,如果食道超声提示患者合并二尖瓣、三尖瓣病变需要同期处理,则选择上下腔静脉插管。建立体外循环(CPB)后降温,监测鼻咽温度和膀胱温度。室颤后阻断升主动脉,切开升主动脉,经冠状动脉开口直接灌注心脏停跳液,年龄大、怀疑合并冠心病的患者需要加用冠状静脉窦逆行灌注,心脏停跳满意后温度降至28 ℃停循环,需行全弓置换患者温度降至25 ℃停循环,选择腋动脉顺行脑灌注,流量8 mL/(kg·min), 其余患者选择上腔静脉逆行脑灌注,流量5 mL/(kg·min)。根据患者夹层破口位置和是否合并主动脉瓣及窦部扩张选择不同术式,包括Bentall+次全弓人工血管置换术, Bentall+全弓人工血管置换+降主动脉支架植入术, Wheat+次全弓人工血管置换术,升主动脉+次全弓人工血管置换术。胸部手术结束后,观察上下肢血压,并关注双下肢股动脉搏动情况和皮肤温度、颜色。动力型下肢缺血主动脉手术完成后,下肢血供多数得到恢复,不需要行股股转流; 若患肢血供不佳,则需要加行股股转流,根据股动脉直径选择8~10 mm人工血管通过会阴部皮下行双侧股动脉端侧吻合。
嘱患者出院后3、6、12个月及此后每年复查主动脉CTA及心脏彩超,根据复查结果确定是否需要再次行腔内修复手术及股股转流人工血管通畅情况。
1.3 统计学分析

2 结 果
2.1 临床资料
318例AAD手术患者中, 34例患者合并下肢灌注不良,另284例患者未合并下肢灌注不良。与无下肢灌注不良的AAD患者相比,合并下肢灌注不良的AAD患者CPB时间更长,术中出血量更多,术后透析概率更高,呼吸机支持时间、重症监护室(ICU)停留时间更长,且肾脏灌注不良发生率更高,差异有统计学意义(P<0.05); 合并下肢灌注不良的患者与未合并下肢灌注不良的患者在性别、年龄、吸烟史、主动脉阻断(ACC)时间、深低温停循环(HCA)时间、死亡情况等方面比较,差异无统计学意义(P>0.05), 见表1。

表1 318例AAD手术患者的临床资料
34例合并下肢灌注不良的患者中,手术方式为Bentall+次全弓人工血管置换术5例, Bentall+全弓人工血管置换+降主动脉支架植入术4例, Wheat+次全弓人工血管置换术5例,升主动脉+次全弓人工血管置换术20例; 行股股转流14例,术后行降主动脉支架植入术2例; 术后肾功能衰竭17例,术后呼吸衰竭而再次气管插管者3例,骨筋膜室综合征2例,术后肠坏死2例(其中1例术后发生结肠和胆囊坏死,经结肠切除造瘘和胆囊切除术治疗后康复出院),死亡2例(1例因合并肠缺血坏死而死亡,另1例因术后发生骨筋膜室综合征而死亡)。
术后平均随访(27.2±3.5)个月, 6例股股转流患者发生人工血管闭塞,经保守治疗,患肢麻木症状好转,未进一步手术,其余8例股股转流患者人工血管通畅,所有存活患者随访结果良好,生活可自理。
2.2 典型病例
患者男, 41岁,因“突发胸背疼痛伴右下肢麻木3 h”入院,入院检查示右下肢收缩压60 mmHg、舒张压40 mmHg, 皮肤花斑、皮温低,肌力2级。主动脉CTA检查提示A 型主动脉夹层,右侧髂总动脉闭塞,少量心包积液。患者入院后立即手术,术中在右侧股动脉缝制8 mm人工血管,经人工血管及右侧腋动脉、右房建立体外循环,恢复右下肢血供,后行升主动脉+次全弓人工血管置换+股股转流术,患者术后顺利恢复,于术后10 d出院,治疗结果见图1。
3 讨 论
AAD合并下肢缺血患者可出现以“5P征”为主要症状的下肢缺血表现,临床发生率约为11%[5-6]。尽管国内外学者多年来已尝试用不同方式治疗AAD合并下肢灌注不良,但患者仍有着较高的病死率。灌注不良是AAD患者死亡的独立危险因素,包括肝、肠、冠状动脉、脑、肾脏等处[7-8]。相关研究[8-9]对灌注不良患者进行术后随访发现,患者表现出略高的病死率,并与肾功能衰竭有关。主动脉夹层所致下肢缺血根据血流动力学可分为2种类型[10]: ① 动力型,指分支血管未受累及,但分支血管近端真腔明显狭窄或撕裂内膜片堵塞分支血管开口导致分支血管血流减少,分支血管仍由真腔供血[11]; ② 静力型,指主动脉夹层累及分支动脉开口,或向分支动脉远端继续剥离,导致分支动脉开口血肿压迫或夹层形成,引起分支血管狭窄甚至完全闭塞。AAD合并下肢灌注不良大多为动力型,可通过近端手术解决,故早期积极的近端手术治疗在合并灌注不良的AAD治疗中发挥着重要作用。对于静力型的灌注不良,使用支架、转流等技术开通受影响的血管,恢复器官血流已被证明是改善预后与降低致死率的关键[12-13]。
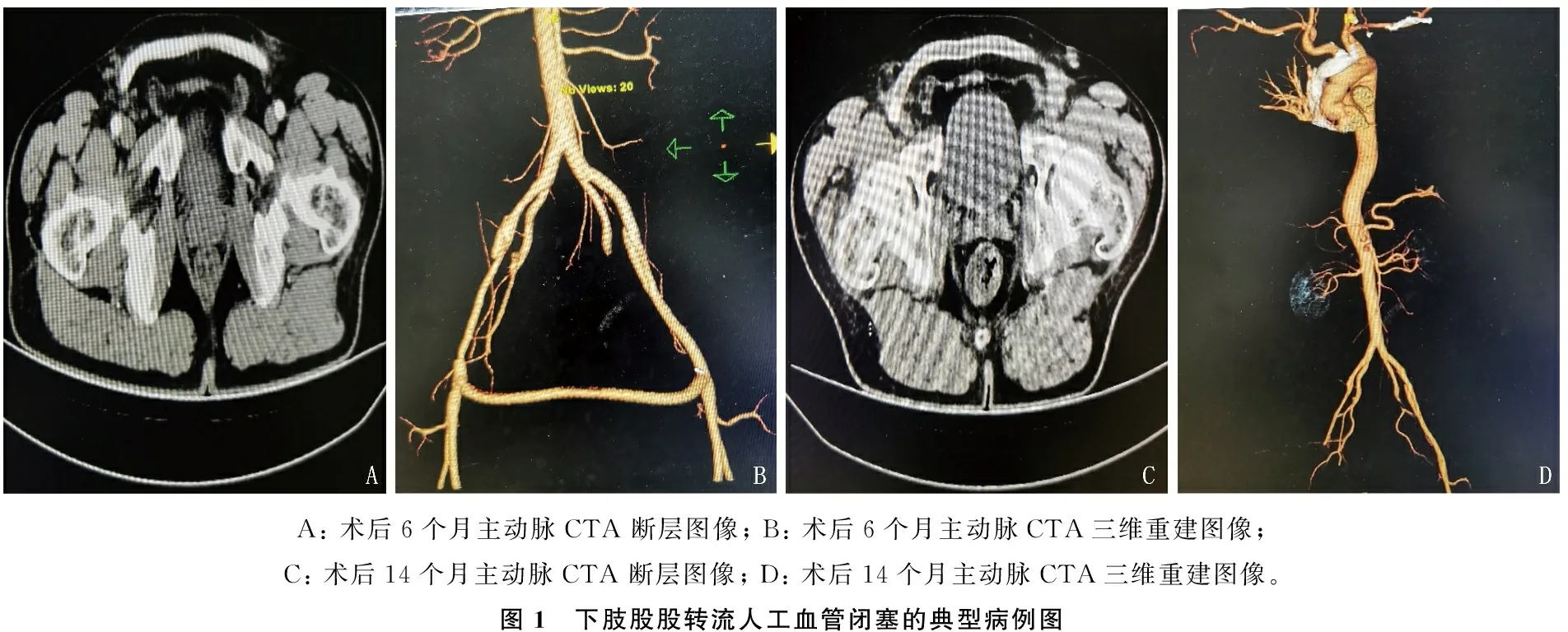
A: 术后6个月主动脉CTA 断层图像; B: 术后6个月主动脉CTA三维重建图像; C: 术后14个月主动脉CTA 断层图像; D: 术后14个月主动脉CTA三维重建图像。图1 下肢股股转流人工血管闭塞的典型病例图
本研究中, 2例AAD合并下肢灌注不良患者死亡均与其他器官灌注不良相关,其中1例患者因夹层累及肠系膜上动脉引起肠缺血坏死而死亡,另1例患者因下肢缺血引起肌肉坏死发生骨筋膜室综合征而死亡。骨筋膜室综合征是AAD合并下肢灌注不良患者最常见的围术期死亡原因,可引起灾难性后果。临床医生应重点关注骨筋膜室综合征发生情况,及时切开减压,以降低患者病死率。下肢灌注不良患者中,大约有一半同时伴有其他任意器官(多为腹部脏器)的灌注不良,另一半则为单纯的下肢灌注不良。下肢灌注不良患者的总体病死率高于非下肢灌注不良患者[14], 因为其存在较高的下肢以外器官灌注不良发生率。单纯下肢灌注不良患者因较为积极及时的治疗(包括近端手术、支架、转流等),病死率相较于无灌注不良的AAD患者并不升高,但需行连续性肾替代治疗(CRRT)者占比、ICU停留时间等可能依然明显升高或延长。本研究并未发现下肢灌注不良患者的病死率升高,与既往研究[14]结论不符,主要原因可能为: ① 本研究中,除了病情稳定的A型血肿患者,其他AAD患者均接受急诊手术治疗,且合并脏器灌注不良的患者均接受绿色通道急诊手术治疗,大部分患者从入院至急诊手术的时间短于1 h,因此患者下肢缺血时间很短,对机体影响小且往往可逆; ② 本研究采取腋股转流、缺血侧股动脉缝制人工血管灌注、股股转流、缺血股动脉插入侧支灌注、主动脉腔内修复技术等多种方法,可尽快恢复缺血肢体灌注; ③ 术后积极采取CRRT, 可尽快清除体内毒素及炎性介质,减轻缺血再灌注对机体的影响; ④ 本研究中,一旦患者发生骨筋膜室综合征等并发症,就采取切开减压等措施及时治疗。
本研究中, 17例患者术后因肾功能衰竭接受CRRT, 发生率为50.0%, 与既往研究[15-16]结果基本一致。本研究制订了相对积极的CRRT方案(若患者术后出现尿少或肌红蛋白尿,则积极予以CRRT), 因为患者即使术后脏器及肢体血供恢复,也仍会存在不同程度的缺血再灌注损伤,大量代谢废物及炎症因子释放入血会加重脏器尤其是肾的损伤。在股股转流抗凝管理方面,若患者行Bentall手术和Wheat手术,由于同期行主动脉瓣置换,若置换机械瓣,术后需长期服用华法林抗凝,采用主动脉瓣机械瓣抗凝方案即可,若置换生物瓣,则服用华法林抗凝3~6个月后改为终身服用阿司匹林抗凝。值得注意的是,即使术后长期服用华法林或阿司匹林, 14例患者中也有多达6例出现下肢股股转流人工血管闭塞,这可能是由原动脉系统血供恢复而产生竞争性血流导致,但此类患者大多症状较轻,往往经保守治疗可改善,与相关研究[17]结论一致。
对于下肢灌注不良AAD患者的手术时机与手术方案的选择,国内外一些研究[18-19]指出先通过主动脉手术处理原发破口可使60%~100%的患者缺血肢体恢复血供,且这些下肢血供恢复患者的预后与不合并下肢灌注不良患者相当; 另有研究[20-22]表明应优先处理下肢灌注不良而推迟主动脉手术时间,但这些患者中约有1/3的患者会在等待主动脉手术的过程中死亡。本研究的经验是术中缺血一侧股动脉用8~10 mm人工血管与股动脉做端侧吻合,在人工血管中插入24号普通主动脉插管,同时行腋动脉插管,在建立体外循环的同时尽快恢复患肢血供。本研究还尝试在患者健侧股动脉插入20~22号体外膜肺氧合(ECMO)插管,同时游离患肢股动脉,向股动脉远端插入双腔深静脉置管,将股动脉插管侧支与深静脉置管近端连接尽快恢复患肢血供。这种方法不需要游离右侧腋动脉,加快了缺血肢体的恢复。本研究建议优先选择主动脉修复作为AAD患者的主要治疗方法,即使肢体缺血是表现特征。在主动脉修复和血管重建手术后,若患者仍存在肢体缺血,应立即对肢体进行重新评估,采取介入或股股转流等方法恢复其缺血肢体血供。
综上所述,快速而积极地采用多种方法恢复血流是AAD合并下肢灌注不良患者的最佳治疗方案,临床医生应根据患者术后相关症状积极予以透析治疗,并密切监测骨筋膜室综合征的发生情况。

