妊娠期糖尿病患者血清NLRP3炎性小体信号通路的临床研究
何 苗, 曹 羽, 王 佳, 陈 璐, 苗春菊
(苏州大学附属常熟医院 产科, 江苏 常熟, 215500)
妊娠期糖尿病(GDM)是妊娠期常见的糖代谢异常,全球发生率约为18%[1], 中国发病率为5%~10%[2]。GDM发病率呈逐年上升趋势,俨然成为世界范围内重要且日益升级的健康问题。GDM不仅增加胎儿畸形、羊水过少、羊水过多、胎儿发育迟缓、巨大儿、肩难产、臂丛神经损伤、新生儿呼吸窘迫综合征、死胎、死产等不良妊娠结局的发生风险,同时增加母体妊娠期高血压性疾病、难产、手术产、产时及产后出血及产后2型糖尿病的发生风险。因此,探索GDM的发病机制及寻找有效的防治方法是临床亟待解决的问题。目前研究发现, GDM的发生与机体固有免疫系统介导的炎症反应密切相关。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体活化后在凋亡相关斑点样蛋白(ASC)的协助下募集并活化半胱氨酸天冬氨酸特异性蛋白水解酶-1(Caspase-1), 导致炎性因子白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18)的成熟和分泌,进而介导炎症性程序性细胞死亡(即细胞焦亡),诱导产生一系列的炎症反应,与GDM的发生密切相关。故本研究探讨核苷酸NLRP3炎性小体的细胞焦亡相关NLRP3-ASC-Caspase-1-IL-1β/IL-18-TGF-β信号通路在GDM发生发展过程中的作用。
1 材料与方法
1.1 研究对象与材料
1.1.1 研究对象: 选取2020年6月—2022年6月在本院产科门诊产检的GDM患者80例为研究对象。其中孕期未予胰岛素治疗患者60例(未予胰岛素治疗GDM组),平均年龄为(29.13±5.28)岁,平均孕周为(24.45±2.70)周。孕期予胰岛素治疗患者20例(胰岛素治疗GDM组),平均年龄为(30.01±4.86)岁,平均孕周为(24.50±1.15)周。选择同期健康孕妇30例作为对照组,平均年龄(28.73±5.42)岁,平均孕周为(24.22±1.59)周。各组在年龄、孕周等方面比较,差异无统计学意义(P>0. 05), 具有可比性。本研究已取得所有患者的知情同意,并获得伦理委员会批准。
纳入标准: 根据人民卫生出版社《妇产科学》(第九版)诊断标准,于孕24~28周行75 g葡萄糖耐量试验(OGTT), 空腹、OGTT 1 h、OGTT 2 h的血糖界值分别为5.1、10.0、8.5 mmol/L, 任何一项达到或超过其相应界值即可诊断为GDM。纳入标准: 患者为自然受孕的单胎妊娠,且临床资料完整。排除标准: 妊娠前糖尿病患者; 感染性疾病、甲状腺功能亢进等其他内分泌系统疾病患者; 近期服用糖皮质激素以及心、肺、肾等功能障碍患者。
1.1.2 主要仪器及试剂: 北京东胜ETC811 PCR扩增仪、新加坡ABI QuantStudio 5荧光定量PCR测定仪、美国Eppendorf Centrifuge 5418R台式高速冷冻离心机、Centrifuge 5702R台式高速离心机、上海天能电泳装置、Tanon 4600SF凝胶成像系统、杭州奥盛Nanodrop 400A超微量紫外分光光度计、美国Molecular Devices FlexStation 3多功能酶标仪、海门其林贝尔GL-1900恒温金属浴、上海一恒DHP-9082电热恒温培养箱。北京达科为生物技术有限公司: 人淋巴细胞分离液; Takara Bio: PrimeScriptTMRTreagent Kit、RNAiso plus试剂盒、SYBR Premix ExTaqTM Ⅱ荧光定量试剂盒; abcam: Anti-NLRP3 antibody、Anti-ASC antibody、Anti-Caspase-1 antibody; 上海碧云天生物有限公司: Western blot细胞裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、SDS-PAGE蛋白上样缓冲液; 上海广锐生物科技有限公司: IL-1β、IL-18、TGF-β ELISA试剂盒。
1.2 方法
1.2.1 资料收集: 收集研究对象年龄、孕周、身高、体质量等基础资料,同时检测空腹血糖(FPG)、糖化血红蛋白(HbA1c)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)等生化资料。所有研究对象均禁食8 h以上,抽取20 mL肘静脉血,取2 mL全血3 000转/mL离心10 min, 留取上清并冻存于-80 ℃冰箱备用,剩余全血经人淋巴细胞分离液分离后采用Ficoll-Hypaque密度梯度分离法,严格按照试剂盒说明书分离出外周单个核细胞(PBMCs)备用。
1.2.2 实时荧光定量聚合酶链反应技术(qRT-PCR): 应用RNAiso plus试剂盒提取人PBMCs总RNA。经纯度检测与定量后,根据逆转录试剂说明书逆转录为cDNA。再按照RT-PCR试剂说明书及预实验确定的反应时间与温度进行实时定量。PCR反应条件为95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 30 s, 50个循环。引物序列:NLRP3上游引物为5′-AAAGCCAAGAATCCACAGTGTAAC-3′, 下游引物为5′-TTGCCTCGCAGGTAAAGGT-3′;ASC上游引物为5′-GGATGCTCTGTACGGGAAGG-3′, 下游引物为5′-CGCATCTTGCTTGGGTTG-3′;Caspase-1上游引物为5′-AGGCATGACAATGCTGCTACAA-3′, 下游引物为5′-TGTGCAAATGCCTCCAGCTC-3′;GAPDH上游引物为5′-CTTTGGTATCGTGGAAGGACTC-3′, 下游引物为5′-GTAGAGGCAGGGATGATGTTCT-3′。以GAPDH为内参,采用2-△△Ct方法分析相对表达量。
1.2.3 蛋白质免疫印迹(Western blot) : 常规方法提取人PBMCs总蛋白,严格按照BCA蛋白浓度测定试剂盒说明书测定蛋白浓度。含50 ng蛋白质的上样样品经8%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转移到聚偏氟乙烯(PDVF)膜上, BSA-TBS室温封闭1 h, 与一抗稀释液(NLRP3、ASC、Caspase-1、GAPDH)4 ℃孵育过夜。次日,经洗膜缓冲液(TBST)洗涤后,加入辣根过氧化物酶标记的二抗,室温孵育1 h。使用Tanon-Chemi成像系统(Tanon-4600SF)扫描蛋白条带。
1.2.4 酶联免疫吸附试验(ELISA): 应用人IL-1β、IL-18、TGF-β ELISA试剂盒,严格按照说明书操作,每个样本均设置2个复孔,取均值纳入数据统计。
1.3 统计学分析

2 结 果
2.1 3组患者基本情况及血脂、血糖水平变化
3组患者年龄、孕周比较,差异无统计学意义(P>0.05); GDM患者(未予胰岛素治疗GDM组、胰岛素治疗GDM组)的BMI、FPG、HbA1c、TC、TG高于对照组, HDL-C低于对照组,差异有统计学意义(P<0.05); 胰岛素治疗GDM组的FPG、HbA1c高于未予胰岛素治疗GDM组,差异有统计学意义(P<0.05), 见表1。

表1 3组基本情况及血脂、血糖水平变化比较
2.2 3组PBMCs中NLRP3、ASC、Caspase-1 mRNA及其蛋白水平
胰岛素治疗GDM组(Treated)和未予胰岛素治疗GDM组(Untreated)的NLRP3、ASC、Caspase-1mRNA表达高于对照组(Ctrl),差异有统计学意义(P<0.05); 胰岛素治疗GDM组略高于未予胰岛素治疗GDM组,但差异无统计学意义(P>0.05), 见图1。胰岛素治疗GDM组(Treated)中的NLRP3、ASC和Caspase-1的蛋白表达高于未予胰岛素治疗GDM组(Untreated)和对照组(Ctrl), 差异有统计学意义(P<0.05), 见图2。
2.3 3组血清中IL-1β、IL-18、TGF-β水平变化
GDM患者(未予胰岛素治疗GDM组、胰岛素治疗GDM组)的血清IL-1β、IL-18、TGF-β高于对照组,差异有统计学意义(P<0.05); 胰岛素治疗GDM组的血清IL-1β、IL-18、TGF-β高于未予胰岛素治疗GDM组,差异有统计学意义(P<0.05), 见表2。

表2 3组血清IL-1β、IL-18、TGF-β水平变化比较 ng/L
2.4 3组NLRP3、ASC、Caspase-1 mRNA水平与各变量的Spearman相关性分析
NLRP3mRNA在对照组、未予胰岛素治疗GDM组均无相关性,在胰岛素治疗GDM组与FPG呈正相关,相关系数为0.322(P=0.028);ASCmRNA在对照组无相关性,在未予胰岛素治疗GDM组与HbA1c呈正相关,相关系数为0.483(P=0.035), 在胰岛素治疗GDM组与HbA1c、TG呈正相关,相关系数分别为0.512(P=0.026)和0.427(P=0.029);Caspase-1mRNA在对照组与FPG 呈正相关,相关系数为0.438(P=0.015), 在未予胰岛素治疗GDM组与BMI呈正相关,相关系数为0.328(P=0.036), 在胰岛素治疗GDM组与BMI、TC呈正相关,相关系数分别为0.352(P=0.033)和0.487(P=0.017)。
2.5 3组NLRP3、ASC、Caspase-1蛋白水平与各变量的Spearman相关性分析
NLRP3在3组均无相关性; ASC在对照组无相关性,在未予胰岛素治疗GDM组与FPG、HbA1c呈正相关,相关系数分别为0.384(P=0.031)和0.463(P=0.027), 在胰岛素治疗GDM组与FPG、TC、IL-1β、IL-18呈正相关,相关系数分别为0.414(P=0.023)、0.472(P=0.031)、0.493(P=0.029)和0.512(P=0.019)。Caspase-1在对照组与FPG呈正相关,相关系数为0.537(P=0.025), 在未予胰岛素治疗GDM组与FPG、HbA1c、LDL-C、IL-1β呈正相关,相关系数分别为0.439(P=0.013)、0.452(P=0.021)、0.517(P=0.018)和0.602(P=0.009); Caspase-1在胰岛素治疗GDM组与FPG、HbA1c、LDL-C、IL-1β呈正相关,相关系数分别为0.578(P=0.021)、0.502(P=0.021)、0.491(P=0.017)和0.584(P=0.023), 见表3。
2.6 3组血清IL-1β、IL-18、TGF-β之间的Spearman相关性分析
IL-1β在GDM患者(未予胰岛素治疗GDM组、胰岛素治疗GDM组)与TGF-β呈正相关,相关系数分别为0.613(P=0.014)和0.729(P=0.009), 而三者之间在对照组无相关性,见表4。
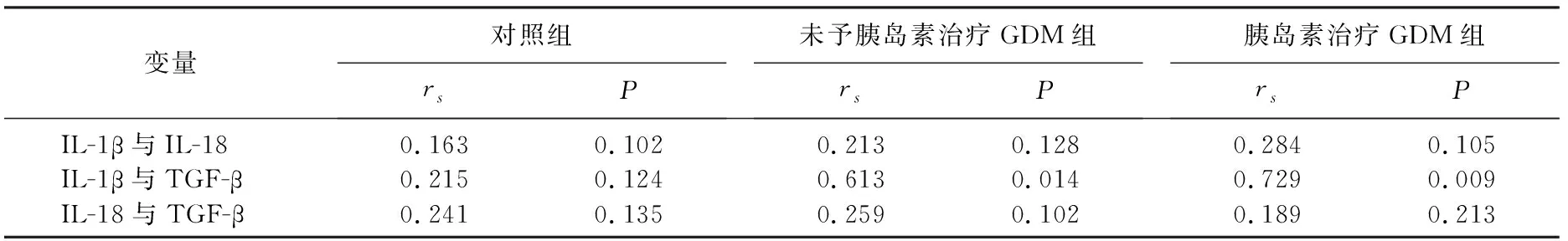
表4 3组血清IL-1β、IL-18、TGF-β之间的相关性分析
3 讨 论
正常孕妇由于体内拮抗胰岛素样物质增加,胰岛素敏感性下降50%~60%, 同时胰岛素代偿性分泌增加以维持正常血糖。胰岛素抵抗(IR)被认为参与GDM发生发展的病理生理过程[3-4]。IR是胰岛素敏感性降低的一种病理生理状态,可由缺氧、糖脂代谢异常等通过炎症反应介导而产生,炎症因子很有可能是IR的“启动子”[5-7]。
细胞焦亡是一种炎症性程序性细胞死亡形式[8-9]。细胞焦亡的经典途径之一是通过NLRP3识别病原体相关分子模式和损伤相关分子模式,激活由NLRP3、ASC和Caspase-1前体(pro-Caspase-1)组成的多蛋白复合体,即NLRP3炎性体,进而活化和产生Caspase-1; 活化的Caspase-1切割下游的Gasdermin D, 在细胞膜上形成孔洞,进而促进裂解性细胞死亡; 同时Caspase-1活化和释放IL-1β、IL-18等炎症因子,进一步诱发炎症反应[9-10]。炎症因子的表达增加促使抗炎因子TGF-β的过度表达。研究[11]指出, GDM患者胎盘组织中H2S合成酶缺乏,可能会过度激活NLRP3炎症小体,促使炎症反应引起细胞焦亡。
IL-1β作为趋化因子家族的一员,是重要的炎性细胞因子。一方面, GDM患者体内高水平IL-1β可激活脂肪组织中的p38MAPK, 增强母体炎症反应及IR; 另一方面,通过下调胰岛素受体底物-1的表达,降低脂肪细胞中葡萄糖转运体(GLUT-4D)及胰岛素敏感基因PPARy的表达等途径产生IR; 同时研究[12]发现, GDM患者IL-1β rs16944 AA基因型与胰岛素治疗频率及每日需求量的增加有关。通过小鼠试验[13]发现, IL-1β表达量在GDM小鼠子宫、胎盘组织及血液中均增加,而GDM小鼠应用抗IL-1β抗体后糖耐量得到改善,但胰岛素分泌无显著改变,表明抗IL-1β治疗后有胰岛素增敏作用。
IL-18作为一种促炎因子,被激活后可穿过细胞膜上的孔洞,促进炎症因子的合成、聚集,引发炎症反应[14]。本研究中, GDM患者血清IL-18水平升高,与武楠等[3]研究相符。FATIMA S S等[15]发现, GDM患者IL-18水平升高与低度炎症、IR有关。TARNOWSKI M等[16]研究发现, IL-18 rs187238和rs1946518基因多态性可能影响孕妇GDM的发生风险。
TGF-β作为蛋白质超家族的一员,可调节细胞生长和分化。活化的TGF-β可抑制β细胞增殖,加快β细胞凋亡,从而使得胰岛素分泌减少。TGF-β通过促进纤溶酶原激活物抑制剂-1的表达诱导IR; 同时激活Smad3 信号通路,促进参与胰岛素作用的相关基因和脂代谢基因的表达,进而导致IR[17]。研究[18]发现, TGF-β3 rs2284792的AA和AG基因型多态性可能与GDM患病风险增加相关。
本研究显示, GDM患者PBMCs中NLRP3、ASC、Caspase-1mRNA表达水平及其蛋白表达水平显著性增加; 血清中IL-1β、IL-18、TGF-β水平显著增加, ASC与IL-1β、IL-18呈正相关, Caspase-1与IL-1β呈正相关,且IL-1β与TGF-β呈正相关,提示以NLRP3炎性小体为中心的细胞焦亡相关NLRP3-ASC-Caspase-1-IL-1β/IL-18-TGF-β信号通路可能在GDM的发生发展中发挥重要作用。研究[19]发现,细胞焦亡促使胰腺β细胞数量减少和IR的发生。本研究认为,以NLRP3炎性小体为中心的细胞焦亡信号通路活化并产生下游炎性因子,进而介导IR,导致GDM的发生。研究[20]发现, NLRP3炎性小体和细胞焦亡经典途径的激活可能促进脂肪或胎盘组织炎症,参与GDM发生; OLMOS-ORTIZ A等[21]也认为,胎盘和脂肪组织中的炎症反应是引起IR及进一步导致GDM发生的重要因素。韩宁等[22]研究发现,细胞焦亡因子NLRP3、Caspase-1、IL-1β、IL-18表达水平在GDM孕妇血清中显著升高,这与本研究结果基本相符,同时研究指出由细胞焦亡诱发炎症相关信号通路的激活,而产生的慢性炎症状态是导致IR的重要因素,且与孕妇不良妊娠结局风险的增加相关。
本研究显示, GDM组患者PBMCs中NLRP3、ASC、Caspase-1mRNA表达水平均显著增加,且ASCmRNA与HbA1c、TG呈正相关,Caspase-1mRNA与BMI、TC呈正相关,提示在基因转录水平, GDM患者NLRP3炎性小体的表达显著增加,糖脂代谢异常、高BMI可能对其起到促进作用。GDM组患者PBMCs中NLRP3、ASC、Caspase-1蛋白表达水平显著增加,且ASC蛋白表达水平与FPG、HbA1c、TC呈正相关, Caspase-1蛋白表达水平与FPG、HbA1c、LDL-C呈正相关,提示在翻译水平, GDM患者NLRP3炎性小体的表达显著增加,高血糖、高血脂可能对其起到促进作用。温金等[23]发现,在GDM发病过程中,高糖可诱导细胞焦亡并释放炎性介质,导致局部以及全身炎症并引发IR, 与本研究结果相符。
综上所述,激活NLRP3炎性小体表达的危险因素包括高血糖、高血脂及高BMI, 加强孕期对血糖、血脂、体质量的控制,降低以NLRP3炎性小体为中心的细胞焦亡信号通路的激活,减轻不同炎症因子之间互相交错的炎症反应,可能对GDM的防治、早期干预以及良好母婴结局有重要意义。研究[24]发现,过敏介质阻释剂——曲尼司特通过抑制NLRP3炎性小体的激活减轻炎症反应,对GDM起到正向作用。进一步研究NLRP3炎性小体及其下游炎症因子的激活、调控机制,有望在细胞和分子水平进一步明确GDM的发病机制,为GDM的预防及诊治提供潜在靶标和新突破点。

