绵羊CD14基因在临床型乳腺炎乳腺组织中的表达
范梓文,尹德恩,满永恒,郭 磊,马友记*
(1.甘肃农业大学 动物科学技术学院,甘肃 兰州 730070;2.甘肃省动物生殖生理与繁殖调控重点实验室,甘肃 兰州 730070;3.甘肃省金昌市永昌县畜牧兽医技术服务中心,甘肃 金昌 737200)
绵羊乳腺炎是对养羊业有极大影响的一种疾病,哺乳期最易患病[1]。目前,对于哺乳动物乳腺炎的相关研究主要集中在奶牛[2-3],在病原体[4]、发病机理[5]、疾病预防[6]等方面研究较为广泛,而关于绵羊乳腺炎发病机理的相关研究较少。绵羊乳腺炎的发病率为5%~30%,在少数暴发乳腺炎的大规模集约化羊群中,只有10%的患病母羊存活下来,由此可见,乳腺炎的发生严重制约着养羊业的发展[7]。研究结果表明,乳腺炎不仅会影响母羊自身的繁殖和生产过程,而且会降低乳制品生产水平和质量[8]。患病动物表型发生改变(如体细胞数增多、产奶量下降、乳品质降低)的主要原因是由于乳腺炎可在细胞水平诱导乳腺组织内多种类型细胞的凋亡[9]。本试验以湖羊为研究对象,湖羊具有四季发情、泌乳性能较好、多胎高产等优点,是我国较为优秀的绵羊品种之一[10]。
白细胞分化抗原14 (cluster of differentiation antigen 14,CD14)是近年来备受关注的多功能炎症细胞性因子,在炎症免疫反应中发挥重要作用[11]。通过对哺乳动物的研究发现,CD14最初是在人体单核细胞的表面被检测出来,位于人体5号常染色体的长臂端5q23-q31,在细胞内的表达是通过GPI固定于细胞膜上,形成55 kD的糖蛋白[12-14],其也在1990年被确定为内毒素脂多糖(lipopolysaccharide,LPS)的识别受体[15],作为LPS受体,CD14的主要生物学功能是识别、结合LPS/LBP复合物,介导LPS性细胞反应。当机体发生革兰阴性菌等感染源侵入时,CD14识别并结合LPS后,可激活Toll-like受体4信号转导通路,并进一步介导单核巨噬细胞分泌炎症因子和共刺激因子的表达,激发机体炎症反应[16]。当病原菌侵入乳腺,白细胞迁移到乳腺组织提供了第一道防线。在母畜乳腺由健康到患病过程中,白细胞发挥着重要作用。白细胞依靠表面受体包括趋化因子、CD14等,依靠这些表面受体迁移并黏附内皮细胞,发挥和吞噬功能[17]。白细胞及其表面受体对母畜乳腺炎发生有着重要的影响。研究表明,母畜分娩前后乳腺的局部及全身免疫防御系统存在缺陷,在对正常母畜与围产期前后母畜白细胞体内和体外功能的研究中发现,分娩前后的母畜与乳腺局部免疫防御系统存在缺陷[18]。这种免疫缺陷在PREISLER等[19]研究中得到证明,母畜围产期淋巴细胞和单核细胞糖皮质激素受体表达减少,这可能是由淋巴细胞和单核细胞表型或功能(或两者)的改变引起,乳腺炎易感性增加。截至目前,对CD14基因在绵羊乳腺炎乳腺组织的相关研究还处于空白阶段。因此本研究以绵羊为研究对象,运用生物分析学方法对CD14蛋白理化性质、跨膜结构域、磷酸化位点、二级结构与三级结构及其不同物种间的同源性等进行分析预测。同时使用qRT-PCR、Western blot 与免疫组织化学染色的方法检测CD14 mRNA与蛋白在健康和临床型乳腺炎湖羊乳腺组织中的表达与分布情况,以期为进一步绵羊乳腺炎发病过程中有关细胞凋亡的分子调控机制提供参考依据。
1 材料与方法
1.1 实验动物及样品采集选用6只2岁龄湖羊母羊,均由平长湖羊繁育基地(甘肃,临洮)提供,其中患有临床型乳腺炎湖羊3只,健康湖羊3只。患病湖羊临床症状为乳房发红、发肿,乳房内有硬结,且乳汁稀薄有异味,变色呈灰白色或深黄色。健康湖羊则为乳房正常,且乳汁无异味呈乳香型。
1.2 主要试剂TRIzol RNA提取试剂盒、Revert Aid First Strand cDNA Synthesis Kit、焦碳酸二乙酯(Diethyl pyrocarbonate,DEPC)水、Tran Start Tip Green qPCR Super Mix和Passive Reference Dye、RIPA组织裂解液等均购自北京全式金生物公司;一抗兔源CD14(货号:bs-1192R)购自Abcam;羊抗兔二抗(Goat Anti-rabbit IgG/HRP)、二抗DAB显色试剂盒、免疫组化试剂盒(SP-0022)均购自北京博奥森生物技术有限责任公司。
1.3 样品采集通过静脉放血的方法处死试验羊,采集其乳腺组织,其中一部分乳腺组织样品通过超低温保存,用于提取总RNA和蛋白质;用4%多聚甲醛固定其余样品,用于制备石蜡切片。
1.4 总RNA提取及反转录使用TRIzol试剂提取组织总RNA,利用超微量分光光度计(Thermo Scientific,德国)检测其总RNA浓度和纯度。之后按照反转录试剂盒的说明合成第一链cDNA。
1.5 引物设计与合成依据NCBI网站已公布绵羊CD14(登录号:NM_001077209.2)和内参蛋白β-actin(NM_001009784.1)序列,使用Oligo 7.0软件设计引物并送至北京擎科生物科技有限公司西安分公司进行合成。引物序列见表1。

表1 qRT-PCR引物
1.6 CD14生物信息学分析基于NCBI网站已公布的绵羊CD14基因CDS序列,采用BLAST进行同源序列的搜索;使用DNAMAN软件对来自不同物种的CD14核苷酸和氨基酸序列进行多次对比;使用ProtParam在线程序对CD14的基本理化性质进行预测分析;CD14蛋白信号肽由SignalP在线程序进行预测;跨膜结构域由TMHMM在线程序进行预测;通过NetPhos在线程序对磷酸化位点进行预测;通过SOPMA、phyre2在线程序对二级结构、三级结构进行预测分析。
1.7 qRT-PCR反应体系(20 μL):上、下游引物(10 μmol/L)各0.4 μL,cDNA 1 μL,2×Tran Start TipGreen qPCR SuperMix 10 μL,ddH2O 7.8 μL。反应条件:94℃ 30 s;94℃ 5 s,60℃ 15 s,40个循环;72℃ 10 s。使用2﹣△△Ct方法计算CD14 mRNA相对表达量。
1.8 Western blot使用RIPA组织裂解液提取总蛋白质。利用12% SDS-PAGE进行电泳分离,将分离好的蛋白转移至PVDF(polyvinylidenefluo-ride)膜上,封闭保存2 h后,分别加入兔源CD14一抗(1∶500)与β-actin 一抗(1∶1 500)4℃孵育过夜。用磷酸缓冲液(PBST)洗膜后,加入羊抗兔二抗(1∶5 000)室温孵育1.5 h,PBST再次洗膜后,加入ECL化学发光剂使蛋白阳性信号可视化。Western blot结果使用AlphaEaseFC图像分析软件进行测定。
1.9 免疫组织化学染色石蜡切片60℃烤片3~5 h 后,进行脱蜡、脱水、抗原修复处理,然后根据免疫组化试剂盒中的说明滴加3% H2O2消除内源性过氧化物酶,PBS洗涤后用试剂A封闭30 min,随后分别滴加一抗(兔源CD14,1∶100)和PBS(阴性对照)于4℃ 孵育过夜。PBS洗涤后滴加二抗37℃孵育30 min,PBS再次洗涤后使用DAB显色,终止染色,最后经水洗、复染、脱水、透明后封片。免疫组织化学染色结果使用Sunny EX31 生物显微镜进行观察并拍照。

2 结果
2.1 CD14蛋白理化性质及结构预测根据NCBI网站已公布绵羊CD14基因CDS序列长度为1 122 bp,编码372个氨基酸。 ProtParam软件分析,CD14基因编码的蛋白质的相对分子质量、理论等电点和分子式分别为93.14 kD、4.17和C3239H5358N1122O1337S366;氨基酸组成成分中,半胱氨酸是主要氨基酸(32.6%),其次为甘氨酸(30.4%)、苏氨酸(19.1%)、丙氨酸(17.9%);CD14蛋白在哺乳动物网织红细胞中的半衰期为4.4 h,CD14蛋白的脂肪系数为17.91,平均亲水值为0.883,CD14蛋白的不稳定性系数为58.08,推测得此蛋白为疏水性不稳定蛋白。
2.2 CD14蛋白信号肽及跨膜螺旋结构域预测SignalP在线软件预测结果显示CD14具有信号肽,信号肽剪切位点位于20和21号氨基酸之间(图1A);TMHMM在线工具预测结果显示CD14不具有跨膜区域(图1B)。可推测CD14蛋白为分泌蛋白。

A.信号肽;B.跨膜结构域
2.3 磷酸化位点预测运用Netphos在线软件对CD14蛋白磷酸化位点预测,结果显示具有磷酸化位点;其中CD14蛋白具有59个苏氨酸(Thr)位点(图2)。

图2 CD14蛋白的磷酸化位点分析
2.4 CD14蛋白二级结构与三级结构预测通过SOPMA在线程序对CD14蛋白二级结构预测结果显示,CD14蛋白由161个无规卷曲(43.28%)、150个α螺旋(40.32%)、40个延伸链(10.75%)、21个β转角(5.65%)组成(图3 A);CD14(图3 B)蛋白三级结构预测结果显示其组成成分与二级结构相似,由无规卷曲、α螺旋、延伸链和β转角组成,且进一步在空间上扩展。
2.5 CD14基因CDS序列与其他物种间同源性分析根据序列比对结果如表1所示,绵羊CD14基因的CDS序列与山羊的氨基酸序列同源性最高为98.39%,与骆驼的同源性最低为74.93%;表明CD14基因在不同物种间进化水平相近。
2.6 CD14 mRNA在绵羊乳腺组织中的表达qRT-PCR结果显示,CD14 mRNA在健康与临床型乳腺炎绵羊乳腺组织中均有表达,且患有临床型乳腺炎乳腺组织中的CD14 mRNA的表达量显著(P<0.05)高于健康组(图4)。
2.7 绵羊乳腺组织中CD14蛋白的表达Western blot结果显示,CD14蛋白在绵羊健康乳腺组织与临床型乳腺炎乳腺组织中均有表达,且临床型乳腺炎乳腺组织中的CD14蛋白的表达量极显著(P<0.01)高于健康组(图5),与CD14 mRNA结果基本一致。

图3 CD14蛋白的二级结构与三级结构预测

表1 绵羊CD14基因CDS序列与不同物种间同源性比较
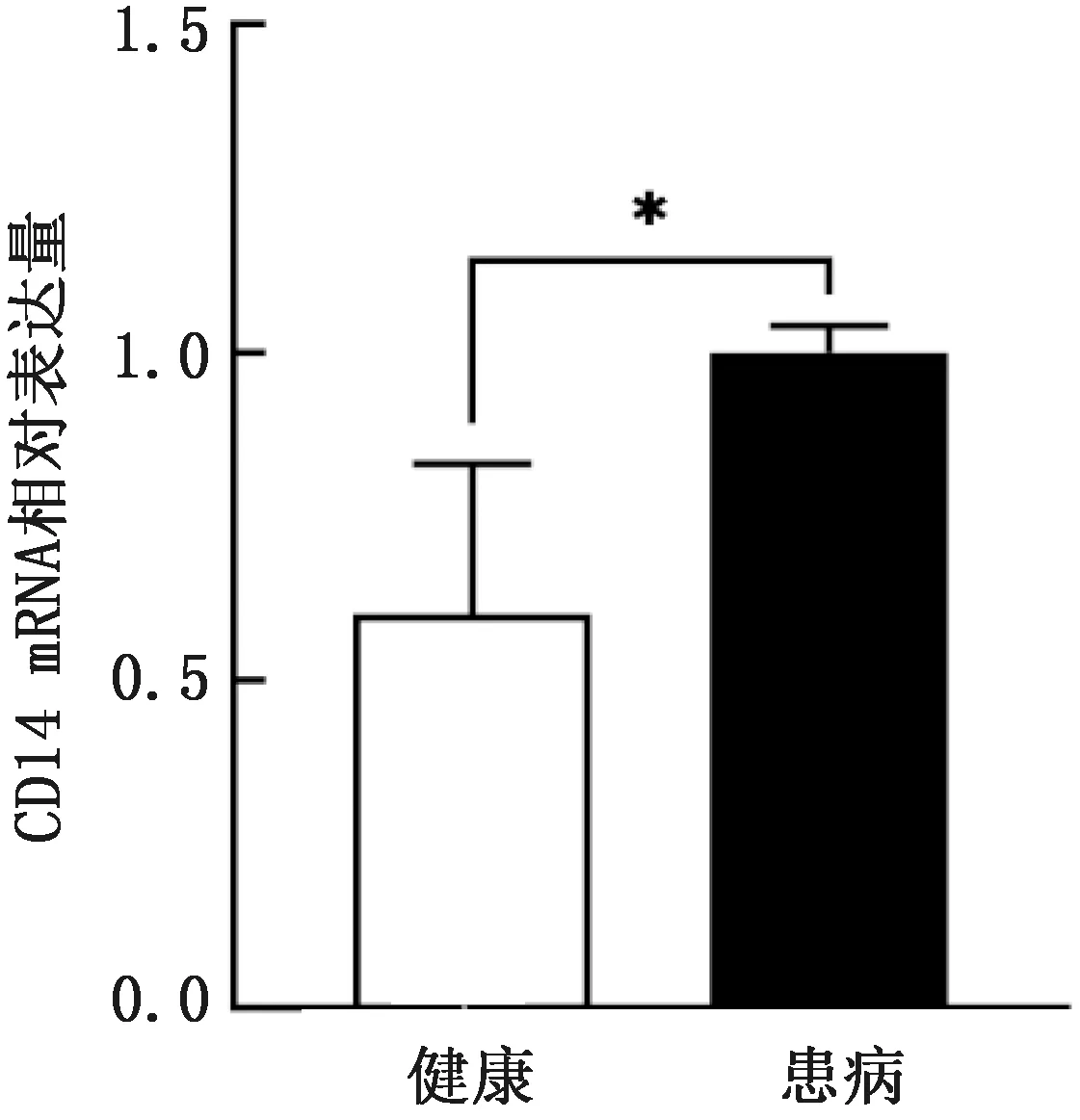
图4 CD14 mRNA的表达特征

图5 乳腺组织中CD14蛋白的检测
2.8 免疫组织化学检测CD14蛋白在绵羊乳腺组织中表达与定位染色阳性产物呈黄褐色,表明有该蛋白的分布。免疫组织化学染色显示,CD14蛋白阳性信号在健康和临床型乳腺炎乳腺组织中的分布和强度不同;在健康绵羊乳腺组织细胞中CD14蛋白主要存在于基质细胞中;而在患有临床型乳腺炎绵羊乳腺组织中则强烈分布于基质细胞和乳腺上皮细胞中(图6)。

A、B.分别为健康和临床型乳腺炎乳腺组织中CD14蛋白的表达;C、D.分别为健康和临床型乳腺炎乳腺组织的阴性对照;EC.乳腺上皮细胞;SC.基质细胞
3 讨论
CD14为LPS受体,存在于单核细胞、白细胞等表面分化抗原,具有识别、结合LPS及其复合物,在LPS介导的炎症反应中发挥重要作用[20]。LPS能够引起哺乳动物发生免疫反应,进而导致促炎因子的释放[21]。相关研究表明,CD14可识别特殊病原体表面的脂蛋白,从而激活CD14/TLR1-TLR2/p38 MAPK通路,诱导促炎因子分泌引起机体的炎症反应[22]。本试验通过对CD14基因序列进行预测,结果显示CD14基因CDS序列长度为1 122 bp,编码372个氨基酸;通过与其他物种氨基酸序列对比发现,CD14基因在不同物种间的进化保守性较高,这可能由CD14基因不同的生物学功能决定。
有研究表明,CD14单核细胞被认为是炎症性疾病的潜在治疗靶点,CD14的差异表达与抗原的加工和呈递、炎症反应、单核细胞的激活密切联系[23]。在胡蓉等[21]的研究中,对CD14基因的功能进行抑制,特异性的阻断CD14与LPS及LPS复合物结合,能够阻止以炎症反应为主的病理反应的发生。不仅如此,MARTEAU等[24]对患病组与健康受试者基因进行筛选比较,发现在高血压、肥胖或肥胖相关高血压个体中CD14基因表达存在差异。此外,HOPWOOD等[25]对人类骨关节炎患者差异表达基因进行筛选,同样发现CD14基因的差异表达。在CD14与炎症性疾病研究中,王晓敏等[26]对化脓性牙髓炎患者研究发现,CD14呈现高表达,而经过治疗后,表达水平降低。邓伟等[27]通过检测变应性鼻炎患者血清中发现CD14水平显著高于正常人群,并与疾病严重程度呈正相关。本试验中,临床型绵羊乳腺组织中CD14 mRNA和蛋白均显著高于健康组,与上述研究结果类似,推测在绵羊临床型乳腺炎乳腺组织中,CD14基因的高表达与乳腺炎的发生密切联系。FU等[28]研究表明,黄芩苷通过抑制CD14的表达,可抑制LPS诱导的TLR4/NF-κB p65通路激活和小鼠炎症反应。YOSHIO等[29]通过对产后母牛的初乳进行检测,发现CD14蛋白水平表达较低的母牛在产犊后1周内表现出感染乳腺炎的几率显著增加。SLADEK等[30]通过检测患有乳腺炎母牛乳腺组织中发现CD14蛋白表达水平显著高于正常母牛。进一步对CD14蛋白在健康和临床型乳腺炎乳腺组织中的定位检测发现,CD14蛋白强烈分布于临床型乳腺炎绵羊乳腺组织中的基质细胞与乳腺上皮细胞。推测可能是由于CD14基因表达上调,导致患临床型乳腺炎乳腺组织中基质细胞与乳腺上皮细胞中炎症反应加剧。因此,维持CD14基因表达量处于正常水平,对控制临床型绵羊乳腺炎的发生和治疗具有重要意义。

