纳米氧化锌对17℃保存猪精子质量的影响
胡启蒙,张云秋,黄 琴,高智清
(廊坊师范学院 生命科学学院 河北省动物多样性重点实验室,河北 廊坊 065000)
人工授精技术通常用于畜牧业生产[1],人工授精所需要的精源通常使用17℃液体保存,其具有成本低、便于运输以及不易污染等优点。但保存精子 会受到氧化应激和细菌感染损伤[2],特别是猪精子,因具有低胆固醇/磷脂比,对低温和氧化刺激较敏感,更容易在保存中受到损伤[3],通常采用研发稀释剂解决精子保存技术的瓶颈。目前,研究主要集中在外源添加抗氧化剂和抑菌剂,以减少精子损伤和维持精子正常功能。
纳米技术是生物技术的一个新兴领域,纳米氧化锌颗粒(ZnO NPs)是一种粒径为1~100 nm的氧化颗粒,其具有抗氧化性、杀菌性和安全性等优异性能且在生物医学领域已得到证实[4],并广泛应用于畜牧业生产[5],用于精子保存时可缓解精子在冷冻和解冻过程中造成的损伤。冷冻保存牛、鸡精子添加纳米氧化锌(ZnO)可提高解冻后精子质量[6]。已知锌在睾丸发育、精子发生、获能和精子运动中发挥重要作用[7]。
哺乳动物成熟精子是一种高度分化的细胞[8],成熟后几乎无新蛋白质生成,因此翻译后修饰成为精子功能的重要调控机制,其中蛋白磷酸化修饰是最重要的调节方式,在精子运动和能量代谢等过程中发挥重要作用[9]。线粒体是精子成熟后极少数被保留下来的细胞器之一,是产生ATP的主要场所,为精子运动提供能量保障[10]。
ZnO在猪精子保存过程中的效果和作用机理还未完全了解,本研究拟从精子质量(活力和膜完整性)、抗氧化层面分析ZnO NPs对保存猪精子全蛋白和亚组分(骨架和膜)蛋白的磷酸化修饰,探讨ZnO NPs对保存猪精子氧化应激缓解作用机理及对精子质量和蛋白磷酸化保护效果。
1 材料与方法
1.1 试验材料供试精子取自成年健康雄性杜洛克猪,精子活力良好(>70%)。用Androstar Plus稀释液按1∶2的比例稀释精液,700×g离心5 min,去掉1/3的上清液后,将剩余的精液重悬于Androstar Plus稀释液中,得到总体积为50 mL、精子终浓度为1×107个/mL的稀释精液。
1.2 主要试剂PKA底物磷酸化检测抗体购自CST公司,对应的二抗、荧光二抗购自上海碧云天生物技术有限公司。ZnO NPs(30~80 nm)购自南京先丰纳米材料科技有限公司。总超氧化物歧化酶(SOD)和微量丙二醛(MDA)测定试剂盒购自南京建成生物工程研究所。
1.3 溶液配制精子未获能培养液(pH7.4)配方为 2.7 mmol/L KCl、1.5 mmol/L KH2PO4、8.1 mmol/L NaH2PO4、137 mmol/L NaCl、5.55 mmol/L葡萄糖溶液和2 mmol/L丙酮酸钠溶液。
1.4 试验设计
1.4.1试验一 在5 mL稀释精液中添加不同质量浓度(0,20,50,100,200 mg/L)的ZnO NPs,在17℃恒温箱中保存,每12 h轻轻摇动溶液,避免精子沉淀。分别于保存1,3,5,7 d后检测0,50 mg/L处理组精子总抗氧化能力(T-AOC)和MDA含量;保存7 d后,收集各处理精子加入适量未获能培养液,在37℃、5% CO2细胞培养箱中培养2 h,用于检测各处理组(0,20,50,100,200 mg/L)精子质量(活力、膜完整性)和蛋白磷酸化。
1.4.2试验二 在100 mg/L ZnO NPs处理下添加1 mmol/L dbcAMP或0.1 mmol/L H-89,17℃恒温箱中保存7 d后,收集精子加入适量培养液,在37℃、5% CO2细胞培养箱中培养2 h后检测蛋白磷酸化。
1.5 精子质量检测
1.5.1精子活力 在光学显微镜下,使用37℃预热的精子计数板,观察各组200个精子的运动情况,统计前进运动精子的数量,前进运动精子率=(前进运动精子数量/200)×100%。
1.5.2质膜完整性 采用考马斯亮蓝染色法检测精子膜的完整性。质膜完整的精子顶体中含蛋白质成分可被考马斯亮蓝染液染成蓝色,质膜不完整的精子头部则不会被染色。用光学显微镜观察200个精子的染色情况,膜完整率=(染色精子数/200)×100%。
1.6 T-AOC活性测定使用T-AOC检测试剂盒,通过比色法测定,保存猪精液T-AOC活性,比色波长为520 nm,相关操作均严格按照试剂盒说明书要求进行。
1.7 MDA含量测定使用MDA含量检测试剂盒,通过比色法测定,保存猪精液MDA含量,比色波长为532 nm,相关操作均严格按照试剂盒说明书要求进行。
1.8 蛋白质免疫印迹
1.8.1蛋白的分离和定量 全蛋白提取:每组样品4℃、12 500×g离心5 min,用4℃ PBS清洗细胞沉淀,离心收集精子细胞,加入200 μL的蛋白裂解液,煮沸4 min。收集上清液后加入10% β-巯基乙醇沸水浴3 min,收集上清液即为蛋白样品。Triton溶解性和非溶解性蛋白提取:在精子样品中添加0.1% TritonX-100缓冲液,采用涡旋(5 min)和冰浴(5 min)循环30 min充分混合样品,低温高速离心,分离出Triton溶解性蛋白(上清)和Trtion非溶解性蛋白(沉淀),再加蛋白质裂解液得到蛋白样品,裂解方法与全蛋白相同。
1.8.2SDS-PAGE和免疫印迹法 蛋白质样品经12%丙烯酰胺凝胶电泳分离,使用转移电槽(10 V,12 h)转移到PVDF膜上。用1% BSA的TBST溶液封闭1 h后,将PVDF膜与一抗PKA底物磷酸化(1∶10 000)在4℃下孵育4 h,然后用T-TBS缓冲液洗涤。将PVDF膜与相应的二抗在4℃下孵育2 h,再将PVDF膜用ECL孵育1 min,随后于暗室中曝光,用Bio-Rad凝胶成像系统拍照。
1.9 免疫荧光检测将300 μL精子样品悬浮于10%甲醛溶液中,4℃固定至少12 h。将样品洗涤3次后均匀涂于载玻片上,在室温下风干2 h。用3.7%甲醛固定20 min,用渗透液渗透10 min,再用封闭液封闭2 h,每步骤间用洗脱液洗涤5次,每次3 min。精子样本用p-PKA抗体(1∶5 000)在4℃下孵育过夜。洗脱液洗涤一抗后,使用对应的荧光二抗(1∶2 000)在4℃下孵育2 h。通过荧光显微镜观察并拍照。
1.10 数据分析应用Image J图像分析软件检测蛋白免疫印迹的灰度值,用Excel录入数据,采用SPSS 20软件对数据进行单因素方差分析并对组间差异进行多重比较,差异显著水平设定为P<0.05。
2 结果
2.1 ZnO NPs对保存精子活力和膜完整性的影响由表1可以看出,ZnO组的精子活力与对照组无显著性差异,而50,100,200 mg/L ZnO NPs处理组精子膜的完整性显著高于对照组(P<0.05)。

表1 不同质量浓度ZnO NPs对17℃保存猪精子活力和膜完整性的影响 %
2.2 ZnO NPs对保存精子抗氧化能力的影响如表2所示,与对照组相比,50,100,200 mg/L ZnO NPs处理组精子的T-AOC活性显著提高(P<0.05)。ZnO NPs处理组的精子MDA均显著低于对照组(P<0.05)。在保存期间,以50 mg/L ZnO NPs处理为例进行选择天数检测发现,3 d后,ZnO NPs处理组的T-AOC活性显著高于对照组(表3),MDA含量显著低于对照组(表4)。

表2 不同质量浓度ZnO NPs对17℃保存猪精子T-AOC活性和MDA含量的影响

表3 不同保存时间下ZnO NPs对17℃保存猪精子T-AOC活性的影响 U/mg

表4 不同保存时间下ZnO NPs对17℃保存猪精子MDA含量的影响 μmol/L
2.3 ZnO NPs对保存精子PKA底物磷酸化的影响全蛋白可分为Triton溶解性蛋白(膜蛋白)和Triton非溶解蛋白(骨架蛋白)。由图1可以看出,100,200 mg/L ZnO NPs处理组精子全蛋白磷酸化灰度值显著高于对照组(P<0.05),其他处理与对照差异不显著。猪精子蛋白磷酸化免疫定位显示,ZnO NPs处理组的精子鞭毛中段和主段蛋白质磷酸化修饰增强(图2),这与蛋白免疫印迹结果一致。膜蛋白和骨架蛋白的磷酸化修饰变化趋势与全蛋白质相同,且ZnO NPs处理组的灰度值均显著高于对照组(P<0.05,图3,4)。
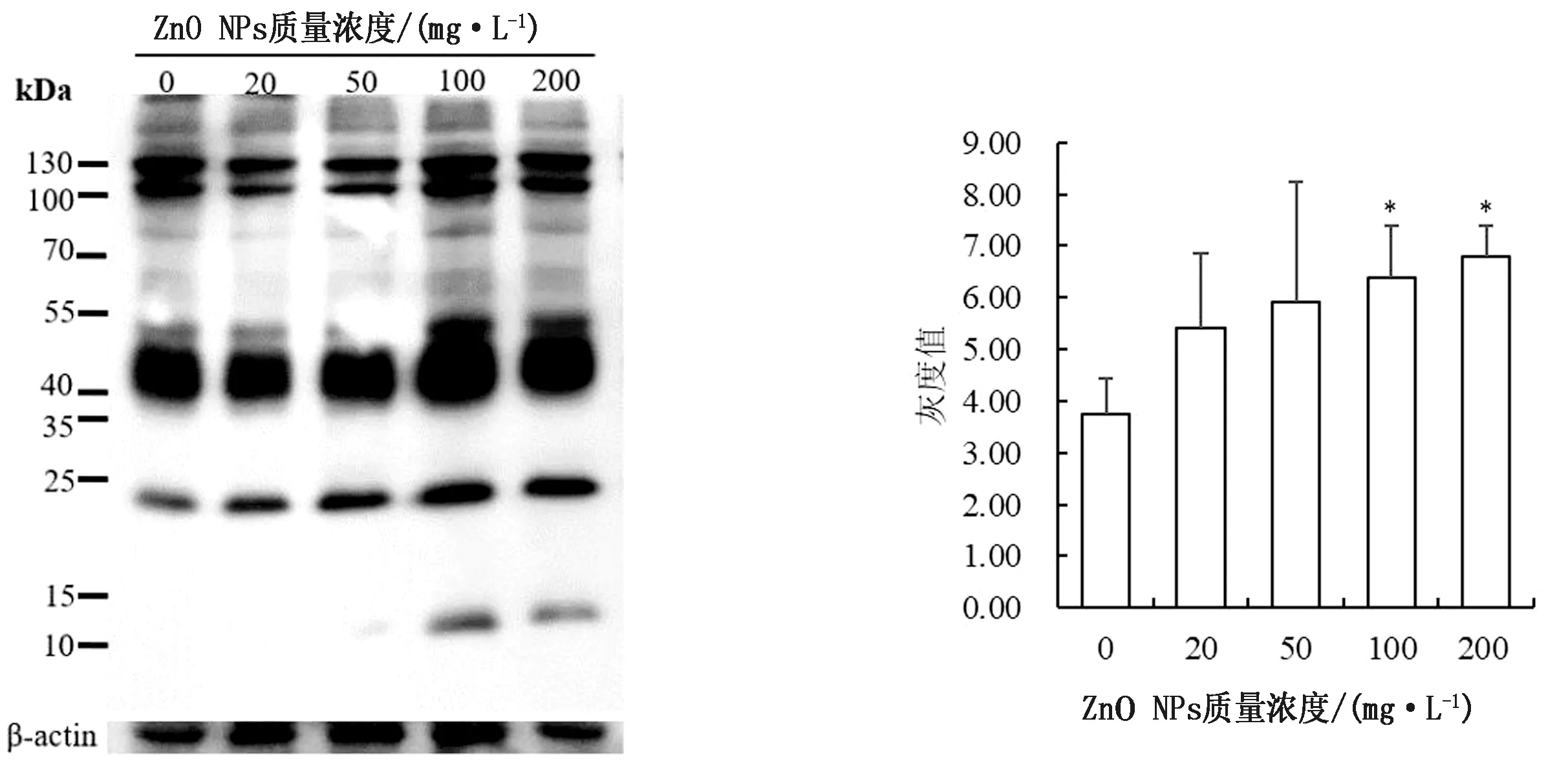
图1 不同质量浓度ZnO NPs对17℃保存猪精子全蛋白磷酸化影响的免疫印迹分析
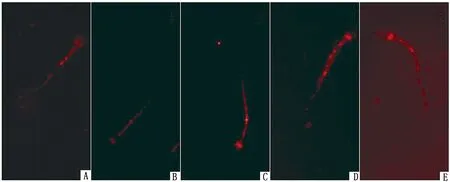
A~E.ZnO NPs质量浓度分别为0,20,50,100,200 mg/L
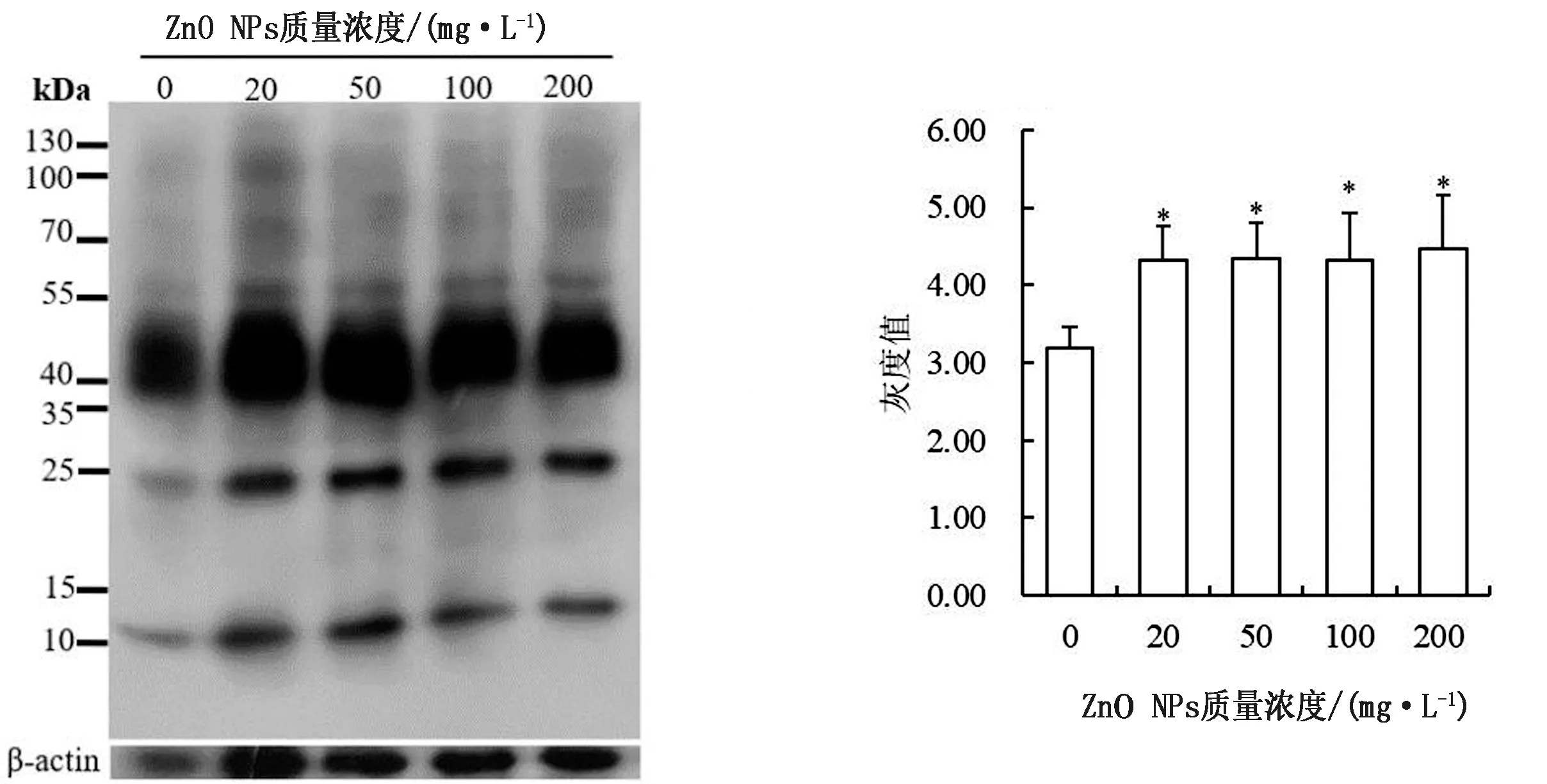
图3 不同质量浓度ZnO NPs对17℃保存猪精子Triton不溶性蛋白磷酸化影响的免疫印迹分析
2.4 ZnO NPs对cAMP/PKA通路的影响由图5可知,ZnO NPs+H-89处理组的蛋白磷酸化水平显著低于ZnO NPs组(P<0.05);ZnO NPs+dbcAMP处理组的蛋白磷酸化水平显著高于ZnO NPs组(P<0.05)。添加ZnO NPs不影响dbcAMP或H-89调节精子的磷酸化,表明ZnO NPs并不干扰cAMP/PKA通路,而cAMP/PKA通路是蛋白磷酸化最重要的信号通路。p-PKAs在猪精子中的免疫定位进一步证实了免疫蛋白印迹结果(图6)。
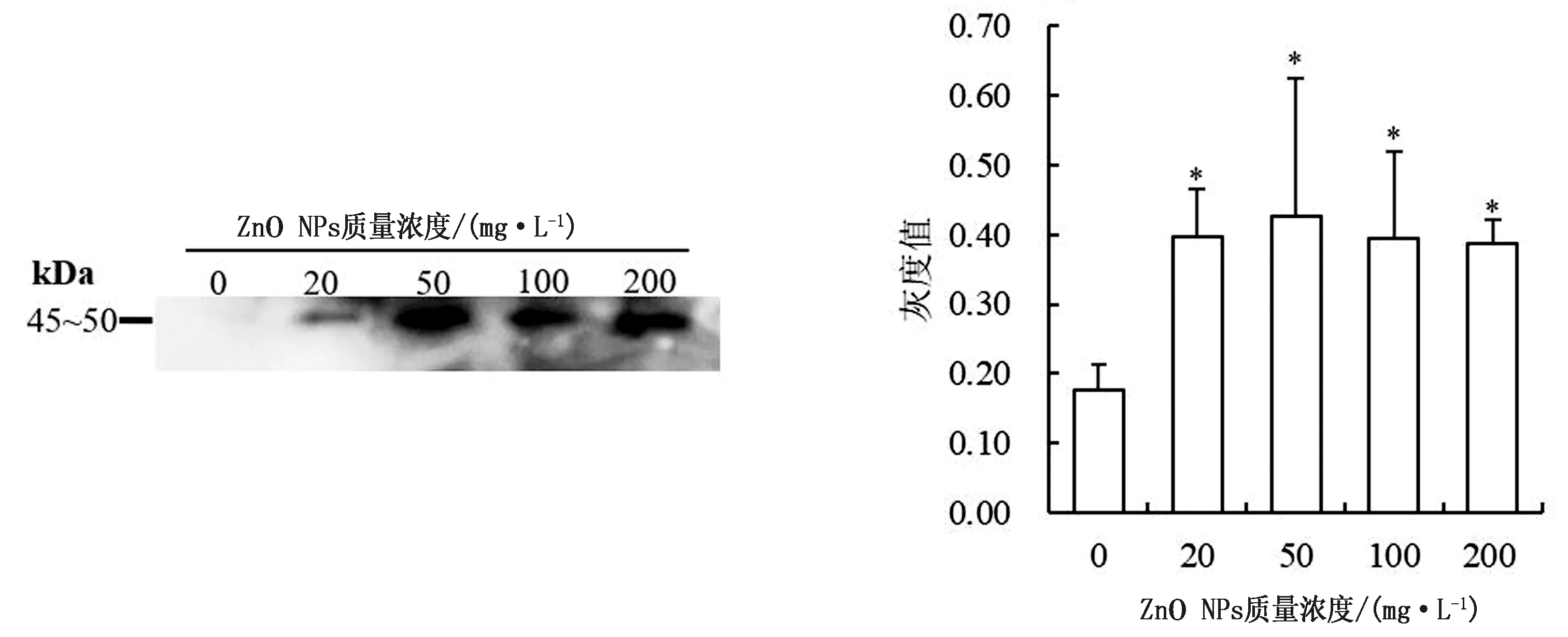
图4 不同质量浓度ZnO NPs对Triton溶解性蛋白磷酸化影响的免疫印迹分析
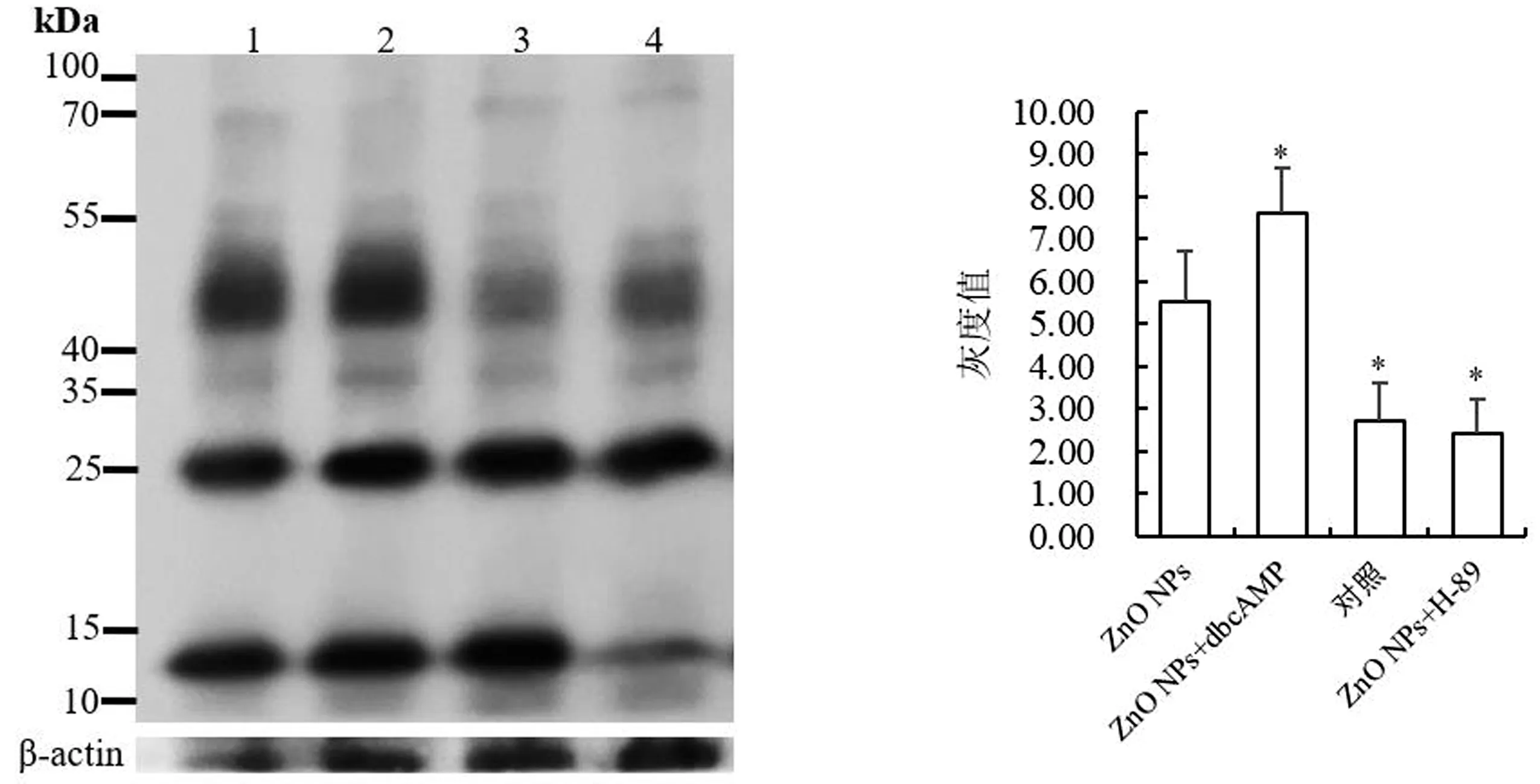
1.100 mg/L ZnO NPs;2.100 mg/L ZnO NPs+1 mmol/L dbcAMP;3.对照;4.100 mg/L ZnO NPs+0.1 mmol/L H-89
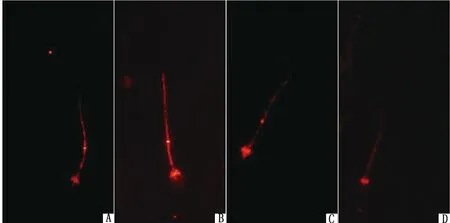
A.100 mg/L ZnO NPs;B.100 mg/L ZnO NPs+1 mmol/L dbcAMP;C.对照;D.100 mg/L ZnO NPs+0.1 mmol/L H-89
3 讨论
17℃保存动物精子是一种简单、经济、有效的方法,广泛应用于畜牧业生产中。但此技术由于细菌感染和氧化损伤的制约,只能有效储存约3 d[2]。在猪精子的保存过程中会产生活性氧(ROS)的积累,对精子功能造成损害[2]。研究发现,氧化应激是多种雄性生殖障碍的诱导因素,可通过抑制线粒体活性、降低精子活力或增加猪精子细胞膜的脂质过氧化的方式影响精子功能的正常发挥[11]。在精子保存稀释液中添加抗氧化物质可以消除精子中的MDA,减轻线粒体氧化磷酸化电子传递链的氧化损伤。ZnO NPs被证明可以保护精子膜和线粒体免受氧化应激,而抗氧化能力的提升可以明显改善精子在保存过程中的进行性活力和质膜完整性。
使用弱酸性环境保存精液可以抑制精子的运动,使其处于可逆的静止状态,减少能量消耗,不失去受精的能力[12]。添加ZnO NPs后,精子活力保持稳定状态,未诱导精子运动加速,这有利于精子的有效保存。哺乳动物的精子必须通过糖酵解和/或氧化磷酸化途径来产生ATP,以维持鞭毛的运动[10]。氧化磷酸化主要发生在精子中段的线粒体,糖酵解主要发生在精子的鞭毛主段。糖酵解所需的关键酶多集中于纤维鞘上。ZnO NPs可提高保存精子的膜完整性,对维持线粒体正常功能和糖酵解功能具有重要意义。该功能可能与ZnO NPs具有大的表面积、能够清除ROS、降低MDA诱导的氧化应激有关[13]。本研究发现,ZnO NPs提高了保存精子的T-AOC,T-AOC的提高可能与精子膜的完整性有关。
通过分析精子磷酸化发现,ZnO NPs可以保护细胞膜蛋白或细胞骨架蛋白的功能蛋白磷酸化。成熟精子是一种高度分化的细胞,其功能的调控主要通过蛋白翻译后修饰,其中蛋白质磷酸化是重要方式之一,蛋白磷酸化也成为反应精子功能的重要指标[14]。通过分析蛋白磷酸化修饰程度和位置,可为了解外源ZnO NPs对精子保护作用的分子机制及其在生殖技术中的应用提供理论基础。据报道,精子在低温保存后细胞骨架结构变化[15]。研究发现,冷冻保存后精子的总肌动蛋白的表达显著下降,肌动蛋白的位置改变,精子的体积和结构也发生改变[16]。受精前,精子需在雌性生殖道中获能,肌动蛋白聚合是参与哺乳动物精子获能的重要过程。肌动蛋白通常在尾部区域聚合,然后发展到头部区域,蛋白磷酸化可以调节肌动蛋白聚合[17]。同时,肌动蛋白在哺乳动物精子质膜和顶体外膜间的定位,在精子获能和顶体反应中起着关键作用[18]。
本研究发现,ZnO NPs可以保护猪精子膜的完整性。精子顶体含有多种水解酶,当与卵细胞融合时溶解卵细胞的保护层,促进精子的融合和受精[19]。保持精子顶体的完整性是确保精子完成复杂的受精过程的关键步骤。精子的长期储存需要考虑到猪精子具有脆弱和敏感的结构,具有低胆固醇/磷脂比,精子的结构完整性决定精子功能的完整性[20]。通过分析精子膜蛋白的磷酸化状态发现,添加ZnO NPs对精子膜有较强的保护作用。
本研究分析了蛋白磷酸化和cAMP/PKA调控。调控精子蛋白磷酸化的信号通路是复杂而多样的,研究最广泛的途径是cAMP/PKA信号通路[9]。在保存稀释液中添加ZnO NPs并不影响cAMP/PKA调控精子蛋白磷酸化的能力。精液保存中补充抗氧化剂保护精子是一个重要的研究内容。本试验利用精子评估了ZnO NPs作为一种替代型抗氧化剂的安全性,ZnO NPs其特有的物理和化学特性,使得外源性添加ZnO NPs可有效提高保存精子抗氧化能力,提升保存精子的膜完整性,保证了精子蛋白磷酸化正常修饰作用。
通过外源添加抗氧化剂来保护精子免受氧化应激是当前辅助生殖技术的重要研究课题。本研究结果表明,ZnO NPs作为公猪精液稀释剂的补充物是安全可行的,有助于更全面地了解ZnO NPs对精子保护作用的分子机制。

