提高污泥含固率对高温厌氧消化互营产甲烷影响
朱俊兆,卓 杨,华飞虎,周梦雨,王雪娜,刘金洋,韩 芸
提高污泥含固率对高温厌氧消化互营产甲烷影响
朱俊兆,卓 杨,华飞虎,周梦雨,王雪娜,刘金洋,韩 芸*
(西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
以常规含固率(2%)剩余污泥高温厌氧消化排泥为接种污泥,分析接种污泥在不同氨浓度下厌氧消化各步骤的动力学速率变化,并以热水解预处理的高含固污泥(10%)为基质进行连续试验,探讨高温厌氧消化条件下基质由常规含固率快速切换至高含固率的产甲烷性能变化.结果表明,随着氨浓度上升,接种污泥对乙酸、丙酸、丁酸和热水解污泥的比产甲烷活性均有所下降,但其氢利用速率和互营乙酸氧化速率未受到显著影响.高温厌氧消化基质含固率由2%切换至10%连续运行试验结果表明,在有机负荷高达14g COD/(L·d)时,虽然系统COD去除率不足(27.99±3.66)%,且存在VFAs积累(10.41±2.25)g COD/L,但pH值仍可稳定在(7.74±0.09),说明该切换策略具有可行性.稳定运行系统中产氢产乙酸和互营乙酸氧化功能菌属以(15.29%)、(8.89%)(17.99%)和(1.60%)为主,切换后乙酸营养型产甲烷菌被淘汰,而参与互营乙酸氧化过程的和相对丰度显著提高,说明体系通过构建互营乙酸氧化产甲烷途径来抵御高温高氨的环境胁迫.因此,以常规含固率高温厌氧消化污泥作为接种泥是实现由常规含固率切换至高含固热水解-高温厌氧消化的有效策略,并且接种污泥的互营乙酸氧化活性是切换成功的关键因素.
高含固污泥;高温厌氧消化;热水解预处理;互营乙酸氧化;氨抑制
厌氧消化作为广泛应用的污泥稳定化和资源化技术,可将污泥中的生物质能以甲烷形式回收[1].近年来,污泥热水解预处理技术的发展将厌氧消化污泥含固率提升至10%以上,可有效解决高含固污泥在厌氧消化时传质受阻和中间产物积累的问题[2].高含固污泥热水解厌氧消化工艺具有机负荷高和投资低等优势,成为城市污水处理厂污泥厌氧消化系统改进工艺的主推方向之一[3].高温厌氧消化是高含固热水解预处理技术理想的耦合工艺,厌氧消化在高温条件下不仅拥有更快的产甲烷速率,而且有利于热水解换热过程中的能量回收[4].然而,高含固热水解-高温厌氧消化(THP-TAD)具有高氨和高pH值的特点,并且在高温下大幅上升的游离氨将对厌氧消化过程产生更强的抑制作用[5].除此之外,有机负荷和高温条件极易致使产甲烷菌受到抑制作用,进而导致氢分压上升和挥发性脂肪酸(VFAs)过量积累,最终导致反应器的酸化甚至崩溃.因此,在高氨氮环境下维持稳定的产甲烷性能是THP-TAD需要解决的首要问题.
互营乙酸氧化菌(SAOB)是与产甲烷作用相关的核心菌群[6].SAOB通常适宜在高温下将乙酸氧化为H2与CO2,继而被氢营养型产甲烷菌利用[7],即互营乙酸氧化产甲烷过程(SAO-HM).在不利于乙酸营养型产甲烷菌生长的厌氧环境下,SAOB通常会调节乙酸降解动力学[8].例如在高氨[9]和高VFAs[10]环境中,互营乙酸氧化产甲烷是降解乙酸的主要途径.因此,在厌氧体系中建立SAO-HM是实现THP-TAD的关键因素,已有研究证实可通过氨诱导和酸诱导逐步建立SAO-HM[11-12].在常规高温厌氧消化切换至高含固热水解-高温厌氧消化过程中,低氨低VFAs环境会逐渐转向高氨高VFAs环境,更有利于SAOB与氢营养型产甲烷菌建立互营关系.此种切换方式是在THP-TAD体系下实现SAO-HM途径的潜在策略,而目前对其可行性及运行特性尚缺乏研究.
本研究以常规高温厌氧消化污泥为接种泥开展THP-TAD切换试验,通过分析氨抑制条件下常规高温厌氧污泥代谢典型基质的产甲烷特性,特别是不同氨浓度下的氢利用速率以及互营乙酸氧化速率以探讨该策略的可行性.通过监测连续运行反应器中指标以评估该策略的适用性,并探讨切换后的核心菌群和产甲烷菌之间的代谢关系,为高含固热水解-高温厌氧消化系统启动和工艺优化提供技术支撑.
1 材料与方法
1.1 接种污泥与基质
接种污泥取自实验室稳定运行280d以上的常规高温厌氧消化反应器(55 ± 1)℃,接种污泥基本指标如表1所示.该反应器有效容积5L,基质为剩余污泥,COD去除率为(34.39 ± 2.83)%,水力停留时间(HRT)20d.连续运行试验所用消化基质为热水解预处理的剩余污泥,剩余污泥取自西安市某污水处理厂(A2/O工艺),脱水后调整含固率至10%,后置于热水解反应釜(KCF-5,北京世纪森朗),热水解条件为165 ℃、30min.消化基质于4 ℃冰箱保存待用.样品预处理方法:将污泥样品于10000r/min离心10min后(5804R,Eppendorf),取上清液测定溶解态指标,将污泥样品在超声破碎机中破胞进行总化学需氧量测定.接种污泥和消化基质指标见表1.
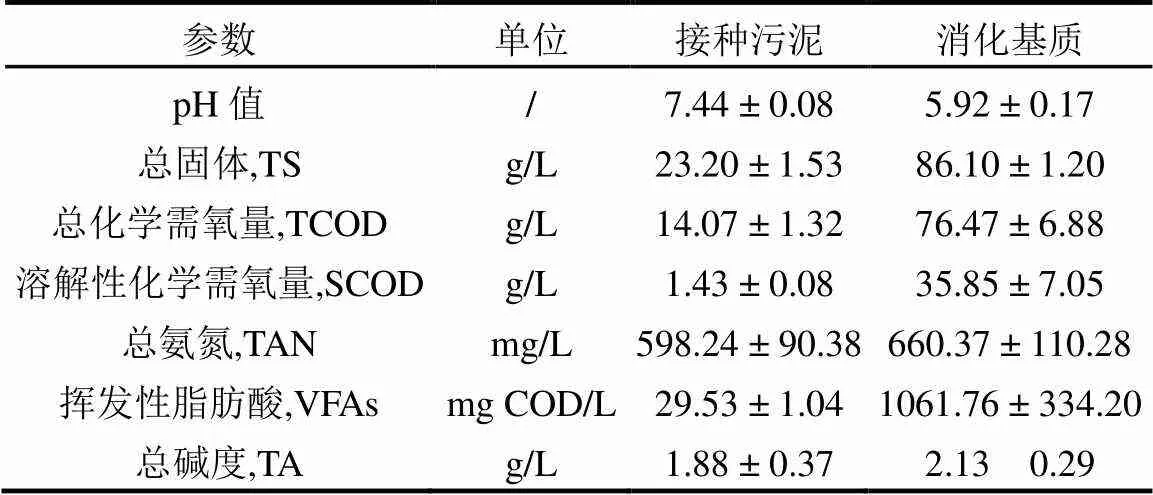
表1 接种污泥和消化基质基本指标
注:“/”表示该指标无单位.
1.2 试验设置
1.2.1 比产甲烷活性测定 为探究氨氮浓度对接种污泥底物代谢的影响,试验测定了不同氨氮浓度下接种污泥对典型基质的比产甲烷活性(SMA),采用有效容积120mL厌氧瓶一式3份进行,操作流程如图1所示:
各试验组氨氮浓度为接种泥所含有的氨氮浓度及氨氮投加浓度之和,未包含热水解滤液投加导致的氨氮浓度增加(约28.88mg/L).产生的气体用玻璃注射器测量体积后用排水集气法收集,并利用气相色谱仪测量气体组分.计算公式为:

式中:SMA为比产甲烷活性,mLCH4/(gVSS·d);CH4为累计甲烷产量,mL;R为厌氧瓶中添加的污泥量,L;VSS为所用污泥的挥发性悬浮固体含量,g/L;为时间,d.
图1 比产甲烷活性测定流程
Fig.1 The measurement process of specific methanogenic activity
1.2.2 氢利用速率和互营乙酸氧化速率 为表征其代谢速率,设计测定装置如下:
(1)氢利用速率测定使用文献[13]所示的方法,计算公式为:
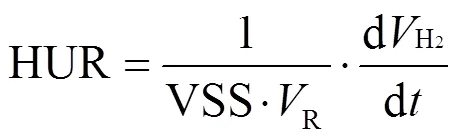
式中:HUR为氢利用速率,mLH2/(gVSS·h);H2为累计氢气消耗量,mL;R为厌氧瓶中添加的污泥量,L;VSS为所用污泥的挥发性悬浮固体含量,g/L;为时间,h.
同型产乙酸速率测定:杀灭产甲烷菌后,测定方法和计算方法与氢利用速率相同.
(2)互营乙酸氧化速率测定装置:如图所示,将一定体积已杀灭产甲烷菌的厌氧污泥置于厌氧瓶,投加适量乙酸钠作为消化基质,厌氧瓶顶空与气袋相连接以扩大顶空体积,设置蠕动泵加速气体循环,每隔一定时间在厌氧瓶中取样,测定液体样品中的乙酸浓度,在气袋中采样测定气体中的氢气含量.计算公式为:
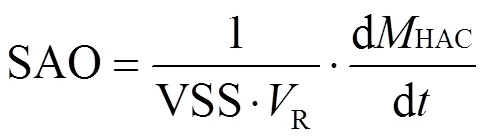
式中:SAO为互营乙酸氧化速率,mgHAc/(gVSS·h);HAc为乙酸消耗量,mg;R为厌氧瓶中添加的污泥量,L;VSS为所用污泥的挥发性悬浮固体含量,g/L;为时间,h.
1.2.3 连续运行试验设置 实验设置4个连续运行的完全混合厌氧反应器,反应器有效容积均为1.2L,HRT分别为20、15、10和5d,依次编号R1~R4,反应器接种常规高温厌氧消化污泥800mL,并以热水解污泥为基质进行连续运行试验,采用集气袋收集气体,每日手动进排污泥.在连续运行期间监测VFAs、TAN、COD、容积产气率和碱度等指标.
1.3 理化指标分析
TS和VSS均采用重量法测定;COD采用重铬酸钾法测定;pH值采用上海精科PHS-3CpH计测定;碱度采用滴定法测定,总碱度的滴定终点为3.8[14];氨氮采用纳氏试剂分光光度法测定;VFAs测定采用气相色谱法(BEIFEN Corp.3420A、FID检测器),色谱柱为DB-FFAP毛细柱(50m × 0. 32mm × 0.50μm),测定条件为初始柱箱温度120℃,保持初始柱箱温度1min后进入升温程序1,升温程序1以10℃/min速率升温,最终温度为180℃,最终保持时间5min,然后进入程序2,程序以10℃/min速率升温,最终温度为220℃,最终保持时间5min.进样口温度180℃、检测器温度250℃;气体组分包括CH4、CO2、H2和N2,采用气相色谱法(BEIFEN Corp.3420A、TCD检测器),色谱柱为兰化TDX-01(3mm×2m),测定条件为进样口温度80℃、柱箱温度100℃、检测器温度100℃.
游离氨(FAN)浓度依据文献[15]中的公式计算:
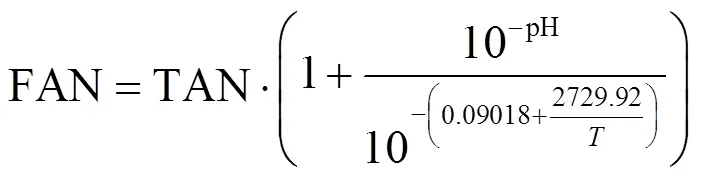
式中:FAN为游离氨,mg/L;TAN为总氨氮,mg/L;为厌氧消化热力学温度,K.
Gompertz方程广泛应用于估算甲烷产量和氢气消耗量,利用修正的Gompertz方程拟合产甲烷和耗氢的动力学曲线,得到相关参数并评估了参数与模型的拟合度,其方程如下式所示:
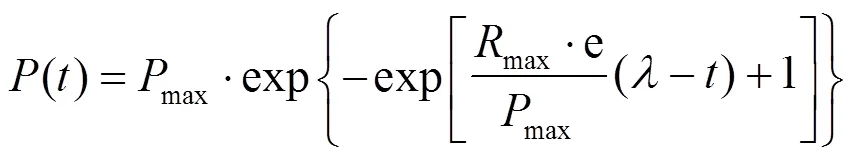
式中:()为时间时刻累计甲烷产量或耗氢量,mL;max为最大累计甲烷产量或耗氢量,mL;max为最大甲烷产率或耗氢速率,mL/d或mL/h;为滞后时间;为消化时间;e为自然指数常数.
1.4 微生物群落分析
为探讨切换前后微生物群落结构变化,在稳定运行的常规高温反应器C1和切换完成后的R1~R4高含固热水解高温反应器中采集微生物样本.使用E.Z.N.ATMMag-Bind Soil DNA Kit (OMEGA, M5635-02)对样本进行DNA抽提.利用Qubit3.0DNA检测试剂盒对基因组DNA精确定量后,以确定PCR反应加入的DNA量.细菌PCR第一轮扩增所用引物为341F(5'-CCTACGGGNGG- CWGCAG-3')和805R(5'-GACTACHVGGGTATC- TAATCC-3').第二轮扩增引入Illumina桥式PCR兼容引物.古菌引用槽式PCR扩增有三轮,第一轮使用340F(5'-CCCTAYGGGGYGCASCAG-3')和1000R (5'-GGCCATGCACYWCYTCTC-3')进行引物扩增.第二轮使用第一轮PCR产物进行扩增,349F(5'- GYGCASCAGKCGMGAAW-3')和806R(5'-GGA- CTACVSGGGTATCTAAT-3'),第三轮扩增引入Illumina桥式PCR兼容引物.细菌和古菌PCR所用引物均融合了测序平台的V3~V4通用引物.通过2%琼脂糖凝胶电泳检测文库大小,使用Qubit3.0荧光定量仪进行文库浓度测定,最后在Illumina平台进行高通量测序.数据处理由上海生工生物工程股份有限公司完成.
2 结果与讨论
2.1 不同氨浓度下常规含固率高温厌氧污泥的产甲烷特性
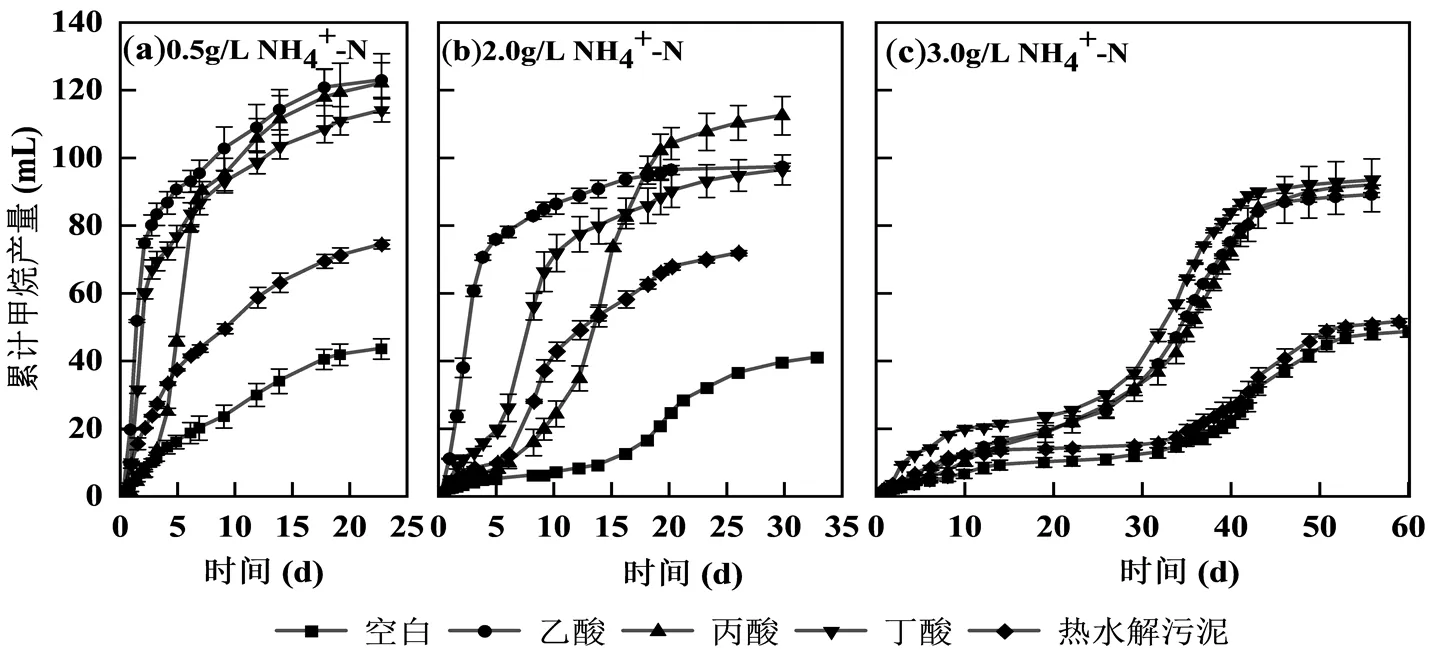
图2 不同氨浓度接种污泥对典型基质的产甲烷特性
为探讨常规含固率高温厌氧消化污泥作为接种污泥实现高含固热水解-高温厌氧消化的可行性,对常规高温厌氧污泥在不同氨浓度下代谢典型基质的产甲烷性能进行测定,结果如图2所示,在0.5和2.0g/LNH4+-N时,乙酸、丙酸和丁酸的累计产甲烷量基本相同,分别为(62.21±5.82)和(44.01± 12.61) mLCH4,而热水解污泥的累计产甲烷量明显低于其他组,仅为(23.99±2.52)和(16.70±0.90)mLCH4,这是由于热水解污泥含有的抑制物会影响产甲烷性能[16].在2g/LNH4+-N时,丙酸组累计产甲烷量略高于乙酸和丁酸,这可能是不同VFAs的产氢产乙酸反应过程差异及接种泥的乙酸裂解、氧化反应在不同氨浓度下的抑制性导致.丙酸组具有最长的滞后期,为2.74d(表2),丙酸是高温厌氧消化系统中最易积累的VFAs之一,与其他VFAs相比其对产甲烷菌的毒性最大,故而代谢缓慢[17].产甲烷菌可以直接利用乙酸产生甲烷,而代谢丁酸微生物的比生长速率较大,尤其是在高温条件下可达到0.77d-1,故丁酸作为底物时也极易降解,通常难以发生积累[18].图2中空白组最大产甲烷速度早于部分基质组,因此对最大甲烷产量及最大产甲烷速率进行数据拟合,随后将最大甲烷产量及甲烷产率减去空白组,其结果见表2.SMA由最大产甲烷速率折算至每克挥发性悬浮固体.SMA在0.5g/LNH4+-N下最大.随着氨氮浓度增加到2.0g/LNH4+-N,各组SMA分别下降了28.05%,57.89%,61.27%和13.33%.其中,乙酸和热水解污泥的下降程度较小,这说明乙酸裂解型产甲烷依然贡献度较大,且微生物对热水解污泥的适应性较强.
当氨氮浓度增加到3.0g/LNH4+-N时,产甲烷过程明显呈现两段式产气,见图2.在第一阶段,各组SMA均受到严重抑制,相较于2.0g/LNH4+-N分别下降了97.12%,94.74%,77.27%和80.17%.接种污泥体系中的产甲烷途径为乙酸裂解型产甲烷,但乙酸营养型产甲烷菌对氨耐受能力较差,导致产甲烷过程近乎停滞[19].研究表明,互营乙酸氧化产甲烷途径占比在大于3.0g/LNH4+-N时会显著增加[20],而接种污泥的氢营养型产甲烷菌相对丰度较低,这可能是导致氨氮浓度提升至3000mg/L后SMA降幅较大的原因.在第二阶段时,除热水解污泥组下降外,其余各组的SMA分别提升至76.67%,83.33%和44.44%,这可能是由于参与SAO-HM过程的微生物对氨氮具有更高的耐受能力,在高氨氮环境中对乙酸代谢起重要作用.同时,第二阶段中热水解污泥组SMA下降,可能是高氨氮环境与热水解污泥携带的抑制物协同作用,对微生物产生抑制[21].
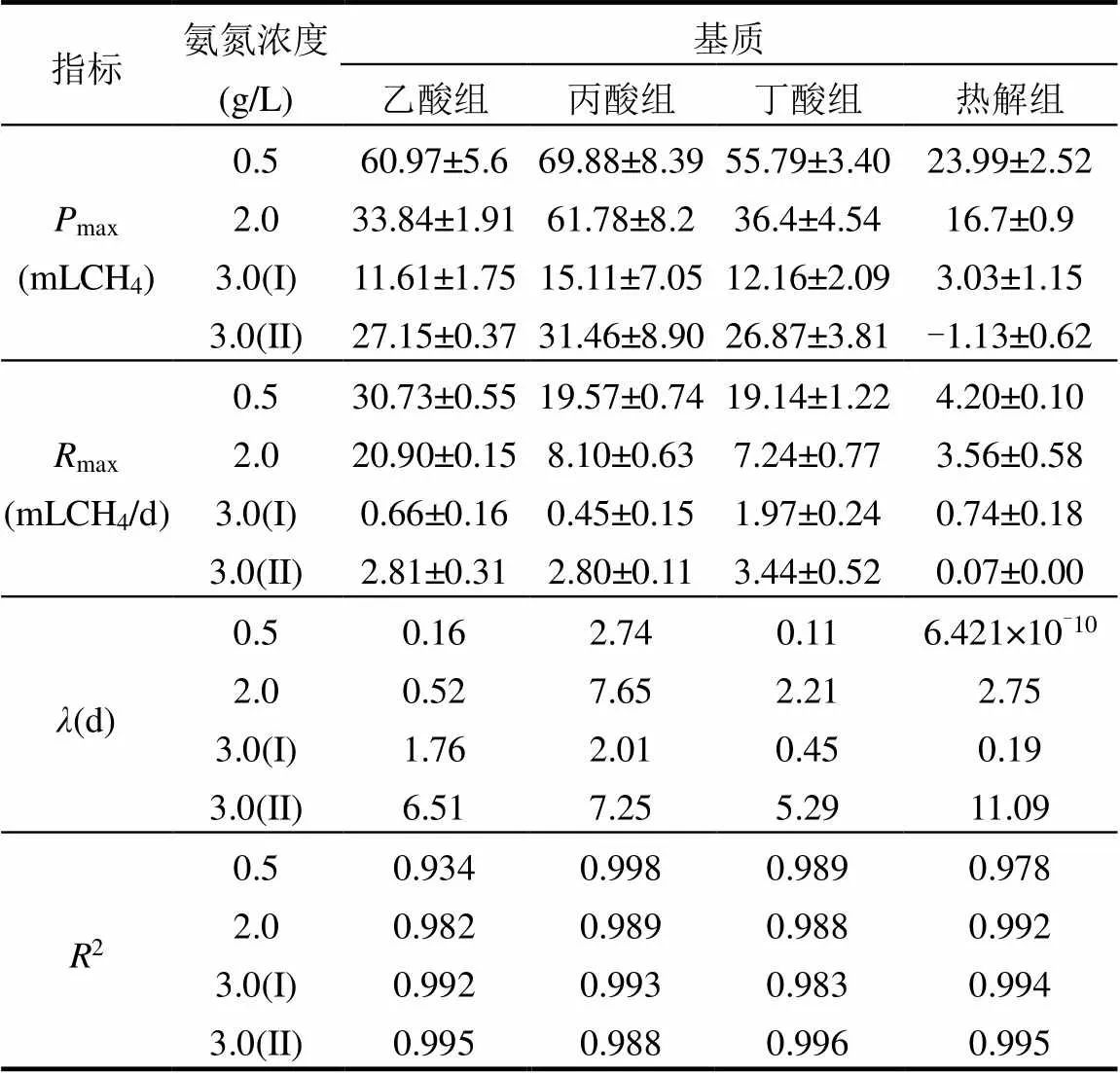
表2 不同氨浓度下接种污泥对典型基质代谢的动力学参数
注:由于3g/LNH4+-N时为两段式产气,故分别进行拟合.
2.2 氢利用速率及互营乙酸氧化速率
氢利用速率和同型产乙酸速率大小能够反映接种污泥对厌氧系统氢分压的调控潜能.对不同氨浓度下常规高温厌氧污泥的氢利用速率、同型产乙酸速率和互营乙酸氧化速率进行测定,由图3(a)和(b)可知,氢营养型产甲烷菌和同型产乙酸菌能快速适应高氢分压环境.

在测定开始时其耗氢量便快速增长,此时装置中的氢气基质充足,反应不受限制,在经过3~4h后,由于氢分压降低,反应受基质浓度限制速率逐步减缓,其总氢利用速率和同型产乙酸速率在2.0g/ LNH4+-N时达到最大,分别为(6.98±0.86)和(6.65± 0.41)mLH2/(gVSS·h),而在3.0g/LNH4+-N时,氢利用速率为(5.26±0.28)mLH2/(gVSS·h),与2.0g/LNH4+-N相比仅下降24.79%.接种的常规高温厌氧污泥以乙酸营养型产甲烷菌为主,在0.5g/ LNH4+-N时其乙酸的SMA为(40.96±0.16)mLCH4/(gVSS·d),而在3.0g/ LNH4+-N时乙酸SMA仅为(3.65±0.48)mLCH4/ (gVSS·d),与2.0g/LNH4+-N相比下降87.76%,氨氮浓度上升对乙酸SMA影响较大.对氢利用速率进行单因素ANOVA检验,显著性为0.252(>0.05),这说明氨氮浓度对氢利用速率影响不显著.氢营养型产甲烷菌是高氨氮环境下主导产甲烷过程的功能菌群[22],彭韵等[23]发现在高氨氮环境中,乙酸型产甲烷途径会发生转变,而氢型产甲烷途径相关基因依然保持稳定.上述结果为高氨氮环境下实现互营乙酸氧化产甲烷奠定了基础.
SAOB是高氨氮环境中代谢乙酸的核心菌群,其活性大小能间接表征厌氧微生物通过互营乙酸氧化产甲烷的代谢速率.由图3(c)可知,在2.0g/ LNH4+-N时,其互营乙酸氧化速率和同型产乙酸速率均最高,分别为(5.16±0.51)和(6.65±0.41)mLH2/ (gVSS·h).同型产乙酸和互营乙酸氧化速率同时偏高的原因可能是由于它们是同一种SAOB介导,因为部分SAOB同时具有互营乙酸氧化功能和同型产乙酸功能[24,25],接种污泥的互营乙酸氧化速率在0.5和3.0g/LNH4+-N时分别为(4.74±0.33)和(4.40± 0.30)mgHAc/(gVSS·h).对互营乙酸氧化速率进行单因素ANOVA检验,显著性为0.534(p>0.05),此结果说明常规含固率高温厌氧消化污泥在高氨氮或低氨氮环境中,即便乙酸营养型产甲烷菌被抑制也依然保持代谢乙酸的能力,说明采用该污泥作为接种泥强化SAO-HM途径实现高含固热水解-高温厌氧消化具备可能性.
2.3 切换过程中高含固热水解高温厌氧消化的运行特性
2.3.1 反应器运行性能 以2%含固率高温厌氧消化污泥为接种污泥,经热水解预处理的10%高含固污泥为基质,采用小试CSTR系统开展连续运行实验.各反应器共运行69d,CSTR系统运行性能和OLR如图4所示.系统在启动大约12d后产气量达到稳定,容积产气率分别稳定在 (0.40±0.09),(0.61±0.12), (0.95±0.17)和(1.79±0.22)L/(L·d),且在较短的HRT也可以有效转化有机物.在高OLR下,系统仍可维持一定的有机物去除率.在稳定期时COD去除率分别为(37.76±3.11)%(HRT为20d),(33.04±3.28)%(HRT为15d),(30.62±3.71)%(HRT为10d)和(27.99±3.66)% (HRT为5d).OLR最高时的COD去除率相比最低时下降25.87%,表明更高的OLR可能会使微生物承受的负荷更大,进而导致COD转化率降低[26].同时,VS去除率分别为(35.65±2.68)%,(30.57±3.04)%, (28.47 ±2.57)%和(26.13±2.34)%.Wu等[27]分析了水热预处理后的高含固污泥高温厌氧消化去除率,热水解后的污泥TCOD为83.6g/L,VS/TS为0.55,高温条件下反应器的COD去除率为37.8%,与本研究的去除率接近.说明在高氨氮、高酸以及高负荷冲击环境下,系统仍然能保持正常的COD去除率.因此,提高含固率是实现高含固热水解-高温厌氧消化的合理策略.
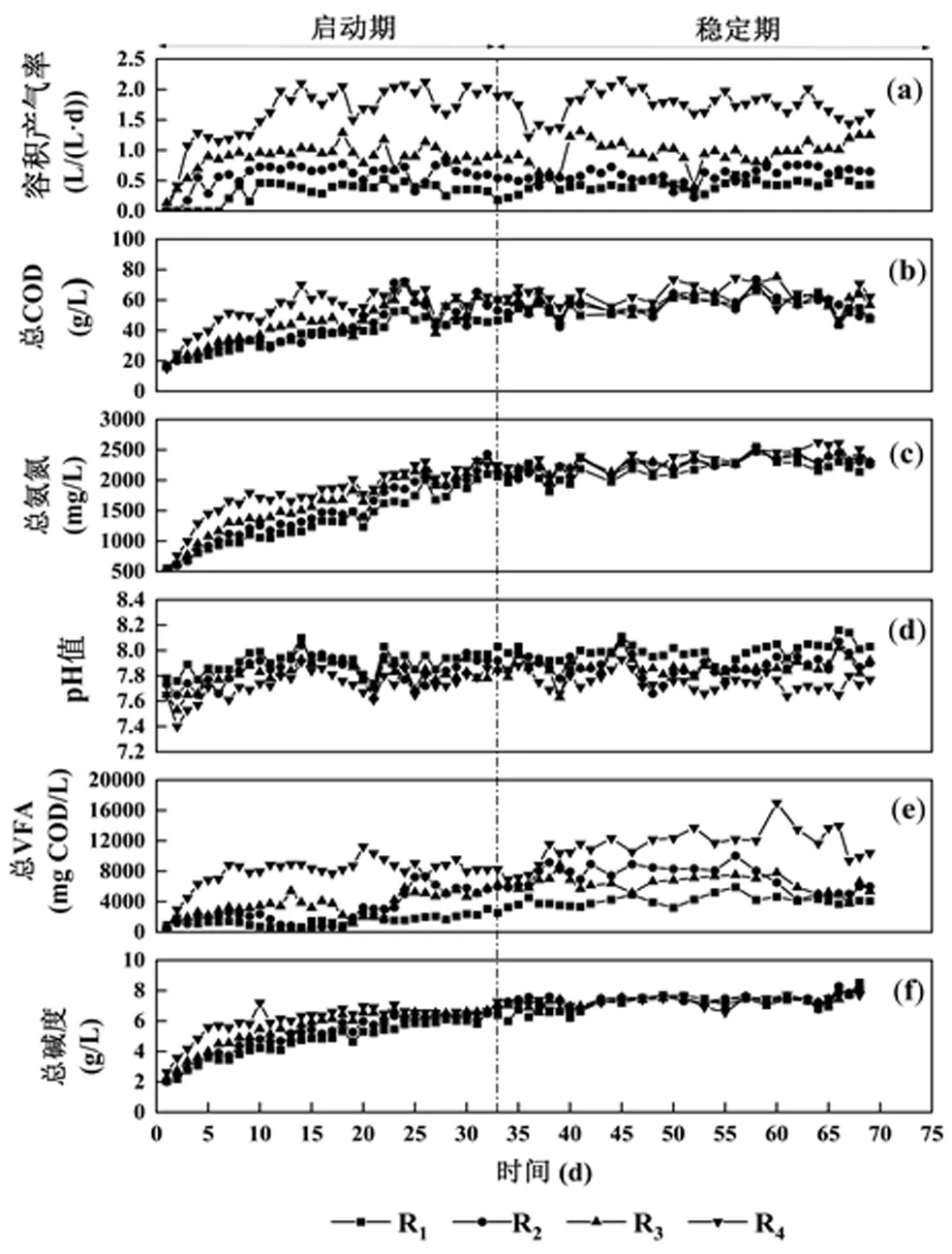
图4 切换过程中高含固热水解高温厌氧消化的运行特性
氨抑制是影响高温厌氧消化过程稳定性的重要因素[28],在本实验切换过程中却未出现明显的氨抑制现象.常规高温厌氧污泥的总氨氮浓度为(599.98± 90.12)mg/L,在基质改变为热水解污泥后,各反应器的总氨氮浓度逐渐上升,在稳定期时,各反应器总氨氮浓度达到(2349.37±110.22)mg/L(见图4).游离氨可对微生物表现出更强的毒性,但也存在高游离氨浓度环境下系统稳定运行的现象,Kim等[29]发现游离氨浓度达到700mg/L时系统仍能稳定运行不受抑制.Calli等[30]将配水运行的厌氧消化系统游离氨浓度提升至800mg/L,但COD降解率仍能维持在78%~96%.戴晓虎等[31]认为厌氧消化氨抑制研究的重点不仅在于获得抑制阈值浓度,更应该倾向于解析游离氨浓度带来的微生物种群结构和代谢途径的变化.在高温厌氧消化由常规含固率提升至高含固率过程中,游离氨浓度由接种污泥的(87.80±7.60)mg/L增加至切换完成后的(665.65±121.29)mg/L,在此过程中,游离氨上升很可能会造成微生物种群结构的变化,进而导致产甲烷途径的改变.在高氨氮厌氧消化环境中,互营乙酸氧化产甲烷途径占甲烷生成的68%~75%[32],该途径的转变有利于体系中的乙酸降解乃至其余VFAs氧化反应.因此,氨氮浓度提升对于切换过程中产甲烷途径的转变至关重要.
2.3.2 pH值、VFAs、碱度及氢分压 pH值、VFAs、碱度是影响体系稳定性的主要因素,能反映厌氧体系的酸碱平衡和缓冲能力[33].在切换过程中,所有反应器的pH值在稳定期均保持在7.6~8.2之间,在启动期(第1~33d)pH值均在不断升高,这是由于基质中蛋白质含量随着含固率升高.同时,这也导致各反应器在切换过程中总碱度在不断上升,最终每台反应器的总碱度维持在(7.41±0.08)g/L(见图4),表明系统的缓冲能力得到极大提升.
启动初期的总VFAs浓度较低,仅为(0.60± 0.27)gCOD/L,且各反应器均以乙酸和丙酸为主(图5).在稳定期时各反应器总VFAs分别增加到(4.12± 0.71),(7.17±1.39),(6.20±1.01)和(10.41±2.25)g COD/ L(图4),丙酸逐渐取代乙酸成为VFAs的主要成分,分别占总组份的44.41%,66.63%,61.15%和55.39%.高负荷厌氧体系的丙酸易发生积累[34],较高的OLR容易导致产酸和产甲烷过程代谢失衡[35],VFAs积累最终会导致系统pH值急剧下降.本研究中,随着OLR的增加体系中丁酸和戊酸的比例随之增加,丁酸易在高有机负荷下积累[36],而由于戊酸氧化的主要中间产物丙酸较难降解,戊酸的产氢产乙酸过程也被限制.在启动初期,体系中氨浓度和VFAs浓度逐渐上升,产甲烷过程被抑制,氢分压增加导致VFAs积累[37],虽然VFAs浓度上升,但同时总碱度也在逐步增加,这可能减缓了VFAs积累,使得水解产酸菌和产甲烷菌达到代谢平衡.在稳定期,SAOB和氢营养型产甲烷菌逐渐取代乙酸营养型产甲烷菌成为优势菌群,使得产甲烷途径转变为SAO-HM, VFAs浓度逐渐趋缓并保持稳定.
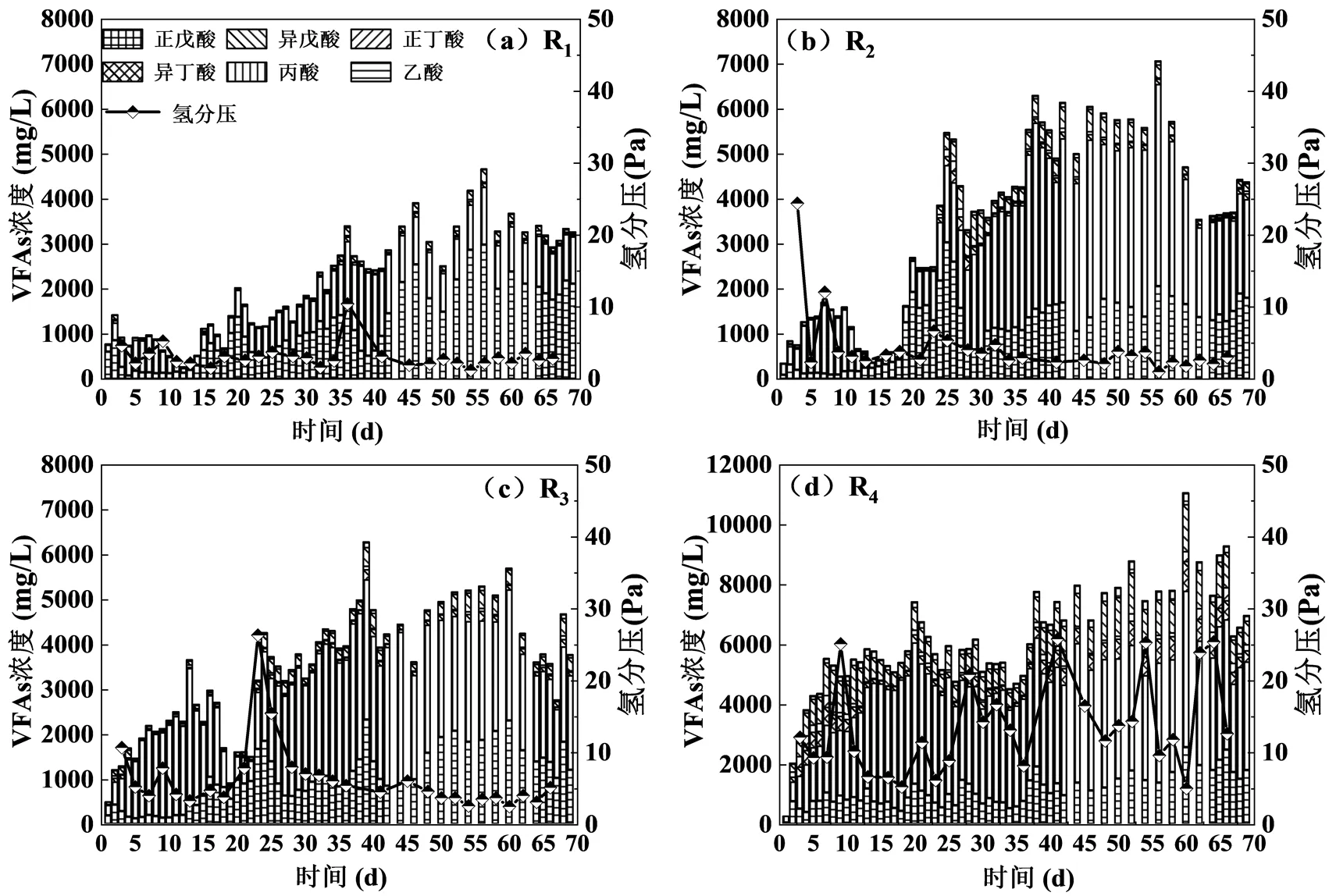
图5 连续运行反应器中VFAs浓度(a)R1;(b)R2;(c)R3;(d)R4
氢分压影响厌氧消化过程中的热力学和降解途径,高氢分压会抑制VFAs降解导致其积累.在本文中,各反应器的氢分压均保持在极低的范围(图5),分别为(3.04±1.69),(4.25±4.44),(6.25±4.79)和(13.60±6.66)Pa,这说明系统消耗氢的能力逐渐提升.随着SAO-HM体系的建立,氢营养型产甲烷菌对氢气的消耗促使系统维持低氢分压,保证SAO-HM过程能够顺利进行,故而氢分压并未影响VFAs氧化反应.
2.3.3 最大产甲烷活性和氢利用速率 为探讨切换过程中产甲烷途径的变化,将切换完成后各反应器的排泥用无氧水淘洗并低速离心,控制氨氮浓度至(0.52±0.02)g/LNH4+-N测定氢利用速率和乙酸SMA.其结果由图6所示,HRT为5d时其氢利用速率达到最大,为(14.84±0.57)mLH2/(gVSS·h),在HRT提升后,其氢利用速率分别为(11.46±0.71),(7.95±0.84)和(10.89±0.79)mLH2/(gVSS·h),与常规高温厌氧污泥在0.5g/LNH4+-N下的氢利用速率(5.89± 0.43) mLH2/(gVSS·h)相比分别提升了151.95%,94.57%, 34.97%和84.89%;另一方面,常规高温厌氧消化污泥在0.5g/LNH4+-N下乙酸的SMA为(40.96±0.16) mLCH4/(gVSS·d),切换后乙酸SMA分别变化至(15.01±1.98),(35.71±4.23),(16.79±1.25)和(39.47± 2.56)mLCH4/(gVSS·d).切换完成后,氢利用速率均有不同程度的提升,而乙酸SMA呈现下降趋势.乙酸是产甲烷菌最易利用的基质之一,但乙酸SMA下降,这说明关于乙酸代谢的功能微生物出现抑制或转化路径发生改变.SAO-HM途径相比乙酸裂解途径的乙酸降解速率较慢[38],这可能是导致乙酸SMA下降的重要原因.氢利用速率提升说明产甲烷菌群从乙酸营养型转变为氢营养型,产甲烷途径已经转变为SAO-HM.
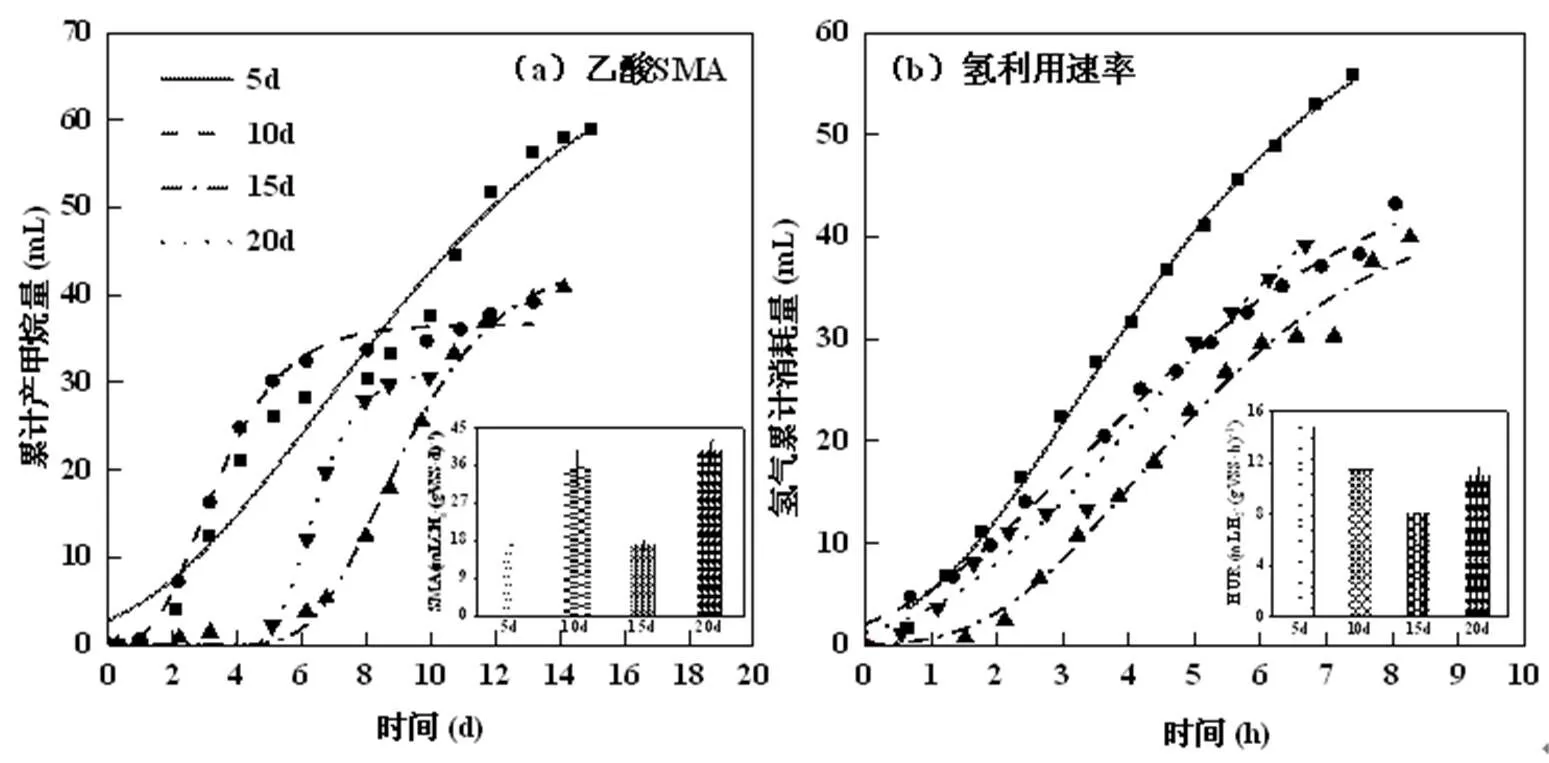
图6 切换完成后的最大乙酸SMA和最大氢利用速率
Fig 6 The maximum specific acetate methanogenic activity and hydrogen utilization rate after switching completion
2.4 微生物群落结构变化
在厌氧系统中,细菌直接参与底物降解过程,其中间产物会被产甲烷菌利用,因此细菌的群落结构会最先受到影响.细菌属水平的相对丰度如图7(a)所示,属为嗜热厌氧菌,其相对丰度由7.65%上升至15.29%.已有研究证实,是与氢营养型产甲烷菌共同进行互营氧化过程中降解乙酸盐的主要菌属[21].的相对丰度由0.19%提高至3.29%,该类菌属主要是在高温条件下对大分子有机物(如蛋白质)降解过程起重要作用[39].和相对丰度分别由0.46%和0.05%显著提升至8.89%和17.99%,二者主要将糖转化为乙酸、H2和CO2[40-41],可能与氢营养型产甲烷菌存在互营关系.此外,和对高氨氮和高VFAs环境也表现出极强的耐受性,研究也发现这些菌属只在高氨氮反应体系中出现[42].互营单胞菌属相对丰度由0.09%提高至1.60%,其主要功能就是将有机酸降解为乙酸和氢气供产甲烷菌利用,参与互营乙酸氧化代谢过程[43].因此以上结果说明,在高温厌氧消化由常规含固率切换至高含固率的过程中,环境变化导致、和等菌属的相对丰度增加,促进SAO-HM途径的构建.此类细菌对极端环境的强耐受性保障了高含固热水解-高温厌氧消化体系下水解酸化、产氢产乙酸和互营乙酸氧化阶段的顺利进行,这可能也是在高温高氨环境下系统切换过程保持稳定的重要原因.
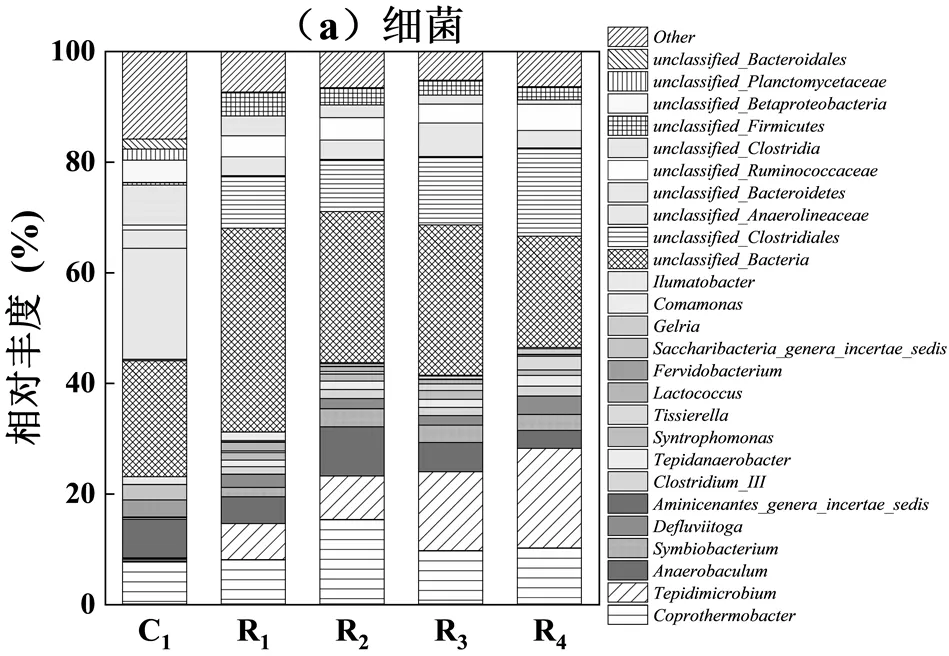
由图7(b)中可知,甲烷八叠球菌()、甲烷丝菌()和甲烷热杆菌()是系统的优势古菌属.在切换完成后,其相对丰度从接种污泥的16.52%分别上升至49.78%,53.48%, 67.01%和64.73%.除可利用乙酸外,可利用氢气产生甲烷,并且已有研究证实其可以促进SAOB的生长[44].另外,因细胞表面有较高的卷起率,游离氨会更少扩散进其细胞内[6].因此推测在高含固厌氧消化系统中,游离氨浓度上升对相对丰度影响不显著[31].常规含固率高温接种污泥以乙酸营养型的甲烷丝菌主导,其相对丰度达到62.41%,切换后相对丰度由62.41%分别下降至0.47%,0.65%,0.69%和0.74%,这可能是切换过程中体系中的氨氮浓度在不断增加所导致的.研究表明,氨氮高于1700mg/L时,会显著抑制的活性,但的氨氮耐受阈值高达7000mg/L[45].因此,在高VFAs和高氨氮浓度体系下,而非会成为优势菌属,这与之前的研究结果一致[46–48].氢营养型甲烷热杆菌在接种污泥中相对丰度仅占2.69%.在55℃以上的消化温度,被认为是产甲烷的核心功能微生物,能利用H2与CO2合成甲烷[49],并且已证实其是能够参与SAO- HM途径的产甲烷古菌[50].相对丰度在切换后从2.69%分别上升至48.71%, 37.79%,28.89%和33.34%,这可能是切换后系统氢利用速率大幅提升的重要原因.
综上所述,在切换过程中SAOB和氢营养型产甲烷菌强化的互营作用抵御了高温下的氨胁迫和酸胁迫.因此,在厌氧体系中保持高丰度的氢营养型产甲烷菌有利于体系保持低氢分压,从而更易于保持高负荷体系下乙酸化和甲烷化的平衡,促进产甲烷菌与互营氧化细菌之间的物质及能量交换过程.切换完成后,体系的产甲烷途径转变为互营乙酸氧化产甲烷,证实以常规高温厌氧消化污泥为接种泥切换至高含固热水解-高温厌氧消化是一种有效策略.
3 结论
3.1 乙酸、丙酸、丁酸和热水解污泥的SMA随着氨浓度的上升均受到显著抑制,而氢利用速率和互营乙酸氧化速率却未受到明显影响,表明通过建立互营乙酸氧化产甲烷途径实现高含固热水解-高温厌氧消化具备可行性.
3.2 连续运行试验显示不同HRT下的高含固热水解-高温厌氧消化反应器均能稳定运行,容积产气率分别为(0.40±0.09),(0.61±0.12),(0.95±0.17)和(1.79± 0.22)L/(L·d).游离氨达到(665.65±121.29)mg/L时,系统未有明显的氨抑制和酸积累现象.在切换过程中,微生物通过改变产甲烷途径来响应游离氨浓度上升产生的环境胁迫.
3.3 切换后各反应器污泥最大乙酸SMA均有不同程度的降低,而最大氢利用速率显著提升.同时产氢产乙酸和互营乙酸氧化功能微生物主要为、、和,其相对丰度均大幅提升,促进了互营乙酸氧化产甲烷途径的构建.切换后乙酸营养型产甲烷菌被淘汰,参与互营乙酸氧化过程的和相对丰度显著提高.切换过程成功将产甲烷途径由乙酸裂解产甲烷转变为互营乙酸氧化产甲烷,从而证实高温厌氧消化由常规含固率切换至高含固率是实现高含固热水解-高温厌氧消化的有效策略.
[1] 董 滨,高 君,陈思思,等.我国剩余污泥厌氧消化的主要影响因素及强化[J]. 环境科学, 2020,41(7):3384–3391. Dong B, Gao J, Chen S S, et al. Main Influencing Factors and Strengthening of Anaerobic Transformation of Excess Sludge in China [J]. Environmental Science, 2020,41(7):3384–3391.
[2] Liao X, Li H, Cheng Y, et al. Process performance of high-solids batch anaerobic digestion of sewage sludge [J]. Environmental Technology, 2014,35(21):2652–2659.
[3] 戴晓虎.我国污泥处理处置现状及发展趋势[J]. 科学, 2020,72(6): 30–34. Dai X H. Status quo and development trend of sludge treatment and disposal in China [J]. Science, 2020,72(6):30–34.
[4] Han D, Lee C Y, Chang S W, et al. Enhanced methane production and wastewater sludge stabilization of a continuous full-scale thermal pretreatment and thermophilic anaerobic digestion [J]. Bioresource Technology, 2017,245(Pt A):1162–1167.
[5] Zhuo Y, Han Y, Qu Q, et al. Pre-separation of ammonium content during high solid thermal-alkaline pretreatment to mitigate ammonia inhibition: Kinetics and feasibility analysis [J]. Water Research, 2018, 139:363–371.
[6] Westerholm M, Moestedt J, Schnürer A. Biogas production through syntrophic acetate oxidation and deliberate operating strategies for improved digester performance [J]. Applied Energy, 2016,179:124– 135.
[7] Dyksma S, Jansen L, Gallert C. Syntrophic acetate oxidation replaces acetoclastic methanogenesis during thermophilic digestion of biowaste [J]. Microbiome, 2020,8(1):105.
[8] Pan P, Hong B, Mbadinga S M, et al. Iron oxides alter methanogenic pathways of acetate in production water of high-temperature petroleum reservoir [J]. Applied Microbiology and Biotechnology, 2017,101(18):7053–7063.
[9] Schnürer A, Nordberg Å. Ammonia, a selective agent for methane production by syntrophic acetate oxidation at mesophilic temperature [J]. Water Science and Technology, 2008,57(5):735–740.
[10] Wang H, Fotidis I A, Angelidaki I. Ammonia effect on hydrogenotrophic methanogens and syntrophic acetate-oxidizing bacteria [J]. FEMS microbiology ecology, 2015,91(11):fiv130.
[11] Hao L P, Lü F, He P J, et al. Predominant Contribution of Syntrophic Acetate Oxidation to Thermophilic Methane Formation at High Acetate Concentrations [J]. Environmental Science & Technology, 2011,45(2):508–513.
[12] Werner J J, Garcia M L, Perkins S D, et al. Microbial community dynamics and stability during an ammonia-induced shift to syntrophic acetate oxidation [J]. Applied and Environmental Microbiology, 2014, 80(11):3375–3383.
[13] Hou Y, Peng D, Xue X, et al. Hydrogen utilization rate: A crucial indicator for anaerobic digestion process evaluation and monitoring [J]. Journal of Bioscience and Bioengineering, 2014,117(4):519–523.
[14] Anderson G K, Yang G. Determination of bicarbonate and total volatile acid concentration in anaerobic digesters using a simple titration [J]. Water Environment Research, 1992,64(1):53–59.
[15] Hansen K H, Angelidaki I, Ahring B K. Anaerobic digestion of swine manure: inhibition by ammonia [J]. Water Research, 1998,32(1):5–12.
[16] Lu D, Sun F, Zhou Y. Insights into anaerobic transformation of key dissolved organic matters produced by thermal hydrolysis sludge pretreatment [J]. Bioresource Technology, 2018,266:60–67.
[17] Barredo M S, Evison L M. Effect of propionate toxicity on methanogen-enriched sludge,smithii, andhungatii at different pH values [J]. Applied and Environmental Microbiology, 1991,57(6):1764–1769.
[18] Ahring B K, Westermann P. Kinetics of butyrate, acetate, and hydrogen metabolism in a thermophilic, anaerobic, butyrate- degrading triculture [J]. Applied and Environmental Microbiology, 1987,53(2):434–439.
[19] Chen Y, Cheng J J, Creamer K S. Inhibition of anaerobic digestion process: A review [J]. Bioresource Technology, 2008,99(10):4044– 4064.
[20] Schnürer A, Zellner G, Svensson B H. Mesophilic syntrophic acetate oxidation during methane formation in biogas reactors [J]. FEMS Microbiology Ecology, 1999,29(3):249–261.
[21] Chen Z, Li W, Qin W, et al. Long-term performance and microbial community characteristics of pilot-scale anaerobic reactors for thermal hydrolyzed sludge digestion under mesophilic and thermophilic conditions [J]. Science of the Total Environment, 2020,720:137566.
[22] Tian H, Yan M, Treu L, et al. Hydrogenotrophic methanogens are the key for a successful bioaugmentation to alleviate ammonia inhibition in thermophilic anaerobic digesters [J]. Bioresource Technology, 2019, 293:122070.
[23] 彭 韵,李 蕾,伍 迪,等.微生物群落对氨胁迫响应的宏基因组学研究[J]. 中国环境科学, 2022,42(2):777–786. Peng Y, Li L,Wu D, et al. Metagenomic analysis on the responses of microbial community to ammonia stress [J] China Environmental Science, 2022,42(2):777–786.
[24] Balk M, Weijma J, Stams A J M.. nov., a novel thermophilic, methanol-degrading bacterium isolated from a thermophilic anaerobic reactor [J]. International Journal of Systematic and Evolutionary Microbiology, 2002,52(4):1361–1368.
[25] Hattori S, Kamagata Y, Hanada S, et al.gen. nov., sp. nov., a strictly anaerobic, thermophilic, syntrophic acetate-oxidizing bacterium [J]. International Journal of Systematic and Evolutionary Microbiology, 2000,50(4):1601–1609.
[26] Hadiyarto A, Budiyono B, Djohari S, et al. The effect of F/M ratio to the anaerobic decomposition of biogas production from fish offal waste [J]. Waste Technology, 2015,3(2):58–61.
[27] Wu L J, Li X X, Liu Y X, et al. Optimization of hydrothermal pretreatment conditions for mesophilic and thermophilic anaerobic digestion of high-solid sludge [J]. Bioresource Technology, 2021,321 (September 2020):124454.
[28] Angelidaki I, Karakashev D, Batstone D J, et al. Chapter sixteen Biomethanation and Its Potential [J]. Methods in Enzymology, 2011, 494:327–351.
[29] Kim D H, Oh S E. Continuous high-solids anaerobic co-digestion of organic solid wastes under mesophilic conditions [J]. Waste Management, 2011,31(9/10):1943–1948.
[30] Calli B, Mertoglu B, Inanc B, et al. Effects of high free ammonia concentrations on the performances of anaerobic bioreactors [J]. Process Biochemistry, 2005,40(3/4):1285–1292.
[31] 戴晓虎,何 进,严 寒,等.游离氨调控对污泥高含固厌氧消化反应器性能的影响[J]. 环境科学, 2017,38(2):679–687. Dai X H, He J, Yan H, et al. Effects of free ammonia regulation on the performance of high solid anaerobic digesters with dewatered sludge [J]. Environmental Science, 2017,38(2):679–687.
[32] Jiang Y, Banks C, Zhang Y, et al. Quantifying the percentage of methane formation via acetoclastic and syntrophic acetate oxidation pathways in anaerobic digesters [J]. Waste Management, 2018,71:749– 756.
[33] Wu L J, Kobayashi T, Kuramochi H, et al. High loading anaerobic co-digestion of food waste and grease trap waste: Determination of the limit and lipid/long chain fatty acid conversion [J]. Chemical Engineering Journal, 2018,338:422–431.
[34] Jiang M, Qiao W, Wang Y, et al. Balancing acidogenesis and methanogenesis metabolism in thermophilic anaerobic digestion of food waste under a high loading rate [J]. Science of the Total Environment, 2022,824:153867.
[35] Cheng H, Li Y, Li L, et al. Long-term operation performance and fouling behavior of a high-solid anaerobic membrane bioreactor in treating food waste [J]. Chemical Engineering Journal, 2020,394: 124918.
[36] Zhang Y, Li J, Liu F, et al. Reduction of Gibbs free energy and enhancement ofby bicarbonate to promote anaerobic syntrophic butyrate oxidation [J]. Bioresource Technology, 2018,267: 209–217.
[37] Li D, Ran Y, Chen L, et al. Instability diagnosis and syntrophic acetate oxidation during thermophilic digestion of vegetable waste [J]. Water Research, 2018,139:263–271.
[38] Yin D-M, Westerholm M, Qiao W, et al. An explanation of the methanogenic pathway for methane production in anaerobic digestion of nitrogen-rich materials under mesophilic and thermophilic conditions [J]. Bioresource Technology, 2018,264:42–50.
[39] Sasaki D, Hori T, Haruta S, et al. Methanogenic pathway and community structure in a thermophilic anaerobic digestion process of organic solid waste [J]. Journal of Bioscience and Bioengineering, 2011,111(1):41–46.
[40] Niu L, Song L, Liu X, et al.xylanilyticum sp. nov., an anaerobic xylanolytic bacterium, and emended description of the genus[J]. International Journal of Systematic and Evolutionary Microbiology, 2009,59(11):2698–2701.
[41] Maune M W, Tanner R S. Description ofsp. nov., an anaerobe that produces hydrogen from glucose, and emended description of the genus[J]. International Journal of Systematic and Evolutionary Microbiology, 2012,62(Pt 4):832–838.
[42] Hao L, Lü F, Mazéas L, et al. Stable isotope probing of acetate fed anaerobic batch incubations shows a partial resistance of acetoclastic methanogenesis catalyzed byto sudden increase of ammonia level [J]. Water Research, 2015,69:90–99.
[43] 李 蕾,何 琴,马 垚,等.厌氧消化过程稳定性与微生物群落的相关性[J]. 中国环境科学, 2016,36(11):3397–3404. Li L, He Q, Ma Y, et al. Investigation on the relationship between process stability and microbial community in anaerobic digestion [J]. China Environmental Science, 2016,36(11):3397–3404.
[44] Shah F A, Mahmood Q, Shah M M, et al. Microbial ecology of anaerobic digesters: the key players of anaerobiosis [J]. The Scientific World Journal, 2014,2014:183752.
[45] Franke-Whittle I H, Walter A, Ebner C, et al. Investigation into the effect of high concentrations of volatile fatty acids in anaerobic digestion on methanogenic communities [J]. Waste Management, 2014,34(11):2080–2089.
[46] Guo X, Wang C, Sun F, et al. A comparison of microbial characteristics between the thermophilic and mesophilic anaerobic digesters exposed to elevated food waste loadings [J]. Bioresource Technology, 2014,152:420–428.
[47] Lerm S, Kleyböcker A, Miethling-Graff R, et al. Archaeal community composition affects the function of anaerobic co-digesters in response to organic overload [J]. Waste Management, 2012,32(3):389–399.
[48] 张 虹,李 蕾,彭 韵,等.氨氮对餐厨垃圾厌氧消化性能及微生物群落的影响[J]. 中国环境科学, 2020,40(8):3465–3474. Zhang H, Li L, Peng Y, et al Effects of ammonia on anaerobic digestion of food waste: Process performance and microbial community [J]. China Environmental Science, 2020,40(8):3465–3474.
[49] Prathiviraj R, Chellapandi P. Comparative genomic analysis reveals starvation survival systems inthermautotrophicus ΔH [J]. Anaerobe, 2020,64:102216.
[50] Manzoor S, Schnürer A, Bongcam-Rudloff E, et al. Complete genome sequence ofbourgensis strain MAB1, the syntrophic partner of mesophilic acetate-oxidising bacteria (SAOB) [J]. Standards in Genomic Sciences, 2016,11(1):80.
Effects of the increased solid content of waste activated sludge on syntrophic acetate oxidation for methane production through thermophilic anaerobic digestion.
ZHUJun-zhao, ZHUO Yang, HUA Fei-hu, ZHOU Meng-yu, WANG Xue-na, LIU Jin-yang, HAN Yun*
(School of Environmental and Municipal Engineering, Xi'an University of Architecture and Technology, Xi'an 710055, China)., 2023,43(9):4697~4707
This study investigated the kinetic rate variations of each stage involved in anaerobic digestion under different ammonia loadings, in this process, the inoculated sludge was obtained from a thermophilic anaerobic digestion system with solid content of 2%. Furthermore, effects of thequick switch between low solid content (2%) and high solid content (10%) on methane production potentials were explored through feeding thermal hydrolyzed sludge to a continuous flow model. Results showed that with ammonia loading increasing, the specific methanogenic activities of typical substrates like acetic acid, propionic acid, butyric acid, and thermal hydrolyzed sludge were all decreased, while the hydrogen utilization rates (HUR) and syntrophic acetate oxidation (SAO) rates were not significantly affected. With continuous flow model, although the chemical oxygen demand (COD) removal ratio was insufficient (27.99±3.66)% and the VFAs accumulation (10.41±2.25) g COD/L was observed when the organic loading reached 14g COD/(L·d), the pH values remained stable at (7.74±0.09). This result suggested that this switching strategy was feasible in achieving stable operating condition. The predominant hydrogen-producing acetogen and syntrophic acetate oxidizing functional genera were(15.29%),(8.89%),(17.99%), and(1.60%) at stable stage. Moreover,, acetoclastic methanogen, was eliminated, whileand, being involved in the syntrophic acetate oxidation process, was significantly enriched. It can be concluded that the above anaerobic digestion system resists the environmental stress of high temperature and ammonia through establishing syntrophic acetate oxidation coupled with hydrogenotrophic methanogenesis (SAO-HM) pathway. Overall, using conventional thermophilic anaerobic digestion sludge as the inoculated sludge is an effective strategy to achieveswitching from conventional solid content to high solid thermal hydrolysis pretreatment following thermophilic anaerobic digestion (THP-TAD), and the syntrophic acetate oxidation activity of the inoculated sludge is the key factor for this successful switch.
high solid sludge;thermophilic anaerobic digestion;thermal hydrolysis pretreatment;syntrophic acetate oxidation;ammonia inhibition
X703
A
1000-6923(2023)09-4697-11
朱俊兆(1998-),男,陕西西安人,西安建筑科技大学硕士研究生,主要研究方向为城市污水厂污泥处理与处置.17342947626@163.com
朱俊兆,卓 杨,华飞虎,等.提高污泥含固率对高温厌氧消化互营产甲烷影响 [J]. 中国环境科学, 2023,43(9):4697-4707.
ZhuJ Z, Zhuo Y, Hua F H, et al. Effects of the increased solid content of waste activated sludge on syntrophic acetate oxidation for methane production through thermophilic anaerobic digestion [J]. China Environmental Science, 2023,43(9):4697-4707.
2023-02-19
国家自然科学基金面上项目(52070153);国家自然科学基金青年科学基金项目(52200175);陕西省自然科学基础研究计划资助项目(项目编号2022JQ-445)
* 责任作者, 教授, hanyun@ xauat.edu.cn

