银杏外种皮与垂序商陆叶提取物复配剂对小菜蛾及十字花科作物幼苗的生理影响
蒋蜜涵,廖灵洁,廖 阳,黄卓颖,王丽倩,于凌一丹,闫荣玲
1湖南科技学院化学与生物工程学院;2湘南优势植物资源综合利用湖南省重点实验室;3湖南省银杏工程技术中心,永州 425199;4内蒙古大学生命科学学院,呼和浩特 010021
小菜蛾(Plutellaxylostella)作为全球频发鳞翅目农业害虫,主要取食甘蓝、花菜、萝卜等十字花科植物叶片,对其有效防控具有显著经济与社会价值[1]。植物源生物农药不易产生抗药性、对食物链破坏小、不随食物链富集等优点使其在农业病虫害防治中优势独特[2,3]。银杏外种皮(Ginkgobilobasarcotesta,Gbs)和垂序商陆叶(Phytolaccaamericanaleaf,Pal) 作为两种获取容易、成本低廉的植物资源,其提取物已被证明具有良好小菜蛾的灭杀活性与防控效应,且特定比例下二者复配剂的效果优于各自单方,从而表现出显著开发潜力[4,5]。生物农药尤其是复配型生物农药是多种活性组分的混合物,其灭杀活性往往是多成分协同作用的结果,因此作用机制较化学农药更复杂[6,7]。其中,破坏农业害虫肠壁组织、改变神经递质合成量、引发神经递质受体功能失常或神经损伤、干扰胞内物质代谢、阻断机体解毒反应等多种途径,是生物农药实现农业害虫有效灭杀的常见机制[8-11]。银杏外种皮与垂序商陆叶提取物复配剂已被证明可有效灭杀小菜蛾,但其作用机制还不明了。另一方面,植物源生物农药喷施到植物茎叶等部位后,其中一部分进入植物体内,可能诱发植物发生不同程度生理响应,并表现到生长发育及生理指标上。不同植物源生物农药由于所含活性成分不同,诱发的生理响应可能差显著甚至截然相反[12,13]。十字花科植物是小菜蛾的主要为害对象,喷施银杏外种皮和垂序商陆叶提取物的复配剂对其进行小菜蛾防治时,复配剂会引发十字花科植物产生怎样的生理响应还不明确。基于此,本研究关注了小菜蛾在银杏外种皮与垂序商陆叶提取物复配剂作用下,其肠道组织结构,以及体内与神经毒性、化学解毒与抗氧化等机能密切相关的标志性酶活性变化,以期初步探明复配剂对小菜蛾消化、神经和解毒等生理机能的影响,并以十字花科代表性植物萝卜幼苗为研究对象,协同关注了复配剂处理对植株幼苗生长与生理产生的影响,从而为复配剂在农业生产中的科学施用提供试验依据。
1 材料与方法
1.1 试验材料
银杏外种皮(11月采自永州桐子坳)与垂序商陆叶(9月采自湖南科技学院校园附近空地,去柄)经清洗沥干后,60 ℃烘至恒重,两种植物材料经化学与生物工程学院黄国文博士鉴定为银杏科银杏属的银杏外种皮和银杏商陆科商陆属的垂序商陆叶;小菜蛾虫卵购于河南济源白云实业有限公司,孵化后挑选3龄幼虫用于试验;萝卜种子(兴宁市庆丰盈科种子有限公司);营养土购自沈阳花诺生物科技有限公司。
1.2 仪器试剂
光合速率仪(LI-6800,北京力高泰公司);紫外可见光分光光度计(SP-756P,上海光谱仪器有限公司);二硫双硝基苯甲酸(合肥巴斯夫生物科技有限公司,AR,批号:BSF201125);碘化硫代乙酰胆碱(合肥巴斯夫生物科技有限公司,AR,批号:BSF201119);丙酮(衡阳市凯信化工试剂股份有限公司,AR,批号:20180820)、磷酸氢二钠(天津大茂化学试剂厂,AR,批号:20200901);磷酸氢二钾(天津大茂化学试剂厂,AR,批号:20200901);过氧化氢(天津福晨化学试剂厂,AR,批号:20190520);EDTA(天津市致远化学试剂有限公司,AR,批号:20200501);SDS(天津大茂化学试剂厂,AR,批号:20201101);核黄素(上海展云化工有限公司,AR,批号:B2108119);愈创木酚(天津福晨化学试剂厂,AR,批号:20210812);考马斯亮蓝(天津福晨化学试剂厂,AR,批号:20200807);毒扁豆碱(上海源叶生物科技有限公司,纯度>98%,批号:P09D6Y6464);α-醋酸萘酯(上海源叶生物科技有限公司,纯度95%,批号:A22J9X62572);坚固蓝B盐(上海源叶生物科技有限公司,纯度95%,批号:M25J10L90 478)
1.3 研究方法
1.3.1 复配剂制备
烘至恒重的银杏外种皮与垂序商陆叶置粉碎机打成粉末后80目过筛。分别称取200 g银杏外种皮与垂序商陆叶粉末,加入95%乙醇1 500 mL,400 W微波持续处理60 s,抽滤、减压浓缩至稠膏状后40 ℃烘至恒重。根据课题组前期研究确定的两种提取物半致死浓度(银杏外种皮提取物2.95 mg/mL,垂序商陆叶提取物6.09 mg/mL),以及二者最佳复配比例(银杏外种皮∶垂序商陆叶1∶11,体积比),95%乙醇溶解配制成各自半致死浓度后按最佳复配比混合制得浓度为3.21 mg/mL的复配剂[4]。
1.3.2 小菜蛾培养及给药处理
选用实验室营养土栽培白菜幼苗鲜嫩叶片,复配剂浸泡10 s后取出挥干,放入垫有湿润滤纸培养皿中;挑选形态大小基本一致且饥饿处理2 h后的3龄小菜蛾幼虫置培养皿中饲喂,每皿30头,每12 h清理培养皿更换新鲜叶片,所有叶片均作提取物复配剂液浸泡处理;以随行试剂95%乙醇作为空白对照,对照组及处理组各同步重复培养10皿。
1.3.3 小菜蛾茧重及破茧羽化率统计
因前期研究已确定复配剂的小菜蛾灭杀活性,本研究仅动态观察和计数复配剂处理下小菜蛾死亡虫数,重点关注和比较了对照组与处理组小菜蛾蛹重及蛹的破茧率,不进行校正死亡率的计算。对照组和处理组的茧随机每10头一组,用电子天平直接称出各组10头茧总重后求平均值(mg),称后放回培养皿中观察和计数成茧后第4、6、8、10、12、16 d的破茧出蛾数,根据公式计算破茧率:破茧羽化率=(破茧数/茧总数)×100%。
1.3.4 小菜蛾肠道解剖观察
复配剂给药饲喂小菜蛾幼虫36 h后,处理组小菜蛾致死率达到较高水平,此时随机选取对照组和处理组的若干小菜蛾幼虫显微镜下解剖分离出其肠道,用磷酸盐缓冲液反复冲洗后,观察肠道形状、颜色是否有显著变化,肠壁是否出现穿孔。
1.3.5 小菜蛾乙酰胆碱酯酶与羧酸酯酶活性测试
参考已有文献进行小菜蛾乙酰胆碱酯酶(acetylcholinesterase,AChE)与羧酸酯酶(carboxylesterase,CarE)活性测试[14]。小菜蛾经复配剂给药饲喂24 h后,对照组和处理组小菜蛾幼虫适量,分别置预冷的特定浓度磷酸缓冲液中,冰浴匀浆后4 ℃下离心10 min,取上清作待测酶液。取0.1 mL待测酶液与0.1 mL的10 mol/L碘化硫代乙酰胆碱混匀,30 ℃水浴15 min,然后加入二硫双硝基苯甲酸终止反应并显色,412 nm处测定OD值,计算乙酰胆碱酯酶比活力[nmol/(min·mg pro)];取0.2 mL待测酶液与1.0 mL α-醋酸萘酯(含1 ×10-5mol/L毒扁碱)混匀,30 ℃温育15 min,再加入显色剂(1%坚固蓝B盐和5% SDS按体积比2∶5混合而成),混匀后室温置30 min,颜色稳定后600 nm处测OD值,计算羧酸酯酶比活力[nmol/(min· mg pro)]。试验均重复3次取平均值。
1.3.6 小菜蛾抗氧化酶活性测定
参照已有文献方法进行小菜蛾抗氧化酶活性测定[15,16]。小菜蛾经复配剂给药24 h后,对照组和处理组小菜蛾幼虫各20头,分别加入50 mmol/L磷酸盐缓冲液3 mL,冰浴匀浆,12 000 r/min离心20 min,上清液为待测酶液,利用考马斯亮蓝法测定过氧化氢酶酶(hydrogen peroxidease,CAT)活力与过氧化物酶(peroxidase,POD)活力。
1.3.7 复配剂对十字花科代表性植物萝卜幼苗生长及生理影响
萝卜种子萌发后72 h,选长势一致幼苗移至营养土塑料盆,每盆约300株。移栽后第5 d下午6时进行不同浓度复配剂喷雾处理(取部分复配液分别稀释至原浓度的2/3和1/2,得到对应的2.14 mg/mL、1.61 mg/mL浓度)。喷雾处理时,对照组喷随行试剂,处理组喷不同浓度的复配液,对照组和各处理组溶液用量均恒定为1 L,均匀喷到幼苗叶片至湿润。喷药当天及喷药后第8 d上午9时进行叶片电导率、光合速率、SOD与POD活性、MDA含量测定[17,18];并随机选取对照组与处理组幼苗各5株,分别用直尺和分析天平测定株高(cm)和鲜重(g)后,置100 ℃烘箱杀青10 min后80 ℃烘至恒重,电子天平称重求平均值(g)。所有指标均重复测定三次,求平均值。
1.3.8 数据处理
数据经Excel2003整理分析得到平均值及标准差,经SPSS19.0进行差异显著性分析(t-test),经Sigmaplot10.0作图,P<0.05表示差异具有统计学意义。
2 实验结果
2.1 复配剂对小菜蛾蛹重、破茧率及肠壁的影响
复配剂对小菜蛾幼虫表现出显著灭杀活性,少量未被杀死的幼虫继续完成后续生长发育阶段并结茧。比较对照组与处理组每10头茧总重发现,处理组茧重37.6 mg显著低于对照组的58.7 mg(见图1A)。结茧后第4 d,对照组和处理组均有虫体完成茧内发育并羽化出蛾;各组羽化率均随时间推移逐渐增加,但对照组羽化率始终高于处理组;第10 d时,对照组和处理组羽化率分别达到96%和46%后不再增加(见图1B)。

图1 银杏外种皮与垂序商陆叶提取物复配剂对小菜蛾蛹重(A)及破茧羽化率(B)的影响Fig.1 Effect of the extract mixture of Gbs and Pal on weight and ECLOSION rate of P.xylostella pupal
图2显示通过解剖分离得到的小菜蛾幼虫肠道。经显微镜放大后对比,未发现处理组幼虫肠道的形状与颜色相对对照组发生显著的改变,也未发现处理组组幼虫的肠壁出现明显肿胀、溃烂、破损及穿孔等现象。
2.2 复配剂对小菜蛾体内酶活性的影响
复配剂处理24 h后,小菜蛾幼虫体内AchE及CarE的酶活性均出现大幅减少(t-test,P<0.05),其中前者从0.116降为0.087 nmol/(min·mg pro),后者则从1.183降至0.807 nmol/(min·mg pro)(见图3)。
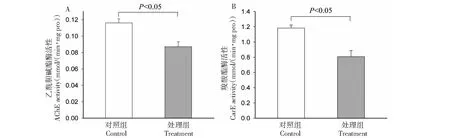
图3 复配剂对小菜蛾乙酰胆碱酯酶(A)与羧酸酯酶(B)活性的影响Fig.3 Effects of extract mixture of Gbs and Pal on activity of AChE (A) and CarE (B) in P.xylostella
与乙酰胆碱酯酶及羧酸酯酶活性变化趋势一致,小菜蛾幼虫体内过氧化物酶和过氧化氢酶酶活性也急剧减少。给药24 h后,前者从对照组的8.52 U/(g·min)降至1.23 U/(g·min),后者则从对照组的12.25 U/(g·min)降至2.24 U/(g·min)(见表1)。

表1 复配剂对小菜蛾幼虫过氧化物酶(POD)与过氧化氢酶(CAT)活性的影响
2.3 复配剂对十字花科代表性作物萝卜幼苗生长及生理的影响
复配剂对萝卜幼苗生长有一定抑制作用(见图4)。观察期内对照组平均株高从5.02 cm增至13.14 cm,而1.64、2.14、3.21 mg/mL处理组分别增至12.11、11.94、11.12 cm(见表2),各处理组幼苗植株鲜重、干重均也明显低于对照组(P<0.05,见表2),且处理组株高、干重及鲜重均随复配剂浓度增加呈减少趋势。

表2 提取物复配剂对十字花科代表性作物萝卜幼苗生长的影响(¯x ± s,n = 3)

图4 复配剂处理8 d后萝卜幼苗各组株高比较Fig.4 Height of radish seedlings among different groups after eight days treating with extract mixture of Gbs and Pal
如表3所示,复配剂对萝卜幼苗抗氧化系统产生了不同程度影响。从第0 d到第8 d,除对照组幼苗叶片的电导率、MDA含量未出现显著变化外(P>0.05),处理组SOD活性、POD活性、MDA含量、叶片电导率,及对照组的SOD活性、POD活性均不同程度增加,且处理组各指标增幅明显大于对照组,增幅也随复配剂浓度增加呈增加趋势。

表3 提取物复配剂对十字花科作物萝卜幼苗生理指标的影响(¯x ± s,n = 3)
各组叶片光合速率随时间的变化规律如图5所示。对照组叶片净光合速率随培养天数延长逐渐增加,但喷施不同浓度复配剂的萝卜幼苗的叶片净光合速率在喷施后一段时期内先降后升,与对照组的差异随时间推移逐渐缩小。复配剂浓度越小,叶片净光合速率恢复越快,其中1.61 mg/mL组于处理后第6 d即恢复至对照组水平。

图5 复配剂处理对萝卜幼苗叶片光合速率的影响Fig.5 Effects of extract mixture of Gbs and Pal on the photosynthesis rate of radish leaf
3 讨论与结论
3.1 复配剂对未致死小菜蛾的毒害效应可延续至蛹期
越来越多地方特色植物资源被证明具有良好的农业害虫灭杀活性,在植物源生物农药领域极具开发潜力,但人们评估植物源生物农药效果时往往仅关注短期灭杀活性[19,20]。本研究发现,Gbs和Pal提取物复配剂处理下,部分小菜蛾幼虫未在施药阶段被杀死,继续完成了后续生长发育历程并结茧;然而相较对照组,茧重及茧的羽化率显著降低,提示被摄入小菜蛾体内的复配剂毒性效应并非局限幼虫阶段这一短暂时间窗,而是横跨小菜蛾生命历程的各阶段甚至蛹期。积雪草、构树以及细叶桉等植物叶片提取物近年也被证明对小菜蛾化蛹率及蛹重等具有显著抑制作用[21]。可见,植物源生物农药可能作用小菜蛾以及其他植食性昆虫幼虫到成虫的整个生命周期,从而在人们之前并不太关注的蛹、成虫阶段也发挥着一定农业害虫防治功效。有研究发现,适当浓度银杏外种皮提取液不仅未抑制蚕茧产量和品质,还提高了蚕茧的这两个生产指标[22],基于此,我们初步推测本研究复配剂对小菜蛾茧重及羽化率的抑制效应主要来自垂序商陆叶片提取物,或者是两种提取物互作的结果。
3.2 复配剂对小菜蛾幼虫的毒害效应是多种作用机制协同的结果
植物源生物农药所含活性成分复杂多样,基于多种植物提取物复配而成的混合型制剂成分则更为复杂。提取物活性成分被摄入农业害虫体内后,可能协同作用于虫体的多靶标而非单一靶标,进而影响其消化、代谢、神经、循环等多种生理机能,从而表现出拒食、麻醉、致死等效用[23]。本研究发现,Gbs和Pal提取物复配剂处理后,小菜蛾幼虫肠道形状、颜色、结构较对照组均未发生明显变化,提示复配剂未对小菜蛾消化道产生明显破坏作用;但显著降低了虫体AchE与CarE的活性,AchE可催化乙酰胆碱水解而影响胆碱能神经信号传递及调节神经组织发育和再生,而CarE可催化脂肪羧酸酯、芳香酯、芳香胺等化合物的分解,发挥解毒酶功能而赋予虫体杀虫剂抗性,AchE与CarE活性降低表明复配剂中含有的皂苷、糖蛋白、酚酸、内酯等活性成分可能通过下调小菜蛾体内上述酶基因表达,或通过与AchE与CarE结合影响酶分子空间结构等途径降低了酶活,导致小菜蛾神经信号传递及解毒机能减弱[24]。复配剂处理下,小菜蛾体内过氧化物酶、过氧化氢酶活性较对照组也显著降低,提示复配剂还可能干扰了虫体抗氧化系统,引发抗氧化系统严重失衡以及自由基的大量富集,从而导致细胞结构及生理机能的异常。因此,Gbs和Pal提取物复配剂对小菜蛾幼虫的毒害效应可能并非依赖某一单一机制,而应该是多种机制协同作用的结果。
3.3 复配剂的施用会诱发被施植物的生理响应与生长发育
生物农药喷施于农作物表面尤其叶片后,在灭杀农业害虫的同时,还可能对被施作物的生长、发育、生理产生不同程度影响。研究发现,适当浓度银杏外种皮提取液可促进桑树枝条生长,及禾本科、豆科植物种子萌发与幼苗生长;细辛等植物提取物可提高茄苗抗逆性[12,22,25]。本研究发现,复配剂处理对十字花科代表作物萝卜的幼苗叶片净光合速率以及植株生长产生了一定程度的抑制作用,且幼苗叶片中SOD活性、POD活性、MDA含量、电导率等生理指标显著高于对照组,这提示复配剂的喷施会诱发萝卜等十字花科植物幼苗的应激响应,同时还会不同程度抑制叶片光合速率及植株生长发育,虽然抑制效应未随浓度增加呈线性递增,但也提示实际应用中达到有效防控小菜蛾前提下,应尽可能降低复配剂施用浓度,避免其对十字花科植物幼苗生长发育的不良影响。

