异喹啉修饰金属有机骨架配合物的合成及其二氧化碳和碘的吸附性能
米生雍, 郭华东
(长春师范大学 化学学院, 长春 130032)
天然气作为一种相对清洁的化石能源, 具有燃烧值高、 排放污染物含量低以及价格低等优点, 使用天然气不仅可减少煤和石油的用量, 而且能极大地改善环境污染问题[1-2]. 天然气的主要成分为甲烷, 在其开发和运输过程中, 其中的杂质CO2易导致管网腐蚀, 且在燃烧过程中也降低了甲烷的燃烧值[3]. 因此, 设计和开发高效吸附剂去除天然气中的CO2是当前材料化学的研究热点. 核能作为一种清洁、 高效、 经济的新型能源, 备受人们关注[4-6]. 但在核裂变释放能量的同时, 核燃料中碘、 铯、 锝等裂变元素自发放射出α,β,γ等射线, 对人体及周边环境造成不可逆转的危害[7]. 因此, 捕获放射性碘是一个亟需解决的问题[8-10]. 目前, 捕获放射性碘的方法主要有渗透法、 生物法和物理吸附法等, 但考虑成本、 效率和操作便捷等因素, 物理吸附法是捕获碘较好的方法[11-13], 其中3种多孔吸附剂(活性炭、 硅胶、 沸石)在商业应用中占据主导地位, 由于I2的特殊理化性质, 传统吸附剂存在一定的局限性[14]. 因此, 探索高效、 低成本、 选择性强的多孔吸附材料十分重要.
作为一种新型多孔材料, 金属有机框架(MOFs)由于结构和性质的可调性和多样性, 因此在气体吸附、 分离、 荧光传感和催化等方面应用前景广阔[4,15-17]. 通过对有机配体进行化学修饰, 在主体骨架中引入氨基、 羟基、 羧基以及磺酸基等有机官能团, 能增强其对不同客体分子的吸附能力[18]. 本文设计合成异喹啉基团修饰的5-(5-异喹啉)-1,3-间苯二甲酸作为有机配体(H2L), 得到一个新型的多孔金属有机骨架配合物 [Cu3(L)3·2DMF]·2DMF. 异喹啉基团具有较强的共轭性, 能促进电子的离域, 从而增强与碘和CO2间的结合能力[19]. 实验结果表明, 该配合物可选择性分离甲烷中的CO2, 并对溶液中的碘有较高的吸附能力, 最大吸附量达661.84 mg/g.
1 实 验
1.1 试剂与仪器
5-溴-异喹啉(分析纯, 上海阿拉丁试剂有限公司), 六水合硝酸铜和3,5-二甲氧羰基苯硼酸(分析纯, 上海阿拉丁试剂有限公司), N,N-二甲基甲酰(DMF)和其他无机盐试剂(分析纯, 北京化工厂).
采用Bruker D2 Phaser型X射线多晶衍射仪(德国Bruker公司)进行粉末衍射测试, 2θ=5°~50°, 升温速率为5°/min; 采用Perkin-Elmer TG-7型元素分析仪(美国Perkin公司)进行元素分析; 采用TA Q600型热重分析仪(美国TA公司)进行热重分析, 氮气氛围下, 升温速率为10 ℃/min, 测试温度为25~800 ℃; 采用Perkin-Elmer 580B型红外光谱仪(美国Perkin公司)进行红外光谱测试, KBr压片, 测试范围为4 000~400 cm-1; 使用UV-3101 pc型分光光度计(日本岛津公司)进行紫外测试, 测试范围为350~700 nm-1.
1.2 [Cu3(L)3·2DMF]·2DMF(1)的制备
准确称取Cu(NO3)2·6H2O(0.029 7 g, 0.5 mmol), H2L(15.4 mg, 0.1 mmol), 5 mL DMF, HNO3(1 mL, 0.1 mol/L)置于20 mL聚四氟乙烯反应釜中, 于80 ℃加热2 d. 冷却至室温后得绿色晶体, 所得晶体用甲醇洗涤, 晾干, 得到配合物1. 产率: 64% (基于H2L). 元素分析的理论值(%): C 56.55, H 3.41, N 5.79; 实验值(%): C 56.60, H 3.51, N 5.70. 将所得晶体用干燥的DMF和甲醇反复交换3~4次, 真空干燥活化.
1.3 晶体结构测定和解析
在Smart ApexⅡ 衍射仪(德国Bruker公司)上, 采用经石墨单色器单色化的MoKα射线(λ=0.071 073 nm)收集配合物1的晶体数据, 并采用多扫描技术进行吸收校正. 利用直接法, 通过SHELXL程序解析配合物1的结构; 在精修过程中, 利用全矩阵最小二乘法对晶体结构和所有非氢原子的各向异性温度参数进行精修(Shelrick2018程序), 所有氢原子通过理论加氢得到. 最后推导出配合物1的分子式、 结构细化参数和晶体学数据列于表1.

表1 配合物1的分子式、 结构细化参数和晶体学数据Table 1 Molecular formula, structural refinement parameters and crystallographic data of complex 1
配合物1的部分键长和键角分别列于表2和表3.
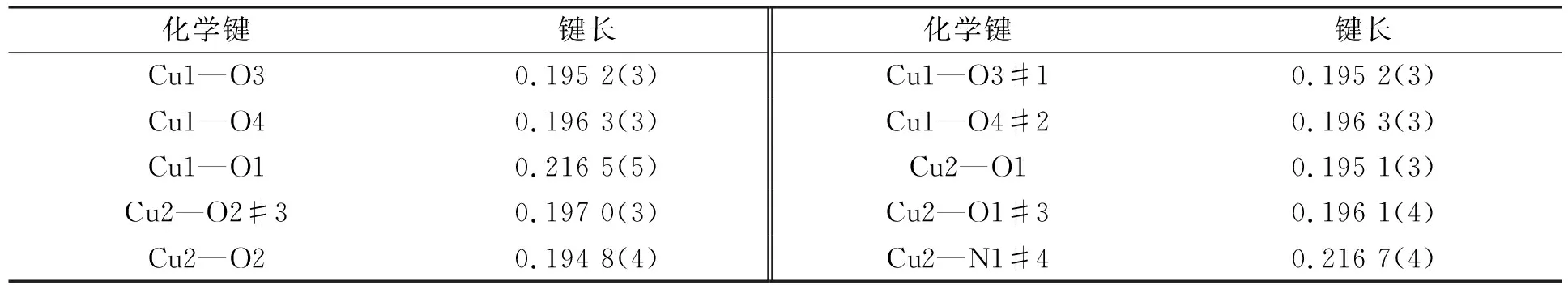
表2 配合物1的部分键长 Table 2 Partial bond lengths of complex 1 nm
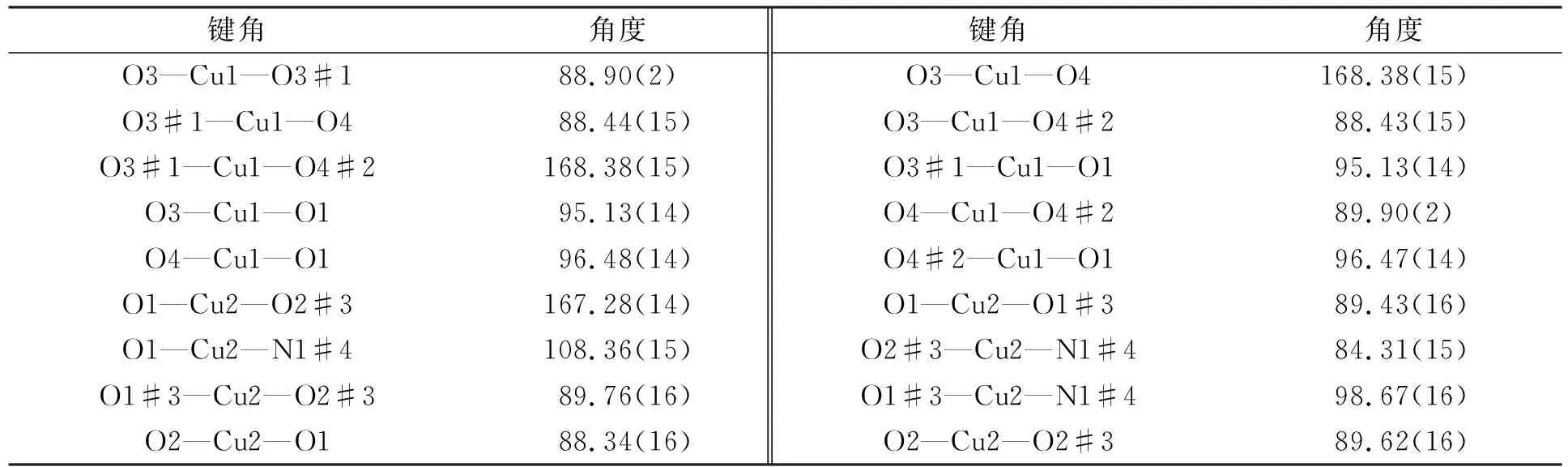
表3 配合物1的部分键角 Table 3 Partial bond angles of complex 1 (°)
2 结果与讨论
2.1 配合物1的晶体结构
X单晶射线衍射分析表明, 配合物1结晶于单斜晶系C2/m空间群. 图1为配合物1的晶体结构.
由图1(A)可见, 在该配合物中, 存在2种晶体学独立的Cu(Ⅱ)离子, 2种配位模式不同的L2-配体, 以及1个配位的DMF分子. 1个L2-配体通过2个双齿的羧基以及1个氮原子连接5个Cu(Ⅱ)离子; 而另一个L2-配体通过2个双齿的羧基连接4个Cu(Ⅱ)离子, 所有键长键角都在合理范围内, 该配体上的氮原子并未参与配位. 2个Cu1离子通过4个羧基相连形成桨轮形的双核簇{Cu1}2, 其轴向被2个配位的DMF分子占据; 2个Cu(Ⅱ)离子通过4个羧基相连形成另一个桨轮形的双核簇{Cu2}2, 其轴向位置被配体上的2个氮原子占据. 该配合物呈三维网络结构 (图1(B)). 根据拓扑简化原则, {Cu1}2可抽象为1个四连接的节点, {Cu2}2可抽象为1个六连接的节点, 2个有机配体分别被抽象为1个三连接的节点和连线. 因此, 该配合物可简化为1个{3,4,6}-连接的新型拓扑网络(图1(C)). 由图1(B),(D)可见, 在该配合物中存在笼状空穴以及一维孔道, 其空间被游离的以及配位的DMF分子占据. PLATON计算结果表明, 孔隙占有率约为29.1%.
2.2 配合物1的表征
为检测配合物1的样品纯度以及骨架的稳定性, 分别对其进行X射线多晶粉末衍射 (PXRD)、 热重和红外光谱分析, 结果如图2所示. 由图2(A)可见, 样品的测试谱与该配合物的模拟谱基本一致, 表明所得配合物为纯品. 由图2(B)可见: 该配合物在60~230 ℃内出现的失质量, 归属于失去游离的以及配位的DMF分子 (理论值: 24.1%, 实验值: 20.0%); 配合物的骨架从320 ℃开始坍塌. 由图2(C)可见, 配合物1在吸附碘前后的红外谱基本一致, 表明该配合物的构型稳定.
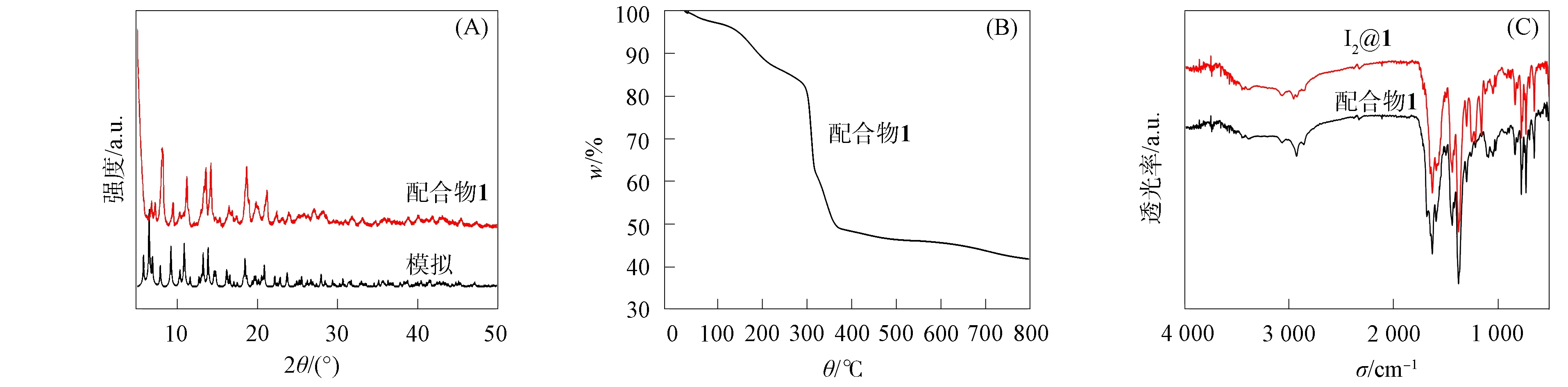
图2 配合物1的X单晶粉末衍射谱(A)、 热重曲线(B)和红外谱(C)Fig.2 PXRD patterns (A), TGA curve (B) and FTIR spectra (C) of complex 1
2.3 配合物1对CO2的选择性吸附
基于该配合物的热稳定性以及较大的孔隙率, 对其进行气体吸附测定, 结果如图3所示. 由图3(A)可见, 在273 K时, 配合物1对CO2,CH4和N2的最大吸附量分别为78.1,22.4,6.9 cm3/g; 由图3(B)可见, 在298 K时, 配合物1对CO2,CH4和N2的最大吸附量分别为51.6,16.3,4.0 cm3/g.
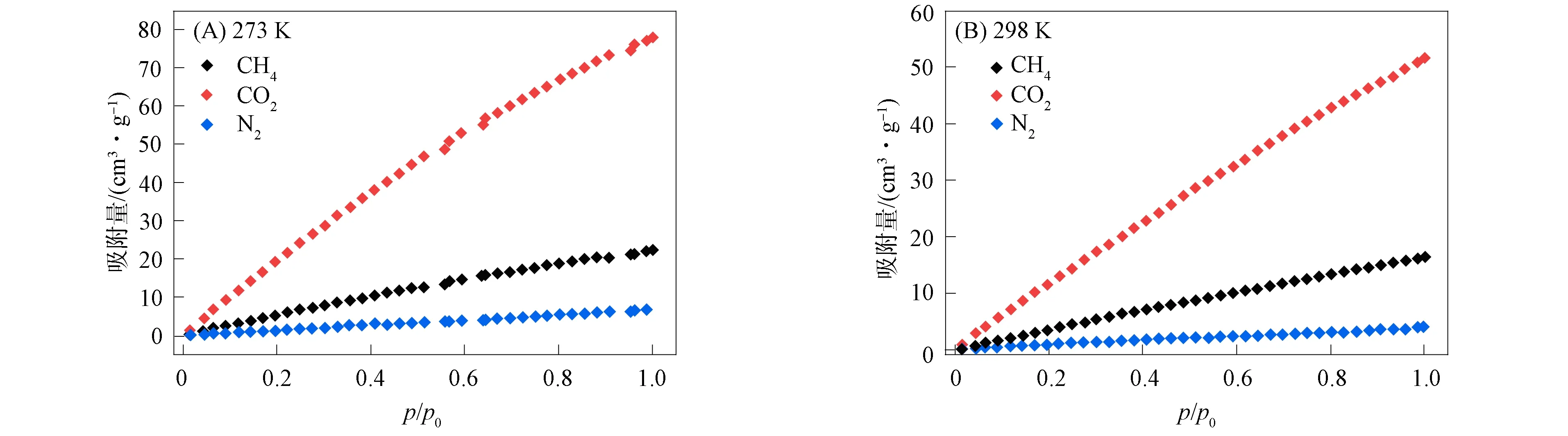
图3 不同温度下配合物1对氮气、 甲烷和二氧化碳的等温吸附曲线Fig.3 Isothermal adsorption curves of complex 1 for N2, CH4 and CO2 at different temperatures
配合物1对二氧化碳和甲烷的吸附焓曲线如图4所示. 由图4可见, 气体吸附焓 (Qst) 计算结果表明, 其对CO2的吸附焓值为15.7 kJ/mol, 对CH4的吸附焓值为11.6 kJ/mol. 该配合物对CO2和CH4的吸附性差异主要源于未配位的N原子与CO2分子间存在较强的相互作用. 基于该配合物对CO2和CH4的吸附量和吸附焓的显著差异, 采用IAST方法计算在273,298 K时其对CO2/CH4的吸附选择性, 结果如图5所示. 由图5可见, 其分离比约为4.5. 因此, 该配合物可作为从天然气中选择性分离CO2的潜在功能材料.
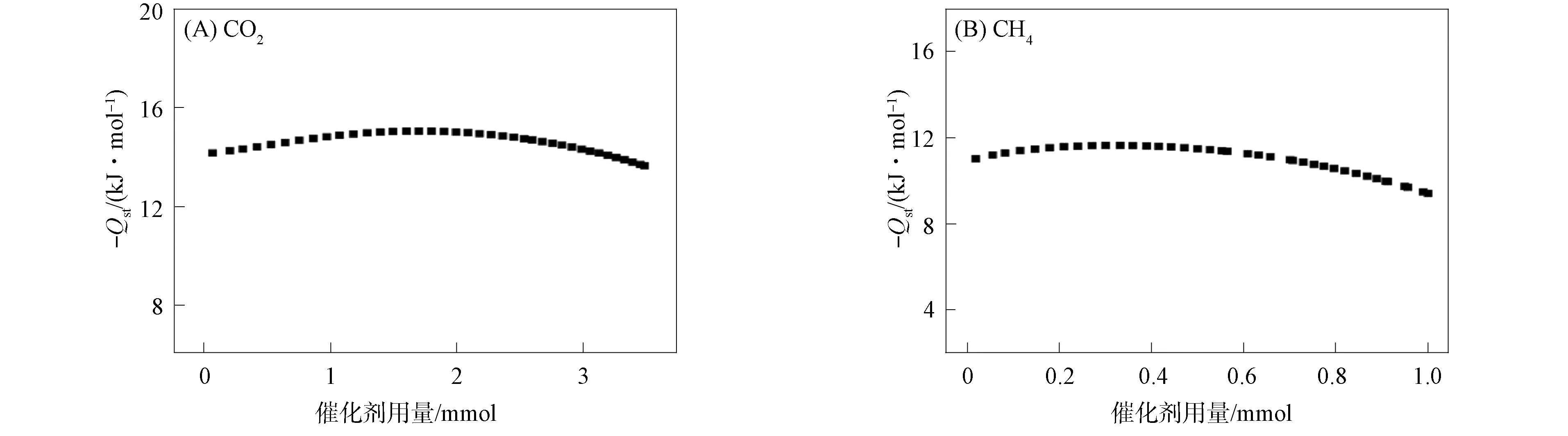
图4 配合物1对二氧化碳(A)和甲烷(B)的吸附焓曲线Fig.4 Adsorption enthalpy curves of complex 1 for CO2 (A) and CH4 (B)

图5 配合物1在273 K(A),298 K(B)对CO2/CH4混合气体的IAST分离比Fig.5 IAST separation ratios of complex 1 for CO2/CH4 mixture at 273 K (A) and 298 K (B)
2.4 配合物1对碘的吸附和脱附性能
由于配合物1中存在较大的孔隙率及部分未参与配位的异喹啉基团可增强其对碘的吸附. 因此, 考察配合物1对碘的吸附性能. 将活化后的20 mg晶体浸入碘的正己烷溶液中 (1×10-3mol/L, 5 mL), 测定间隔0.5,1,6,12,24,48 h时的紫外吸收光谱, 结果如图6所示. 由图6可见, 随着浸入时间的增加, 碘溶液的颜色逐渐由深紫色褪为无色, 至48 h后颜色不再发生变化, 达到动力学吸附饱和. 其溶液颜色变化与紫外吸收谱图一致.
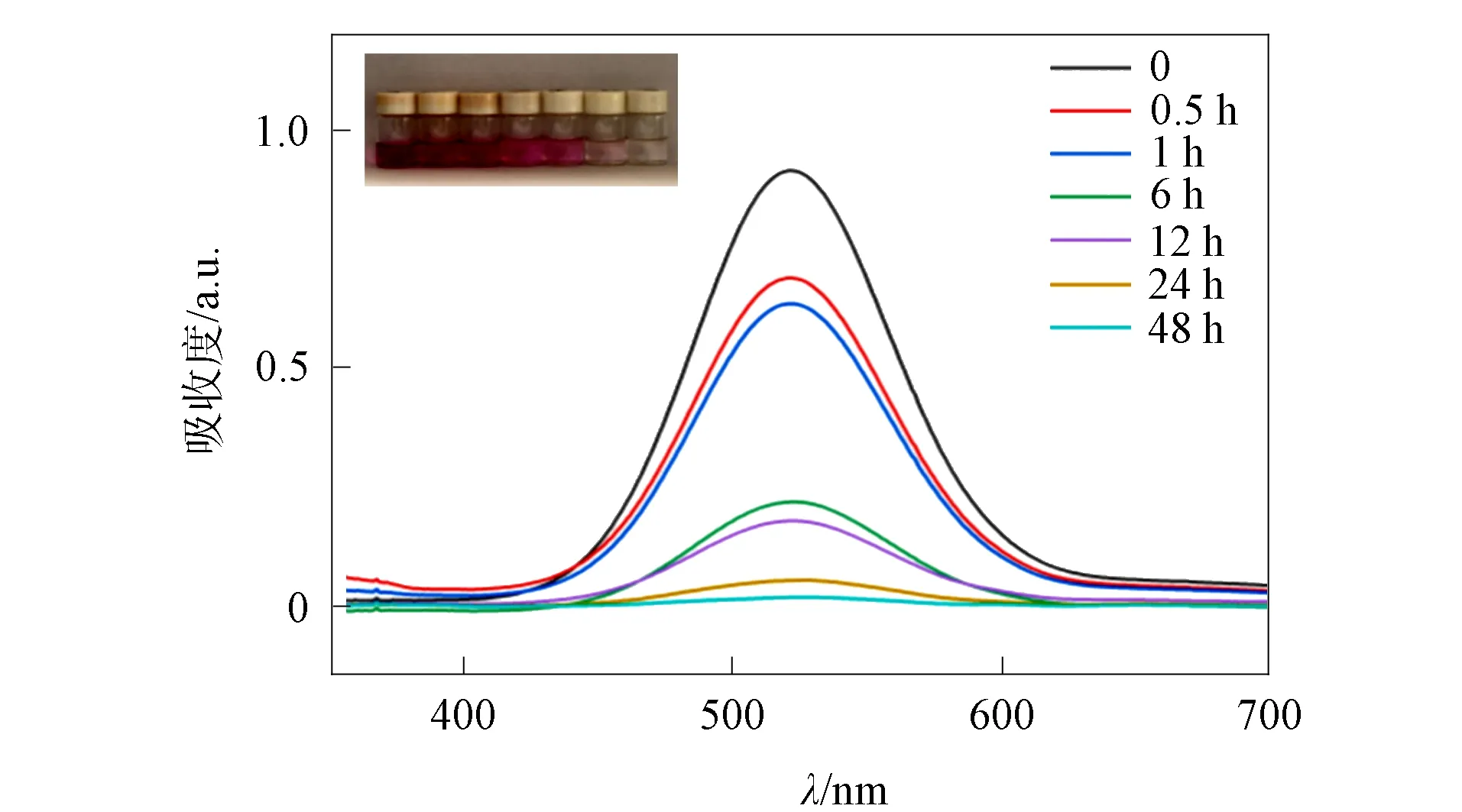
图6 配合物1的碘吸附紫外-可见吸收光谱Fig.6 UV-Vis absorption spectra of iodine adsorbed by complex 1
为确定该配合物对碘分子的最大吸附量, 准确称取20 mg样品分别分散到200~1 800 mg/L不同质量浓度的碘液中(5 mL), 密闭, 静置于阴暗处进行吸附, 并于48 h后抽取上清液测定其吸光度, 结果如图7所示. 由图7可见, 随着溶液质量浓度的增大, 该配合物对碘的吸附量逐渐增加, 其最大吸附量为661.84 mg/g, 优于文献[20-24]的吸附量(表4).
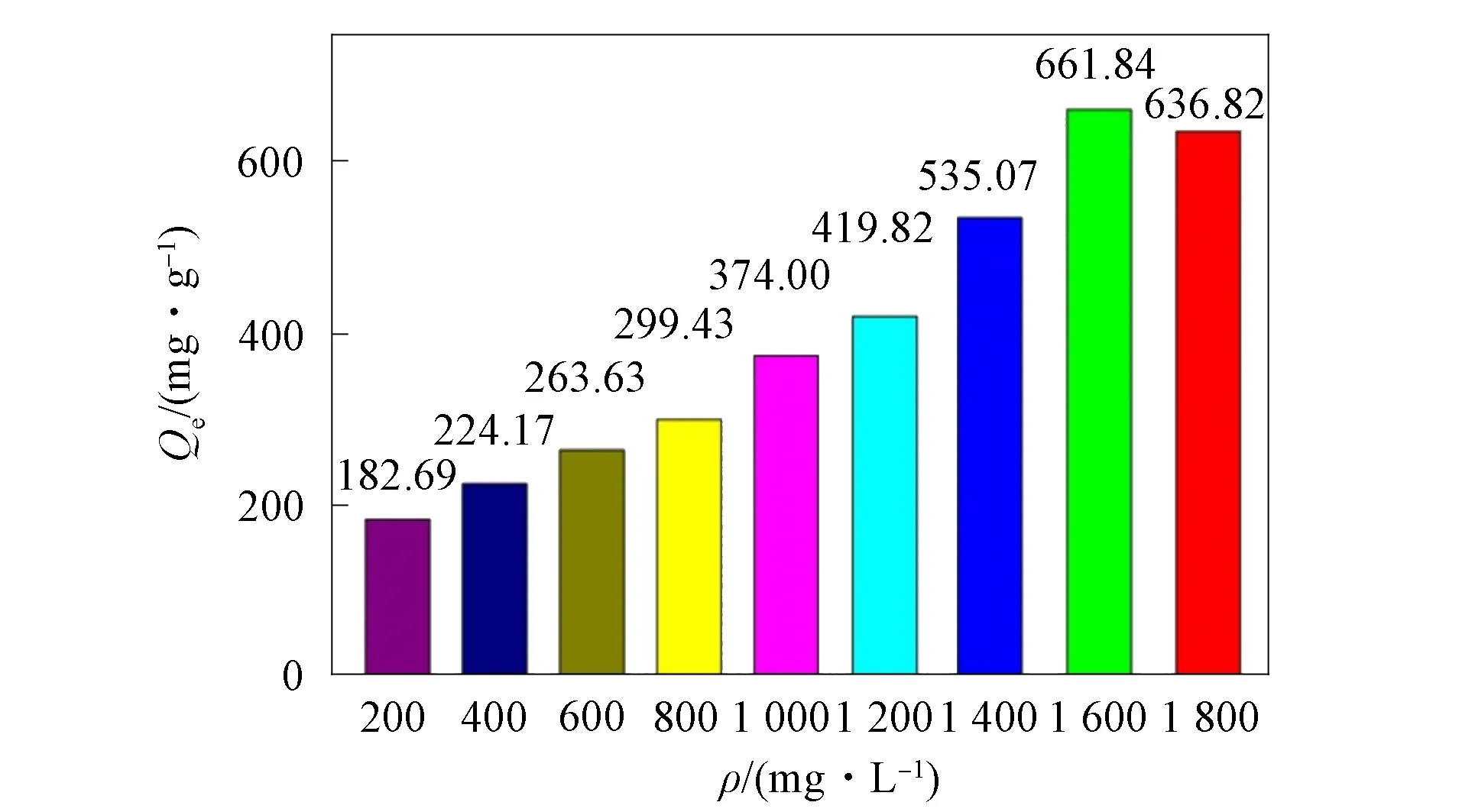
图7 配合物1在不同质量浓度溶液中的最大吸附碘量Fig.7 Maximum adsorption capacity of complex 1 for iodine in solutions of different mass concentrations

表4 不同吸附剂对碘的吸附能力Table 4 Adsorption capacity of different adsorbents for iodine
为考察该配合物对吸附碘分子的释放性能, 将 20 mg棕色配合物I2@1晶体浸入5 mL乙醇中, 并测定不同时间间隔内溶液的紫外吸收光谱, 结果如图8所示. 由图8可见, 随着时间的增加及碘分子的释放, 乙醇溶液逐渐变为黄色, 而晶体的颜色也由棕色变为浅橙色. 碘脱附后乙醇溶液的紫外-可见吸收光谱如图9所示. 由图9可见, 溶液中碘的吸光度逐渐增强, 但释放的速率逐渐降低, 60 min后达到释放饱和, 表明该配合物对碘分子具有良好的吸附-脱附性能.
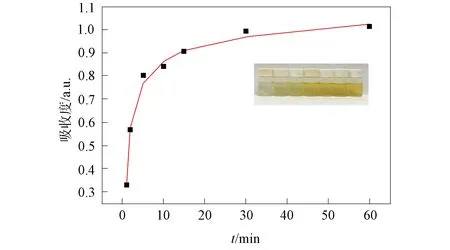
图8 配合物1在乙醇中对碘的脱附曲线Fig.8 Desorption curve of complex 1 for iodine in ethanol
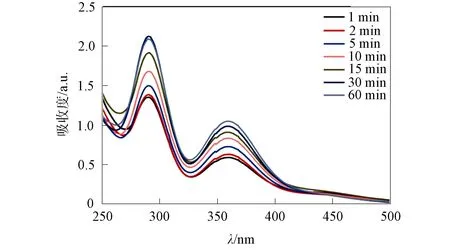
图9 碘脱附后乙醇溶液的紫外-可见吸收光谱Fig.9 UV-Vis absorption spectra of ethanol solution after iodine desorption
综上所述, 本文利用异喹啉基团修饰的间苯二甲酸作为有机配体, 设计并合成了一个新型的金属有机骨架配合物. 该配合物结构中存在笼状的空穴以及一维孔道, 并存在部分未参与配位的异喹啉基团作为潜在的吸附位点. 研究表明, 该配合物对CO2的吸附量较高, 可选择性分离甲烷中的CO2, 并对溶液中的碘有良好的吸附性能, 最大吸附量达661.84 mg/g. 本文的研究结果对设计新型多功能有机/无机吸附材料, 探索其在能源和环保等领域的应用具有一定的指导意义.

