澳洲坚果茎段组织培养研究
农成银 许光德 刘正鲁 岑湘涛 沈 伟 牛俊乐
(百色学院农业与食品工程学院,广西百色 533000)
澳洲坚果(Macadamia integrifolia &Macadamiate Trapbylla)为山龙眼科澳洲坚果属,原产于亚热带,1940年被定为夏威夷经济作物,因此又称“夏威夷果”[1]。因营养成分丰富,香味独特、质地细腻,备受国际市场青睐,有“坚果之王”的美誉。截至2022年,我国澳洲坚果种植面积达30 万hm2[2]。
生产中澳洲坚果的主要繁殖方式分为种子实生苗繁殖、嫁接、扦插、压条4 种。种子实生苗繁殖存在生长周期长、易发生变异、遗传稳定性差等问题[3]。目前生产中多采用嫁接繁殖方式,但木本果树枝干质地硬、皮薄,且单宁含量高,常规嫁接成活率一般在50%~80%[4]。扦插和压条方式下根系的形成需较长时间,同时树种也需要人工辅助管理,成本较高,生产上未得到广泛推广。植物组织培养技术是根据植物细胞的全能性,利用组织、器官、细胞等培育获得完整植株,在保持母株优良性状的基础上,还具有生长周期短、繁殖率高、管理方便、有利于工厂化生产和自动化控制等优点。苹果、樱桃、桑葚等果树利用组织培养技术,通过器官发生、丛生芽繁殖、体细胞胚胎发生等方式均可获得优良稳定的组培苗木[5-7]。
本研究以澳洲坚果品种‘桂热1号’带芽茎段为外植体,探究适宜茎段外植体腋芽萌动的灭菌时间、腋芽萌发生长适宜的培养基种类,以期在短时间内培育出遗传性状稳定的优质无菌芽,为澳洲坚果组培快繁提供一定的理论支持。
1 材料与方法
1.1 试验材料
供试材料为澳洲坚果‘桂热1号’健壮嫩枝,采摘于农业与食品工程学院苗圃。采摘活动于3~5个晴天午后进行,将采摘的外植体修剪为长度3 cm左右带1~2个腋芽的茎段备用。
1.2 培养条件
培养温度为(26±1)℃,光照度为2 000 lx、12 h/d。
1.3 试验方法
1.3.1 外植体灭菌 将外植体冲洗干净后用洗衣粉水浸泡15 min,冲洗干净后再用0.1%的高锰酸钾浸泡10 min,自来水冲洗干净备用。将外植体放入无菌瓶用75%乙醇浸泡30 s 后倒出,用无菌水漂洗2~3 遍,再将外植体放进另一个新的无菌瓶倒入0.2%氯化汞表面消毒6、7、8、9、10、11、12 min,倒出0.2%氯化汞后用无菌水漂洗2~3遍,再用无菌吸水纸吸干水分后接种到以MS为基本培养基添加2.0 mg/L 6-BA和0.1 mg/L NAA的培养基上,7 d统计污染率,15 d统计腋芽萌动率。污染率和腋芽萌动率计算公式:污染率(%)=(污染数/接种数)×100;腋芽萌动率(%)=(接种未污染腋芽萌动数/接种数)×100。
1.3.2 腋芽萌发生长培养 将在最佳灭菌时间灭菌后的外植体分别接种在以MS 为基本培养基添加6-BA(1.0、2.0 mg/L)配合NAA(0.1、0.5、1.0 mg/L)或GA3(0.1、0.5、1.0 mg/L)的培养基上进行腋芽萌发生长培养。45 d统计腋芽萌发率及长势。萌芽率计算公式:萌芽率(%)=(接种未污腋芽萌发数/接种数)×100。
2 结果与分析
2.1 外植体灭菌
据表1 可知,在75%乙醇浸泡30 s 配合0.2%氯化汞溶液进行灭菌的条件下,随着灭菌时间的增加,污染率从最高的65.00%逐渐降低到最低的8.69%,但腋芽无膨大萌动趋势;芽萌动率先从30.00%升高到57.70%,随着灭菌时间的延长降低到4.35%。试验结果表明,75%乙醇配合0.2%氯化汞对澳洲坚果品种‘桂热1号’茎段灭菌的最佳时间是9 min,此时污染率是26.92%,腋芽萌动率是57.7%,腋芽膨大明显。

表1 0.2%氯化汞不同灭菌时间对茎段污染率及腋芽萌动率的影响
2.2 腋芽萌发生长
据表2 可知,在培养基为6-BA(1.0、2.0 mg/L)、NAA(0.1、0.5、1.0 mg/L)情况下,各个培养基的萌芽率都在50%左右,腋芽在培养基为6-BA(2.0 mg/L)配合NAA(0.5 mg/L)时长势最好。接种10 d左右外植体基部开始形成愈伤组织,愈伤组量随着时间延长逐渐增多,其中NAA(1.0 mg/L)培养基愈伤组量最多,基本覆盖住腋芽,开始时呈颗粒状乳白色,质地紧实,60 d 部分愈伤组织呈翠绿色。在6-BA(1.0、2.0 mg/L)、GA3(0.1、0.5、1.0 mg/L)培养基下的整体萌芽率稍低于6-BA 和NAA 组合的培养基,随着GA3浓度增加,芽长势逐渐减弱。形成的愈伤组织呈白色,质地相对松软,量少。试验结果表明,MS+6-BA(2.0 mg/L)+NAA(0.5 mg/L)适合澳洲坚果品种‘桂热1号’无菌芽萌发生长。
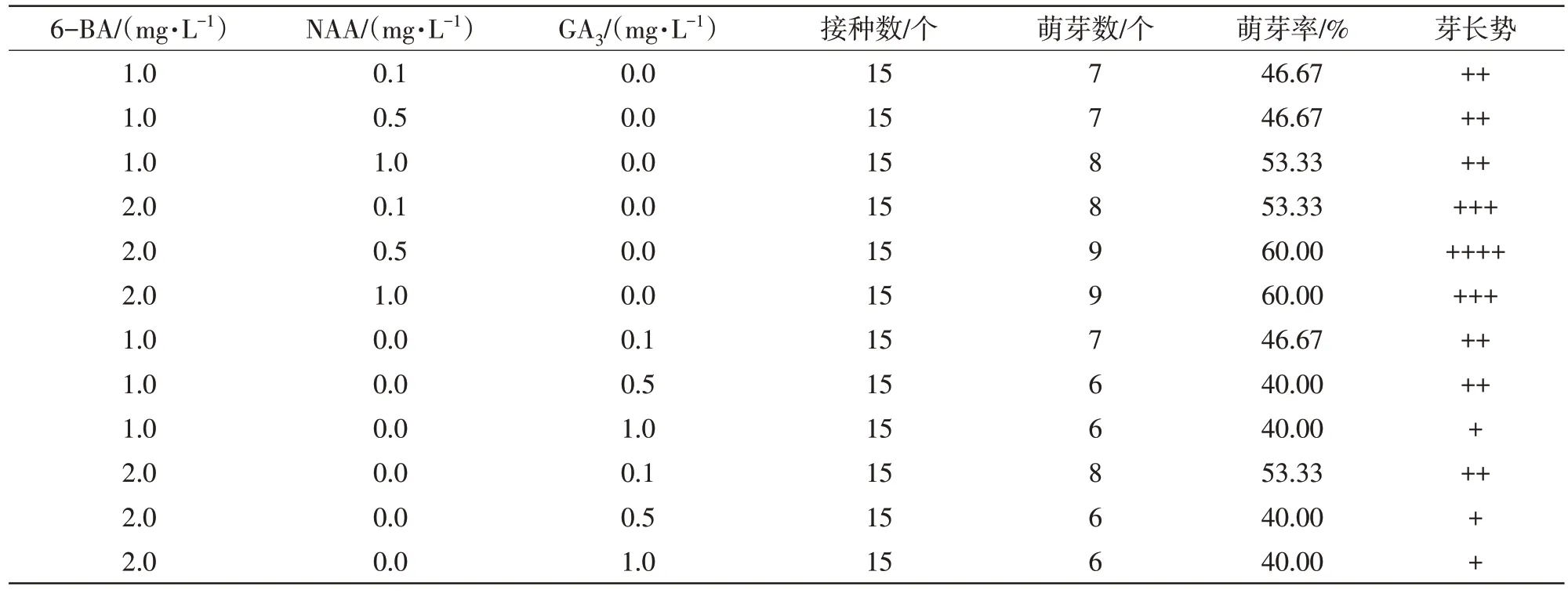
表2 培养基种类对腋芽萌发生长的影响
3 结论与讨论
3.1 外植体的灭菌
外植体的杂菌感染是植物组织培养过程中面临的主要问题之一[8]。因此,外植体材料的灭菌是植物组织培养的一项重要工作。灭菌时间短会造成灭菌不彻底、污染严重的问题,灭菌时间过长又会导致外植体死亡、萌发延迟、分化率低等情况出现[9]。氯化汞是植物组织培养过程中外植体灭菌的常用灭菌剂,具有灭菌效果好、用量少的优点。75%乙醇与氯化汞组合是植物组织培养常用的一种灭菌方法。韩笑等[8]使用不同浓度的碱化乙醇和0.1%的氯化汞对金银花茎尖进行灭菌处理,结果表明,用0.1%氯化汞浸泡7 min 灭菌效果最好,污染率降到8.3%。岑湘涛等[10]在杧果带腋芽茎段灭菌的研究中发现,75%乙醇浸泡30 s配合0.1%氯化汞灭菌8 min效果最佳。于静等[11]在单因素预实验的基础上,采用单一变量实验设计,筛选出先用75%的乙醇消毒20 s,再配合0.1%的氯化汞溶液处理6 min是积雪草外植体最佳灭菌方法及时间。本试验选用的75%乙醇浸泡30 s配合0.2%氯化汞处理9 min在澳洲坚果品种‘桂热1 号’茎段灭菌中取得较好灭菌效果,与前人研究结果一致。
3.2 腋芽萌发生长
外植体分化的关键是植物生长调节剂的种类及浓度配比。常用的细胞分裂素包括6-BA、TDZ、KT等,常用的植物生长素有IAA、IBA、2,4-D、NAA[12-13]。生长素能够促进节间的伸长和根的形成,而细胞分裂素可以使侧芽从顶端优势中解放出来。细胞分裂素能抑制生根,在生根培养基中通常除去细胞分裂素而加入一定浓度的生长素[14]。高浓度的细胞分裂素配合低浓度的生长素具有促进腋芽萌发和丛生芽分化的作用。GA3可以刺激器官生长,但是会抑制器官发生,抑制不定根的形成。肖祖飞等[15]研究表明,诱导1,8-桉叶油素型油樟茎段组织培萌芽最适培养基是MS+6-BA(1.0 mg/L)+IBA(0.05 mg/L),萌芽率73.33%。吴高殷等[16]以山杏茎尖和茎段为外植体,在对初代培养基激素配比的研究中发现,茎尖初代培养最佳激素配比为6-BA(0.5 mg/L)+NAA(0.2 mg/L);茎段初代培养最佳培养基激素配比为6-BA(0.5 mg/L)+NAA(0.1 mg/L)。余志杰[17]研究发现,6-BA和NAA都是诱导牟平野生玫瑰茎段不定芽萌发和生长的主要因素,MS+6-BA(1.5 mg/L)+NAA(0.l mg/L)是诱导牟平野生玫瑰茎段不定芽发生的最佳培养基。郭丽[18]以单芽茎段为外植体研究钻石海棠组织培养快繁体系的建立,结果表明:MS+6-BA(1.0 mg/L)+NAA(0.l mg/L)为丛生芽最佳诱导培养基,诱导率60.7%。本研究筛选出适合澳洲坚果品种‘桂热1号’腋芽萌发生长培养基配方是MS+6-BA(2.0 mg/L)+NAA(0.5 mg/L),与前人研究结果相符。

