基于Ser-SELEX技术的结肠癌血清适配体的筛选及其应用研究*
张广鑫 王 佳 石 明 刘志伟 丁婷婷 岳金媛 李 健 栗 坤 **
(1)燕山大学环境与化学工程学院,秦皇岛 066000;2)燕山大学河北省纳米生物技术重点实验室,秦皇岛 066000;3)燕山大学亚稳材料制备技术与科学国家重点实验室,秦皇岛 066000)
结肠癌是一种常见的胃肠道恶性肿瘤,在癌症相关死亡的病因中排名第三[1],全球范围内每年有近两百万人成为确诊的结肠癌患者。据统计,中国结肠癌发病率居于全国第3位,死亡率位居全国第5位,且发病率和死亡率仍在逐年上升[2]。
目前结肠癌的诊断一般依据肠镜[3]、计算机断层扫描(CT)和核磁共振(NMR)等检查手段。在早期症状较轻时,肠镜检查必要性较低,故结肠癌很难早期发现,即使诊断出结肠癌并及时进行手术,癌细胞也有比较高的转移风险[2-4]。不仅如此,结肠癌早期,症状较轻不易引起注意。因此,如何有效早期确诊,在普通查体中快速预警是否存在肿瘤状况,成为了当下着重研究的热点问题[5]。
适配体全称为核酸适配体,本质是体外合成的寡核苷酸片段,因其能与相应的配体分子进行高亲和力强特异性的结合而得名“适配体”[6]。它是一种近年来新兴发展的化学抗体,相对抗体而言,具备很多优点:其三维构型多变,易形成螺旋、发夹、茎环和假结等结构[7-8],具有极高的生物相容性,可以与多种活性物质进行结合,反应快速、反应过程灵敏且具有较强亲和力[9],易于体外合成,成本较低[10];同时,适配体可匹配的靶标分子范围广泛,包括动植物细胞、单一蛋白质、病毒和维生素等[11];作为检测工具有着较多优点[12],作为诊断试剂和治疗试剂,追踪siRNA、抗癌药物甚至药物蛋白[13],可以提供更精准的治疗效果[14],而抗体作为药物传递系统的可行度非常复杂,在靶向治疗中选择使用适配体作为引导分子,则有助于避开这些缺陷[15],适配体的递送系统能够执行更有选择性的决策并实现更精确的治疗效果[16]。
除此之外,适配体对于生物标记物的发现有一定的帮助,比如新的特异性肿瘤标志物[17],有助于疾病的早期发现和及时治疗[18]。生物标志物还可用于定向给药及标记成像等,在医学研究检测方向十分必要,也有极大的前景[19]。在当前研究阶段,适配体可以更灵敏地根据靶标细胞表面膜蛋白微量的差异,将靶标细胞与正常细胞区分开来,因此适配体作用于新型生物标志物研究有着巨大的潜力[20]。
血清筛选是以人血清中含有的蛋白质为靶标,基于血清体系进行筛选,由于血清中具有非常丰富的蛋白质信息,因此将不同疾病中含量异常的蛋白质作为靶标,利用血清筛选分离出相应的适配体[21-22]。血清筛选具有非常多的优点,但在许多疾病初期,血清中大量的免疫分子、免疫蛋白过量分泌[23],会对血清中低丰度蛋白的筛选造成较大影响。如何在血清环境下,对部分高丰度蛋白进行简单分离成为血清筛选前期的技术问题,相比于单一蛋白质的筛选,血清靶标的筛选结果充满可能,对未知的标志物分子进行钓取和后续蛋白质的分析[24],有助于推动疾病研究在分子基础上的发展,对疾病的诊断和治疗有着重要的作用。
本研究以结肠癌血清为正筛靶标、健康查体血清和其他癌症血清为反筛靶标,利用血清筛选技术(Ser-SELEX),筛选了可以特异性结合结肠癌血清的适配体,为结肠癌早期诊断提供识别工具和新的技术手段。
1 材料与方法
1.1 仪器与试剂
本研究所使用的初始文库是长度为88个碱基的寡核苷酸片段,该片段由两端各自固定12个碱基序列的和中间部分40个随机的碱基序列构成。试验所用PCR体系中的引物(P7/P11)为24 nt长度的序列,用于制备次级库的体系则使用带标记的下游引物P11-Bio,所用序列见表 1,由生工生物工程(Sangon Biotech)公司合成寄送。

Table 1 The primer and library sequences used in screening
本研究中所用到的人体血清均由秦皇岛市第一医院收集,以健康查体、首次诊断结肠癌、首次诊断肺癌、首次诊断乳腺癌和首次诊断直肠癌五类人群分类,琼脂糖磁珠为本实验室制备。
实时定量PCR(美国Bio-rad集团)、电泳仪(北京六一仪器厂)、多功能酶标仪(美国Molecular Devices集团)、J-1500圆二色谱仪(日本JASCO公司)、旋涡混匀器(德国IKA集团)、凝胶成像系统(南京世研设备公司)。
1.2 材料准备
血清准备:将健康查体和癌症病人的抗凝血血液,在4℃、3 000 r/min条件下离心10 min,弃去油脂沉淀,取上清于37℃孵育15 min,在15 000g、4℃条件下离心30 min,重复2次后,涡旋混匀震荡器混匀约20 s,-20℃保存,使用时以血清∶乙腈∶水=2∶1∶4体积比混合,将乙腈和DEPC水混匀后加入血清,涡旋混匀震荡器混匀约20 s,室温水浴超声5 min,在15 000g、4℃条件下离心15 min,吸取上清待用。
琼脂糖磁珠活化:称取100 μl磁珠,每次以1 ml 0.025 mol/L 2-(N-吗啡啉)乙磺酸(MES)洗涤3次,加入300 μl 50 g/L的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和300 μl 50 g/L N-羟基琥珀酰亚胺(NHS),室温反应30 min,得到活化后的羧基磁珠。
1.3 Ser-SELEX筛选适配体
筛选流程如图1所示,首先活化的磁珠结合反筛血清中蛋白质,封闭磁珠,筛选初始文库适配体,取上清,再取新的磁珠结合正筛血清蛋白,封闭磁珠,筛选反筛上清中适配体,洗脱磁珠结合的适配体,经过扩增制单连,制备次级库进行下一轮筛选,通过前期结肠癌血清正筛-正常人血清反筛步骤和后期结肠癌血清正筛-其他癌症血清反筛步骤循环的方式,经过16轮的筛选流程,得到高特异性的适配体,首先是正筛,取400 µl离心后的结肠癌血清上清,与活化后的磁珠孵育45 min(血清浓度和孵育时间逐轮递减),弃去血清孵育液,磷酸缓冲盐溶液PBS清洗磁珠,加入1 ml封闭液(0.4 g蔗糖,0.05 g牛血清白蛋白,0.05 g酪蛋白溶于40 ml PBS中),继续孵育30 min,减少磁珠对适配体的非特异性吸附。将封闭好的磁珠与初始文库/次级库孵育30 min。磁珠变性:弃去未结合上清,加入500 µl DEPC水,金属浴95℃ 5 min,冰浴5 min。取上清,为该轮正筛模板,将模板PCR扩增,一轮筛选完成后,使用链霉亲和素磁珠法将制得的正筛模板制备成单链ssDNA,将链霉亲和素冻干粉末在15 000g,4℃离心10 min,水溶成50 g/L,混匀后取10 μl与150 μl磁珠37℃旋转孵育30 min,然后将正筛模板用P11-Bio下游引物进行PCR扩增,在平台期停止扩增,得到生物素标记的双链,PBS清洗链霉亲和素-磁珠复合物,加入PCR扩增双链孵育30 min,PBS清洗,加入5%甲酰胺溶液,40℃水浴5 min,清洗后向管内加入300 μl 0.1 mol/L NaOH溶液,95℃ 5 min,冰浴5 min变性,调节pH至中性,获得次级库,即为下一轮文库。每一轮的筛选均需经过正筛-制库-反筛3个步骤,以此往复循环,增加筛选压力,提升清洗力度,通过不断的正向富集和反向消除,获得表现更优异的适配体;以正常人血清做为反筛靶标,共进行7轮筛选,再以肺癌、乳腺癌、直肠癌血清作为反筛靶标分别进行3轮筛选。
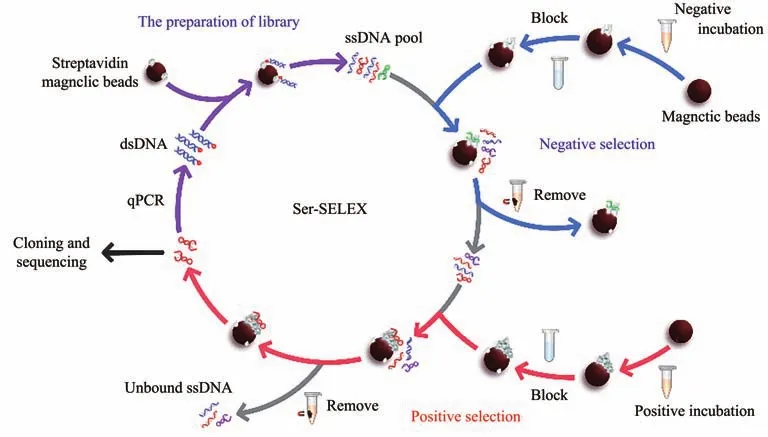
Fig.1 Screening process
1.4 适配体结构预测
将前期以健康查体血清为反筛的筛选终点和后期以非目标癌症血清为反筛的筛选终点的两轮阳性模板进行扩增,并将获得的双链DNA进行高通量测序得到一级结构,并进行同源性分析,利用NUPACK网站进行二级结构的预测,并且对二级结构上的茎环、发夹、螺旋和假结等结构进行分析,并利用3dRNA/DNAWeb Server对适配体的三维结构进行模拟。
1.5 适配体特异性和亲和力的表征
利用qPCR进行了适配体的亲和力测定,将准备好的结肠癌血清与琼脂糖磁珠偶联,充分洗涤后加入封闭液,防止适配体分子与其他结合位点结合,分别加入 0、15.63、31.25、62.5、125和250 nmol/L浓度的适配体溶液,37℃条件下使适配体与目标分子结合;弃去过量适配体,分别取3 μl上清和17 μl PCR扩增体系于37℃条件下将模板加入PCR管,95℃预变性1 min,95℃ 30 s,60℃ 30 s,共30个循环,记录扩增后每个反应管内荧光信号到达设定的域值时所经历的循环数,即Ct值,利用GraphPad Prism 8.0软件分别计算出候选适配体APT-1、APT-2、APT-3和APT-4的亲和力常数,即Kd值。
采用qPCR法特异性验证(图2),将200 μl活化的磁珠与150 μl结肠癌患者血清和健康查体血清分别孵育结合后,加入等量适配体溶液,37℃恒温旋转孵育30 min,弃去过量适配体,加水热变性,洗脱,qPCR法对洗脱的适配体进行定量分析。以健康查体的血清组作为阴性对照,验证候选适配体与结肠癌患者血清的结合情况。
1.6 最显著检测结果测定
为了获得最显著检测结果及患者血清检测用量阈值,选用最优候选适配体并设置浓度为100 nmol/L,将血清梯度稀释并投入等量适配体,通过qPCR定量计算最低检测限。
1.7 统计学分析
所有数据经过GraphPad Prism 8.0统计软件进行处理,比较阳性组与阴性组数据,以P<0.05为差异有统计学意义。
2 结果
2.1 血清中高丰度蛋白去除
本研究将40例癌症病人的血清充分混合,消除癌症病人血清的个体差异性,并设置每例病人血清量等量,保证个体同等性,同时将混合血清中的一些高丰度的非特异性蛋白(如白蛋白、球蛋白等)进行去除,人类血清原液总蛋白质含量约为70 g/L,离心去除上层脂肪后血清总蛋白质含量降低到约60 g/L,使用乙腈处理血清的方式将血清中高丰度蛋白含量降低,以血清∶乙腈∶水=2∶1∶4体积比混合后超声离心,将处理后的血清进行了蛋白质含量和蛋白质电泳测试,经乙腈处理离心后的总蛋白质含量降低至40~50 g/L,保证在乙腈的处理下,血清中原有的低丰度蛋白质尽可能地不受到影响,而对原有的高丰度蛋白质含量进行削减。
2.2 筛选过程监测
2.2.1 qPCR监测富集程度
每一轮筛选后,需对制得的正筛以及反筛模板进行qPCR扩增,确认模板中核酸含量,以监测适配体分子与血清蛋白结合程度,筛选后的模板量应为随着轮次逐渐降低,Ct值与模板量的变化相反(图2),随着筛选的进行,阳性模板量逐渐增大,阴性模板量逐渐降低,其∆Ct值(Ct阴-Ct阳)越来越小,且由初始阴性模板量大于阳性模板量变为阳性逐渐升高直至反超阴性模板,直至筛选结果的阴阳性差值逐渐缩小,根据Ct值计算适配体浓度,计算结合比,即正筛模板浓度/次级库浓度(图3),初始几轮筛选由于具有不稳定性,导致结合比变化不规律,但同一反筛靶标下,结合比逐渐增大,说明适配体在富集,直至更换反筛靶标,参考16轮结合比趋势,及每轮阴阳模板含量变化,适配体分子已富集,为避免PCR扩增偏好导致的误差,第7轮和第12轮模板为测序最佳选择。
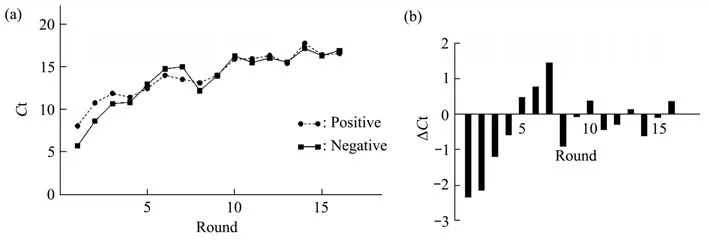
Fig.2 The change of positive and negative template content in each round
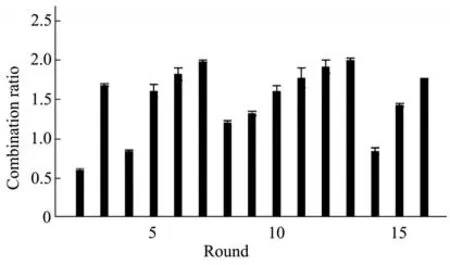
Fig.3 Combination ratio in screening process (normal screen template concentration/secondary library concentration)
2.2.2 琼脂糖凝胶电泳监测扩增的特异性
适配体分子在溶液中会形成稳定且复杂的三级结构,导致模板在扩增过程中会出现少量引物二聚体,进行了琼脂糖凝胶电泳,扩增后模板含有少量引物二聚体,因在下一轮制次级库扩增单链时,引物二聚体无法与设定引物进行配对进而无法扩增,故少量引物二聚体对后续筛选无影响。对第7、10、13和16轮制得模板DNA进行电泳,结果显示条带位置位于50~100 bp之间,约为88 bp,验证了筛选结果的可靠性。
2.3 结构分析
适配体的家族分析对挑选最优适配体具有重要意义,由于前20条序列家族同源性高达90%以上,为了保证候选库池的多样性,选择前100条适配体做了家族树图(图4),筛选得到的前100条序列主要以右侧的一个大家族和左侧的许多小家族为主,这几个家族可能具有优势结构,再优先考虑高通量测序中的重复情况、碱基分布情况和吉布斯最低自由能等条件,从右侧的大家族中选择了A1和A2两条适配体,并在左侧的小家族中选择了A5和A54两条适配体最为最终的候选适配体,将4条候选适配体进行家族同源性分析(图5),结果表明3条适配体具有较高家族同源性(不包括APT-54),APT-1、APT-2和APT-5三条适配体对结肠癌血清具有较高特异性,推测此家族中某些特殊结构可能是结合靶标蛋白的重要因素,且APT-1和APT-5的结果和预测结果几乎完全相同,两条适配体家族同源性高达97%。
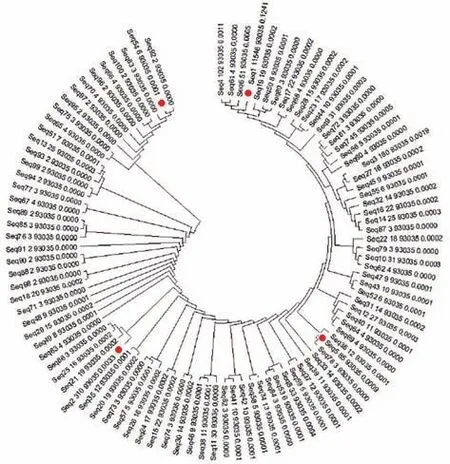
Fig.4 The family tree of the first 100 aptamers
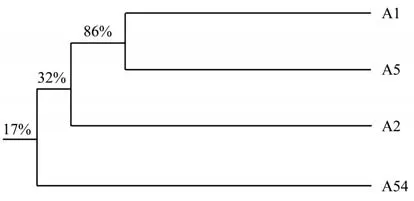
Fig.5 Homology analysis of four candidate aptamers
利用NUPACK软件对4条候选适配体进行二级结构预测(图6),4条适配体均具有15个碱基左右茎环结构,且APT-1、APT-2、APT-5和APT-54的吉布斯自由能分别为-5.68、-7.57、-5.88、-5.63 kcal/mol,自由能均在-5~-8 kcal/mol区间,说明筛选的适配体序列具有较稳定的结构。
在二级结构基础上,对4条候选适配体三级结构进行模拟(图7a,c),APT-1和APT-5两条适配体均在红色螺旋部分有一个较大茎环,绿色部分有较小茎环,分析认为两个茎环中碱基附带的磷酸基团可能在环内形成一个强负电电势,可能是与目标蛋白结合的主要位点。图7b为APT-2模拟结果,双螺旋为主要结构,但其具有一个开放的单链端,这种开放的单链端可能由于自身体积小的因素对目标蛋白上狭隘结构有着一定的结合能力。APT-54上端的紫红色结构部分中具有一个特殊的假结结构(图7d),其主要螺旋部分结构松散,结合时可能通过多种变化,如在不同pH条件下弯折形成具有特异性结构,或在结合时解开双链形成较大茎环,以此达到对靶标分子的作用。
2.4 亲和力和特异性测定
将4个候选适配体在过量血清条件下,设置适配体浓度分别为200、100、50、25、12.5 nmol/L和无适配体添加作为对照,检测与结肠癌患者血清的亲和力,4条候选适配体均可与结肠癌患者血清结合,但亲和力强弱略有不同。统计学软件GraphPad Prism 8.0计算分析解离常数,4条候选适配体与结肠癌患者血清结合的Kd值分别为(4.466±0.384)、(6.122±0.615)、(5.610±0.202)及(6.964±0.181)nmol/L,均小于10 nmol/L,表明4条候选适配体对结肠癌患者血清中的目标分子有较高亲和力,其中APT-1结合能力最强,APT-2和APT-5结合能力次之,而适配体APT-54的结合能力较弱。
为确保特异性验证的准确性,使用qPCR法以验证4条候选适配体的特异性。以16例不同结肠癌血清作为试验组,16例健康查体血清作为对照组,分析比较ΔCt值。结果如图8所示:APT-1的ΔCt值小于2(图8a),表明此适配体特异性不是很好,APT-2的ΔCt值为3~5范围内(图8b),表明此适配体特异性较好,与结肠癌患者血清的结合程度较强,阳性检出率约为82.5%;APT-5和APT-54的ΔCt值小于1(图8c,d),说明识别结肠癌患者血清的特异性较弱。
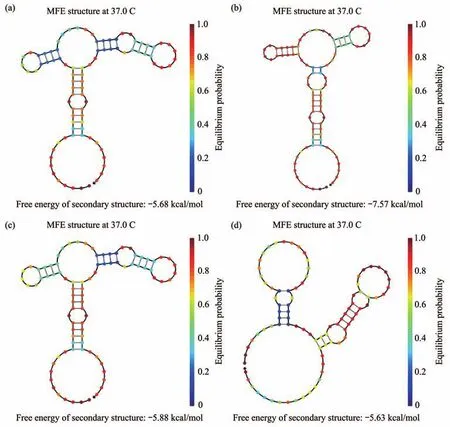
Fig.6 Secondary structure of candidate aptamers in the NUPACK software

Fig.7 3D structural simulation of candidate aptamers
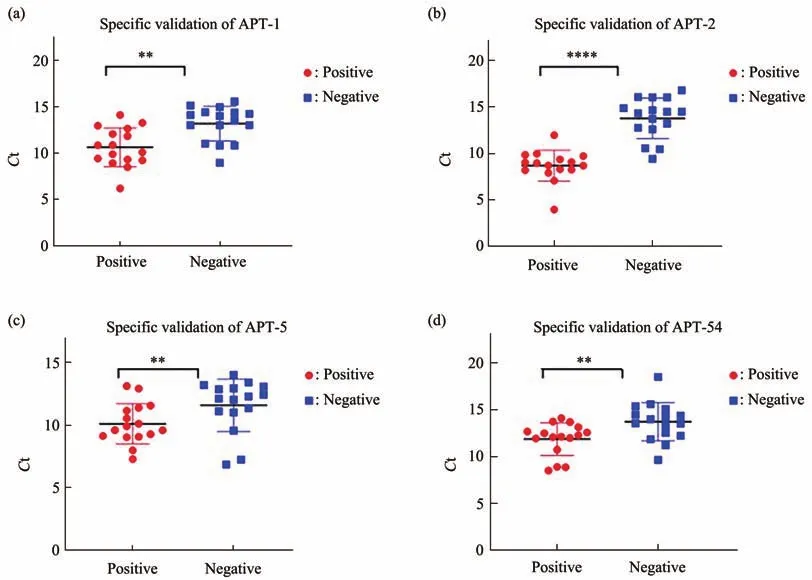
Fig.8 Specific validation of APT-1,APT-2,APT-5 and APT-54 for colon cancer serums
针对特异性较强的适配体APT-2,补充了32例其他癌症患者血清进一步验证,分析APT-2对其他癌症的特异性(图9),该适配体对结肠癌患者血清检出率仍可达到80%以上,表明该适配体具有较强的结合结肠癌患者血清能力。分析认为APT-2可与结肠癌患者血清中高表达的未知目标蛋白分子进行稳定结合,显示了APT-2可以稳定检出结肠血清的能力,分析APT-2的二级结构可知,APT-2的主要结构为茎环,且其自由能仅为-5.88 kcal/mol,所以其结构稳定,与特异性表征试验结果一致。
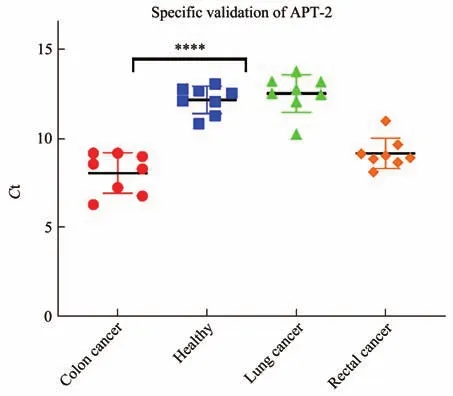
Fig.9 Specific validation of APT-2
2.5 最显著检测结果
为确定标定qPCR法检测时血清用量,选取不同浓度的血清和同一浓度的适配体进行检测(图10)。当结肠癌血清用量在30~200 μl时,阴阳性模板量有显著差别;当血清量低于30 μl时,血清中未知的目标蛋白含量较低,结果无显著差异;血清用量超过200 μl时,由于琼脂糖磁珠用量固定,阳性血清中的目标蛋白无法全部结合,导致模板量的差异无显著变化,故最佳血清用量为30~200 μl。
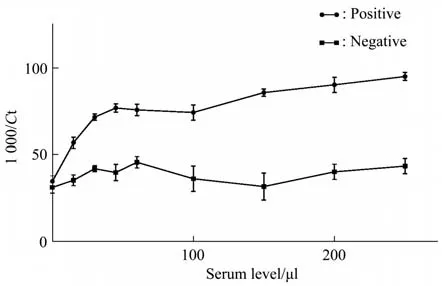
Fig.10 Optimum serum dosage for testing
3 讨论
本研究以琼脂糖磁珠为载体,结肠癌患者血清为正筛样本,健康查体、肺癌患者、直肠癌患者和乳腺癌患者血清为反筛样本,通过正反筛交替循环的筛选步骤,建立了完整有效的Ser-SELEX技术,筛选结肠癌血清的适配体,从随机程度较高的库池中进行筛选,通过逐渐增加筛选压力,如减少正筛靶标的孵育时间,增加反筛靶标的孵育时间和洗脱步骤得到具有更高的亲和力,性质更稳定的适配体序列。并通过qPCR对获得的正筛模板进行定量监测,确保适配体库池得到富集,在此过程不断消减阴阳性靶标共有蛋白质结合的适配体,使库池中的序列具有较高特异性,在模板量监测过程中,若出现筛选结果不理想,即阴阳性模板差异没有明显缩小,则应重复当天轮次直至阴阳性模板量差异缩小,以确保筛选每一轮的有效性。
经过16轮筛选,获得了具有特异性结合结肠癌患者血清蛋白的适配体库池,对此序列池与阴阳性靶标结合进行对比,发现筛选得到的序列池已经对阳性靶标蛋白有一定的结合能力,在阴阳性对比时有明显差异,对这个序列池里第7轮正筛模板和第16轮正筛模板进行第二代测序,并对测序结果进行理论分析,通过适配体的碱基分布情况和二级结构的预测挑选出了APT-1、APT-2、APT-5和APT-54四条适配体作为最终的候选适配体,并对候选适配体进行碱基分布情况与二级和三级结构分析。根据最低自由能原则分析,发现在模板库池中,茎环是主要存在的结构类型,尤其是适配体APT-2和APT-54,其结构以一个大茎环为主,适配体APT-1和APT-5,除茎环结构外,在序列的一端呈现发夹结构,茎环和发夹结构可能是适配体分子识别目标分子的特殊结构域。
为确保适配体具有良好特异性,筛选结肠癌患者血清适配体时使用健康查体血清等作为反筛。结果表明适配体APT-1与结肠癌血清的亲和力最高,而APT-54亲和力较弱。通过对约60例病人血清的特异性分析,发现适配体APT-2能特异性识别结肠癌,阳性检出率约为 82.5%,Kd为(6.122±0.615)nmol/L,因此适配体APT-2为最优适配体,且适配体APT-2对结肠癌血清的检测范围较广,在30~150 μl范围内均有良好的差异性和稳定的检出率。
4 结论
本研究筛选得到一条表现优异的功能性核酸适配体APT-2,该适配体可与结肠癌患者血清进行特异性结合,并具有良好的亲和力,为构建以适配体为核心的结肠癌血清生物传感器和结肠癌早期临床诊断技术提供了理论依据和试验方法。

