氧原子补偿缺陷对Ni3S2(101)晶面析氧反应性能的影响
王俊迪, 李中林, 孙锦如, 潘 靖
(扬州大学物理科学与技术学院, 江苏 扬州 225002)
水电催化分解制氢是解决环境问题和能源危机的有效手段[1-3].水分解包括2个半反应: 析氢反应(hydrogen evolution reaction, HER)和析氧反应(oxygen evolution reaction, OER).相对于析氢反应的两电子过程, 析氧反应更复杂, 包含4个缓慢的质子耦合电子转移过程, 也是限制水分解技术发展的重要因素, 因此提高析氧反应活性是决定水分解效率的关键步骤.目前, IrO2和RuO2等贵金属氧化物因在OER过程中具有较小的过电位而成为最理想的OER电催化剂, 然而高成本、低储量却阻碍了它们在水分解中的商业应用[4-7], 故设计和开发具有高性能且成本低的电解水催化剂显得十分重要.
镍元素在地球上储量丰富, 且镍基材料是OER最常见的催化剂[8-9], 其中镍基硫化物(Ni3S2、NiS2和NiS)因具有独特的电子结构、良好的电子输运性、低成本、温和简单的合成工艺, 而在电催化中展现出优异的性能[10-12].Wang等[13]运用镍蒸气和硫化氢气相沉积法制备出NiSx薄膜, 实现了较低负载且高效催化析氢反应(HER); Luo等[4]使用水热法生长出的NiS-Ni3S2异质结构在催化OER中表现出巨大的潜能.有趣的是, 通过控制不同Ni/S的化学计量比可获得不同电子结构的镍基硫化物, 其中具有较高Ni/S比的Ni3S2因具有较强的金属性, 使其表现出较高的电催化活性, 而Ni3S2(101)晶面则是理想的OER催化剂[13].然而, Ni3S2晶体制备过程中极易产生S缺陷, 而缺陷将改变Ni3S2的电子结构并最终导致晶体结构的不稳定, 对OER催化活性产生较大的影响[14-15], 故通过将S缺陷位置补偿其他合适的金属/非金属元素可增强其稳定性, 这对保持催化剂的OER催化活性至关重要.Liu等[16]将Zn掺杂到Ni3S2纳米片中, 发现碱性环境中OER的电流密度提高了90 mV, 且催化剂展现出良好的长期稳定性; Zhang等[17]通过掺杂一些过渡金属(如Mn、Fe、Co等), 显著提高了Ni3S2的稳定性和OER催化活性.目前的研究重点是通过金属元素的补偿来改善Ni3S2的性质, 然而非金属元素的半径和电负性与Ni的差异较大, 更易引起局部环境的变化, 对Ni3S2的几何和电子结构均有更大的影响.Chen等[18]发现N掺杂对Ni3S2的晶体结构和电子性质影响很大, 能显著提高其电导率和HER活性.因此, 通过非金属原子来调控Ni3S2的电子性质, 从而影响其OER性能是一种更有效的手段.本文拟运用第一性原理研究S空位对Ni3S2OER性能的影响, 并用O原子对缺陷进行补偿, 分析其对Ni3S2催化活性的影响.
1 模型与计算方法
所有计算均基于密度泛函理论(density functional theory, DFT), 采用Perdew-Burke-Ernzerhof(PBE)交换相关泛函的广义梯度近似(generalized gradient approximation, GGA)[19-20], 以平面投影缀加波(projector augmented wave, PAW)赝势描述离子实和价电子之间的相互作用[21], 平面波截断能为400 eV, 能量收敛标准为1.0×10-5eV, 原子力收敛标准为0.01 eV·Å-1.结构优化和态密度中布里渊区的积分计算采用k点网格分别为7×7×1和11×11×1的Monkorst-Park方案.所有计算在VASP软件中完成.
构建如图1(a)(b)所示的双层Ni3S2(101)晶面, 为了避免周期性作用, 在z轴方向加15 Å的真空层, 晶胞中包含18个Ni原子和12个S原子, 其中3个Ni原子暴露在表面上, 模拟OER催化的活性位点, 并通过公式[17]Eb=EH2O-Ni3S2-ENi3S2-EH2O计算H2O在Ni3S2表面不同活性位点的结合能, 式中EH2O-Ni3S2是水分子吸附在Ni3S2表面的能量,ENi3S2是Ni3S2晶体的能量,EH2O是水分子的能量.计算结果表明, 活性位点Ni1、Ni2、Ni3处的吸附能分别为-0.32, -0.26, -0.29 eV.因结合能越小, 水分子越容易吸附, 故Ni1被认为是最佳活性位点.图1(c)显示了与Ni1近邻的3个不同的S空位, 分别记为Svac1, Svac2, Svac3.图1(d)为采用O原子替位填补S空位的结构.
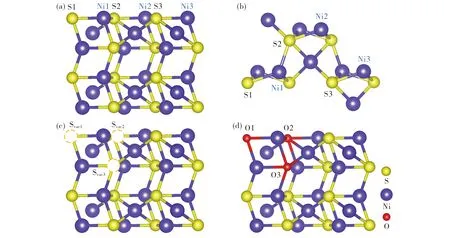
图1 Ni3S2(101)晶面结构((a) 侧视图; (b) 俯视图; (c) S空位的侧视图; (d) O原子补偿的侧视图)Fig.1 Ni3S2(101) facet structure diagram ((a) side view; (b) top view; (c) side view of S vacancies; (d) side view of O atom compensating for the vacancies)
2 结果与讨论
图2(a)给出了Ni3S2(101)晶面的电子态密度.计算结果显示, 费米面附近主要由Ni的3d轨道和S的3p轨道组成, 其电子态跨过了费米能级, 表明体系具有显著的金属性质, 使Ni3S2本征的Ni-Ni网格结构有助于电子传输, 这将有利于OER反应的进行[22-23].OER反应过程为
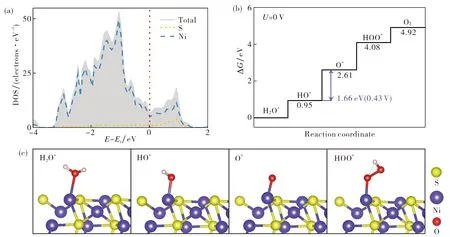
图2 Ni3S2(101)晶面 (a)部分态密度图; (b)四步反应自由能台阶图; (c) 反应过程构型Fig.2 Ni3S2(101) facet (a) partial density of state (PDOS); (b) free energy of the four steps; (c) the reaction process configuration diagrams
H2O+*→ HO*+H++e-,
(1)
HO*→ O*+H++e-,
(2)
O*+H2O → HOO*+H++e-,
(3)
HOO*→*+O2+H++e-,
(4)
其中*表示催化剂表面的吸附位点, X*表示吸附在催化剂表面的含氧中间体.定义OER过程的吉布斯自由能ΔG=ΔE+ΔEZPE-TΔS, 其中ΔE为各步的反应能, ΔEZPE为零点能量的变化量, ΔS为熵的变化量[24-25],T为体系的温度.图2(b)(c)分别给出了反应过程中吉布斯自由能台阶图和构型图.结果显示, 反应(1)~(4)的自由能分别为0.95, 2.61, 4.08和4.92 eV; 当平衡电位U=0 V时, 整个过程是吸热过程; 而当平衡电位U=1.23 V时, 虽然第一步和第四步是放热反应, 但第二步和第三步仍然处于吸热过程, 且最大电位差是U=1.66 V, 此时反应过程的过电位是0.43 V, 第二步为决速步, 表明催化过程中被吸附的HO*较难释放质子.
2.1 S空位的影响
图3给出空位分别在表面S1,S2和内部S3时的OER台阶图及相应的构型.图3(a)结果显示, 当空位在表面S1位置(即Svac1)时, H2O吸附在催化剂表面形成HO*的过程中, 自由能变化为0.37 eV, 小于无缺陷Ni3S2的0.95 eV, 表明催化剂表面空位的存在有利于HO*的形成; 而表面吸附O*时, 活性位点Ni和与其相连的S原子之间存在明显的竞争, 使O*远离了Ni原子, 而更倾向于吸附在S原子上, 此步反应的自由能变化为1.79 eV, 略低于无缺陷的Ni3S2催化剂; 在HOO*的形成过程中, 活性位点仍在表面的S原子上, 反应自由能增加到4.89 eV, 说明此步反应难度较大, 故此步反应为整个OER反应的决速步, 反应的过电位达1.88 V.
图3(b)结果显示, 当空位在表面S2位置(即Svac2)时, 第一步和第二步反应都变得非常容易, 自由能分别为-0.17和0.20 eV.构型图表明, 在HO*的形成过程中, O位于空位两边Ni原子的桥位, 并与Ni成键, 说明两个Ni之间存在竞争, 并通过O使结构变得更稳定; 在O*形成过程中, 被吸附的O原子进入Ni3S2晶体的内部, 并对S空位进行补偿, 使第三步反应中出现一个O吸附于Ni位点上, 而另一个O补偿S空位的结构; 在最后一步反应中, 需要较大的能量才能使补偿在S空位处的O脱离表面, 并与Ni位点处的O结合形成O2.因此, 第四步是这一反应进程的决速步, 所需的过电位达2.42 V.
图3(c)结果表明, 当空位位于Ni3S2内部(即Svac3)时, HO*的形成与无缺陷Ni3S2类似, 自由能为0.91 eV, 说明此处的空位对这一步反应的影响并不大; 然而, O*形成过程中, O并未吸附于活性位点的顶位, 而是在附近Ni的作用下, 吸附到Ni—Ni桥位, 且与两边的Ni原子都能成键, 主要原因是在内部S空位的作用下, O有进入内部的趋势, 弥补空位带来的结构不平衡; 第三步反应中, 在另一个水分子的作用下, 吸附在桥位的O迁移到活性位点Ni上, 但该过程需要较大的能量(自由能高达4.02 eV), 表明此步反应是整个过程的决速步, 过电位为1.75 V.计算结果表明, Ni3S2催化剂中不同位置的空位对OER过程产生不同的影响,由于反应过程中含氧中间体很容易进入空位, 弥补空位所造成的催化剂结构上的不平衡, 造成催化剂具有较大的过电位和较低的OER催化活性.
为了更好地研究含氧中间体对OER过程的影响, 计算了OER过程中各中间体的吸附自由能ΔG, 即ΔGHO*=ΔG1, ΔGO*=ΔG1+ΔG2, ΔGHOO*=ΔG1+ΔG2+ΔG3, 其中ΔG1、ΔG2、ΔG3分别为第1~3步的自由能, 结果如图4所示, 图中水平虚线表示每步的理想值分别为1.23, 2.46, 3.69 eV.当中间体的自由能大于理想值时, 说明中间产物与表面的相互作用较弱; 而中间体的自由能小于理想值时, 说明中间产物与表面的相互作用较强, 不利于中间体的解吸附.从图4可明显看出, 空位的存在改变了含氧中间体与催化剂表面的相互作用, 使得含氧中间体的自由能远离理想值, 导致OER催化性能下降.
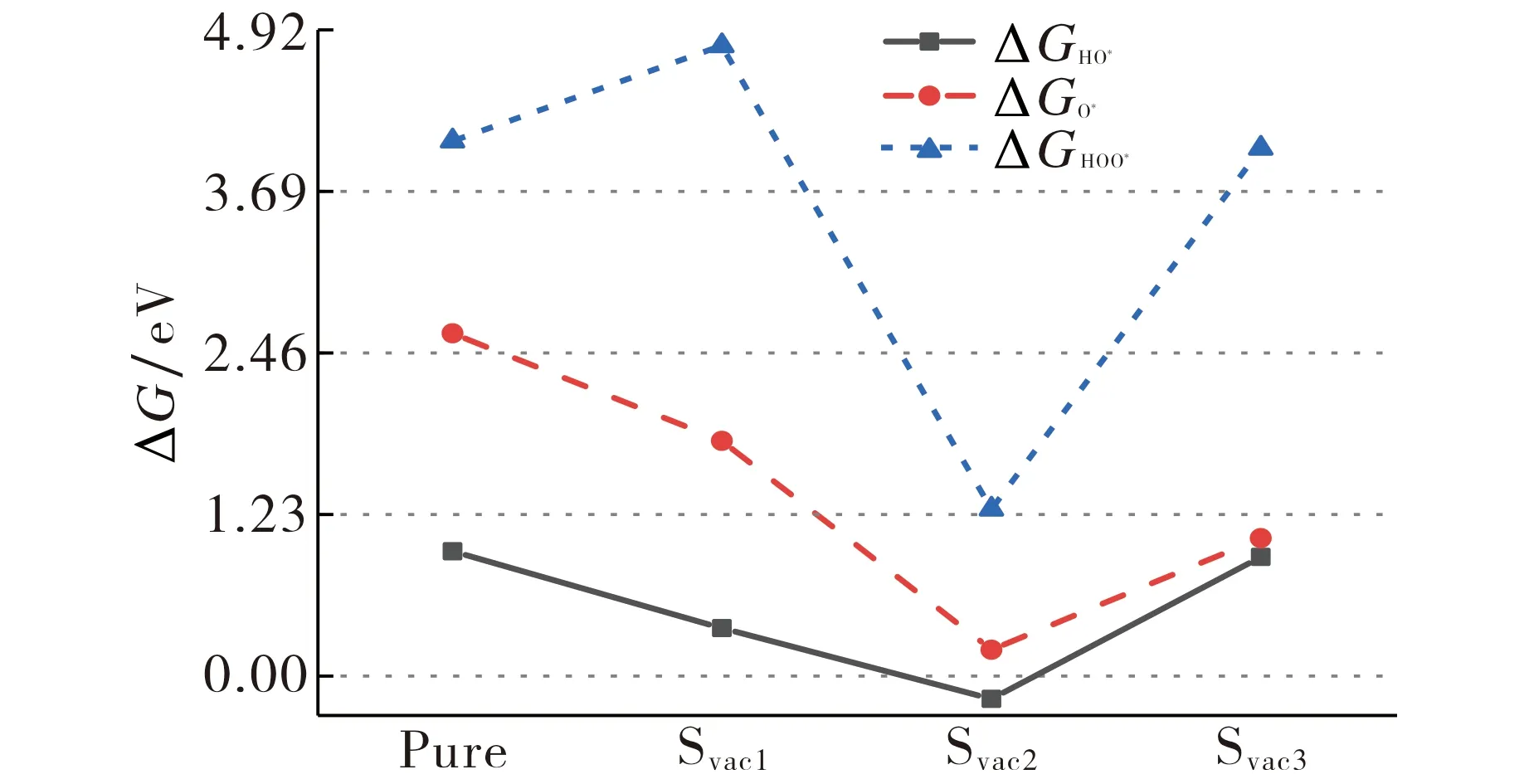
图4 纯Ni3S2(101)和不同空位构型的Ni3S2(101)晶面OER过程中各步含氧中间体的自由能Fig.4 The free energies of the oxygen-containing intermediate at each step during the OER process on pure Ni3S2 (101) facet and Ni3S2 (101) facet with different vacancies sites
2.2 O替位掺杂补偿S空位的影响
图5为O补偿不同位置时OER的台阶图.从图5可以看出, O补偿Svac1, Svac2, Svac3位置时的过电位分别为0.39, 0.92, 0.43 V, 显著提升了有空位Ni3S2的OER性能.从构型图中不难发现, O原子有效地补偿了空位的缺失, 很好地稳定了Ni3S2的结构.为了进一步分析O原子补偿空位后Ni3S2的稳定性, 计算了体系的形成能Ef=EO@Ni3S2-ENi3S2-μO-μNi, 其中EO@Ni3S2是O原子补偿后体系的能量,ENi3S2是无缺陷Ni3S2的能量,μO和μNi分别是O原子和Ni单质的能量.计算结果显示, O1,O2和O3补偿后, 体系的形成能分别为-2.34,-2.34,-2.56 eV, 负值表明O补偿容易形成, 进一步证明了O原子补偿能很好地提升体系的稳定性.此外, 在OER过程中, 周边的S以及掺杂的O原子未对活性位点产生竞争, 含氧中间体吸附在Ni的顶位且未受到O原子掺杂的干扰, 较好地改善了活性位点与中间体的相互作用.以O1补偿空位Svac1为例, 在HOO*吸附过程中, 由于O的补偿作用, 吸附位点由原来表面上的S原子作为活性位点改变成Ni原子, 显著增强了HOO*与表面的作用, 使吸附自由能从原来的4.89 eV降至3.71 eV.由于吸附性的增强, 使OER反应更容易进行, 反应的过电位由1.88 V降至0.39 V.
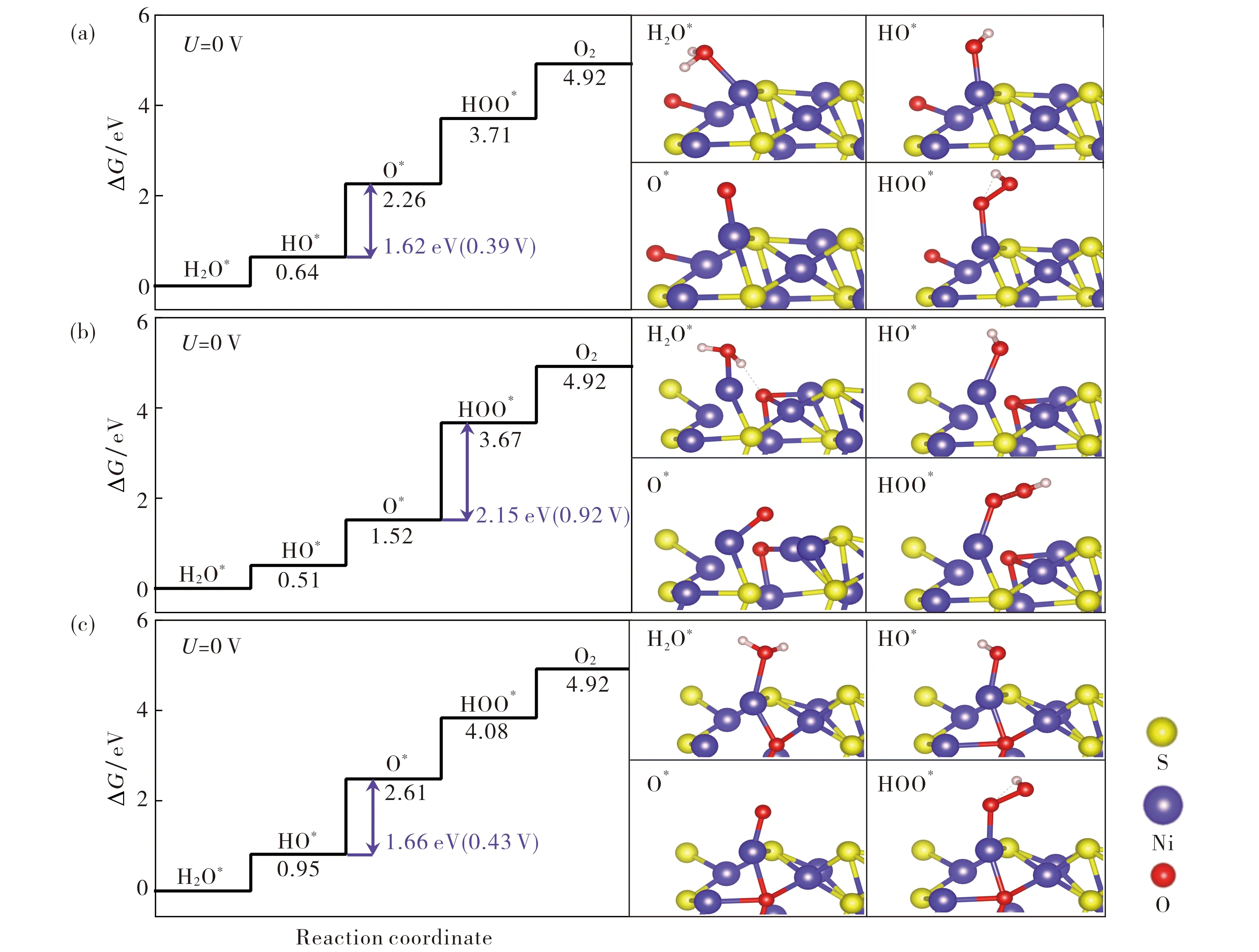
图5 自由能台阶图和OER反应过程的构型图 (a) O1补偿Svac1; (b) O2补偿Svac2; (c) O3补偿Svac3Fig.5 Step diagram and reaction process configuration diagram of (a) O1 compensated Svac1; (b) O2 compensated Svac2; (c) O3 compensated Svac3
图6给出了空位及O原子补偿的体系中含氧中间体的自由能.从图6可以看出, 相对于空位, O原子补偿后各反应过程的自由能更接近于理想值.例如, 补偿Svac2时, 各反应过程中间体的吸附自由能ΔGHO*, ΔGO*, ΔGHOO*分别为-0.17, 0.20, 1.27 eV, 远小于理想值1.23, 2.46, 3.69 eV, 这意味着这些中间体的解吸附非常困难.当O补偿空位Svac2时, 中间体的吸附自由能增加了0.51, 1.52, 3.67 eV, 因此通过O原子的补偿作用能改变中间体与表面的吸附作用, 使OER反应更易发生.
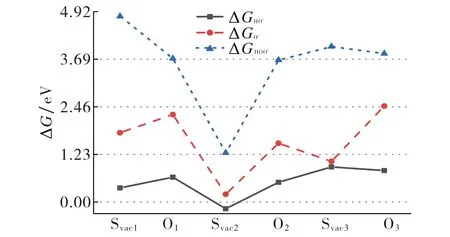
图6 不同空位构型的Ni3S2(101)和O补偿空位OER过程中各含氧中间体的自由能Fig.6 The free energies of the oxygen-containing intermediate at each step during the OER process on Ni3S2 (101) facet with different vacancies sites and Ni3S2 (101) facet compensated by O atoms
3 结论
本文运用密度泛函理论研究了S空位对Ni3S2(101)晶面析氧性能的影响.结果表明: S空位的存在破坏了体系的稳定性; OER过程的结构图显示, 对于含氧中间体, 活性位点与周边原子产生了很强的竞争反应, 使含氧中间体有进入内部补偿S空位的趋势, 弥补了空位带来的结构缺陷, 致使反应需要消耗更多的能量才能使其脱离催化剂的表面.反应过程中, 中间体的吸附自由能与理想值的对比显示, 晶体中的空位极大地增强了Ni3S2与中间体的相互作用, 使含氧中间体更易吸附到Ni3S2表面, 而更难发生解吸附, 这不利于催化反应的进行.OER自由能台阶图显示, 当O原子对体系中S空位进行补偿时, 体系的稳定性得到大幅度提升, 催化过程中活性位点不再受到干扰, 活性位点的解吸附性能也得到改善, 有效提高了体系的催化活性.因此,缺陷补偿是提高二维Ni3S2基催化剂电催化分解水析氧性能的有效手段, 本文结果为此类高性能催化剂的设计提供了理论依据.

