23 株临床分离单核细胞增生李斯特菌菌株的分子特征*
廖希玮,高硕,张燕,纪静茹,沈瀚,周万青,吴超(1.南京医科大学鼓楼临床医学院,南京 210008;2.南京大学医学院附属鼓楼医院a.检验科,b.感染性疾病科,南京 210008)
单核细胞增生李斯特菌(Listeriamonocytogenes,LM)是一种在自然界普遍存在的革兰阳性兼性胞内寄生菌,该菌对外界环境抵抗力强,可在冷藏条件下生存增殖。LM 可经被污染的食物传播导致人畜共患病,造成新生儿、老年人及孕妇等免疫低下人群严重感染后果,例如脑膜炎、败血症、流产及死胎等[1]。监测数据显示,在食源性疾病中李斯特菌病的病死率最高,可达17.6%,且发病率正不断增加[2],逐渐引起公众的重视。2011 年,我国建立食源性疾病监测计划,而对于李斯特菌病监测则是自2013 年开始在部分省份纳入监测计划[3-4]。目前我国尚缺乏有关李斯特菌病的多中心、纵向和全国性流行病学研究,关于李斯特菌病发生的整体信息尚不完整[1]。本研究对23 株临床分离LM 进行菌株药物敏感性检测、血清分型并基于全基因组测序技术分析菌株的毒力基因、耐药基因、ST 型以及CC 型分布情况以丰富临床分离菌株分子特征,并为李斯特菌病流行病学研究提供数据。
1 材料与方法
1.1 菌株来源 从2013 年3 月至2021 年5 月南京大学医学院附属鼓楼医院妇产科、心胸外科及感染科等多个科室收治的临床确诊为LM 感染住院患者临床样本中分离LM 菌株23 株。女19 例,男4 例,年龄25~92 岁。其中,血液样本20 株、脑脊液样本2 株、分泌物样本1 株。采用Vitek 2 Compact全自动细菌鉴定药敏系统及配套GP 鉴定卡对分离菌株进行鉴定,并经VITEK MS 质谱复核。以金黄色葡萄球菌ATCC29213、肺炎链球菌ATCC49619 为药敏试验质控菌株,上述菌株均为南京大学医学院附属鼓楼医院检验科微生物实验室保存菌株。
1.2 主要仪器与试剂 Vitek 2 Compact 全自动细菌鉴定药敏系统、Bacter/Alert 3D 血培养仪、VITEK MS、GP 鉴定卡、GP67 药敏卡、FN、FA 培养瓶(法国梅里埃公司),3111 型CO2孵箱、Qubit 荧光分光光度计、M-H 平板、药敏纸片、哥伦比亚血琼脂平板(美国Thermo Fisher 公司),T100 PCR 扩增仪(美国Bio-Rad 公司),2500 型凝胶成像系统(上海天能公司),Illumina HiSeq 2000 测序系统(美国Illumina公司),小型高速离心机(Eppendorf 公司)。STM 平板、E-Test 试验试剂(郑州安图公司),2×PCR Premix Taq、DL 2000 Marker(苏州近岸蛋白质科技公司),AGAROSE G-10 琼脂糖凝胶(西班牙BIOWEST公司),TBE、磁珠法细菌基因组提取试剂盒(上海生工生物工程公司)。
1.3 菌株药敏试验 分别采用E-Test 试验和纸片扩散法检测LM 药物敏感性。其中青霉素、氨苄西林、美罗培南和红霉素采用E-Test 试验,复方磺胺甲噁唑、四环素、克林霉素、万古霉素、左氧氟沙星、环丙沙星、利奈唑胺、头孢曲松及庆大霉素采用纸片扩散法。参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)M45 A3单核细胞增生李斯特菌最低抑菌浓度折点和M100 S32 中葡萄球菌属的抑菌圈直径折点进行结果判读[5-6]。分别采用肺炎链球菌ATCC49619 和金黄色葡萄球菌ATCC29213 作为药敏试验质控菌株。
1.4 全基因组测序 采用磁珠法提取细菌总DNA,具体操作按照试剂盒说明书进行。所提取DNA 纯度经Qubit 荧光分光光度计测定吸光度(A260nm/A280nm)比值在1.8~2.0 之间,并置于-80 ℃保存。委托上海生工生物公司进行全基因组测序。使用Illumina HiSeq 2000 测序系统进行全基因组测序。提取核酸经琼脂糖凝胶电泳及浓度检测合格后进入文库构建,对样本DNA 进行双向测序(paired-end,PE)构建450 bp 文库;对测序结果进行质量剪切后,用SPAdes v3.13.0 软件(https:/ /www.patricbrc.org/app/Assembly2)将序列进行拼接,以得到最优化组装结果。采用RAST tool kit(RASTtk)工具(https:/ /www.patricbrc.org/app/Annotation)进行基因组注释。采用GTDB-Tk 软件进行菌株进化树分析。获得的基因测序组装结果提交至国家生物信息中心(China National Center for Bioinformation,CNCB),得到序列号(GWHCBGK000 00000-GWHCBGZ00000000,GWHCBHA00000000-GWHCBHG00000000)。
1.5 毒力基因和耐药基因检测 使用Center for Genomic Epidemiolog(http:/ /www.genomicepidemiology.org/;于2022 年7 月3 日访问)的“毒力”工具检测所选菌株基因组中的毒力基因。根据基因存在与否,使用Broad Institute 的Morpheus 矩阵可视化和分析软件生成热图(https:/ /software.broadinstitute.org/morpheus/;于2022 年9 月3 日访问)。采用ResFinder-4.1 Sever 检索耐药基因携带情况(https:/ /cge.food.dtu.dk/services/ResFinder/;于2022 年7 月3 日访问),核苷酸最小一致性设定为60%,最小覆盖设定为90%。
1.6 谱系、多位点序列分型(multilocus sequence typing,MLST)、克隆群(clonal complexes,CCs)分型和血清分型 菌株的序列分型(sequence type,ST)基于全基因组测序结果,利用MLST 网站(https:/ /cge.food.dtu.dk/services/MLST/)分析获得。实验菌株的CC 分型和谱系均基于全基因组测序结果,利用BIGSdb-Lm 数据库(https:/ /bigsdb.pasteur.fr/listeria/)确定。参照Doumith 等[7]方法,采用多重PCR 扩增LM 血清分型相关基因(lmo0737、lmo1118、ORF2819、ORF2110、prs)。引物由上海生工生物工程公司合成,见表1。反应体系为50 μL,包括Premix Taq 25 μL,模板DNA 2 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 13 μL。循环参数:95 ℃3 min;95 ℃40 s,53 ℃60 s,72 ℃60 s,35 个循环;72 ℃7 min。产物经12 g/L 琼脂糖凝胶电泳分析产物大小及确定菌株血清分型结果。血清分型结果判读:lmo0737和prs均检出为血清分型1/2a;ORF2819和prs均检出为血清分型1/2b;ORF2110、ORF2819和prs均检出为血清分型4b。

表1 血清分型PCR 扩增引物信息
2 结果
2.1 药敏结果 23 株LM 对青霉素、氨苄西林、美罗培南、红霉素、万古霉素、左氧氟沙星、环丙沙星、利奈唑胺及庆大霉素均敏感,对克林霉素、头孢曲松均耐药,对四环素和复方磺胺甲噁唑敏感率均为95.7%(LM3157 对此2 种药物耐药)。其中青霉素MIC50和MIC90值分别为0.38 μg/mL 和0.5 μg/mL,氨苄西林MIC50和MIC90值均为0.5 μg/mL,美罗培南MIC50和MIC90值均为0.125 μg/mL,克林霉素MIC50和MIC90值均为0.38 μg/mL。
2.2 毒力基因和耐药基因结果 23 株LM 中共检出89 个不同的毒力基因。1 个分离株有81~88 个毒力基因。所有菌株均携带的主要毒力基因包括prfA、ActA、hly、mpl、plcA、plcB、iap,内化素基因inlA、inlB、inlC、inlJ以及应激调控基因sigB。除LM3157和LM5880 外,其余菌株均检出aut、gtcA、Ami。仅3株检出vip基因(LM12038、LM11456、LM2516);13株检出GadA;5 株缺乏AgrA;12 株存在内蛋白基因InlF、Inlk。见图1。
采用ResFinder-4.1 Sever 数据库检索耐药基因携带情况,发现23 株菌株均检出fosX耐药基因,其中LM3517 同时携带tet(M)和dfrG耐药基因,基因定位预测分析发现,上述耐药基因均存在于菌株染色体上。
2.3 谱系、ST 型、CC 型及血清型分布 23 株LM分属于2 个谱系(Ⅰ和Ⅱ),以谱系Ⅱ为主,共12 株(52.2%);分为8 个ST 型,分别为ST8 型9 株(39.1%)、ST3 型、ST87 型和ST451 型各3 株(各13%),ST5 型2 株(8.7%),ST1 型、ST224 和ST515型各1 株(各4.3%);分为7 个CC 型,包括CC8、CC3、CC87、CC11、CC5、CC1、和CC224,优势CC 型为CC8,共占39.1%(9 株)。见表2。
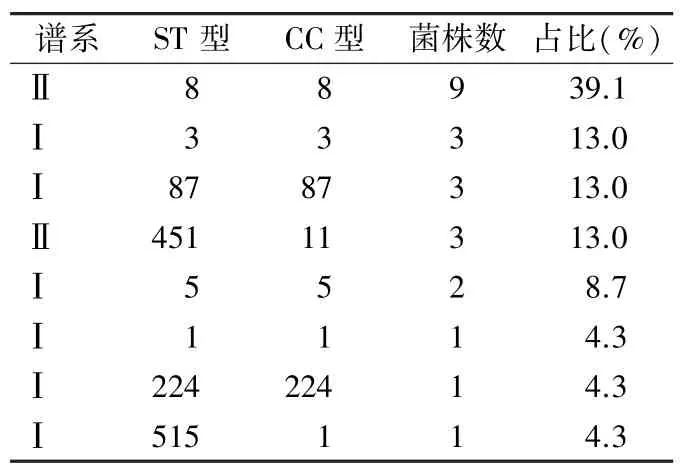
表2 LM 谱系、分型
经多重PCR 扩增及电泳分析显示,23 株LM被分成3 种血清型,包括1/2a、1/2b 及4b,分别为13 株(56.5%)、8 株(34.8%)和2 株(8.7%)。部分菌株电泳结果见图2。
2.4 菌株进化树分析 采用gtdbtk 软件对23 株LM 菌株进行进化树分析,可见23 株LM 菌株基因组进化上分为2 个主要分支。见图3。
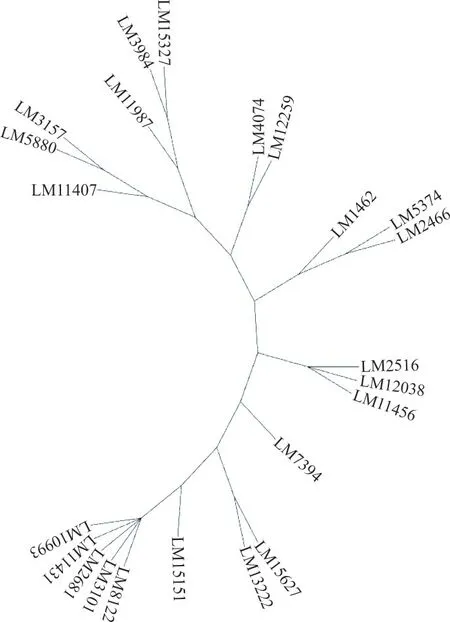
图3 LM 菌株基因组进化树图谱
3 讨论
本研究中23 株LM 对氨苄西林、青霉素、美罗培南以及万古霉素均敏感,与其他报道相一致[8]。因此,临床疑似LM 感染患者可经验性使用氨苄西林和青霉素,亦可根据药敏试验结果调整治疗药物或升级抗生素为美罗培南或万古霉素。本次药敏试验检出1 株同时对四环素和复方磺胺甲噁唑耐药菌株(耐药率为4.3%),经全基因组测序证实耐药表型分别由tet(M)和dfrG基因介导,提示本院临床分离LM 耐药率较低,与其他地区报道不同[8-9],可能与地域性差异或与研究菌株来源不同有关。
根据基因组系统进化,LM 可分为Ⅰ~Ⅳ4 个谱系。其中谱系Ⅰ与LM 临床感染相关,而谱系Ⅱ多与食品污染密切相关。本次调查结果显示,23 株临床分离LM 分为谱系Ⅰ(CC87、CC1、CC3、CC5 和CC224)和谱系Ⅱ(CC8 和CC11),其中以谱系Ⅱ为主(12 株,52.1%),表明谱系ⅡLM 也可能是临床主要流行型别。目前全球流行LM 的CC 型包括CC1、CC3、CC87 和CC8[3,10],国内多见CC8(ST8)[3]。本研究结果以CC8(ST8)型菌株最多,与报道一致[11];其他分型包括CC87(ST87)、CC1(ST1、ST515)、CC3(ST3)、CC5(ST5)、CC224(ST224)和CC11(ST451)等在本院亦有检出,与其他国家或地区分布有所不同[10-12],提示临床分离LM 的CC 型及ST 型具有多样性及地区分布差异性。23 株LM分属1/2a、1/2b 和4b 3 种血清型,其中1/2a 型占比最高(占56.5%),其次为1/2b(占34.8%),与国内多地报道相符[13-14],但与国外血清型分布存在一定差异[10,15],体现出LM 的遗传差异性。虽然1/2a型菌株数占比最高,但分离菌株的患者之间缺乏暴发证据,相似的结论与意大利一项研究相同[16],表明1/2a 血清型为散发病例常见的血清型。
有文献表明inlA和inlB毒力基因分别与LM入侵宿主肠上皮细胞和肝细胞有关;LIPI-1基因(包括ActA、hlyA、mpl、plcA、plcB和prfA)与黏附侵入细胞、在宿主细胞胞浆中运动以及逃逸宿主细胞吞噬等侵袭能力密切相关[17]。本研究中的LM 分离株全部携带LIPI-1、inlA和inlB,与文献报道一致[15],说明菌株能够更好适应宿主环境并且具有较强的致病潜力。由inlC和inlJ基因编码的内化蛋白inlC 和inlJ 均与肠道感染相关[18],Iap编码p60 细胞外蛋白,与LM 在细胞内运动和细胞间扩散有关[19]。本研究中所有菌株均检出上述3 种基因,而从各种食品和环境分离的菌株亦携带上述基因[18-19]。因此,食用被此类菌株污染的食品可能是人类患李斯特菌病的重要风险因素。耐药基因的发现有助于指导临床抗菌药物的选择,本研究中所有菌株均携带fosX耐药基因,与既往文献相符[20],其介导磷霉素耐药,故而对于LM 感染患者不建议使用磷霉素治疗。
本研究通过对临床分离LM 菌株血清分型以及基于全基因组测序技术的毒力因子、耐药基因、ST 型及CC 型分布进行分析,丰富了临床分离LM分子特征的多样性,亦为临床防治LM 感染及其分子流行病学研究提供了重要基础数据。但由于样本量局限性,本研究未能明确LM 分离株相关毒力基因和耐药基因与分型之间的关系,后续将加大样本量进一步探究。

