欣乐本草菁萃对胃黏膜损伤和肠道菌群的影响
王磊 崔琴丹 赵宏伟 史建勋 黄先菊

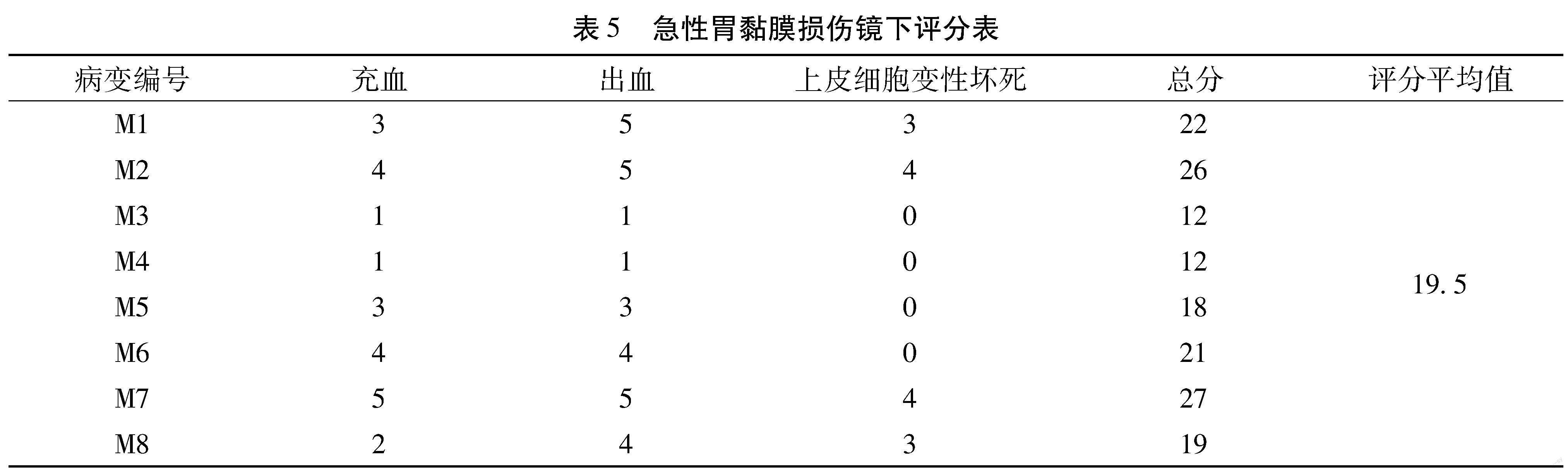



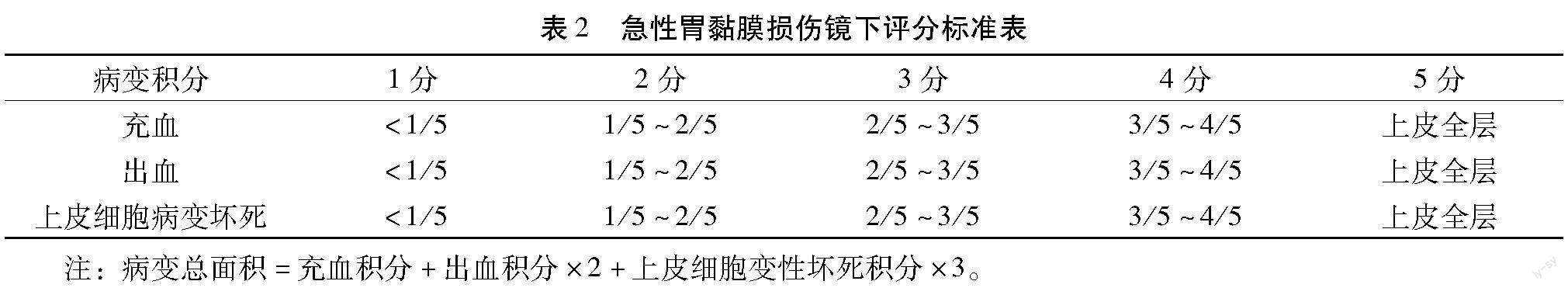
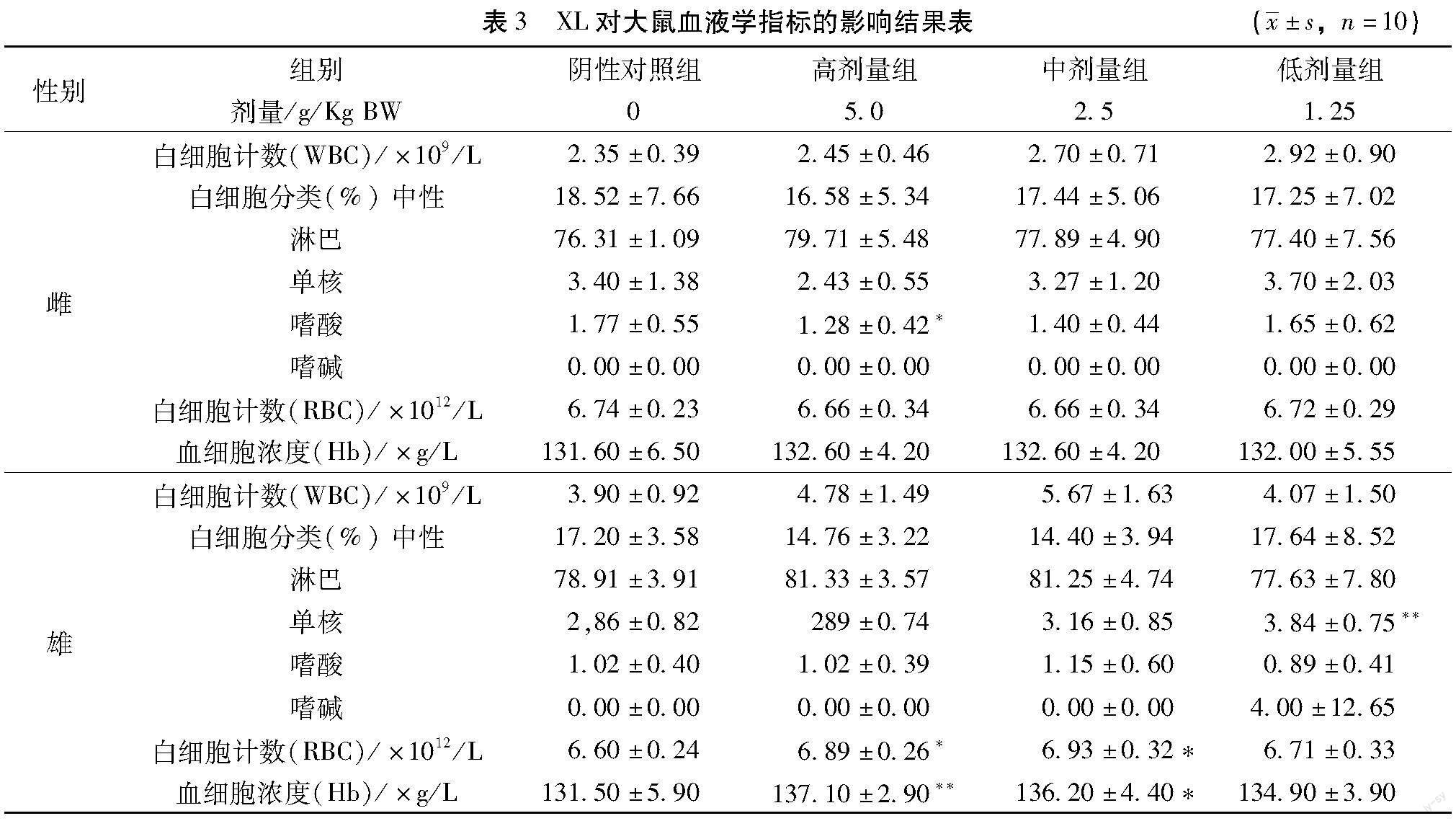


【摘 要】目的:探討欣乐本草菁萃(Xinle herb extract,以下简称XL)对无水乙醇所致大鼠胃黏膜损伤的保护作用和小鼠肠道菌群的调节作用。方法:①以SD大鼠为实验对象,随机分为正常组、模型组,低剂量组(0.033 g/mL)、中剂量组(0.067 g/mL)和高剂量组(0.2 g/mL),各给药组分别灌胃给予受试物,再用无水乙醇诱导大鼠急性胃黏膜损伤,通过解剖观察大鼠胃组织形态学及病理结构,评价XL对大鼠胃黏膜组织的保护作用;②以健康BALB/C 小鼠为实验对象,随机分为对照组、低剂量组(0.033 g/mL)、中剂量组(0.067 g/mL)、高剂量组(0.2 g/mL),各给药组分别灌胃给予受试物,三周后,分组收集小鼠新鲜粪便,连续6 d,进行肠道菌群检测计数。结果:在胃黏膜损伤实验中,与模型组相比,低、中、高剂量给药组对无水乙醇所致胃黏膜损伤均有明显的减轻;在肠道菌群实验中,与正常组相比,各剂量给药组除肠杆菌数量无统计学差异外,益生菌如双歧杆菌(低、中剂量给药组)、乳杆菌(高剂量给药组)及拟杆菌(中、高剂量给药组)数量均上升,而非益生菌如肠球菌(中、高剂量给药组)则出现明显下降,梭杆菌(低、高剂量给药组)及梭菌(低剂量给药组)略有下降。结论:XL可保护无水乙醇所致大鼠胃黏膜损伤,并调节BALB/C 小鼠肠道菌群。
【关键词】 欣乐本草菁萃;胃黏膜保护;乙醇;肠道菌群
【中图分类号】R285.5 【文献标志码】 A【文章编号】1007-8517(2023)16-0016-09
DOI:10.3969/j.issn.1007-8517.2023.16.zgmzmjyyzz202316005
The Influence of Xinle Herb Extract on Gastric Mucosal Lesion and Intestinal Flora
WANG Lei1 CUI Qindan2 ZHAO Hongwei1 SHI Jianxun3 HUANG Xianju2*
1.Infinitus China Co.,Ltd,Guangzhou 510000,China;2.School of Pharmaceutical Sciences,South-Central Minzu University,Wuhan 430074,China;3.Zhejiang Pharmaceutical College,Ningbo 315100,China
Abstract: Objective To clarify the protective effect of Xinle herb extract (XL) on absolute alcohol-induced gastric mucosal lesionin rats as well as the regulation of XL on mice intestinal flora.Methods ①SD rats were randomly divided into normal group,model group,low-dose XL group (0.033 g/mL),middle-dose XL group (0.067 g/mL) and high-dose XL group (0.2 g/mL).The XL groups were daily intragastrical administered with different doses of XL for four weeks.Afterwards,the ratswere intragastrical administered with absolute alcohol to induce acute gastric mucosainjury.The protective effect of XL on rat gastric mucosa injury was evaluated by the detection of morphological and pathological changes of rat stomach.②The health BALB/C mice were randomly divided into normal group,low-dose XL group (0.033 g/mL),middle-dose XL group (0.067 g/mL) and high-dose XL group (0.2 g/mL).The XL group mice were dailyintragastrical administered with XL for three weeks.Then the fresh feces of mice in each group were collected for successive 6 days and the intestinal flora were detected and counted.Results Theresults in rats showed that compared with model group,All the XL groups could significantly reduce the gastric mucosal damage caused by absolute alcohol to some extent.In the mice experiment,the results showed that the number of Enterobacteriaceae has no significant difference among all the groups.However,the number of probiotics such as Bifidobacterium (low,middle dose group),lactobacillus (high dose group) and Bacteroides (middle,high dose group) in XL groups increased when compared with control group.Meanwhile,the number of non-probiotics such as Enterococcus (middle,high dose XL group) significantly decreased,and the number of fusobacterium (low,high dose XL group) and clostridium (low dose XL group) decreased slightly.Conclusion XL could protect the gastric mucosal injury in rats and regulate intestinal flora in mice.
Key words: Xinle Herb Extract;Gastric Mucosal Protection;Alcohol;Intestinal Microflora
胃肠道疾病属于全球卫生流行病之一,据统计,全球有5%~10%的人群患有从胃炎到胃癌等不同程度的疾病[1]。胃病的发生和发展在一定程度上均与胃黏膜损伤有关,胃黏膜损伤是一系列外源性或内源性攻击因子进入胃内刺激胃黏膜所导致的炎症反应,胃黏膜屏障功能被攻击因子侵袭及胃腺体结构受到破坏时可诱发黏膜损伤[2]。其中饮酒是导致胃黏膜损伤最直接的原因,过量饮酒会明显增加上消化道大出血的风险[3]。酒精所含有的主要成分乙醇对胃黏膜组织具有很强的腐蚀性, 破坏表面黏液层和颈黏液细胞, 并破坏胃黏膜的正常代谢所需的生理环境[4]。临床上用于治疗胃黏膜损伤的药品主要有胃酸中和药、H2受体拮抗剂、H+泵抑制剂等[5],然而,服用这些药物可能存在治疗时间长、愈合缓慢、复发率高、副作用大等问题[6]。中医将中药的“四性”和“五味”论运用到食物之中,认为每种食物也具有“四性”、“五味”。许多食物即药物。药食同源类物质本身可以作为实用性的中药材,同时也兼具药食的功能并作用于医疗保健领域。
药食同源物质大多性味平和,具有良好的安全性。欣乐本草菁萃(Xinle herb extract, XL)根据中国传统中药复方参苓白术散进行组方,在选取7种药食同源药材(党参、山药、茯苓、白扁豆、陈皮、砂仁、白术)的基础上同时提取融合猴头菇多糖制成。参苓白术散作为中国传统中药复方,在中医中用于脾胃虚弱,食少便溏,气短咳嗽,肢倦乏力。成份中的人参、山药等是具有改善胃肠道功能作用的药食同源物质;复方中人参补气,健脾养胃;山药、桔梗宣肺养肺;白术、茯苓燥湿健脾;薏苡仁、扁豆健脾化湿;砂仁芳香化湿,和胃降逆;甘草调和诸药,诸药合用,共奏健脾益气、渗湿止泻之效。猴头菇[Hericium erinaceus (Bull.) Pers.]是齿菌科、猴头菇属真菌,也属于中国传统的贵重中药材,《新华本草纲要》中记载,猴头菇味甘,性平。有利五脏、助消化、滋补、抗癌等功能[7]。现代研究表明,其含有的多糖成分,对胃溃疡、溃疡性结肠炎、十二指肠溃疡、胃炎以及癌症等都具有一定的疗效。杨永刚等[8]通过猴头菇多糖对乙酸构建的SD大鼠溃疡性结肠炎治疗,发现猴头菇多糖能够显著提高溃疡性结肠炎大鼠血清中ATP的含量,并具有提高结肠组织中线粒体膜电位的作用。周辉等[9]通过对Lewis肺癌荷瘤小鼠灌胃给与猴头菇多糖,发现其对小鼠Lewis肺癌具有剂量依赖性的抑瘤作用。
探讨XL对胃黏膜损伤的保护作用和肠道菌群的影响,本文基于XL的功效,参考本课题组先前研究[10-11],首先对XL进行临床剂量安全性研究,再采用无水乙醇所致胃黏膜损伤模型,对实验性大小鼠进行给药,测定XL对胃黏膜损伤大鼠的保护作用及对小鼠肠道菌群的影响,以期对XL的进一步应用提供实验基础和参考数据。
1 材料与仪器
1.1 动物、材料与试剂
1.1.1 动物 3~4周龄健康Wistar大鼠80只,雌雄各半[生产许可证号:SCXK(京)2016-0006,北京维通利华实验动物技术有限公司]。SPF级SD雄性大鼠50只,SPF级雄性BALB/C小鼠40只,来源于湖北省实验动物中心[动物生产许可证号为SCXK(鄂)2015-0018]。
1.1.2 材料与试剂 XL来自无限极(中国)有限公司研发中心,密封,4 ℃保存。蒸馏水(武汉三羊泰科技有限公司);0.9%氯化钠注射液(武汉滨湖双鹤药业有限责任公司,批号:1610200801);无水乙醇(国药集团化学试剂有限公司,产品批号:20170605)。
1.2 仪器与设备 XT-2000i型全自动动物血液细胞分析仪(日本希森美康公司);AU 680全自动生化分析仪Beckman Coulter K.K.;PB 302 型电子天平(瑞士梅特勒公司);BS 110S型电子天平(北京赛多利斯天平有限公司);ASP200S 型真空组织脱水机、EG1150 型包埋机、EG1150C 型包埋冷冻台、RM2265 型全自动切片机、HI1210 摊片机、HI1220 烤片机(Leica Biosystems Nussloch GmbH);DM2500顯微照相仪(Leica Microsystems);H-1850R高速冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
2 实验方法
2.1 安全性实验
2.1.1 动物分组与饲养 80只3~4周龄健康大鼠,在温度为20~24℃,湿度为40%~70%及12h 光暗周期环境下进行饲养。适应性喂养一周以后,将大鼠称重并随机分为高剂量组、中剂量组、低剂量组及阴性对照组,均为雌雄各10只。高、中、低三个剂量组分别灌胃给予5g/kg、2.5g/kg、1.25g/kg三种浓度样品溶液,阴性对照组灌胃给予纯净水,每天灌胃一次,灌胃体积均为1.0mL/100g体重,分别相当于人摄入量(以每日口服3次、体重60kg计,折算剂量则为0.05g/kg)的100倍、50倍、25倍。每天灌胃1次,连续30d。
2.1.2 大鼠相关指标的测定
2.1.2.1 一般表现及行为学观察 每日观察并记录所有动物的一般表现、行为、呼吸、中毒表现及死亡情况。每周称一次体重、两次食物摄入量。计算每周及总的食物利用率。每周食物利用率(%)=周体重增重/周饲料摄入量×100%,总食物利用率=试验期间动物体重总增重/饲料总摄入量×100%。
2.1.2.2 血液学及生化指标 灌胃30d后,末次灌胃后大鼠禁食16h,大鼠用戊巴比妥钠溶液腹腔注射麻醉,真空采血管腹主动脉取抗凝血(EDTAK2抗凝)及未抗凝血后,腹主动脉放血处死,抗凝血用于检测血液学指标,未抗凝血分离血清后用于检测血液生化指标。血液学指标检测如下数据:测定血红蛋白(Hb)、红细胞计数及分类(WBC&DC);血液生化指标检测如下数据:丙氨酸氨基转换酶(ALT)、天门冬氨酸氨基转换酶(AST)、尿素氮(BUN)、肌酐(Cr)、血糖(GLU)、白蛋白(ALB)、总蛋白(TP)、总胆固醇(TCHO)、甘油三酯(TFG),计算白蛋白/球蛋白比值(ALB/GIO)。
2.1.2.3 大体解剖及病理观察 试验结束时,对所有大鼠进行大体检查,肉眼观察各组大鼠的器官和组织生理病理状况。HE染色法对阴性对照组及高剂量组大鼠的主要脏器进行组织病理学检查,包括肝、肾、脾、胃肠、卵巢(雌性)、睾丸(雄性)等。
2.1.2.4 脏器重量和脏/体比值 摘取各组大鼠肝、肾、脾、胃肠、卵巢(雌性)、睾丸(雄性),滤纸吸干表面水分,称量上述脏器的绝对重量,脏/体(%)=脏器绝对重量/动物体重×100%(动物体重为禁食后的体重)。
2.2 对胃黏膜损伤的保护作用及肠道菌群影响
2.2.1 对胃黏膜损伤的保护
2.2.1.1 实验动物分组及给药 雄性SD大鼠50只,体重160~180g,随机分为正常组、模型组、低剂量组(0.033g/mL)、中剂量组(0.067g/mL)及高剂量组(0.2g/mL)。适应性喂养5d后,每天1次灌胃给药,连续4周,对照组和模型组给予等体积的生理盐水。
2.2.1.2 胃黏膜损伤观察 4周后全部动物严格禁食24h(不禁水),此期间亦禁止给予受试物。除空白对照组外,所有试验动物给予无水乙醇1mL/只,1 h后处死动物,暴露完整胃,结扎幽门,灌注适量10%甲醛,固定20min,然后沿胃大弯剪开,洗净胃内容物,展开胃黏膜,用游标卡尺测量出血点或出血带长度和宽度,评分标准详见表1。
观察指标:各实验组胃黏膜损伤程度及损伤发生率(%)、损伤积分指数和损伤抑制率。损伤发生率(%)=某组出现出血或溃疡的大鼠数量/该组大鼠数量×100%;损伤积分指数=组损伤评分总和/组动物数量;损伤抑制率(%)=(A-B)/A×100%(A、B分别为模型组与试验组的损伤积分)。
病理组织学观察及评分:大体检查完毕,将每只动物胃黏膜损伤最严重的部位切下,固定于10%甲醛溶液,常规切片,HE染色,镜下观察。注意选择胃黏膜正横切面,包括黏膜全层的区域观察。评分方法:以充血、出血、黏膜细胞变性坏死在整个黏膜上皮层的累计程度分为5级。充血权重为1,出血权重为2,上皮细胞变性坏死权重为3,评分标准及病变总积分公式详见表2。
2.2.2 对肠道菌群的调节作用
2.2.2.1 实验动物分组及给药 雄性BALB/C小鼠40只,体重18~22g,随机分为对照组、低剂量组(0.033g/mL)、中剂量组(0.067g/mL)及高剂量组(0.2g/mL)。每天灌胃给药一次,连续4周,对照组给予等体积的生理盐水。
2.2.2.2 小鼠肠道菌群的检测 给药前,将小鼠称重后随机分组,给药后每周固定时间称重一次,实验结束后绘制体重变化曲线。三周后全部动物分组收集新鲜粪便,每天固定时间收集一次,连续6 d,稀释粪便后涂布平板,进行肠道菌群检测计数。
双歧杆菌:采用TPY琼脂培养基,是GB标准中分离培养双歧杆菌的方法,厌氧培养,菌落小,扁平,呈乳脂色至白色。乳杆菌:采用乳酸杆菌选择性培养基,菌落大饱满,突出,凸起,全缘和无色。肠球菌:采用肠球菌琼脂,该培养基用于肠球菌的快速选择性的分离培养的计数,形成表面圆整、黑色并产生黑色素至培养基中的菌落。肠杆菌:采用肠道菌计数琼脂(VRBDA),该培养基可用于肠道菌计数和肠杆菌科的鉴别,形成菌落呈紫色和棕色。拟杆菌:采用BDS培养基,该培养基用于拟杆菌的分离培养,厌氧培养,形成的菌落表面圆整,全缘和无色。梭杆菌:采用SPS培养基,该培养基可用于梭杆菌的分离培养,厌氧培养,菌落小,表面圆整,全缘和无色。梭菌:采用强化梭菌琼脂,强化梭菌琼脂用于梭菌的培养和计数,厌氧培养,菌落小,表面圆整,全缘和无色。
2.3 统计学处理 所有计量资料均以均值加减标准差表述,采用SPSS 17.0统计软件分析。两组间差异显著性检验采用两独立样本的t检验,多组均数间显著性比较用单因素方差分析(one-way AVONA),以P<0.05表示差异有统计学意义。
3 实验结果
3.1 安全性实验
3.1.1 一般表现及行为学观察 实验过程中,各组动物外观、行为、毛发等一般表现正常,无死亡情况发生。各组大鼠体重正常增长,受试物各剂量组与阴性对照组相比均无显著性差异(P>0.05)。每周摄食量、每周食物利用率、体重总增重、总摄食量及总食物利用率等与阴性对照组比较,均无显著性差异(P>0.05)。
3.1.2 血液学指标 受试物各剂量组与阴性对照组相比,雌性大鼠高剂量组的嗜酸性粒细胞比例略低于对照组;雄性大鼠中剂量组白细胞数量略高于对照组;雄性大鼠低劑量组单核细胞比例略高于对照组;雄性大鼠高剂量组和中剂量组红细胞数量和血红蛋白浓度略高于对照组;这些差异均很小且剂量效应关系不明显,属于正常生理范围内的波动[12-14],无毒理学意义。其余指标的差异均无显著性意义(P>0.05)。结果详见表3。
3.1.3 血液生化指标 受试物各剂量组与阴性对照组相比,雌性大鼠低剂量组的白蛋白含量、中剂量组的肌酐含量、中剂量和低剂量组的白蛋白/球蛋白比值均略高于对照组;雄性大鼠中剂量组甘油三酯、高剂量组的血糖值也略高于对照组。结果详见表4。
3.1.4 脏器重量及脏/体比值 受试物各剂量组与阴性对照组相比,仅雄性大鼠的低剂量组肾脏重量高于对照组,但无剂量效应关系,属于正常范围内的波动[12-14],无毒理学意义。各项指标均无显著性差异(P>0.05)。
3.1.5 大体解剖及组织病理学 检查各组动物,大体解剖心脏、肝脏、脾脏、肺脏、肾脏、胃肠等主要脏器,未见肉眼可见的毒性病理性改变,与阴性对照组比较其外观、颜色和脏器大小正常,均未出现明显渗出、增生、水肿、萎缩等病变。阴性组动物病理学检查结果表明,5只大鼠肝脏出现局灶性、轻微肝细胞脂肪变性,其他大鼠肝结构清晰,各种细胞未见明显病理变化;所有大鼠脾脏被膜及小梁形态完整,红、白髓分界清晰,脾小体形态、体积、数量正常,未见明显病理变化;所有大鼠肾结构正常,肾小球、肾小管及间质均未见明显病理变化;所有大鼠卵巢组织结构正常,卵巢中可见不同发育阶段的卵泡及黄体,未见明显病理变化;所有大鼠睾丸内有大量紧密排列的曲细精管,管内的各级生殖细胞发育正常,管腔内可见精子,未见明显病理变化;7 只大鼠胃黏膜出现轻微的局灶性上皮细胞变性、坏死、脱落,黏膜下层水肿。其他动物胃黏膜表面结构清晰,黏膜下层、肌层及浆膜层未见病理改变,部分可见胃内容物及少量脱落的黏膜上皮,未见明显病理变化;4 只大鼠的肠黏膜上皮细胞变性坏死脱落,肠绒毛断裂脱落。其他动物肠黏膜表面有许多叶状绒毛突起于肠腔,绒毛可见丰富的吸收细胞及少量的杯状细胞。部分肠黏膜上皮细胞脱落,与肠内容物混合,附着于肠黏膜表面,未见炎性细胞浸润,未见其它明显病理变化。
而受试物高剂量组病理学检查结果表明,5只大鼠肝脏出现局灶性、轻微肝细胞脂肪变性。其他大鼠肝结构清晰,各种细胞未见明显病理变化;所有大鼠脾脏被膜及小梁形态完整,红、白髓分界清晰,脾小体形态、体积、数量正常,未见明显病理变化;肾脏组织结构正常,肾小球、肾小管及间质均未见明显病理变化;卵巢组织结构正常,卵巢中可见不同发育阶段的卵泡及黄体,未见明显病理变化;睾丸内有大量紧密排列的曲细精管,管内各级生殖细胞发育正常,管腔内可见精子,未见明显病理变化;7 只大鼠胃黏膜出现轻微的局灶性上皮细胞变性、坏死、脱落,黏膜下层水肿,1只大鼠胃黏膜坏死并伴有出血,其他动物胃黏膜表面结构清晰,黏膜下层、肌层及浆膜层未见病理改变,部分可见胃内容物及少量脱落的黏膜上皮,未见明显病理变化;2 只大鼠的肠黏膜上皮细胞变性坏死脱落,肠绒毛断裂脱落,1只大鼠的肠黏膜坏死并伴有出血,1只大鼠的肠黏膜坏死并伴有淋巴组织增生,其他动物肠黏膜表面有许多叶状绒毛突起于肠腔,绒毛可见丰富的吸收细胞及少量的杯状细胞。部分肠黏膜上皮细胞脱落,与肠内容物混合,附着于肠黏膜表面,未见炎性细胞浸润,未见其它明显病理变化。
3.2 对胃黏膜损伤的保护作用及肠道菌群影响
3.2.1 对胃黏膜损伤的保护
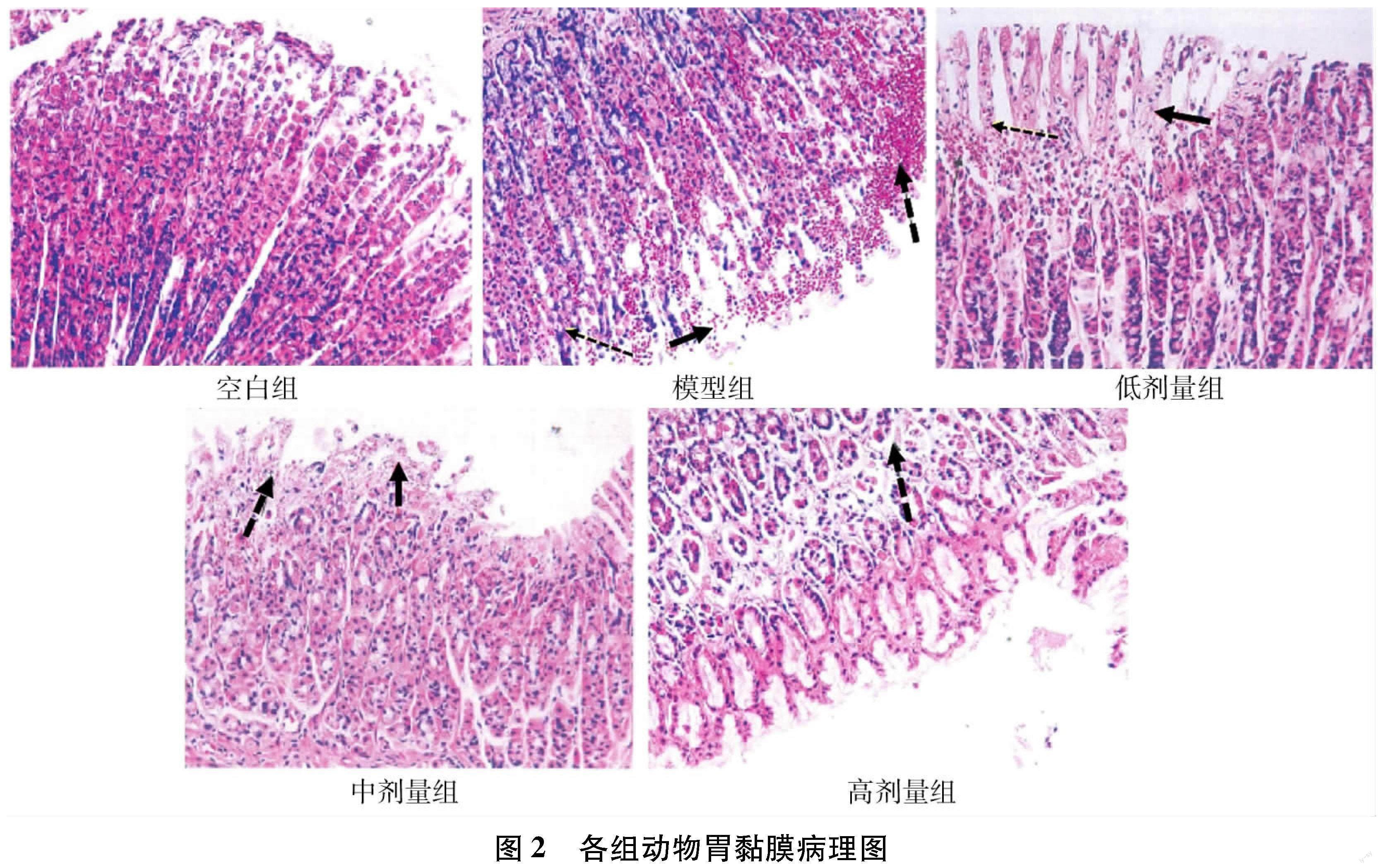
3.2.1.1 急性胃黏膜损伤情况分析 图1结果显示,除空白组外,其余大鼠均出现了黏膜出血,组织坏死(如图1黑色箭头所示)。模型组动物损伤最严重,表现为大块的瘀血,呈鲜红色。高、中、低剂量给药组则表现为点状或条状出血,出血面积明显缩小。根据评分标准计算各组动物损伤评分如表所示,XL可剂量依赖性的保护无水乙醇所致胃黏膜损伤。
3.2.1.2 病理学组织结果 病理学检查结果与肉眼大体观察一致,正常组大鼠胃黏膜组织整体结构基本正常,黏膜上皮无明显坏死,黏膜层无明显出血及炎症,血管无明显充血。模型组大鼠胃黏膜组织整体结构异常,部分胃小凹结构不清,黏膜层可见出血伴大量炎症细胞浸润,如虚线粗箭头所示;黏膜层小血管可见充血,如虚线细箭头所示,部分黏膜上皮糜烂,部分上皮细胞坏死脱落,如实线箭头所示。低剂量动物胃黏膜组织整体结构异常,黏膜层可见出血,如虚线粗箭头所示;部分小血管充盈少量红细胞,如虚线细箭头所示;黏膜层可见部分坏死,如实线箭头所示。中剂量动物胃黏膜组织整体结构轻度异常,黏膜层可见轻度出血及小血管充血,如虚线粗箭头所示;部分黏膜层糜烂,上皮细胞坏死变性,如实线箭头所示。高剂量动物胃黏膜组织整体结构轻度异常,黏膜层可见部分细胞坏死,腺体结构破坏,如虚线粗箭头所示:组织无明显出血,小血管无明显充血。说明XL可剂量依赖性保护胃黏膜损伤(见图2及表5)。
3.2.2 对肠道菌群的调节作用 给药3周以后,XL空白组及各剂量组小鼠体重均增加,各组间不具有统计学差异。各组间除肠杆菌数量无统计学差异外,其他菌种均出现了上升或下降。除与对照组相比,益生菌双歧杆菌(低、中剂量给药组)、乳杆菌(高剂量给药组)及拟杆菌(中、高剂量给药组)数量均上升。而非益生菌如腸球菌(中、高剂量给药组)则出现明显下降,梭杆菌(低、高剂量给药组)及梭菌(低剂量给药组)略有下降(对照组各批次小鼠肠道菌群计数情况详见表6,XL对肠道菌群的调节作用分析结果如图3所示)。上述结果说明本产品对肠道菌群具有良好的调节作用。
4 讨论
XL是在传统中药复方参苓白术散的基础上,融合了猴头菇多糖,复方中含有的所有中药材均属于药食同源类药材。参苓白术散作为由药食同源类药材组成的传统中药复方,在使用上就相比于其它中药或化学药更具有安全性。已有研究[13-15]表明,参苓白术散具有调节胃肠运动、促进机体代谢和提高免疫力,改善由葡聚糖硫酸钠(DSS)诱发的溃疡性结肠炎(UC)炎症反应,改善肠道损伤情况,对哺乳期母鼠肠道菌群紊乱导致的仔鼠肠道稳态失衡以及减轻仔鼠断奶应激也具有调节作用。猴头菇在生活中和临床上常用作于“养胃”食品,研究[16]发现,猴头菇多糖能促进胃黏膜血流量增加,催化多种胃黏膜因子保护作用,起到抗溃疡、保护胃黏膜及治疗应激性胃黏膜损伤的效果。猴头菇多糖还可通过调节超氧化物歧化酶的活性,对慢性胃损伤型大鼠有保护作用[17]。XL与传统中药复方参苓白术散相比,由于其组方中含有的猴头菇多糖,使其具有调节胃肠运动,改善肠道菌群功效的同时,还具有胃黏膜保护作用。本研究以鼠类为研究对象,对XL进行安全性评价。使用不同剂量的XL灌胃给予到大鼠中,30 d后观察其对大鼠的行为学、血液生化、脏器重量及组织病理的影响。结果表明,不同剂量的XL(5 g/kg、2.5 g/kg、1.25 g/kg)对大鼠外观、行为、毛发均无影响,无死亡情况,大鼠体重正常生长;对大鼠血液学及血液生化指标均无毒理学意义;所有大鼠的脏/体比值均无显著性差异;组织病理学结果显示,除了高剂量XL组大鼠出现了部分胃、肝脏和肠道的轻微损伤外,其余大鼠均无明显的组织病理学病变。无水乙醇所致大鼠的急性胃黏膜损伤模型,会出现胃黏膜出血、充血、糜烂、溃疡等病理,常用于研究药物的胃黏膜保护作用,目前普遍认为其发病原因和机制是由多种因素共同作用,其发生与致溃疡因子(胃酸、胃蛋白酶分泌、幽门螺杆菌感染、迷走神经亢进等)和防御因子(黏液分泌、黏膜抵抗等)之间的平衡被打破有关[18]。在动物模型中,胃黏膜损伤指数和组织形态病理学是观察胃黏膜损伤程度的最直观指标[19]。因此,课题组检测了不同剂量XL对无水乙醇所致大鼠胃黏膜损伤的影响,发现XL可以明显减轻无水乙醇所致的胃黏膜损伤,模型组动物胃黏膜表现为大块的瘀血,呈鲜红色;病理学结果显示,模型组大鼠黏膜层出血伴随大量炎症细胞浸润,部分黏膜上皮糜烂,部分上皮细胞脱落坏死。模型组动物黏膜组织整体结构异常。而XL各剂量给药组则明显改善上述现象,黏膜表现为点状或条状出血,出血性损伤明显较少。上述结果表明,XL可剂量依赖性地保护无水乙醇所致的大鼠胃黏膜损伤。
人体胃肠道内分布着大量的菌群,庞大的微生物体系是机体趋于健康态的“桥梁”,它们不但控制着物质的消化吸收和机体免疫,而且具有预防和治疗代谢性疾病等作用[20]。中药中丰富的化学成分往往对肠道菌群具有调节作用,可维持菌群的相对平衡,一些活性成分可以直接被肠道菌群吸收利用,直接起到增加特定肠道菌群丰度的作用[21]。研究[22]表明,参苓白术散在治疗危重病患者肠道菌群失调效果显著,可改善患者肠黏膜通透性,降低肠道菌群失调严重程度,改善患者肠道菌群失调伴随症状与体征。因此在以上相关研究基础上,本研究旨在探索XL对肠道菌群的调节作用,挖掘肠道菌群与胃黏膜保护作用的关系,进一步探究XL是否具有胃黏膜保护和调节肠道菌群的双重作用。本实验结果表明,XL长期给药可以明显增加小鼠肠道益生菌双歧杆菌、乳杆菌及拟杆菌的数量,略降低非益生菌肠球菌、梭杆菌及梭菌的数量。肠道菌群作为保护肠道健康的重要部分,肠道菌群紊乱与疾病的发生密切相关,研究[23]表明,肠道菌群的紊乱与胃黏膜损伤的发生也密切相关。XL能够通过上调小鼠肠道内益生菌的数量,略降低非益生菌的数量来达到调节肠道菌群的目的,这可能是其发挥保护胃黏膜损伤的机制之一。结合上述XL可保护无水乙醇所致大鼠胃黏膜损伤,我们有理由相信,XL作为一种药食同源的保健食品,在保护胃肠道方面具有相当大的潜力。本研究虽证明XL在治疗无水乙醇所致的胃黏膜损伤以及调节肠道菌群方面有显著疗效,但未从其具体物质基础开展具体研究,XL治疗胃黏膜损伤和调节肠道菌群的具体机理研究有待进一步开展。
综上所述,XL临床剂量范围内无明显毒副作用,具有明显的胃黏膜保护和调节肠道菌群双重作用,且由于其药食同源的属性,本方在“药食同补”理论方面具有积极的贡献意义。
6 结论
通过上述研究,XL在实验过程中未出现明显的毒副作用,同时其可以保护胃黏膜损伤,优化调整肠道菌群,对胃肠道功能具有正向调节作用。但其多成分、多途径、多靶点共同调控的机制有待进一步挖掘。
参考文献
[1]SHI H, WANG H Y. Protective effects of bilobalide against ethanol-induced gastric ulcer in vivo/vitro[J].Biomedicine & Pharmacotherapy,2017,85(1):592-600.
[2] 陈崇莲,戴伟锋,秦谊,等. 黄腐酸对酒精所致胃溃疡小鼠胃蛋白活力的影响[J]. 腐植酸,2022(5):23-28,55.
[3] RIEZZO G, CHILOIRO M, MONTANARO S. Protective effect of amtolmetin guacyl versus placebo diclofenac and misoprostol in healthy volunteers evaluated as gastric electrical activity in alcohol-induced stomach damag[J]e. Dig Dis Sci, 2001 , 46(8): 1797-804.
[4] 何绍珍,任建林.乙醇对胃黏膜作用机制的研究进展[J].世界华人消化杂志,2005(21):2591-2596.
[5] LIU J, LIN H, YUAN L, et al. Protective Effects of Anwulignan against HCl/Ethanol-Induced Acute Gastric Ulcer in Mice[J]. Evid Based Complement Alternat Med, 2021 (14): 9998982-9998995.
[6] SIDDIG I A. Protective mechanism of gallic acid and its novel derivative against ethanol-induced gastric ulcerogenesis: Involvement of immunomodulation markers, Hsp70 and Bcl-2-associated X protein [J]. International Immunopharmacology, 2013, 16(2): 296-305.
[7] 韩兴鹏,张强,李洋洋,等.猴头菇药理活性及生物活性物质的研究进展[J].食用菌,2018,40(1):1-5,8.
[8]杨永刚,王丹丹,张艳秋,等.基于线粒体膜电位改变的猴头菇子实体多糖抗溃疡性结肠炎作用机制探讨[J].时珍国医国药,2020,31(1):27-29.
[9]周辉,刘畅,刘杨霖,等.猴头菌多糖对Lewis肺癌荷瘤小鼠抑瘤作用及其机制研究[J].湖南中医药大学学报,2017,37(12):1320-1322.
[10]吕晓,黄先菊,王大贵,等.健胃散对胃黏膜损伤的保护作用及对胃肠道蠕动的推进作用[J].中国现代医药,2019,21(4):454-463.
[11]蒙湘,彭小欢,许馨怡,等.土家药千足虫草抗胃溃疡作用的实验研究[J].中国民族民间医药,2022,31(3):11-16.
[12]魏伟.药理实验方法学[M].北京:人民卫生出版社,2010:1084-1091.
[13]林爱弟.参苓白术散联合赖氨肌醇维B(12)口服溶液与小儿消食颗粒治疗儿童厌食症临床研究[J].新中医,2020,52(9):36-39.
[14]刘玉晖,容子玲,朱洪杨,等.基于NLRP3炎症小体探讨参苓白术散治疗溃疡性结肠炎的作用机制[J].中国中药杂志,2022,47(21):5863-5871.
[15]张文嫦,王志华,练家乐,等.仔鼠哺乳期补充参苓白术散改善抗生素诱导的肠道稳态失衡[J].畜牧兽医学报,2023,54(2):825-836.
[16]邵梦茹.猴头菇多糖对胃肠黏膜保护作用的实验研究[D].广州:广州中医药大学,2014.
[17]倪梦梅,潘香香,陈锦瑶,等.猴头菌丝体对大鼠慢性胃损伤的保护作用及机制研究[J].现代预防医学,2018,45(23):4352-4355,4360.
[18]贺佳佳,易睿,赵迪,等.氢溴酸槟榔碱抗胃黏膜损伤的作用及机制[J].吉林医学,2022,43(2):293-296.
[19]BAGHDANIAN H A,BAGHDANIAN A A,PUPPALAS,et al.Imaging Manifestations of Peptic Ulcer Disease on Computed Tomography [J].Seminars in Ultrasound,CT,and MRI,2018,39(2):183-192.
[20]TODA T,SAITO N,IKARASHIN,et al.Intestinal flora induces the expression of Cyp3a in the mouse liver [J].Xenobiotica,2009,39(4):323-334.
[21]於李龍,陈文华,秦路平,等.中药与肠道菌群相互作用的研究进展[J].浙江中西医结合杂志,2022,32(9):881-884.
[22]陈苑红,林良普,陈愉快.参苓白术散治疗危重病肠道菌群失调的效果[J].临床合理用药杂志,2022,15(13):25-28.
[23]王旒靖,薛婷,吴颖琦,等.针刺对应激性胃溃疡模型大鼠肠道菌群的影响[J].中国针灸,2020,40(5):526-532.

