咖啡叶锈病菌单管巢式PCR 检测体系的建立与应用
吴伟怀,刘宝慧,汪全伟,鹿鹏鹏,贺春萍,梁艳琼,黄兴,易克贤,4※
(1.中国热带农业科学院环境与植物保护研究所/农业农村部热带作物有害生物综合治理重点实验室,海南 海口 571101;2.南京农业大学植物保护学院,江苏 南京 210095;3.中国热带农业科学院科技信息研究所,海南 海口 571101;4.中国热带农业科学院三亚研究院,海南 三亚 572000)
由咖啡驼孢锈菌(Hemileia vastatrix)引起的咖啡叶锈病是小粒种咖啡生产中一种毁灭性病害[1-3]。该病害病原的鉴定主要依赖常规的形态学并结合传统的鉴别寄主法。该方法需经过病原菌的分离或者直接获得病原菌的孢子,经过形态鉴定,再由科赫氏法则验证,此流程大约需要1 个月时间,同时还要求具备专业的分类学知识以及丰富的经验。除此之外,还需要有一个比较干净的接种环境,否则咖啡叶锈病菌夏孢子很容易被重寄生菌侵染,干扰试验结果[4-6],准确性和可信度易受外界因素的影响,难以满足快速、高通量鉴定与检测的实际需求。由此可见,建立一种高效、准确的分子检测技术对于该病害的快速鉴定与监测具有重要意义。
白学慧等[7]采用国际通用的19 个咖啡锈菌小种鉴别寄主,利用人工接种鉴定的方法,对2011~2015 年采自云南咖啡主产区的51 份咖啡锈菌进行了致病性测定,基于其致病表型从而鉴定出9 个生理小种。汪涵等[8]利用咖啡驼孢锈菌DNA 核糖体转录间隔区ITS1~ITS4 特异性区域设计的1 对特异性引物Hv-ITS-F/R,仅能从咖啡驼孢锈菌基因组DNA 中扩增出396 bp 的特异条带,而其他相似或相近的病原真菌则无扩增条带。该检测技术检测浓度可达10 pg/μL,但是普通PCR 检测仍不够灵敏。随着分子生物技术的快速发展,许多分子检测技术由于具有快速、高灵敏度而被广泛应用于植物病原菌的诊断与鉴定中,比较常见的是巢式PCR 检测技术[9,10]。但是,由于巢式PCR 需要进行2 轮独立的PCR 扩增反应,第二轮PCR 扩增反应是以第1 轮PCR 扩增产物为模板,在这过程中需要开管进行模板转移,从而增加了污染的概率[11],而单管巢式PCR 是在巢式PCR 技术发展而来,这就使得单管巢式PCR 检测技术不仅具有巢式PCR 检测技术的特异性和灵敏性,还能节省时间、节约成本,同时又具有可降低潜在污染风险等优点,具有较好的发展前景[12-14]。目前关于咖啡叶锈病菌单管巢式PCR的检测体系尚未建立。针对传统咖啡锈菌鉴定与监测方法费时费力,以及检测技术灵敏度不够高等问题,本研究拟建立咖啡叶锈病菌单管巢式PCR 检测体系,为咖啡叶锈病的早期诊断与病害监测提供快速、可靠的技术支撑。
1 材料与方法
1.1 供试材料
本试验所用的供试样品DNA 包括咖啡驼孢锈菌(H.vastatix)、甘蔗黄锈病菌(Puccinia kuehnii)、甘蔗褐锈病菌(P.melanocephala)、鸡蛋花鞘锈菌(Coleosporium plumierae)、葡萄层锈菌(Phakopsora ampelopsidis)、咖啡炭疽病菌(Colletotrichum gloeosporioides)、咖啡褐斑病菌(Cerospora coffeicola)、咖啡腐皮镰孢黑果病菌(Fusarium solani)、咖啡露湿拟漆斑菌(Paramyrothecium breviseta)以及咖啡拟多盘毛孢叶斑病菌(Pestalotiopsis trachicarpicola),表1。其中2份咖啡驼孢锈菌经提取核酸后检测与克隆测序确认为咖啡驼孢锈菌后,作为本研究的阳性样品,其余甘蔗黄锈病菌、咖啡炭疽病菌、咖啡褐斑病菌、鸡蛋花鞘锈菌、葡萄层锈菌、咖啡腐皮镰孢黑果病菌、咖啡露湿拟漆斑菌和咖啡拟多盘毛孢叶斑病菌样品均经提取核酸与克隆测序确定含有相应病菌后,作为特异性分析模板。所有菌株DNA 样品均保存于中国热带农业科学院环境与植物保护研究所。

表1 供试菌株Table 1 Strains used in this study
1.2 咖啡叶锈病菌病叶DNA提取
采用CTAB法(HexadecyltrimethylAmmoniumBromide,十六烷基三甲基溴化铵法)[15],对咖啡叶锈病叶进行DNA 提取,DNA 样品置于 20℃冰箱保存备用。
1.3 引物设计与合成
将咖啡叶锈病菌ITS 序列与NCBI 公共数据库中同源性较高的序列进行多重比较,获取咖啡叶锈病菌ITS 序列的特异性区段。通过primer explorer 5.0 在线软件对多态性丰富区域设计引物,参考引物设计原理,并结合单管巢式PCR 引物设计原理:一般外引物退火温度高于内引物10 ℃左右,引物由英潍捷基(上海)贸易有限公司广州合成部合成。
1.4 外引物与内引物最佳退火温度
为了进一步确认咖啡叶锈病菌的单管巢式PCR最佳的退火温度,对所设内引物进行52~63 ℃梯度退火温度扩增,筛选出最佳退火温度;在内引物最佳退火温度的基础上,对外引物设置梯度退火温度60~72 ℃,从中筛选出高于内引物最佳退火温度大约10 ℃的外引物最佳退火温度。
扩增均采用20μL反应体系:dd H2O 14.3μL,10 rTaq Buffer 2μL,2.5 mmol/L dNTPs 1.6μL,rTaq DNA Polymerase(5 U/μL)0.1μL,10μL,30 ng/μL 模板DNA 1μL。
内引物的反应程序为:94 ℃预变性3 min,94 ℃变性30 s,梯度退火温度(52~63 ℃)退火10 s,72 ℃延伸25 s,35 个循环,72 ℃延伸4 min,12 ℃保存。外引物的反应程序为:94 ℃预变性3 min,94 ℃变性30 s,梯度退火温度(60~72 ℃)退火10 s,72 ℃延伸25 s,35个循环,72 ℃延伸4 min,12 ℃保存。
1.5 单管巢式PCR反应体系优化
为了获得较为理想的单管巢式PCR 反应体系,在确定外内引物退火温度的基础上,利用SPSS 26.0对外、内引物浓度,dNTPs 浓度,rTaq 酶量等体系关键因素进行正交实验设计,各设定4 个水平,见表2。选用正交表L1(644)设计试验,见表3。单管巢式PCR 反应体系的各试验总体积为20μL,每个试验均加入2.5μL 10 rTaq Buffer 和咖啡叶锈病菌DNA 1μL,其他成分按照正交设计的浓度用量加入,ddH2O补足至20μL。
表2 咖啡叶锈病菌单管巢式PCR 反应体系正交试验的各因素及水平Table 2 Factors and levels of single-tube nested-PCR reaction system for causing coffee leaf rust
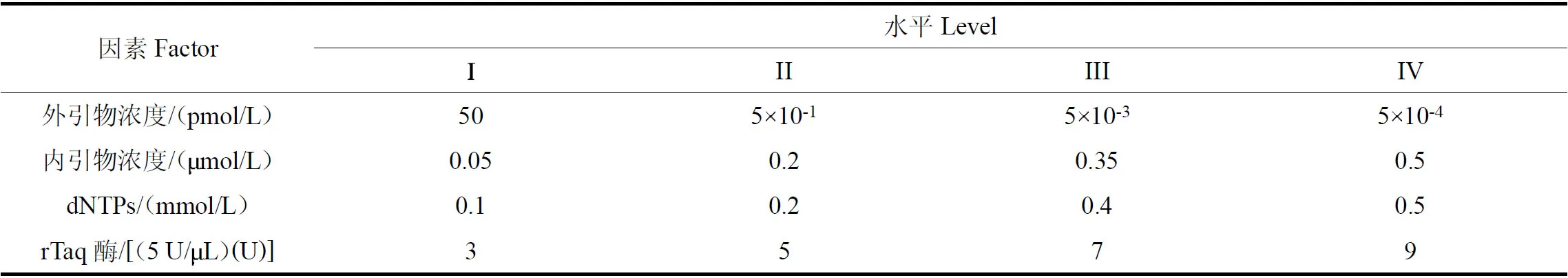
表2 咖啡叶锈病菌单管巢式PCR 反应体系正交试验的各因素及水平Table 2 Factors and levels of single-tube nested-PCR reaction system for causing coffee leaf rust
表3 咖啡驼孢锈菌的单管巢式PCR 不同因素和水平L1(644)正交试验设计Table 3 L16(44)orthogonal test design on different factors and levels of single tube nested PCR for causing coffee leaf rust
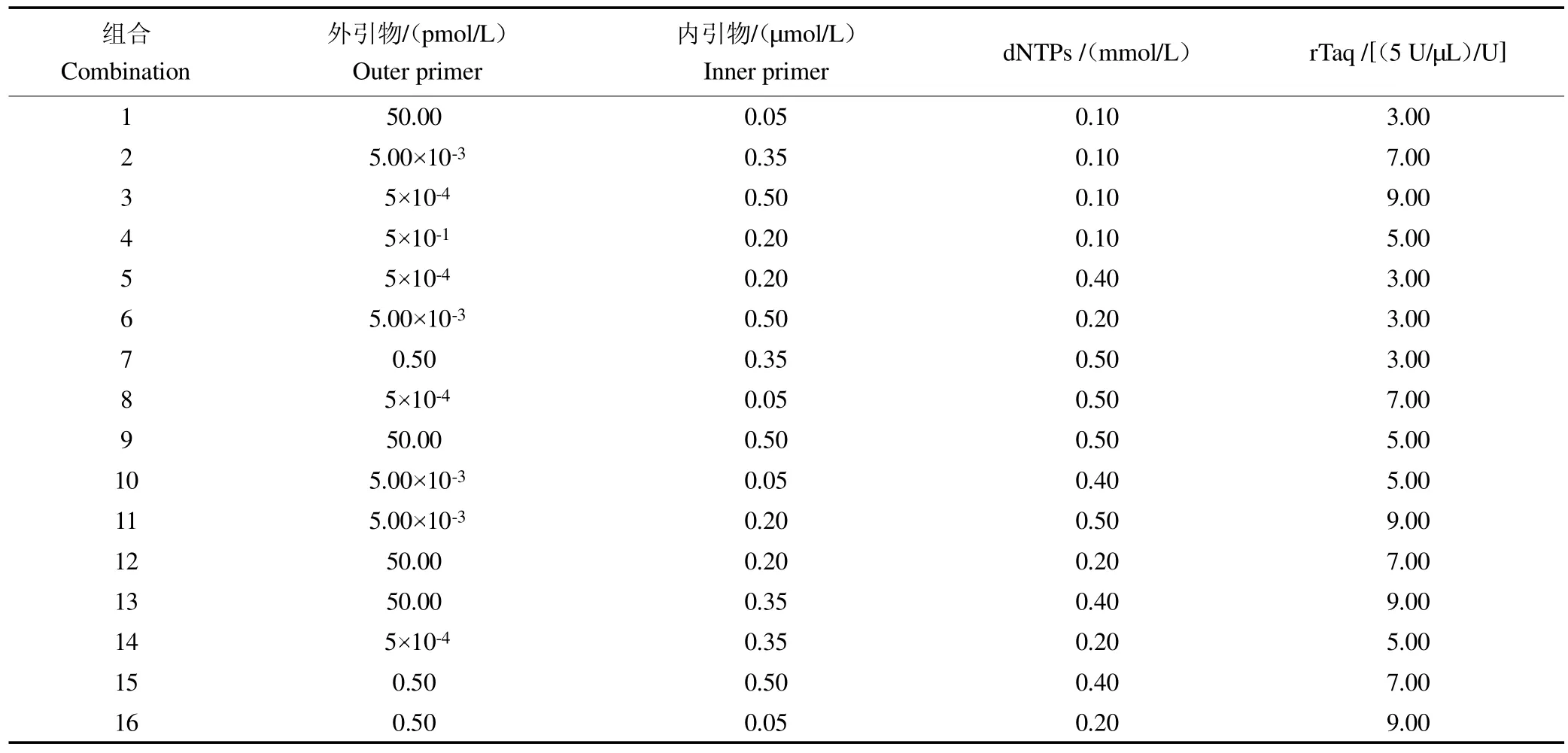
表3 咖啡驼孢锈菌的单管巢式PCR 不同因素和水平L1(644)正交试验设计Table 3 L16(44)orthogonal test design on different factors and levels of single tube nested PCR for causing coffee leaf rust
1.6 单管巢式PCR检测体系特异性分析与酶切验证
以咖啡驼孢锈菌、甘蔗黄锈病菌、甘蔗褐锈病菌、鸡蛋花鞘锈菌、葡萄层锈菌、咖啡炭疽病菌、咖啡褐斑病菌、咖啡腐皮镰孢菌、咖啡露湿拟漆斑菌和咖啡拟多盘毛孢菌等共计16 份菌株DNA 为模板(表1),并以ddH2O 为阴性对照。利用1.5 筛选出的咖啡叶锈病菌单管巢式PCR 检测体系进行特异性分析。采用Apol I 单酶切位点对PCR 产物进行酶切验证。酶切体系(20μL):10 Quick CutBuffer 2μL、PCR 产物8μL、Apol I 1.5μL、dd H2O 8.5μL。酶切程序:65 ℃4 h,85 ℃30 min。酶切产物用2%琼脂糖凝胶电泳检测。
1.7 灵敏度分析
用超微量分光光度计(NanoDrop 2000c)将咖啡驼孢锈菌DNA 初始浓度调整为10 ng/μL,采用浓度梯度稀释法将DNA 进行100~10-6倍的稀释,以100 为阳性对照,dd H2O 为阴性对照,进行单管巢式PCR 检测。扩增产物使用1.2%的琼脂糖凝胶电泳,凝胶成像仪拍照保存。以HvF2/HvR2 进行普通PCR灵敏度检测。
1.8 疑似病样准备
疑似咖啡叶锈病病叶样品采集自云南咖啡园,采用1.2 方法提取DNA,利用咖啡叶锈病菌的单管巢式PCR 进行检测鉴定。
2 结果与分析
2.1 咖啡叶锈病菌单管巢式PCR引物设计
将咖啡叶锈病菌ITS 序列与下载自NCBI 数据库中包括锈菌目同源序列于MultAlin 网站上(http://multalin.toulouse.inra.fr/multalin.html)进行多重比对。结果表明,咖啡叶锈病菌ITS 序列与其他序列相比,除存有单碱基差异导致的多态性区域外,还存在明显的仅存在于咖啡叶锈病菌中的特异性区域。结合上述2 类多态性区域设计了外引物对HvF1/HvR1 与内引物对HvF2/HvR2(表4),二者预期扩增片段大小分别为562 bp 和371 bp。
表4 咖啡叶锈病菌单管巢式PCR 引物Table 4 Single-tube nested PCR primers for
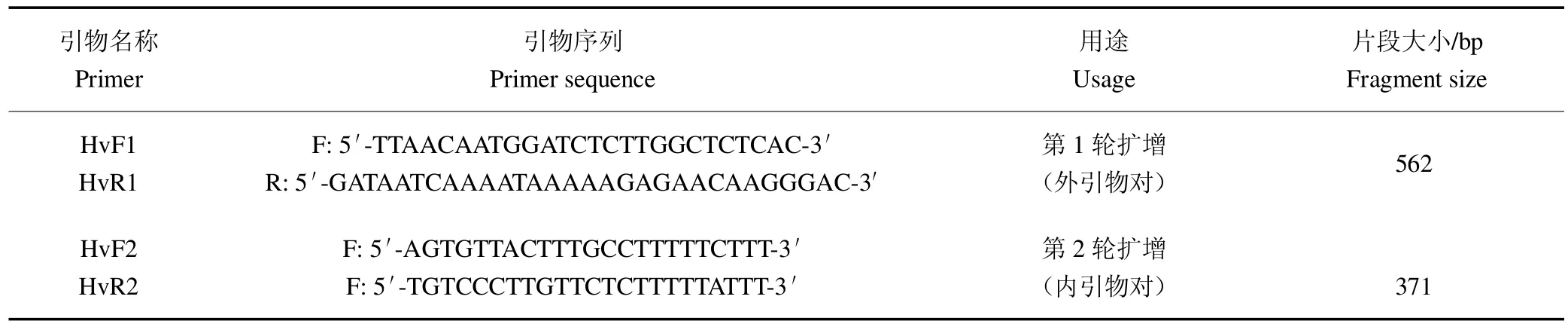
表4 咖啡叶锈病菌单管巢式PCR 引物Table 4 Single-tube nested PCR primers for
2.2 内外引物退火温度筛选
对内引物HvF2/HvR2 进行梯度退火温度PCR扩增,结果表明,在供试的8 个梯度退火温度中,内引物HvF2/HvR2 在退火温度为52.0~60.8 ℃时,均能扩增出目的条带,内引物在退火温度为52.0 ℃、52.8 ℃、56.2 ℃时,扩增出的条带较清晰,在退火温度为54.1℃、58.7 ℃条带稍弱;而在退火温度为60.8 ℃时,仅扩增出一条微弱的条带,而退火温度高于此温度时不能扩增出任何条带,表明内引物的最大退火温度为60.8 ℃,见图1。据此,选取52 ℃为内引物的退火温度,开展后续试验。
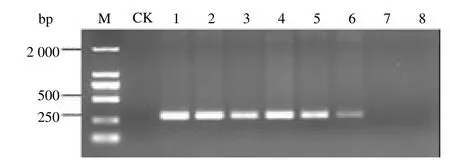
图1 咖啡叶锈病菌单管巢式PCR 内引物HvF2/HvR2 退火温度优化Fig.1 Optimization of the annealing temperature for internal single-tube nested primers HvF2/HvR2 of
对外引物HvF1/R1 进行梯度退火温度PCR 扩增,结果表明,在设定的6 个外引物退火温度中,只有退火温度为60.0~64.5 ℃时能扩增出清晰的条带,而其余的4 个退火温度均未扩增出任何条带,见图2。根据图1 结果可知,内引物在退火温度为60.8 ℃及其以上时,并不能有效扩增。也即只有外引物退火温度为60.8 ℃及其以上时,单管巢式PCR 中外引物即可有效扩增,内引物由于退火温度过高而不能有效扩增。从图2 可看出,当退火温度为62.4 ℃与64.5 ℃时,均可扩增出清晰特异性条带,由此表明外引物的退火温度范围为62.4~64.5 ℃。为了后续试验操作方便,本研究选63 ℃作为HvF1/R1 的退火温度。

图2 咖啡叶锈病菌单管巢式PCR 外引物HvF1/R1 退火温度优化Fig.2 Optimization of the annealing temperature of single tube nested PCR outer primers HvF1/R1 for
2.3 单管巢式PCR检测体系的优化
根据正交实验设计的16 种试验组合进行巢式PCR 扩增。试验结果表明,在16 种组合中,其中组合5、7、9、11、13 均扩增出预期的单一条带,但组合13 扩增条带最强;组合15 虽然扩增条带比组合13 的更强,但是该组合外引物也有少量扩增,见图3。由此筛选出组合13 为最优组合。也即当外引物浓度为50 pM,内引物浓度为0.35μL)量为9 U时,扩增条带既单一又清晰。综上所述,由此而建立的咖啡叶锈病菌单管巢式PCR最佳反应体系(20μL)为:10 rTaq Buffer 2.5μL,2.5 mmol/L dNTPs 3.2μL,rTaq DNA Polymerase(5U/μL)1.8μL,7μL,1 nmol/L的HvF1/HvR1 引物各1μL,模板DNA1μL,ddH2O7.5μL。

图3 单管巢式PCR 正交试验16 种组合扩增效果比较Fig.3 Comparison of amplification effects of 16 combinations in single tube nested PCR orthogonal test
2.4 单管巢式PCR检测体系特异性分析
特异性试验结果表明,只有DNA 来自咖啡叶锈病菌时,电泳可见清晰且特异条带,而其它非咖啡叶锈病菌DNA,均未扩增出任何条带(图4)。同时,以咖啡叶锈病菌模板DNA 为阳性对照,ddH2O 为阴性对照,对扩增出的咖啡叶锈病菌PCR 产物进行ApoLI 单酶切验证,酶切产物电泳可见预期大小(136 bp)的目的条带(图5)。由此表明,所建立的咖啡叶锈病菌单管巢式PCR 检测体系具有较好的特异性。

图4 咖啡叶锈病菌单管巢式PCR 检测体系特异性分析Fig.4 Specificity analysis of single-tube nested PCR for detection of

Fig.5 Digestionofsingle-tube nestedPCRproduct of 图5 咖啡叶锈病菌单管巢式PCR产物酶切
2.5 灵敏度分析
单管巢式PCR 灵敏度结果显示,当DNA 模板浓度为10 ng/μL、1 ng/μL、100 pg/μL 时,扩增条带清晰可见;而当模板浓度为10 pg/μL、1 pg/μL、100 fg/μL 其扩增条带逐渐变弱;当模板浓度为100 fg/μL 时,仅检测出一条微弱的条带;而当模板浓度大于此浓度时,检测不出任何目的条带。由此表明,所建立的咖啡叶锈病菌单管巢式PCR 检测体系的最低检测模板浓度为100 fg/μL,最低检测终浓度为5 fg/μL(图6 A)。比较而言,普通PCR 灵敏度结果显示,当DNA 浓度为10 ng/μL、1 ng/μL 时,可见清晰的条带,当DNA 浓度为100 pg/μL、10 pg/μL 时,条带渐弱,当DNA 浓度大于10 pg/μL时,扩增不出任何条带。因此,普通PCR 的最低检测浓度为10pg/μL,最低检测终浓度为0.5 pg/μL(图6B)。所以,本试验所开发的咖啡叶锈病菌单管巢式PCR反应体系的最低检测终浓度(5 fg/μL)是普通PCR 最低检测终浓度(0.5 pg/μL)的100 倍,具有较高的灵敏性。

图6 咖啡叶锈病菌单管巢式PCR 灵敏度检测Fig.6 Sensitivity of single-tube nested PCR for
2.6 疑似病样检测鉴定
对咖啡园采取的22 份疑似咖啡叶锈菌叶片DNA进行单管巢式PCR 检测。结果显示,采集的22 份样品DNA,经检测均出现预期大小(371 bp)条带,见表5。由此表明,采集的22份样本中均含有咖啡驼孢锈菌。

表5 疑似咖啡叶锈病病样检测鉴定Table 5 Identification of suspected coffee leaf rust by single tube nested PCR
3 讨论
以PCR 为基础的病原菌分子检测技术得以广泛应用的前提条件就是高质量的引物,常常利用特异性的引物实现对靶标病原菌的扩增,而非靶标病原菌扩增不出条带,或者非靶标病原菌虽可扩增出条带,但是其大小明显与靶标病原菌的不同,从而到达二者区分的目的。基于巢式PCR 衍生而来的单管巢式PCR 技术同样如此。为此,在本研究中利用所获得的咖啡叶锈病菌ITS 序列与NCBI 数据库搜索比对,发现咖啡叶锈病菌ITS2 区域与其它非咖啡叶锈病菌存在特异区域。基于该特异性区域,结合单管巢式PCR 引物设计原则中外引物对与内引物对退火温度的要求,最终设计了巢式PCR 嵌套式引物对HvF1/R1 与HvF2/R2,二者退火温度预期相差15 ℃。经NCBI database 搜索比对表明,引物对均具有较高的特异性。进一步通过对所设计的外引物对与内引物对的最佳退火温度进行了筛选与验证。最终筛选出咖啡叶锈病菌单管巢式PCR分子检测技术外、内引物的退火温度分别为63 ℃、52 ℃,二者相差达11 ℃。这已满足了单管巢式PCR检测技术基本要求之一,即外引物的退火温度必须高于内引物的退火温度10 ℃以上[16]。
为了获得本研究中内外引物组的最优引物量之比,为此利用SPSS 软件对外HvF1/HvR1、内引物浓度HvF2/HvR2,dNTPs 浓度,rTaq 酶量等体系关键因素进行正交实验设计。根据正交实验设计的16 种试验组合进行巢式PCR 扩增。结果表明,在16 种组成中,只有组合13 扩增条带单一且清晰。也即当外引物浓度为50 pM,内引物浓度为0.35μL)酶量为9 U 时,反应条带最特异、清晰(图4)。这一引物浓度之比,与已报道的母羊胎儿组织勾形虫(Toxoplasma gondii)外内引物终浓度比例(0.01μM:0.4μM)[17]、谷物样品镰刀病菌(F.culmorum)外内引物终浓度比(0.1 fM:1 pM)[18]、菠萝凋萎病菌(Pineapple mealybug wilt)外内引物浓度比(2 pM:0.2 nM)[16]、猫屎胎三毛滴虫(Tritrichomonas foetus)外内引物浓度比(12.5 fM:0.25 pM)[19]存在一定的差异,可能是由于内外引物的不同所导致的。
所建立的检测体系只能从咖啡叶锈病菌中检测出目的条带,其它所有非咖啡叶锈病菌的模板DNA 没有产生任何条带,这与汪涵等[8]研究结果一致。灵敏度方面可达5 fg/μL,这一结果与检测结核性脑膜炎(Tuberculous meningitis)[20]、与霍乱弧菌(Vibrio cholerae)的灵敏度[21]要稍微弱点,二者的灵敏度均为1 fg/μL;但又明显比检测菠萝凋萎病菌(Pineapple mealybug wilt)的灵敏度(0.95 pg/μL)[16]、以及浓毒症(Pythiosis)的灵敏度(2.7 pg/μL)[22]要灵敏。最后利用该检测技术对22 份田间疑似病样进行了检测,最终从所有样品中均检测出预期大小的条带。总之,鉴于本研究中所建立的咖啡叶锈病菌单管巢式PCR 检测体系较好的特异性、灵敏性以及实用性,故本检测技术可用于咖啡叶锈病菌的快速鉴定,亦可为咖啡锈病监测预警提供技术支持。

