小麦链格孢病原菌鉴定及产毒分析
张瑶瑶,卢苏南,李彦伸,尤艳莉
(烟台大学生命科学学院,山东 烟台 264005)
链格孢霉菌是自然界常见的植物病原菌,能够侵染谷物、蔬菜和水果,造成重大经济损失[1-2]。链格孢霉菌是主要的产毒素真菌属之一,已报道的链格孢霉菌产生的次级代谢产物超过70种[3],被称为链格孢毒素。根据化学结构及毒性不同,常见的链格孢毒素主要分为四大类[4]:最大的一类是二苯吡喃酮化合物,代表性毒素有交链孢酚(alternariol, AOH)、交链孢酚单甲醚(alternariol monomethyl ether, AME)、交链孢烯(altenuene, ALT);第二类是戊醌类化合物,代表毒素有ATX-Ⅰ (altertoxin-Ⅰ)、ATX-Ⅱ (altertoxin-Ⅱ)、ATX-Ⅲ(altertoxin-Ⅲ)等;第三类是四氨基酸衍生物如细交链格孢酮酸(tenuazonic acid, TeA)等;此外还有杂混结构如腾毒素(tentoxin,TEN)、酚类如细格菌素(altenusin, ALU)、环状肽等[5-6]。链格孢毒素对人和牲畜具有急性毒性、细胞毒性、免疫毒性、胚胎毒性甚至是致畸、致癌和致突变性等危害[6-9]。另外,TEN具有植物毒性,导致植物萎黄病[10],被研究为除草剂。
2016—2022年对各类食品中的交链孢毒素进行监测,发现在小麦及其制品中AOH、AME、TEN和TeA污染最为严重,检出率均超过90%[11-13]。国内外文献中陆续报道了应用液相色谱-串联质谱法检测谷物等农产品中多种霉菌毒素的方法[14-15]。霉菌毒素因受到植物、动物和真菌代谢的影响,其结构在新陈代谢或食物加工过程中会发生改变,与极性物质如氨基酸、硫酸盐或糖苷等结合发生修饰形成隐蔽型毒素[16]。这些修饰过的毒素摄入后会在消化道释放游离毒素,给健康带来潜在的危险[17];而这些结构修饰的霉菌毒素在常规提取条件下能够保持稳定,无法通过常规分析技术检测到。由于缺乏可靠的商业化标准品和相关研究数据,难以对这些真菌毒素进行有效全面的检测。因此,监测这些潜在有害代谢物的存在是确保食品安全的主要任务之一。
液相色谱质谱联用技术是近年来真菌毒素分析领域发展最快的分析方法之一,具有特异性强、灵敏度高等优点[18],但是液相色谱-串联质谱法在定性定量准确度方面仍存在不足,而且限制于靶向分析,无法对复杂基质中多种未知风险物质进行筛查[19]。近年来,高分辨质谱的发展解决了这一问题。高分辨质谱相对于一般串联谱,分辨率和分子质量精度均更高[20]。Q-Exactive四极杆/静电场轨道阱高分辨质谱基于目标化合物母离子精准质荷比直接对目标化合物定性定量,具有很强的抗基质干扰能力,适用于未知化合物快速筛查[21]。
本研究从东营市小麦种植区病变小麦中分离纯化并鉴定出12株链格孢霉菌,基于前期研究[22]开发的超高效液相色谱串联高分辨质谱(UPLC-HRMS)结合数据分析软件技术,对链格孢霉毒素和隐蔽性毒素进行可视化分析;并且模拟室温下链格孢侵染小麦种子,对小麦萌发过程产生的链格孢毒素进行定性和定量分析。本研究可为谷类小麦链格孢毒素的发生规律提供理论依据,为我国的食品安全风险评估提供基础数据。
1 材料与方法
1.1 材料与试剂
小麦种子购自山东省烟台市,要求颗粒饱满,无机械损伤和病害;马铃薯购自山东省烟台市烟大市场。于小麦抽穗期收集山东省东营市小麦种植区病变小麦样品。
交链孢毒素标准品:ALT、ALU、AME、AOH、ATX-Ⅰ、TeA和TEN购于青岛普瑞邦(Pribolab)生物工程有限公司。
马铃薯葡萄糖琼脂培养基(PDA) 购自北京陆桥科技有限公司;植物基因组DNA试剂盒(DP305)购自TIANGEN;蔗糖(分析纯)购自西陇化工股份有限公司;琼脂购自上海吉至生化科技有限公司;氯化钠(分析纯)、乙腈(分析纯)、乙酸乙酯(分析纯)、甲醇(色谱纯)购自国药集团化学试剂有限公司。
马铃薯蔗糖琼脂培养基(PSA)由实验室制备:量取500 mL马铃薯提取液,称取20 g蔗糖,17 g琼脂,于500 mL蒸馏水中,121 ℃高压灭菌20 min,倒入9 cm 一次性培养皿中,待培养基冷却凝固后装袋密封,室温保存备用。马铃薯提取液:把400 g去皮马铃薯切成小块,用纱布包好,在1 L水中煮沸10 min,过滤到锥形瓶内,121 ℃高压灭菌20 min,将马铃薯提取液保存在冰箱中备用。
1.2 仪器与设备
SHH-250L生化培养箱(重庆市永生实验仪器厂);3k15高速台式冷冻离心机(德国SIGMA公司);QL-901型涡旋混合器(海门市其林贝尔仪器制造有限公司);血球计数板(上海市求精生化试剂仪器有限公司);电子显微镜(麦克奥迪实业集团有限公司);JA-1003N分析天平(上海精密科学仪器有限公司);超高效液相色谱系统(UltimataTM 1290)(赛默飞世尔科技(中国)有限公司);四级杆/静电场轨道离子阱高分辨质谱仪(Q-Exactive Plus)(赛默飞世尔科技(中国)有限公司)。
1.3 实验方法
1.3.1 病原菌分离与纯化 采用组织培养法,对小麦中的病原菌进行分离纯化。小麦籽粒用无菌水冲洗,去除表面杂质。用75%的乙醇清洗处理30 s,后经5%次氯酸钠清洗消毒2~3 min,无菌水清洗3次,无菌滤纸片擦干水分,将适量籽粒接种于含氯霉素的PDA培养基。25 ℃恒温培养箱中培养3~4 d,培养期间注意观察菌落生长情况。根据菌丝的生成位置、颜色,挑取不同性状的单个菌落孢子接种于新的PDA培养基中,直至得到纯种菌株。将纯化后的菌株保存在25%的甘油中,放置在-80 ℃保种。
1.3.2 病原菌鉴定 对分离纯化得到的病原菌,在PDA培养基培养10 d左右,使用植物基因组DNA试剂盒提取菌株DNA,进行PCR扩增,采用真菌ITS通用引物基因进行序列扩增,上游引物ITS1和下游引物IITS4序列分别为:ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4 (5'-TCCTCCGCTTATTGATATGC-3'),目标片段600 bp。将扩增产物送至烟台硕博源生物科技有限公司测定碱基序列,将获得的序列在NCBI网站提交至GenBank数据库,采用BLAST程序[23]对比获得同源序列,最后借助MEGA X[24]软件建立系统进化树。
1.3.3 标准溶液配置 用千分之一分析天平分别准确称取1.00 mg ALT、ALU、AME、AOH、ATX-Ⅰ、TeA和TEN链格孢毒素标准品至2 mL 棕色小瓶,分别加入1 mL 乙腈,配制1 mg/mL 链格孢毒素标准储备液用甲醇将标准储备液稀释配制成100 μg/mL 链格孢毒素单标溶液,存于-20 ℃。
1.3.4 链格孢霉产毒分析 将12株链格孢霉菌编号如下:BM2-1,BM3-2,GM1-1-1,GM1-1-2,GM2-1-1,MG2-1,MG2-2,MT3-3,XM1,XM2,XM3,XM5。将复苏后的菌株分别接种至PDA 和PSA 培养基,于25 ℃进行培养和产毒研究,对培养10 d左右的菌株进行毒素提取。用无菌1 mL枪头取出6个琼脂块,放入10 mL EP管内。加入4 mL乙酸乙酯,涡旋3 min,超声30 min,再次涡旋3 min,固定在振荡器中振荡30 min。将上清液转移到新的10 mL EP管中,在40 ℃进行氮吹,吹干后加入750 μL甲醇,涡旋1 min复溶, 再加入250 μL的超纯水,将复溶物转移至到2 mL的进样瓶中。样品经0.22 μm注射器过滤器过滤后进入自动进样器小瓶,然后进行UPLC-HRMS分析[25]。
1.3.5 小麦萌发过程中链格孢毒素产生实验 (1)链格孢霉接种小麦种。经预实验发现链格孢霉菌株GM1-1-2和XM5均产链格孢毒素且种类不同,用无菌生理盐水将两株菌株制成孢子悬液。采用培养皿滤纸法培养小麦种子。选取大小一致,籽粒饱满的小麦种子,用75%乙醇泡3~5 min,用超纯水分别冲洗3次,最后用滤纸将水吸干。置于带灭菌滤纸片的培养皿中,每个培养皿50粒小麦均匀地摆在培养皿中,加入适量去离子水,液面高度为小麦种子高度的1/3~1/2处,喷洒孢子悬液。
(2)链格孢霉毒素提取。取适量小麦样品剪碎。称取剪碎好的样品2.00 g于10 mL离心管中,加入4 mL乙酸乙酯,涡旋3 min,超声30 min,再次涡旋3 min,固定在振荡器中振荡30 min。将上清液转移到新的10 mL EP管中,再加入4 mL乙腈,涡旋3 min,超声30 min,再次涡旋3 min,固定在振荡器中振荡30 min。将上清液混合在一起,在40 ℃氮吹,吹干后加入750 μL甲醇,涡旋1 min复溶,再加入250 μL的超纯水。将复溶物过0.22 μm有机滤膜,用UPLC-HRMS检测[25]。
1.3.6 霉菌毒素的UPLC-HRMS检测及条件设置 采用超高效液相色谱串联高分辨质谱正离子模式进行定性分析。色谱条件:色谱柱Hypersil GOLDTMC18 (100 mm×2.1 mm i.d.,1.9 μm);流动相A为0.1%甲酸水溶液,流动相B为乙腈;梯度洗脱如下:0~2 min 5% B、2~3 min 5%~30% B、3~4 min 30%~40% B、4~5.5 min 40%~55% B、5.5~7.5 min 55%~95% B、7.5~9.0 min 95~5% B、9.0~12.0 min 5% B;进样体积为5 μL,流速为0.3 mL/min;柱温为40 ℃。质谱条件:选择数据依赖性采集扫描(DDA)模式;全扫描分辨率70 000 FWHM,扫描m/z范围在120~900,自动增益(AGC Target)设置为3.0×106,最大离子注入时间(maximum IT)100 ms。本工作采用前5位MSMS扫描(ddMS2),分辨率17 500 FWHM。Loop count:10。AGC Target:8.0×103。Maximum IT:50 ms,Isolation window为1.5 Da,碰撞能量(N)CE:20、40、70。最低强度阈值:1.0×103。
1.3.7 数据分析 通过Thermo公司开发的Xcalibur软件与商业标准品对比精准质荷比、元素组成和子离子等信息对霉菌天然产物进行定性分析。MZmine中的诊断片段过滤器是一种针对TMS和MS/MS的采集后数据过滤技术,有效地检测出复杂提取物中给定类的所有化合物[26]。使用MZmine 2的诊断碎片过滤功能[27](Diagnostic Fragmentation Filtering,DFF)对二项结合产物进行筛选。前期对链格孢霉菌株在培养基产毒数据分析显示,几种代谢物解离的中性丢失分子质量为79.956 8 U,推测存在SO3结合的代谢产物。因此本研究中设置诊断中性损失值为79.956 8 U,质荷比公差为0.02或者5.0×10-6,基峰设置为20%。
2 结果与分析
2.1 病原菌形态及分子生物学鉴定
采用组织分离法,从病变小麦中分离纯化得到12株病原菌。如图1(a)所示菌落生长较快,菌丝发达,菌落表面不平,呈绒毡状。BM3-2,GM1-1-1,GM1-1-2,XM2和XM3菌落中心呈墨绿色,中间下陷,有明显的环状轮纹,基质呈灰褐色,颜色较深;MG2-1和XM5菌落初期为灰白色,后转为黑褐色,边缘菌丝颜色比内圈颜色深,基质呈褐色;BM2-1,GM2-1-1,MG2-2和MT3-3,菌落为灰白色或灰褐色,中心凸起,边缘整齐,有明显的环状轮纹;XM1菌落的菌丝初期为白色,后期菌落内圈色泽逐渐变暗转为黑褐色或黄褐色,边缘仍呈白色。
提取12株霉菌DNA进行PCR扩增后,凝胶电泳结果为12株菌条带均在600 bp左右(图1(b)),且条带清晰,可进行下一步测序。将测序结果整理后在NCBI进行Blast对比,找到同源序列构建进化树,进化树结果表明,11株(BM2-1,BM3-2,GM1-1-1,GM1-1-2,GM2-1,MG2-2,MT3-3,XM1,XM2,XM3和XM5)为互隔交链孢菌(Alternariaalternata),1株(MG2-1)为芸苔链格孢菌(Alternariabrasicae),表明小麦病变优势病原菌为链格孢菌。
2.2 游离霉菌毒素确证
采用ESI+模式在固体培养基中检测并鉴定了7种交链孢菌毒素。7种霉菌毒素的名称、化学式、加合物、保留时间、质荷比等信息见表1。与市售标准品对比精准质荷比、保留时间和质谱等信息对链格孢霉菌的7种毒素(ALT、ALU、AME、AOH、ATX-Ⅰ、TeA和TEN)进行了鉴定和定量,标准品和样品中链格孢毒素提取毒素色谱和质谱图如图2所示。

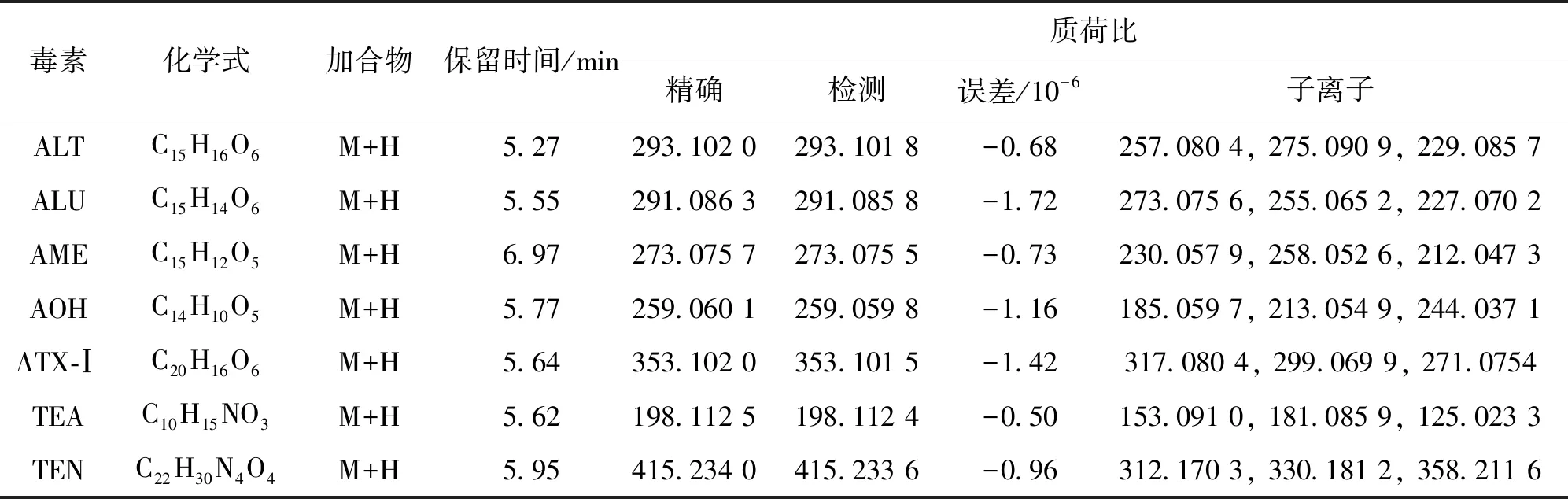
表1 链格孢毒素自定义数据库
2.3 隐蔽型毒素筛选与鉴定
前期对链格孢霉菌菌株在固体培养基产毒原始数据的初步检测显示,几种代谢物解离的中性丢失分子质量为79.956 8 U,推测存在SO3结合的代谢产物。为了充分研究代谢物中是否存在的硫酸盐结合,使用MZmine 2软件对完整原始数据集进行碎片过滤诊断,得到中性丢失结果,将失去的相应SO3(79.956 8 U)分子质量的前体离子进行可视化展示(图3)。在固体培养基中找到了35种硫酸盐结合的霉菌毒素,其中PDA培养基中15种、PSA培养基中20种,小麦中未发现硫酸盐结合产物。

图3 硫酸盐结合产物的中性丢失
用Xcalibur软件进一步确证了硫酸盐结合化合物筛选结果,证实在固体培养基有两种硫酸盐结合的链格孢毒素,其出峰时间分别为6.45 min和9.10 min(图4(a))。除了以硫酸盐结合精确分子质量和SO3的准确中性丢失值为依据外,还通过同位素峰确定分子上存在硫原子。在质谱中,13C×2同位素峰原子质量比单一同位素峰高2.005 U,自然丰度为4.29%的34S的原子质量位移比单一同位素质量高1.995 U,证实硫酸化偶联物结构中存在一个S原子[28](图4(b))。通过二级碎片质谱图对结合型毒素进行确认(图4(c)、(d)),证实两种硫酸盐结合的链格孢毒素,分别为AOH硫酸盐和AME硫酸盐。两种结合型毒素的出峰时间晚于其游离型毒素,与负模式下硫酸盐结合的保留时间早于游离链格孢毒素不同。
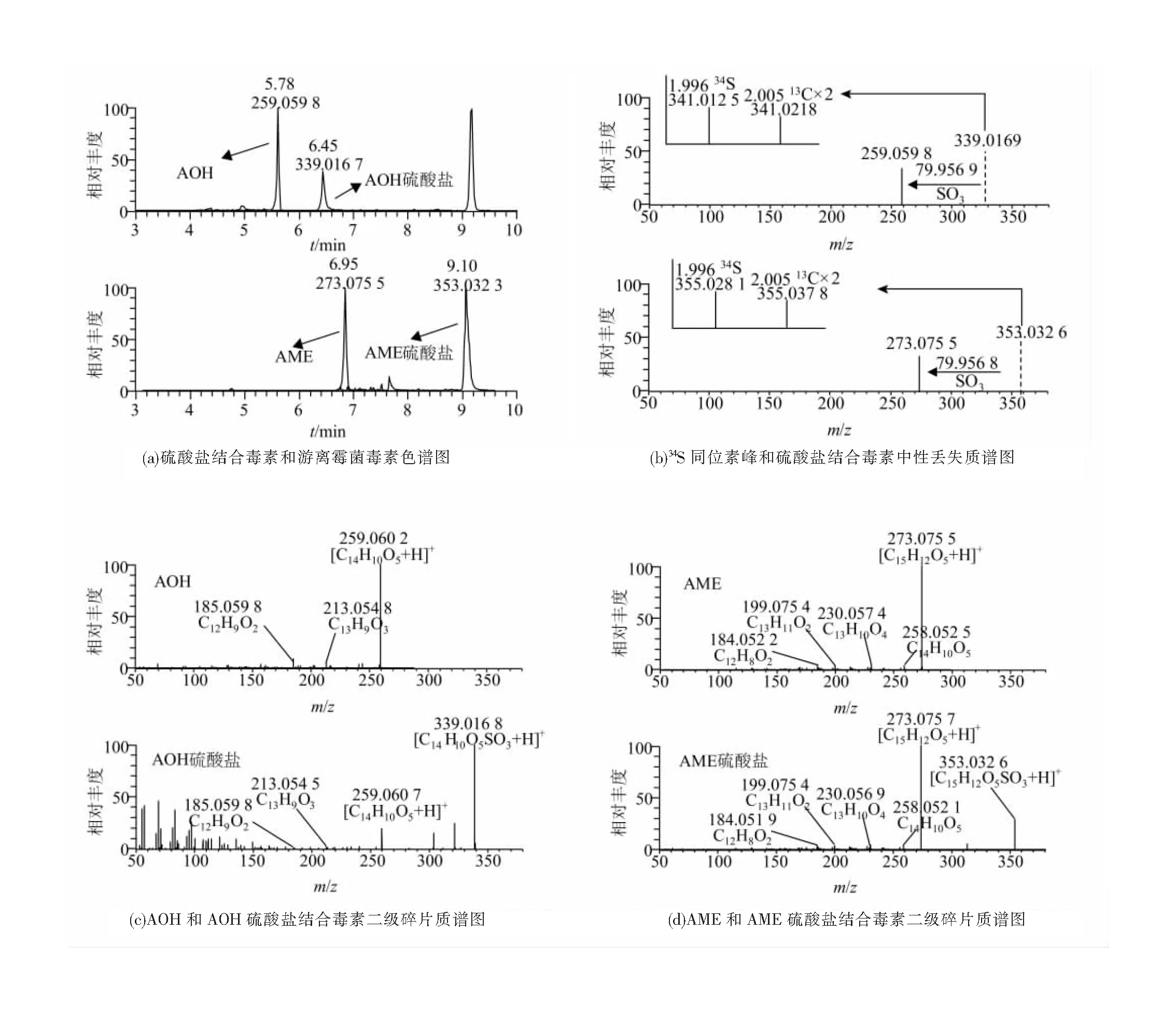
图4 硫酸盐结合产物确证
2.4 链格孢毒素Heatmap分析
利用R语言软件基于峰面积建立热图,对链格孢霉菌在培养基中产生毒素的含量和种类情况进行可视化分析。如图5所示,链格孢霉菌在PDA和PSA培养基中产毒存在差异,所有的菌株均产AOH、AME、ATX-I毒素;只有XM5、XM3、MT3-3不产ALU;除了XM3,其他11株均为产ALT菌株;除了BM2-1、GM2-1、XM2、XM5,其他菌株均产TEN毒素;只有BM2-1、GM1-1-1、GM1-1-2、GM2-1 4株菌株产TeA毒素。而且硫酸盐结合的链格孢毒素只在PSA培养基中产生,推测可能与培养基碳源种类不同有关,葡萄糖促进菌丝的生长,但是蔗糖更有利于孢子的产生[29],所以PSA中的蔗糖比PDA中的葡萄糖更有利于毒素的产生。
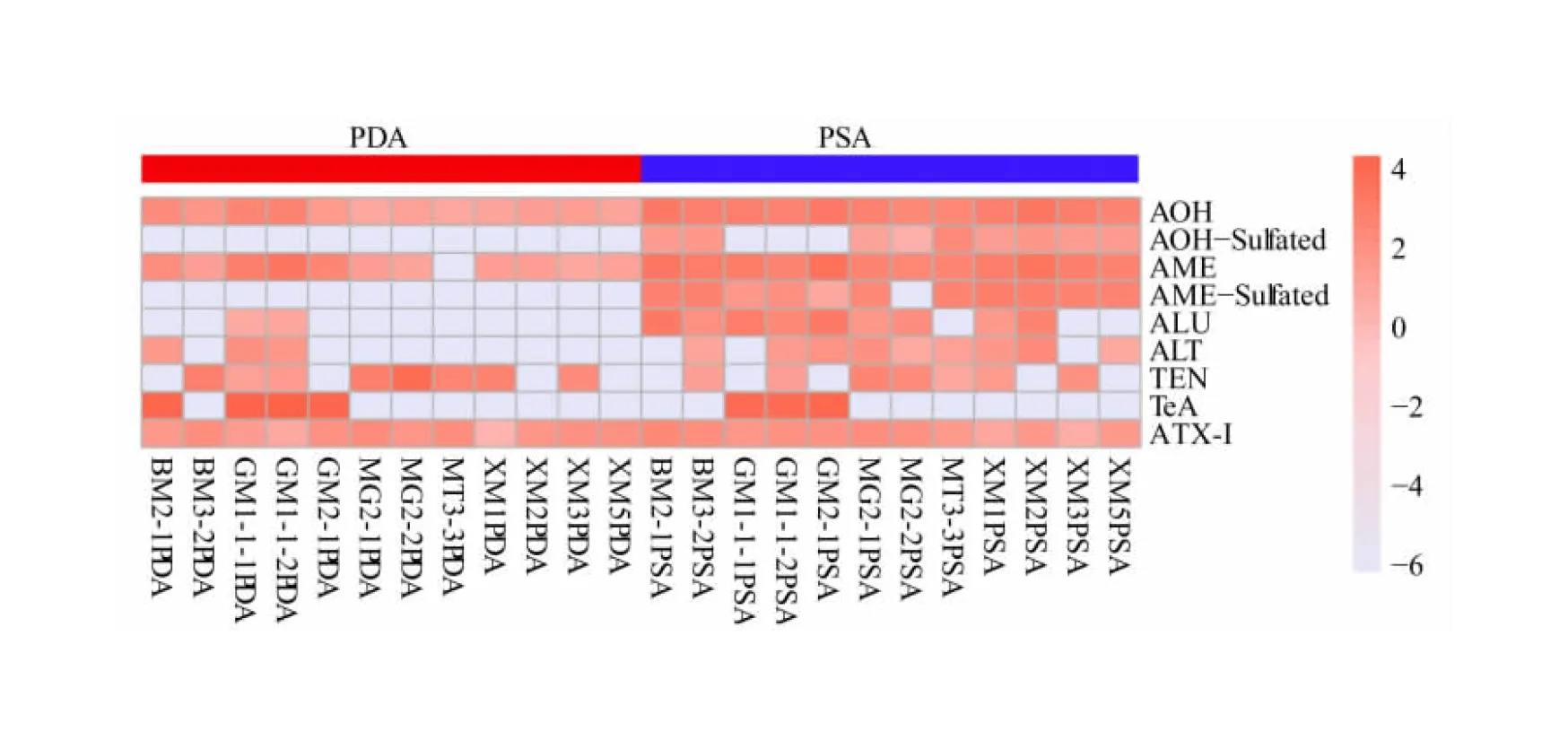
图5 链格孢霉菌在PDA和PSA培养基上产生的链格孢毒素热图分析
2.5 小麦萌发过程中链格孢毒素产生情况分析
在固体培养基中,菌株GM1-1-2产毒素AOH、AME、ALU、ALT、TEN、TeA、ATX-Ⅰ,XM5产毒素AOH、AME、ALT和ATX-Ⅰ;但是在小麦萌发试验中,GM1-1-2 和XM5试验组只检测到毒素AOH、TeA和TEN产生。由表2可知,总体来看,霉菌毒素随着时间增加含量升高。GM1-1-2试验组在第4天检测到AOH的产出,随着时间增加毒素含量上升,到第10天达到71 μg/kg;TEN和TeA在第6天开始检出,TEN在第8天含量最高为130 μg/kg,TeA在第10天含量最高达11151 μg/kg。XM5试验组在第2天检出AOH和TEN,但是含量较低,AOH在第10天达到最高含量为89 μg/kg,TEN在第10天含量最高为62 μg/kg;而TeA只在第10天被检出,含量高达1 128 μg/kg。
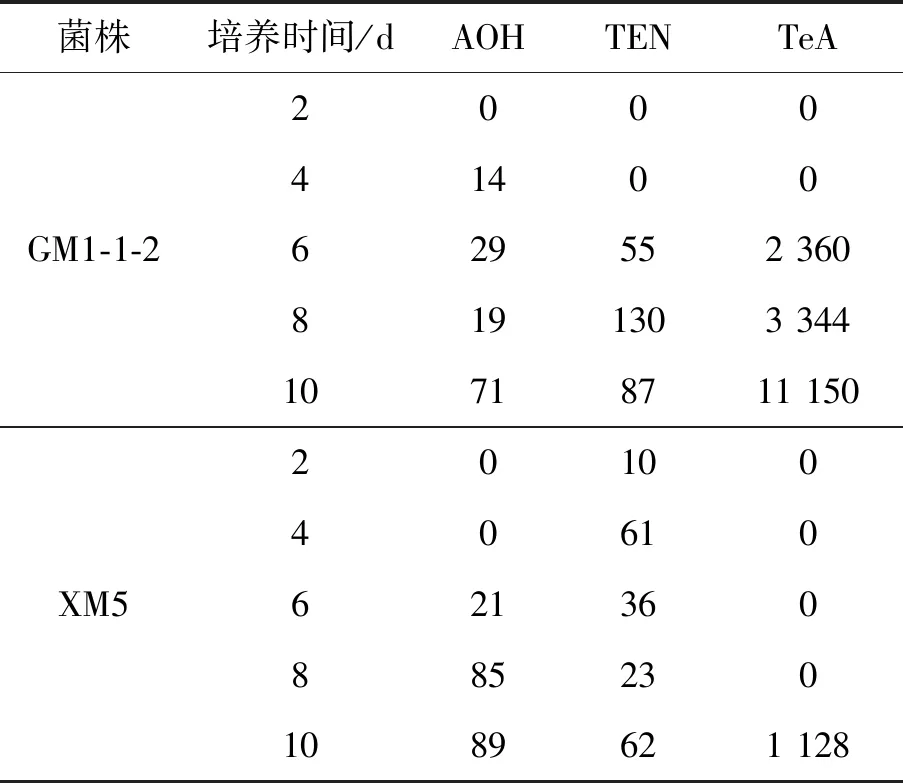
表2 链格孢霉菌侵染小麦中霉菌毒素定量结果
3 讨论与结论
本研究对山东省东营市小麦种植区病变小麦中致病菌株进行分离纯化,结合形态学特征和分子生物学对病原菌进行鉴定,发现小麦病变的优势菌株为互隔交链孢霉,这与李毅然等[30]对进口小麦携带的病原微生物检测结果和匡开源等[31]对陕西大骨节病区的小麦样品检测结果相同。12株链格孢霉菌在固体培养基中共检测到7种游离链格孢毒素(AOH、ALT、ALU、AME、ATX-Ⅰ、TeA、TEN)和2种隐蔽型毒素(AOH-Sulfated和AME-Sulfated)。12株链格孢菌产毒能力和种类存在差别,这种差异可能与链格孢霉产毒基因有关[32-33]。将2株产毒种类不同的链格孢霉菌的孢子悬液接种于小麦种子后,在小麦萌发过程中只检测到毒素AOH、TeA和TEN。链格孢霉菌在侵染植物时,病原菌与宿主植物相互调节作用可能会影响毒素的产生,由植物产生的信号分子或次生代谢产物对毒素的产生起促进或抑制作用[34],因此小麦中链格孢毒素的产生与人工培养基中存在差异。
研究结果表明,互隔链格孢菌(Alternariaalternata)是病害小麦的优势病原菌,可产生链格孢毒素。链格孢霉菌在固体培养基中产生的毒素与在小麦萌发过程中产生的毒素不同。因此,研究谷类中链格孢毒素的发生规律,可为减少链格孢霉病害导致的谷物品质损失提供理论依据。

