数字化技术联合富血小板纤维蛋白新型牙周再生技术治疗后牙舌侧根分叉病变6年随访1例
俞媛媛 钟帅祺 孙伟莲 雷利红
浙江大学医学院附属第二医院牙周病专科,杭州 310009
引导性组织再生术(guided tissue regenera‐tion,GTR)和牙周植骨术是目前获得牙周组织再生最主要的手术方法[1]。然而其在恢复牙周组织的生理结构和功能上还尚未达到临床所期望的目标,对于重度牙周炎通常伴随的Ⅰ壁、水平型等对植入材料包含性差的骨缺损及Ⅲ度根分叉病变尚缺乏实质性治疗成果[2-3]。同时,牙周再生术的技术敏感度高,临床医生经验欠缺可能影响手术预后,甚至导致治疗失败[4]。随着数字化技术在口腔医学领域的应用,通过CT 影像数据获取牙齿、牙列三维信息用于临床诊断、分析和治疗,已成为数字化诊疗不可或缺的环节。运用CT 三维重建技术、计算机辅助设计/制作、快速成型和外科导航技术构建具有完整牙冠、牙根和牙槽骨的三维牙颌模型/导板,以满足种植、正畸、牙体、牙周手术高效、精准实施是口腔医学临床研究关注的热点问题之一。为了提高牙周再生手术的治疗效果、应对临床复杂多样的牙周骨缺损,笔者尝试将富含多种生长因子的自体血小板浓缩物改良富血小板纤维蛋白(advanced platelet-rich fibrin,A-PRF)和注射型富血小板纤维蛋白(injectable plateletrich fibrin,I-PRF)联合应用于牙周再生手术,利用其可辅助植骨材料凝固成型的特性,提高骨移植材料堆塑空间。同时,通过3D 打印技术制备牙槽骨缺损模型用作手术导板,并通过数字化设计复刻出牙周缺损对应修复模块的硅胶阴模,用于A-PRF/I-PRF 骨移植材料成型。2016 年12 月浙江大学医学院附属第二医院牙周病专科收治1例重度牙周炎患者,通过数字化技术个性化定制牙槽骨缺损修复模块阴模,联合牙周植骨术、GTR 和APRF/I-PRF 技术治疗下颌第一磨牙远中及舌侧根分叉区复杂牙槽骨缺损,术后观察6年疗效满意,现报告如下。
1 病例报告
患者,男,38 岁,2016 年2 月因“全口牙龈反复出血1年、右下后牙松动脱落半年”于浙江大学医学院附属第二医院牙周病专科就诊。1 周前外院洁治史,无吸烟史、外伤史、过敏史,无全身系统性疾病史,无家族遗传史。
1.1 检查
口腔卫生一般,牙面可见少量色素,龈缘处可见菌斑软垢堆积,多位点可探及龈下结石。全口牙龈不同程度充血红肿,全口牙周探诊深度(probing depth,PD) 2~10 mm,临床附着水平(clinical attachment level,CAL)3~12 mm,探诊出血(bleeding on probing,BOP)(+) 位点为96%。36 牙远中边缘嵴牙体缺损,探诊无不适,远中颈部龋坏至龈下,探诊敏感,松动Ⅰ度,远颊PD 为7 mm,CAL 为10 mm,远舌PD 为6 mm,舌侧中央PD 为5 mm,颊侧根分叉外形可探及,舌侧根分叉可探入,远中牙龈退缩3 mm,颊侧角化龈宽度近中3.5 mm,远中2.5 mm,颊沟深度9~11 mm,36、37 牙间黑三角明显(图1、2)。46 牙缺失,47牙Ⅲ度松动,近中倾斜。
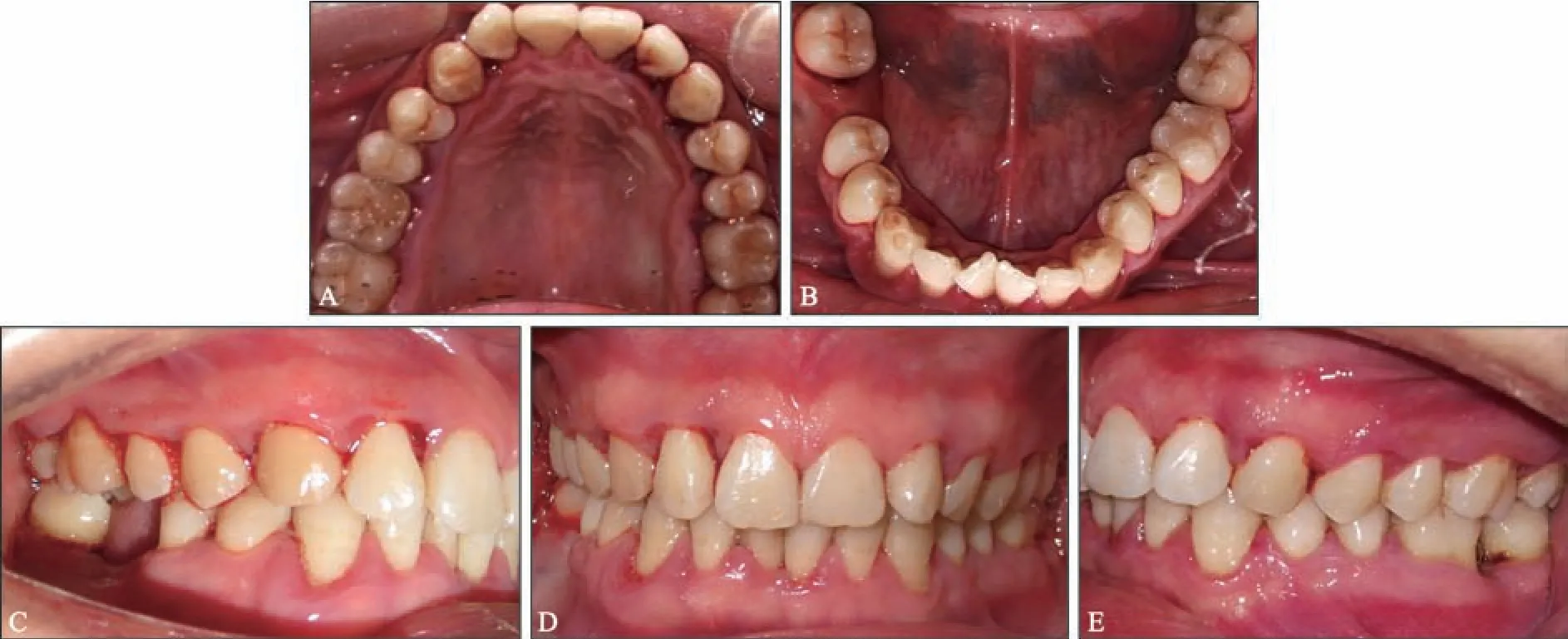
图1 初诊口内像(洁治后)Fig 1 First visit intraoral view (after cleaning)
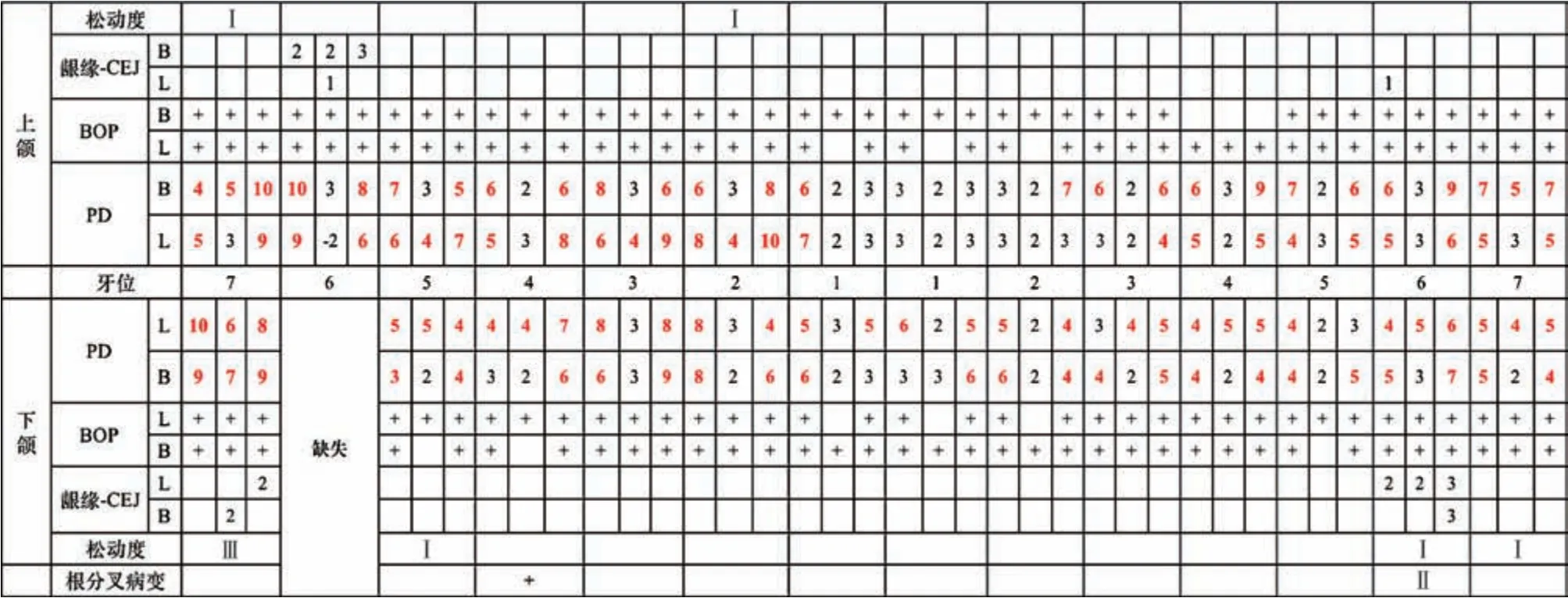
图2 初诊牙周专科检查Fig 2 First visit periodontal examination chart
影像学检查:全口牙槽骨吸收达根长1/3~1/2,36 牙远中牙槽骨吸收至根尖1/3,呈“平坦角形”,根分叉区骨组织密度降低,远中颈部根面低密度影近髓腔(图3),37牙牙槽骨吸收达根长1/2。
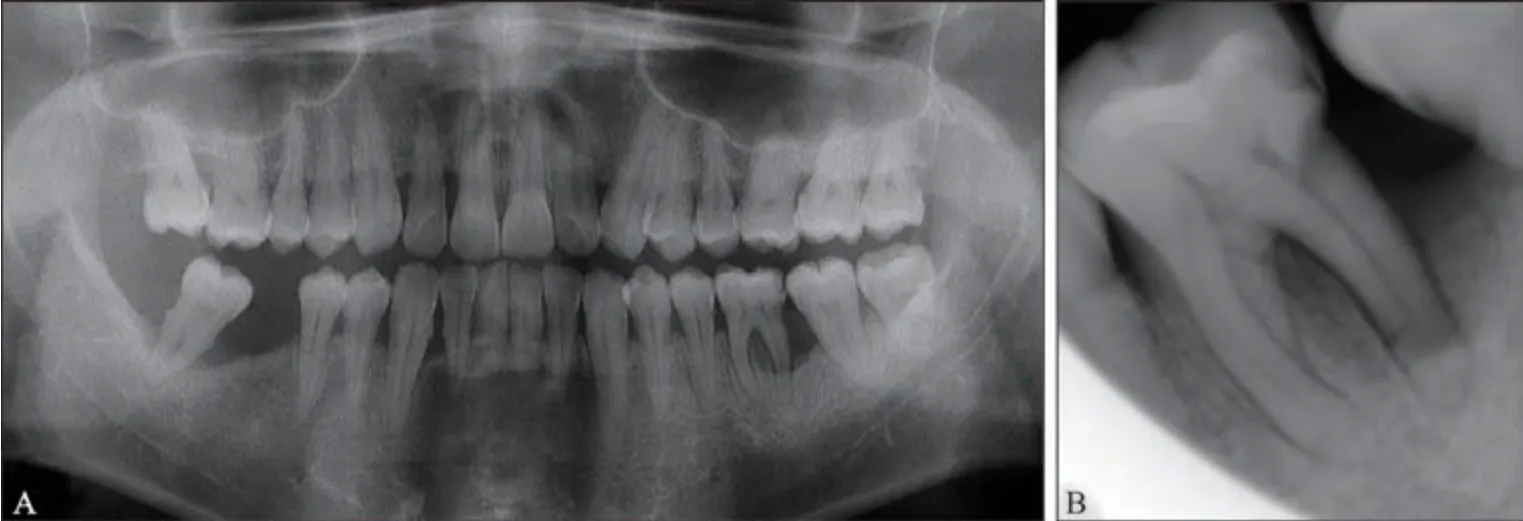
图3 初诊影像学检查Fig 3 First visit panoramic radiograph
诊断:1)牙周炎Ⅲ期,广泛型,C 级[5];2)36牙根分叉病变(舌侧Ⅱ度/颊侧Ⅰ度)[6]。
1.2 治疗
1.2.1 牙周基础治疗 口腔卫生宣教,分区段完成全口龈上洁治、龈下刮治及根面平整,拔除18牙、47 牙,36 牙龋齿充填治疗。6 周复查显示,口腔卫生好转,菌斑减少,牙龈色粉质韧(图4),BOP(+)位点下降至20%,探诊深度及松动度明显减少(图5)。36牙经基础治疗后仍然存在6 mm牙周袋,探诊出血,远中牙龈退缩4 mm,松动Ⅰ度,远中及舌侧骨吸收至根尖1/3,根据锥形束CT(cone beam computerized tomography,CBCT) 数据三维重建后打印出的3D 模型呈现“宽而浅”的平坦骨缺损外形,骨内缺损最深位点深5.02 mm(图6)。
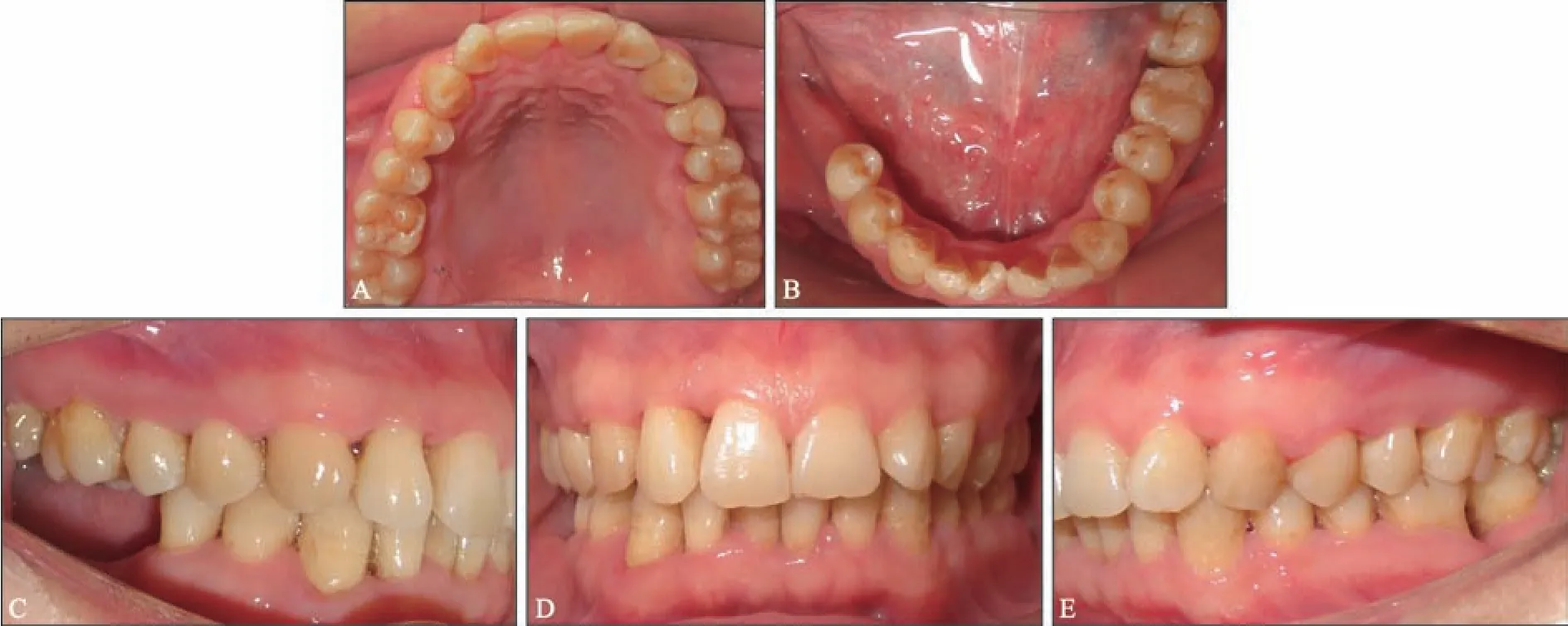
图4 牙周基础治疗后口内像Fig 4 Intraoral view of follow up after basic periodontal treatment
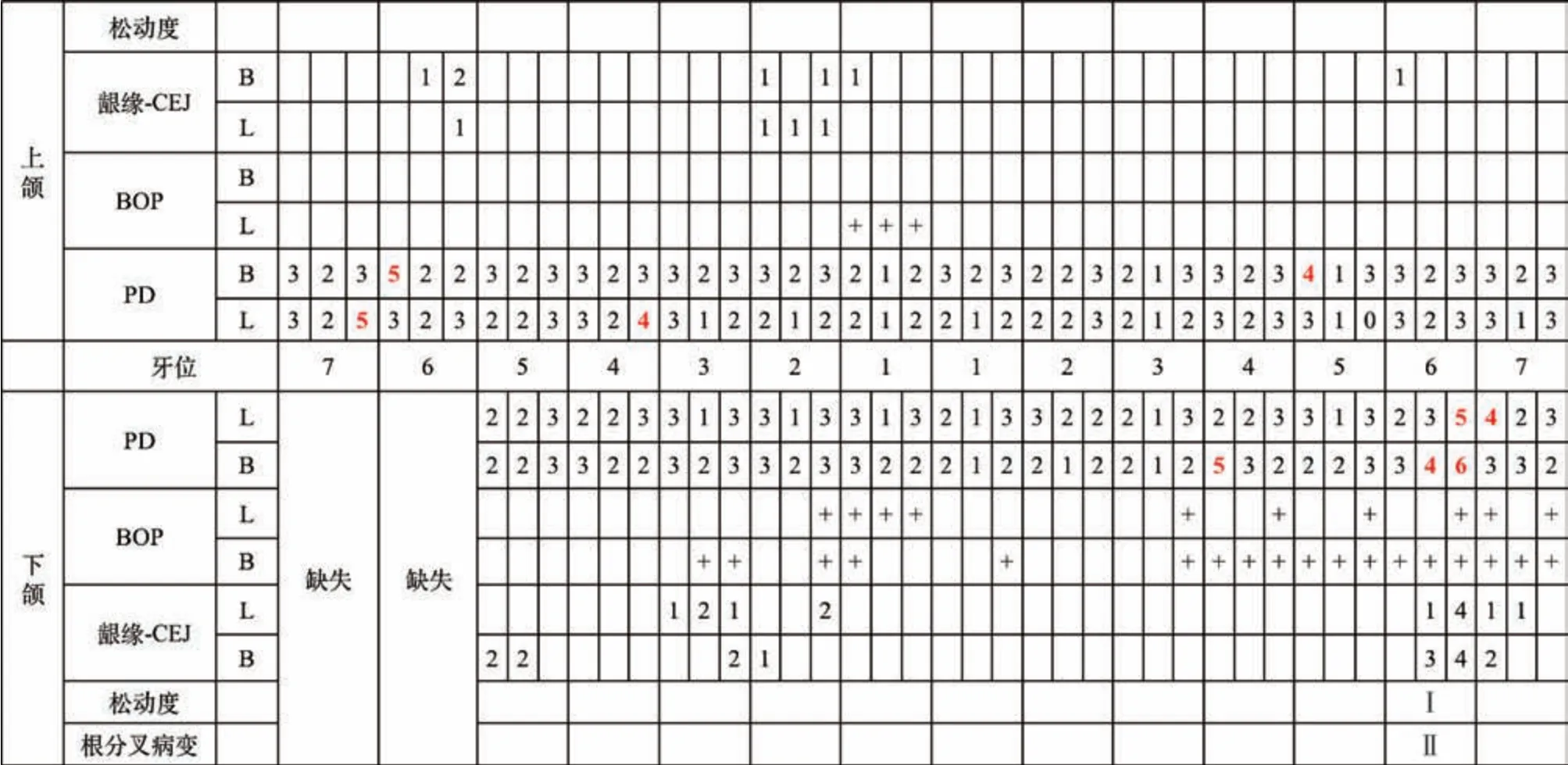
图5 基础治疗后牙周专科检查Fig 5 Periodontal examination chart after basic periodontal treatment
1.2.2 36 牙再生手术 针对36 牙,根据McGuire等[7-8]提出的预后判断标准,36 牙远中附着丧失达10 mm 伴有Ⅱ度根分叉病变,预后不良。分析36牙病因,除去炎症因素,远中颈部根面龋未及时治疗引起的食物嵌塞进一步加剧36 牙远中软硬组织破坏。若不加干预,任其发展必然成为更加棘手的Ⅲ度根分叉问题。如果进行手术治疗,根据数字化重建获得的牙槽骨缺损模型(图6)显示:36 牙骨缺损主要是远中舌侧浅而宽的骨下缺损,存在根分叉入口为视野不佳的舌侧、邻面骨高点位于根分叉缺损入口根方、剩余牙槽骨形态包含性较差等局部不利因素,采用常规GTR 联合牙周植骨术可能存在骨修复量少、术后牙龈退缩进而加重根分叉病变等风险。然而,患者无全身系统性疾病及吸烟史,有强烈的治疗意愿、良好的教育水平及行为控制能力,同时,36牙牙根柱较短,不存在釉珠、釉突、根面凹等解剖结构,这些因素都对预后有利。因此,尝试将数字化技术、自体血小板浓缩物和牙周植骨术,联合应用于GTR术中。采用自体血液提取制备的A-PRF、I-PRF 提高局部牙周环境的再生活性,改善骨粉散在的性状,便于骨替代物塑形,同时利用数字化定制个性化缺损修复模块的阴模堆砌骨替代物,扩大骨缺损修复的空间。
1)3D打印牙槽骨缺损模型及数字化定制缺损修复模块阴模:根据患者术前CBCT 数据,利用Mimics软件(Mimics 10.1,Materialise公司,比利时)重建36 牙及其周围牙槽骨形态,以医用树脂(MED610TM,Stratasys公司,美国)为原料,利用Polyjet 打印机(Connex350TM,Stratasys 公司,美国)打印36 牙牙槽骨缺损模型(图6)。利用数字化技术设计与实际牙槽骨缺损形态相吻合的个性化修复模块:根据CBCT 采集的DICOM 数据重建出手术位点周围牙槽骨形态,设计与实际牙槽骨缺损形态相吻合的修复模块,并根据实际手术植入需要将模块分割为颊舌两块,使用医用硅胶3D打印36 牙牙槽骨缺损修复模块的阴模用于术中骨充填物成型(图7)。
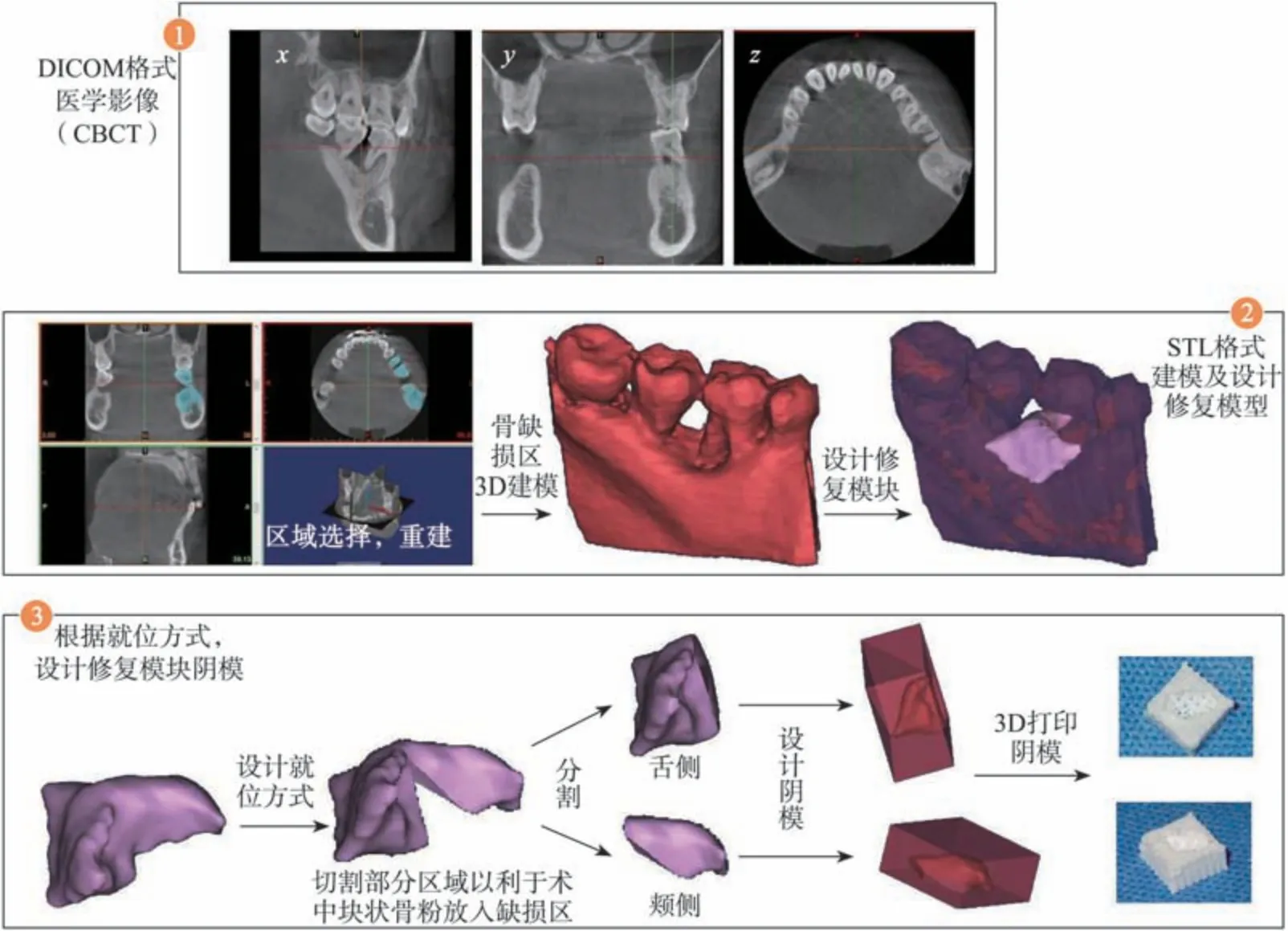
图7 数字化定制个性化牙槽骨缺损修复模块阴模Fig 7 Digitally customized personalized alveolar bone defect repair module negative mold
2)个性化牙槽骨缺损模型及其修复模块引导下的36 牙新型牙周组织再生联合术式:术中采集患者外周血制备A-PRF 及I-PRF(PC-02,PRO‐CESS 公司,法国);术区翻瓣清创后,将A-PRF凝胶剪碎与骨移植材料(Bio-Oss,Geistlich Bio‐materials公司,瑞士)搅拌混合填入个性化牙槽骨缺损修复模块的阴模,并滴入I-PRF,待其凝结成型;根据个性化牙槽骨缺损模型裁剪可吸收胶原膜(Bio-Gide,Geistlich Biomaterials公司,瑞士);将已凝结的A-PRF+Bio-Oss+I-PRF 混合物植入术区骨缺损内,覆盖裁剪合适的Bio-Gide 膜及压制成型的A-PRF 膜,缝合创口(图8)。术后用药:口服头孢呋辛酯片(250 mg/次,2 次/d,5 d)及奥硝唑(500 mg/次,2次/d,10 d),含漱0.12%复方氯己定含漱液。术后2周拆线,详细指导患者严格的菌斑控制。

图8 个性化定制牙槽骨缺损修复模块联合牙周植骨术、GTR、A-PRF/I-PRF技术诱导36牙周组织再生Fig 8 Personalized alveolar bone defect repair module combined with bone graft, GTR and A-PRF/I-PRF technology to guide 36 periodontal tissue regeneration
3)维护期治疗:术后3~6 个月定期复诊,行牙周维护治疗,严格控制菌斑。46、47 牙行种植修复(图9、10)。
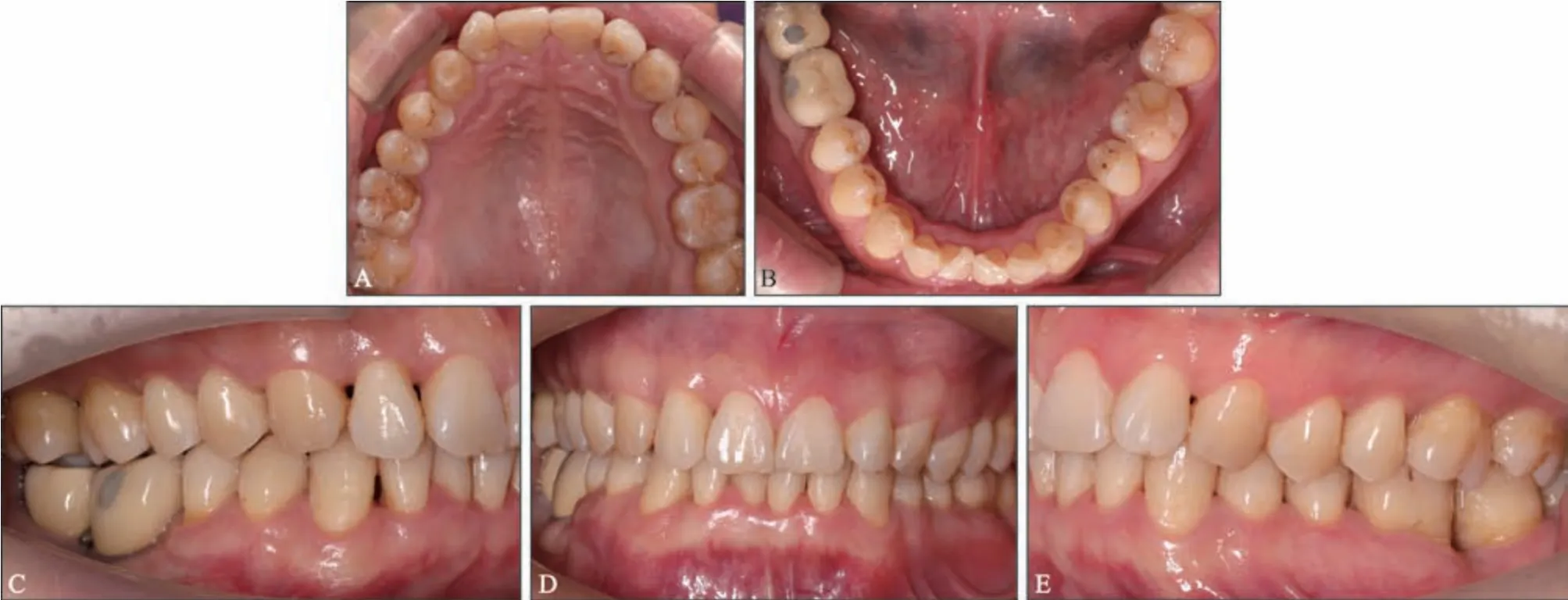
图9 36牙术后6年复诊口内像Fig 9 Intraoral view of 6-year posttreatment
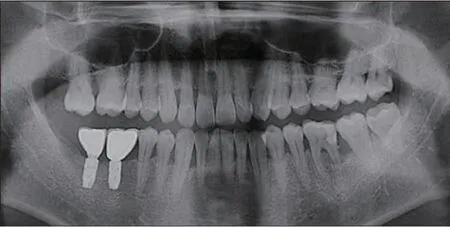
图10 术后6年全口曲面断层片Fig 10 6-year posttreatment panoramic radiograph
治疗效果:36 牙新型牙周组织再生术后疗效随访观察6 年,术区牙周状况稳定,牙龈无进一步退缩(图11)。36 牙PD 减小4 mm,CAL 增加5 mm,由松动Ⅰ度变成无松动(表1),维护期内均无冷热刺激不适。影像学检查显示,术后6个月36 牙根分叉基本得到修复,远中舌侧有显著的牙槽骨增量,其中骨内缺损深度降低4.58 mm,骨充填率达91%,且随时间延长新生牙槽骨稳定,术后6年复查骨充填率仍高达90%,新生骨皮质更加清晰(图12、13)。
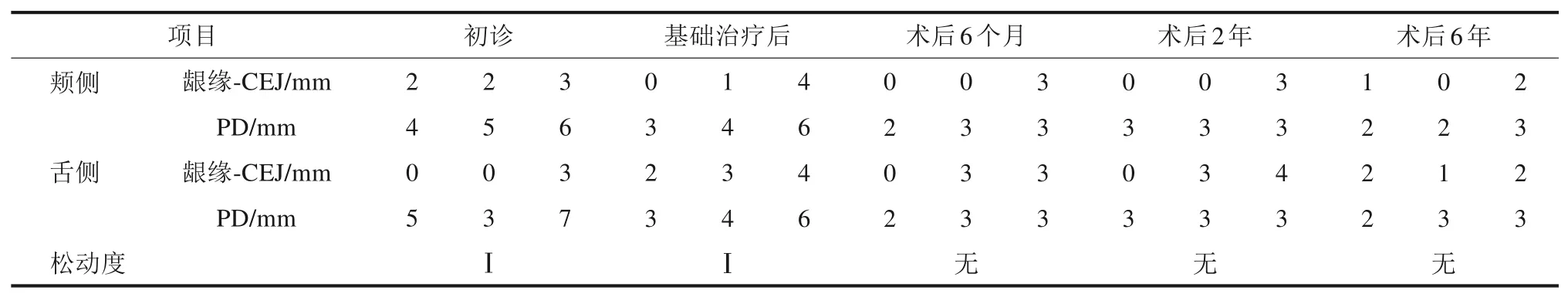
表1 36牙新型牙周组织再生术前后牙周专科检查比较Tab 1 Periodontal examination chart of pretreatment and 6-year posttreatment of 36 novel periodontal tissue regeneration surgery
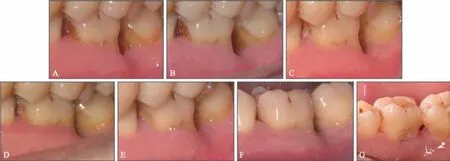
图11 36牙新型牙周组织再生术前后口内照Fig 11 Intraoral view of pretreatment and 6-year posttreatment of 36 novel periodontal tissue regeneration surgery
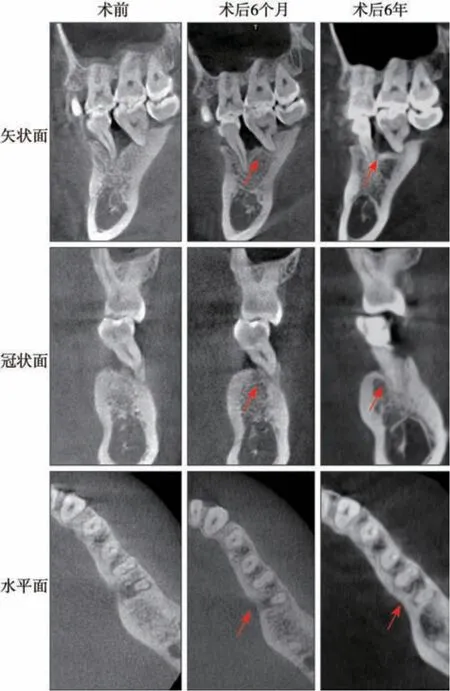
图12 36牙新型牙周组织再生术前后CBCT对比图像Fig 12 CBCT inmage of pretreatment and 6-year posttreatment of 36 novel periodontal tissue regeneration surgery
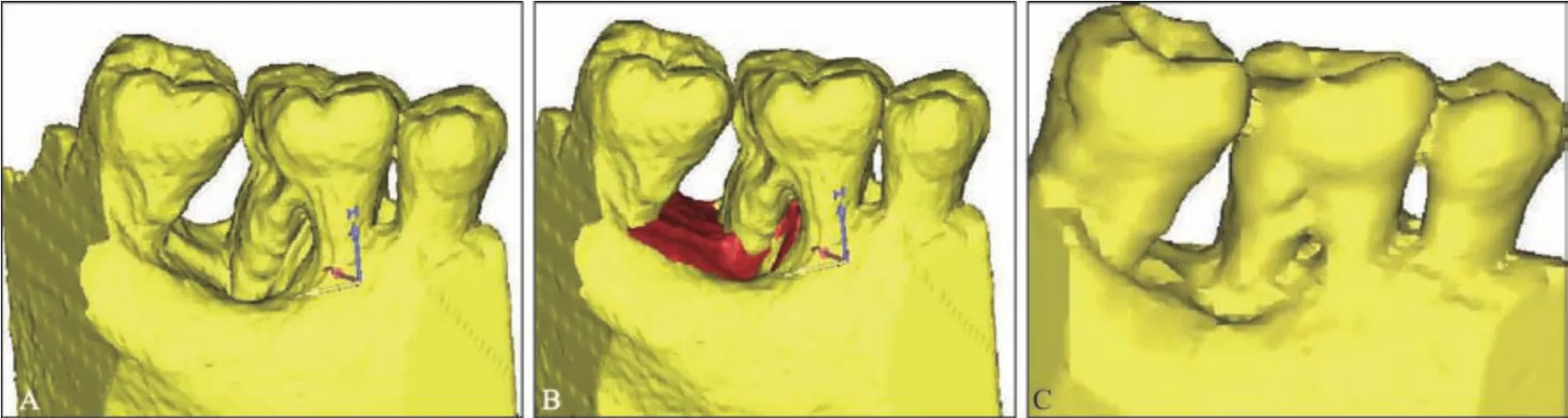
图13 36牙新型牙周组织再生术前后数字化三维重建图Fig 13 3D reconstruction of pretreatment and 6-year posttreatment of 36 novel periodontal tissue regeneration surgery
2 讨论
本病例为重度牙周炎,患者初诊时全口牙周炎症明显,多牙松动。经过完善的牙周基础治疗后,患者症状明显改善,牙周风险评估降低,但后牙仍存在牙周袋,有牙周病变进一步加剧风险。通过个性化制作3D 打印牙槽骨修复模型结合GTR、A-PRF/I-PRF 技术诱导牙周组织再生获得了稳定的牙槽骨再生。
再生是当全身和局部条件较好时可能发生的一种治疗结果[9]。牙周再生治疗成功的关键在于骨修复空间的创造、创面保护和稳定[10]。然而,现有的牙周再生手术临床疗效有限,仅能改善骨内缺损近根方部分,难以完全达到骨内缺损的修复[11-12]。一方面,由于临床常用的颗粒型植骨材料降解率与自体新生骨组织速率不匹配,限制其骨再生能力[13];同时术中存在难以塑形的技术难点,不利于非包含型骨缺损再生空间的稳定维持和对屏障膜的长期支撑[14-15]。另一方面,GTR 成功实施的前提在于临床医生对骨缺损形态和根分叉结构的充分理解。本病例中患牙36 牙位于牙列后方,骨缺损重灾区为远中根舌侧及根分叉区,术区视野有限,操作难度大;且骨缺损形态为平坦的骨下缺损伴随将近Ⅲ度根分叉病变,牙槽骨缺损整体包含性较差,若采用常规GTR 联合牙周植骨术预后不佳。
随着数字化技术在口腔医学领域应用的日益成熟,数字化建模、导板打印等手段使得精确手术设计和精准缺损修复成为可能。CBCT扫描获得的三维影像数据,经过特定算法处理,构建具有完整牙冠、牙根和牙槽骨的数字化牙颌模型,已成功应用于口腔种植导板[16]、颌面外科手术模型[17]、正畸诊断性排牙[18]、根管定位导板[19]等领域。本病例依托计算机辅助设计并联合三维打印技术,术前利用牙槽骨缺损实物模型准确评估骨缺损形态,与患者进行充分的手术方案沟通。基于数字化模型设计骨缺损修复方案,制备个性化缺损修复模块的硅胶阴模,供术中预成型A-PRF+Bio-Oss+I-PRF 混合骨替代移植物,分颊舌双侧置入骨替代移植物,规避牙位限制,降低手术治疗复杂性,最大程度地创造骨修复空间量。除此之外,GTR 术的技术难点之一在于临床医生需要根据患者特异性的骨形态裁剪屏障膜,以确保其延伸范围。Takane 等[20]在牙周炎患者Ⅱ类壁或Ⅲ类壁骨缺损的再生手术中,利用三维打印模型裁剪可吸收胶原膜,结果显示用这种方法制备的胶原膜更加匹配骨缺损区域,大大缩短了手术时间。本病例采用相似方式预成型屏障膜保护创面,降低了屏障膜反复修建试位可能造成的感染风险,高效精准重现术前设计,实现骨缺损再生空间的稳定维持,为后期牙周再生治疗成功提供更高的可能性。
本病例中,富含多种生长因子的自体富血小板纤维蛋白进一步提高了再生性手术的疗效。以低速离心获得的A-PRF与I-PRF被认为是多种细胞因子和细胞的储存池[21-23],可有效刺激成骨细胞再生并参与牙周骨组织的再生[23-24]。本课题组在前期研究中发现A-PRF 含有致密的三维网状纤维蛋白基质,其中网罗着大量血细胞和血小板衍生生长因子(platelet derived growth factor,PDGF)、转化生长因子(transforming growth factor,TGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等生长因子[25],可协同促进牙周膜成纤维细胞增殖、血管新生,抑制破骨细胞分化,为创伤组织的修复再生提供良好的微环境[26-27]。有研究者将A-PRF、I-PRF 与骨替代移植物应用于牙槽嵴骨增量术[28-29]和位点保存术[14],临床结果表明A-PRF 和I-PRF 能减轻术后反应,有效保存拔牙位点骨高度和骨宽度,为后期修复提供有利条件。笔者[30]曾将上述A-PRF+Bio-Oss+I-PRF混合物应用于重度牙周炎骨缺损再生手术治疗中,结果显著促进了创口愈合,获得良好临床疗效。本病例中36 牙远中舌侧骨内缺损及舌侧根分叉骨缺损获得明显修复,术后随访6年,骨增量维持稳定,并且随着时间延长,影像学显示36 牙皮质骨化,骨密度进一步提高,筛状板的新生可包埋穿通纤维,提示可能存在牙骨质-牙周韧带-牙槽骨复合体形成。同时,术后牙周状态长期健康稳定,牙龈无任何退缩,颊侧牙龈高度甚至稍有增加,表明牙周再生手术治疗获得成功。本病例获得的良好疗效进一步证明该方法可改良骨替代物性状,增强再生空间稳定性,利于牙周组织修复再生。
相较传统Bio-Oss、Bio-Gide 联合应用的牙周再生手术,本研究采用的方法具有以下优势:1)数字化技术的引入使传统牙周再生手术焕发新生机,CT 三维重建为术前准确评估牙周组织破坏程度和评价牙周再生手术的疗效提供了新的途径,计算机辅助设计实现了手术方案可视化设计及患牙留存的可行性预估;2)3D打印的牙槽骨缺损模块准确反映局部牙槽骨缺损形态,有助于术中个性化屏障膜的修剪,个性化牙槽骨缺损修复模块的使用实现了精准、高效、微创的手术操作;3)自体富血小板纤维蛋白(A-PRF、I-PRF)中富含生长因子,可早期启动血管生成,提高软组织愈合和新骨生成能力,与Bio-Oss 骨移植物混合后,增大了Bio-Oss 颗粒间的间隙,为组织细胞的迁移生长、血液及有效成分渗入提供更大支撑,同时改变骨粉散在的性状便于塑型和堆砌,扩大了骨缺损修复的空间。此外,患者良好的依从性与定期复查维护治疗为牙周再生提供了良好的局部微环境。
虽然本研究样本量少、随访观察时间较短,尚不足以科学地论证这种新型手术方法的再生治疗效果,然而对于后期进一步大样本的随机临床对照试验及进一步研究具有借鉴意义。
利益冲突声明:作者声明本文无利益冲突。

