基于生物信息学分析YOD1基因在胰腺癌中的作用
席晓明,赵闻侠,李杨,张职铄,邵荣光
·论著·
基于生物信息学分析YOD1基因在胰腺癌中的作用
席晓明*,赵闻侠*,李杨,张职铄,邵荣光
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所肿瘤室(席晓明、赵闻侠、李杨、邵荣光);200092 上海,上海交通大学医学院新华医院急诊科(张职铄)
通过 TCGA 数据库中胰腺癌的 RNAseq,分析 YOD1 作为胰腺癌预后标志物的潜力及其对肿瘤免疫的影响,为胰腺癌的诊断及预后研究提供参考。通过 TCGA 数据获得 RNA 数据集;利用 R survminer 包对数据可视化,survival 包分析 YOD1 对胰腺癌生存期的影响,对于 TCGA 和 GTEx 的 TPM 格式的 RNAseq 数据,利用 ggplot2 包可视化数据,pROC 包对数据进行分析并绘制 ROC 曲线;使用 linkedomics 在线网站对差异基因进行 GO 和 KEGG 分析。通过 miRWalk、TargetScan、miRDB、miRtarBase 共同分析可能调节 YOD1 表达的 miRNA。采用 R-project 中的 GSVA 包对数据进行可视化处理,采用免疫浸润算法 ssGSEA 分析 YOD1 对免疫细胞的影响;利用 TIMER2.0 在线数据库分析 YOD1 对免疫细胞浸润的影响。通过 EdU 和 transwell 实验验证 YOD1 对胰腺腺癌细胞增殖和迁移的影响。通过 MTT 实验验证 YOD1 对巨噬细胞增殖的影响。通过 Western blot 实验验证 YOD1 对巨噬细胞极化的影响。差异分析发现 YOD1 在胰腺癌中高表达;YOD1 高表达患者的总生存期(= 0.028,HR = 1.59)和无病生存期(= 0.036,HR = 1.52)明显低于 YOD1 低表达患者;ROC 曲线证明 YOD1 具有成为胰腺癌诊断标志的潜力(= 0.953,95% CI = 0.931 ~ 0.975);通过不同网站预测发现,存在 31 种 miRNAs 对 YOD1 的表达起负性调控作用。KEGG 富集分析发现,上述 31 种 miRNAs 主要富集在影响癌症进展、p53 信号通路和胰腺癌进展;PPI 网络分析,预测 YOD1 主要与 VCP、UBC、UBB、UBP4、RPS27A、UBXN6、UFD1L、NPLOC4、FAF2、PLAA 发生蛋白-蛋白相互作用;免疫相关分析发现 YOD1 与 Th2 免疫细胞在 PAAD 组织的浸润呈正相关(< 0.05),与 TFH 细胞的浸润呈负相关(< 0.05);体外实验验证 YOD1 能够促进胰腺癌细胞迁移、增殖,抑制巨噬细胞的增殖并逆转巨噬细胞由 M2 型向 M1 型极化。YOD1 作为一种去泛素酶,可能通过影响肿瘤微环境来促进胰腺腺癌的发生发展,进而影响胰腺腺癌患者的预后。YOD1 有潜力成为胰腺癌诊断和治疗的分子标志物。
胰腺癌; YOD1; 生物信息学; 肿瘤分子标志物
胰腺癌具有高侵袭性、早期诊断困难、复发率高、5 年生存率低、且呈显著的免疫抑制性微环境等特点[1-2]。根据美国癌症协会的数据显示,2022 年全世界有超过 6.22 万例新增胰腺癌患者,同时大约有 4.98 万例因患胰腺癌死亡。胰腺癌患者 5 年生存率仅为 11%,为所有癌症中最低,已成为最致命的恶性肿瘤之一。预计到 2030 年,胰腺癌致死率将超过乳腺癌和结直肠癌,成为继肺癌之后的第二大癌症相关死亡原因[3]。由于大部分胰腺癌患者于晚期才具有明显症状,错过根治性手术治疗最佳时期,多数出现不同程度的转移。多药联合化疗是晚期或转移性胰腺癌患者最常用的方案,但是治疗后患者的生存率依然较低[4],因此寻求针对胰腺癌早期诊断和治疗的分子标志物,对于提高胰腺癌患者的预后十分重要。
泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)在真核生物的稳态中发挥了重要作用。据报道,UPS 异常与肿瘤的转移[5]、侵袭[6]、血管的生成[7]等过程密切相关。去泛素化酶(deubiquitination enzymes,DUBs)通过去除泛素链或者在泛素链内进行切割,可逆地调节蛋白泛素化过程,在 UPS 中发挥重要作用。与泛素化酶(ubiquitinase,Ub)相比,DUBs 对癌症的调控作用和机制尚未完全阐明[8]。卵巢肿瘤蛋白酶2(OTUD2,YOD1)属于半胱氨酸基去泛素化酶。据报道,YOD1 在多种肿瘤中表达异常,与肿瘤的发生发展密切相关[9]。Kim 等[10]发现,YOD1 可通过去泛素化 ITCH(LATS 的 E3 连接酶),使 LATS 水平降低,进而导致 YAP/TAZ 水平升高,最终促进肝肿大甚至肝癌的迁移。另有研究发现通过 YOD1 上游 miR-4429 靶向调控,使其表达水平降低,可以抑制卵巢癌的恶性发展[11-12]。
本研究主要通过生物信息学技术结合实验验证,分析 YOD1 对胰腺癌的发展及其肿瘤微环境的影响,判断 YOD1 作为胰腺癌生物标志物的能力,为胰腺癌的诊断和治疗提供新策略。
1 材料与方法
1.1 材料
1.1.1 细胞 小鼠胰腺癌细胞 Pan02、小鼠单核巨噬细胞白血病细胞RAW264.7、人转移胰腺腺癌细胞 AsPC-1、人胰腺癌细胞 MIA-PaCa-2、人胰腺导管癌细胞 SU86.86、人胰腺导管癌细胞 Cf-PAC-1、人胰腺癌细胞 SW1990、人原位胰腺腺癌细胞 BxPC-3 和人正常胰腺导管上皮细胞 HPDE6-C7 均由医药生物技术研究所肿瘤室保存。
1.1.2 实验试剂 细胞培养用 DMEM 培养基和胎牛血清均购自美国 Gibco 公司;10000 U/ml 青霉素及 10000 μg/ml 链霉素购自中科迈晨科技有限公司;4% 多聚甲醛固定液、结晶紫染液、SDS-PAGE 蛋白上样缓冲液(5 ×)、细胞总蛋白的提取及定量所用的 RIPA 裂解液和 BCA 试剂购自上海碧云天生物技术研究所;Western blot 所用一抗购自美国 Cell Signaling Technology 公司;辣根过氧化物酶标记的二抗购自北京中杉金桥生物技术有限公司;PVDF 膜及发光液购自美国 Millipore 公司;5-乙炔基-2'-脱氧尿苷(EdU)细胞增殖检测试剂盒购自广州锐博生物科技有限公司;DAPI 购自美国 Invitrogen 公司;Transwell 小室购自美国 Corning公司。
1.1.3 基因芯片数据库来源 UCSC XENA(https://xenabrowser.net/datapages/)经 Toil 流程统一处理的癌症基因组图谱(the cancer genome atlas,TCGA)和基因型组织表达(genotype-tissue expression,GTEx)的 TPM 格式的 RNAseq 数据。提取 TCGA(https://portal.gdc. cancer.gov/)的胰腺癌和 GTEx 中对应的正常组织数据及 TCGA 胰腺癌项目中 level 3 HTSeq-FPKM 格式的 RNAseq 数据。
TCGA 数据库胰腺癌项目中细分为 4 个板块,分别是导管和小叶肿瘤,腺瘤和腺癌,囊性、黏液性和浆液性肿瘤,上皮性肿瘤。下载上述板块中所有的病例进行数据处理。
数据转化:PKM(fregments per kilobase per million)格式及 TPM(transcripts per million reads)格式的 RNAseq 数据进行 log2 转化。
1.2 方法
1.2.1 差异基因的表达 GEPIA 数据库(http:// gepia.cancer-pku.cn/)是通过对来自 TCGA 和 GTEx 数据进行快速可视化的一个交互式网络应用程序[13]。利用 GEPIA 数据库分析 YOD1 在所有癌症中的表达情况。
1.2.2 生存分析 为了评价 YOD1 与胰腺癌预后的相关性,使用 R(3.6.3 版本)survminer 包(0.4.9 版本)用于可视化分析;survival 包(3.2-10 版本)用于生存资料的统计分析,< 0.05 具有统计学意义。为确定该基因是否可以作为独立预后因素,分析了 YOD1 高表达与胰腺癌患者总生存期(overall survival,OS)和无病生存期(relapse-free survival,RFS)的关系。对于统一处理的 TCGA 和 GTEx 的 TPM 格式的 RNAseq 数据,使用 pROC 包(1.17.0.1 版本)进行分析,ggplot2 包(3.3.3 版本)用于可视化,提取 TCGA 中胰腺癌和 GTEx 中对应的正常组织数据,将其转化为 TPM 格式的 RNAseq 数据并进行 log2 转化后进行样本间的表达比较,绘制 ROC 曲线评估 YOD1 对胰腺癌患者诊断预后的准确性。
1.2.3 富集分析 linkedomics(http://www. linkedomics.org/)包含 32 种 TCGA癌症类型和 11 158 名患者的原发性肿瘤的多组学数据[14]。使用 linkedomics 在线分析网站对胰腺癌数据集进行分析,以 YOD1 中位数分组后,将两组差异基因进行 GO 和 KEGG 富集分析。其中,q < 0.05,FDR < 0.25 的值被认为是具有统计学意义的。然后根据 NES 值对结果进行从高到低排序。
调控 YOD1 表达的上游 miRNA 是通过 miRWalk(http://mirwalk.umm.uni-heidelberg.de/)、TargetScan(https://www.targetscan.org/vert_80/)、miRDB(https://mirdb.org/)、miRtarBase(http:// starbase.sysu.edu.cn/)4 个在线网站预测的,通过韦恩图获取 31 种 miRNA,并通过 KEGG 富集分析在胰腺癌组织中靶向 YOD1 的 miRNA 主要影响的通路。
1.2.4 PPI 网络可视化 使用在线分析工具 STRING(http://www.string-db.org/),= 1.21e-10,节点数 = 11、边数 = 48、平均节点度 = 8.73、平均局部聚类系数 = 0.908。预测在胰腺癌中与 YOD1 相互作用的蛋白,为 YOD1 对胰腺癌的影响提供不同的机制研究策略。
1.2.5 免疫浸润 使用 R 软件 GSVA 包(1.34.0 版本)对胰腺癌项目中 level 3 HTSeq-FPKM 格式的 RNAseq 数据先进行 log2 转化,然后使用免疫浸润算法 ssGSEA(GSVA 包内置算法),分析 YOD1 对免疫微环境中免疫细胞的影响[15],< 0.05 具有统计学意义,Person 或 Spearman 检验,> 0 为正相关,< 0 为负相关。
使用在线分析工具 TIMER2.0(https://cistrome. shinyapps.io/timer/)评估胰腺癌中 YOD1 的表达与免疫细胞浸润水平的相关性[16]。
1.2.6 Transwell 实验 用无血清培养基平衡培养 30 min 后,瞬时转染 24 h,消化对数生长期的 AsPC-1 和 MIA-PaCa-2 细胞。上部隔室用30 000 个/200 μl 无血清培养基接种,下部隔室用 20% FBS 接种。继续培养 48 h,用 4% 的多聚甲醛固定,结晶紫染色后倒置显微镜观察并拍摄。用刀片切下小室膜,溶于 33% 的冰醋酸中,用紫外分光光度仪测定 570 nm 处的吸光度值。
1.2.7 EdU 掺入实验 将转染后的对数生长期的 AsPC-1 和 MIA-PaCa-2 细胞铺于 24 孔爬片,24 h 后加入适量EdU工作液孵育 3 h,根据试剂盒操作说明书进行 4% 多聚甲醛固定、清洗、EdU 反应、DAPI 染色等步骤,使用荧光倒置显微镜拍照。
1.2.8 Western blot 实验 用 RIPA 细胞裂解物(含 1% PMSF)裂解细胞。随后采用 BCA 法测定蛋白质浓度。使用SDS-PAGE电泳分离蛋白质并转移到 PVDF 膜。然后用5% 的脱脂奶粉封闭。完成后,用指定的抗体对膜进行免疫定位,并使用增强的 HRP 底物化学发光溶液(ECL)在凝胶成像仪中进行成像。
1.2.9 巨噬细胞极化 瞬时转染 24 h Pan02 小鼠胰腺癌细胞。将 RAW264.7 细胞以 35万/孔铺于六孔板中,第二天细胞长至 70% ~ 85% 时加入相应培养基配制的 LPS(100 ng/ml)、IFN-γ(20 ng/ml)诱导 16 ~ 24 h,将转染后的对照组和过表达 YOD1 组 Pan02 细胞的上清分别加入到六孔板中,6 h 后收样,Western blot 检测 M1 型巨噬细胞标记物INOS 和 M2 型巨噬细胞标记物 CD206 的表达。
1.2.10 MTT 法检测 YOD1 对巨噬细胞增殖的影响 取对数生长期的 Pan02 细胞消化离心,每孔 1 × 104个/2 ml,接种于六孔板,瞬时转染48 h 后,取对数生长期的 RAW264.7 细胞,8000 个/200 μl 的密度接种于 96 孔板中。次日收集转染 48 h 的Pan02 细胞上清液,加入到巨噬细胞中,于第 24 小时加入 5 mg/ml 的 MTT 溶液 50 μl,继续培养 3.5 h,弃上清,加入 DMSO 溶液 150 μl,振荡后,测定490 nm,计算 YOD1 对巨噬细胞增殖的影响。
2 结果
2.1 YOD1 在胰腺癌中高表达
利用 GEIPA 数据库对 TCGA 和GTEx 数据分析发现,与正常组织相比,YOD1 在消化道肿瘤中普遍表达较高,其中在胰腺癌中显著高表达,且具有统计学意义(< 0.05)(图1A)。为进一步验证 YOD1 在胰腺癌组织中的表达情况,从 GEO 数据库中下载并分析了 6 个数据集:GSE62452、GSE28735、GSE16515、GSE15471、GSE62165 和 GSE71729。结果显示,与正常组织相比,YOD1 在胰腺癌组织中的表达水平均显著升高(图1B)。
2.2 YOD1 的生存期分析
通过 Kaplan-Meier (KM) plotter 分析了 178 例胰腺癌患者生存期情况,以探究 YOD1 与胰腺癌预后之间的关系。结果显示,YOD1 高表达降低了患者的总生存期(OS)(图2A)和无病生存期(RFS)(图2B)。对于 OS,YOD1 风险比(hazard ratio,HR)为 1.59(1.05 ~ 2.42),对于 RFS,HR = 1.52(1.03 ~ 2. 24),值均小于 0.05,提示 YOD1 与胰腺癌不良预后正相关。通过 pROC 包分析 TCGA 数据库胰腺癌数据集中 YOD1 的表达情况,并通过 ggplot2 包可视化生成 ROC 曲线,曲线下面积()为 0.953,95% CI 为0.931 ~ 0.975,提示 YOD1 有希望成为诊断胰腺癌发生的分子标志物。
进一步分析 YOD1 是否会影响胰腺癌的 TNM 分期[17],以评估 YOD1 是否促进胰腺癌发生远处、局部淋巴结转移或浸润到周围器官。通过基础 R 包分析临床基线资料表发现,YOD1 高表达主要影响了 T 分期(= 0.021),即高表达 YOD1 能够促进胰腺癌的发生发展(表1)。

图1 YOD1 在癌症中表达(A:TCGA 数据库中,YOD1 在消化道肿瘤及对应正常组织中的表达情况;B:GEO 数据库 6 个数据集中YOD1 在胰腺癌中的表达;T:肿瘤组织;N:正常组织;*P < 0.05)
Figure 1 Expression of YOD1 in cancer (A: Expression of YOD1 in gastrointestinal tumors and corresponding normal tissues in TCGA database; B: Expression of YOD1 in pancreatic adenocarcinoma in the six data sets of GEO database; T: Tumor; N: Normal;*< 0.05)
2.3 YOD1 高表达后差异基因及上游信号分子富集分析
对于 YOD1 在胰腺癌中的生物学功能,使用 linkedomics 在线网站对以YOD1 中位数分组后的差异基因进行功能注释,选取结果 q < 0.05,FDR < 0.25,GO 和 KEGG 的富集结果均用柱状图表示。GO 分析结果显示,在分子功能相关的富集分析中,胰腺癌差异基因主要富集在细胞黏附分子和网格蛋白的结合(图3A);在生物过程相关的分析中,差异基因主要富集在染色体分离和运动行为(图3B);在细胞成分相关的分析中,差异基因主要富集在 DNA 填充复合物、角质包膜、突触膜(图3C)。KEGG 分析结果显示,差异基因主要富集在类固醇激素生物合成、神经活性配体-受体相互作用、溶酶体通路、紧密结合等(图3D)。结合分析,我们推测 YOD1 对于胰腺癌迁移,可能存在一定的促进作用。
通过 miRWalk、TargetScan、miRDB、miRtarBase4 个网站预测可能调控YOD1 表达的 miRNA,对 q < 0.05 的数据取交集(图4A),最终得到 31 个负调节 YOD1 的 miRNA。对 31 个 miRNA 通过 R-project 语言进行 KEGG 富集分析发现,miRNAs 主要富集在癌症进展、p53 信号通路和胰腺癌进展等(图4B),进一步说明,靶向 YOD1 的 miRNA 可能具有诊断或治疗胰腺癌的作用。
2.4 YOD1 相互作用(PPI)网络分析
通过在线数据库 STRING 预测与 YOD1 具有相互作用的蛋白质(图5、表2)发现,YOD1 与过渡内质网 ATP 酶(VCP)、多泛素 C(UBC)、多泛素 B(UBB)等相互作用。据报道,VCP 参与蛋白质在内质网中的加工和降解[18];UBC 在腺癌[19]、脂肪肝[20]、胃肠道肿瘤[21]等多种疾病中发挥了重要作用;UBB 参与了宫颈癌的发生发展[22]。综上,可以预测 YOD1 可能通过与其他蛋白相互作用参与疾病的进程。阻断蛋白与 YOD1 的相互作用可能成为该疾病治疗的新思路。
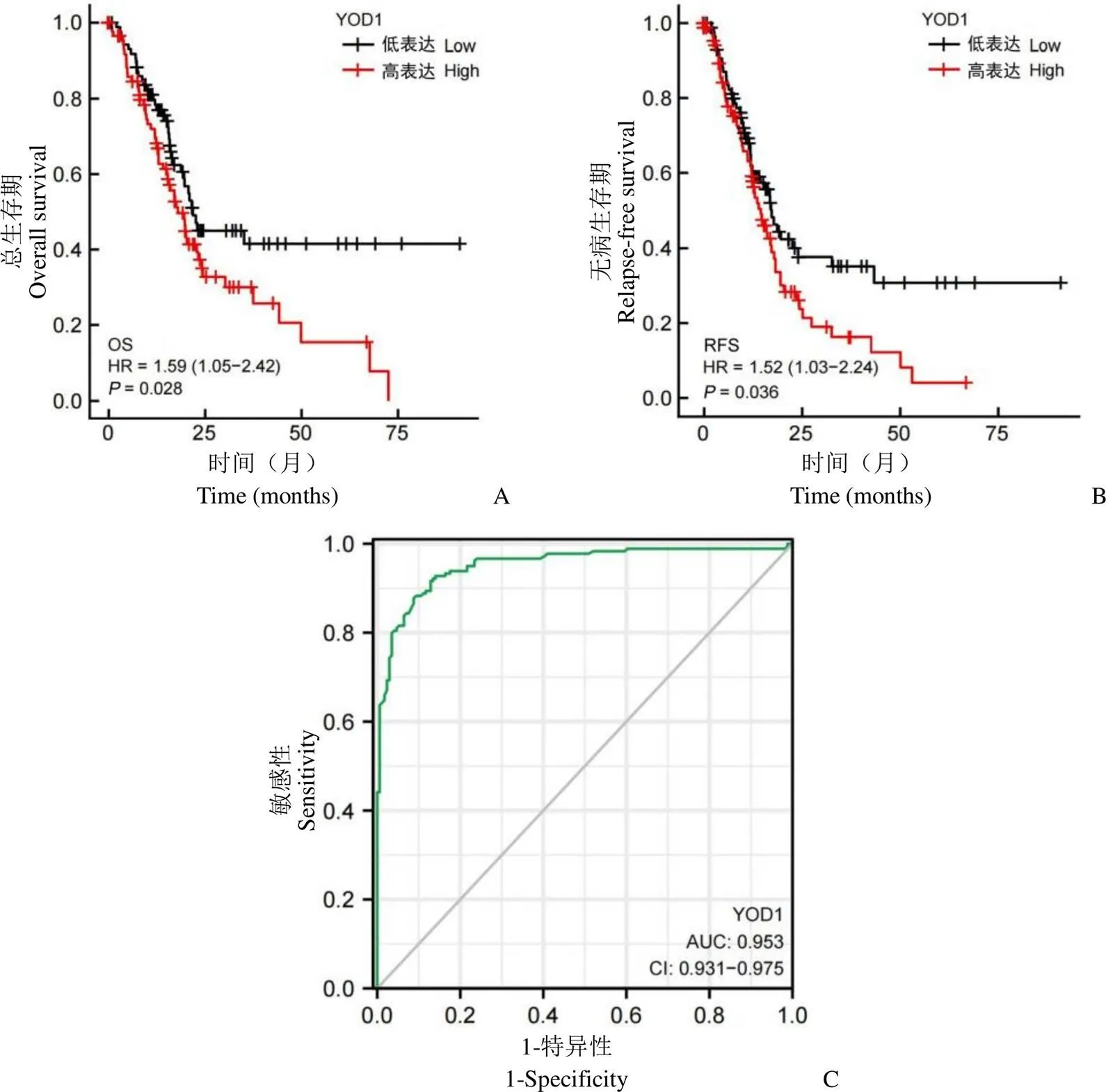
图2 YOD1 对胰腺癌的预后分析(A:YOD1 对患者总生存期的影响;B:YOD1 对患者无病生存期的影响;C:ROC 曲线判断 YOD1 对胰腺癌的诊断潜能)
Figure 2 Prognostic analysis of YOD1 in pancreatic adenocarcinoma (A: Effect of YOD1 on overall survival; B: Effect of YOD1 on relapse-free survival; C: ROC curve to judge the diagnostic potential of YOD1 for PAAD)
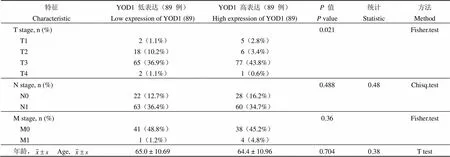
表1 YOD1 对肿瘤分期的影响
注:T:肿瘤组织;N:淋巴结;M:转移。
Notes: T: Tumor; N: Node; M: Metastasis.

图3 YOD1 在胰腺癌组织中的GO 和KEGG 富集分析(A:与分子功能相关的GO 富集分析;B:与生物过程相关的GO 富集分析;C:与细胞成分相关的 GO 富集分析;D:KEGG 通路富集分析)
Figure 3 Enrichment analysis of GO and KEGG differential genes of YOD1 in PAAD tissue (A: GO enrichment analysis related to molecular function; B: GO enrichment analysis related to biological processes; C: GO enrichment analysis related to cell components; D: KEGG pathway enrichment analysis)
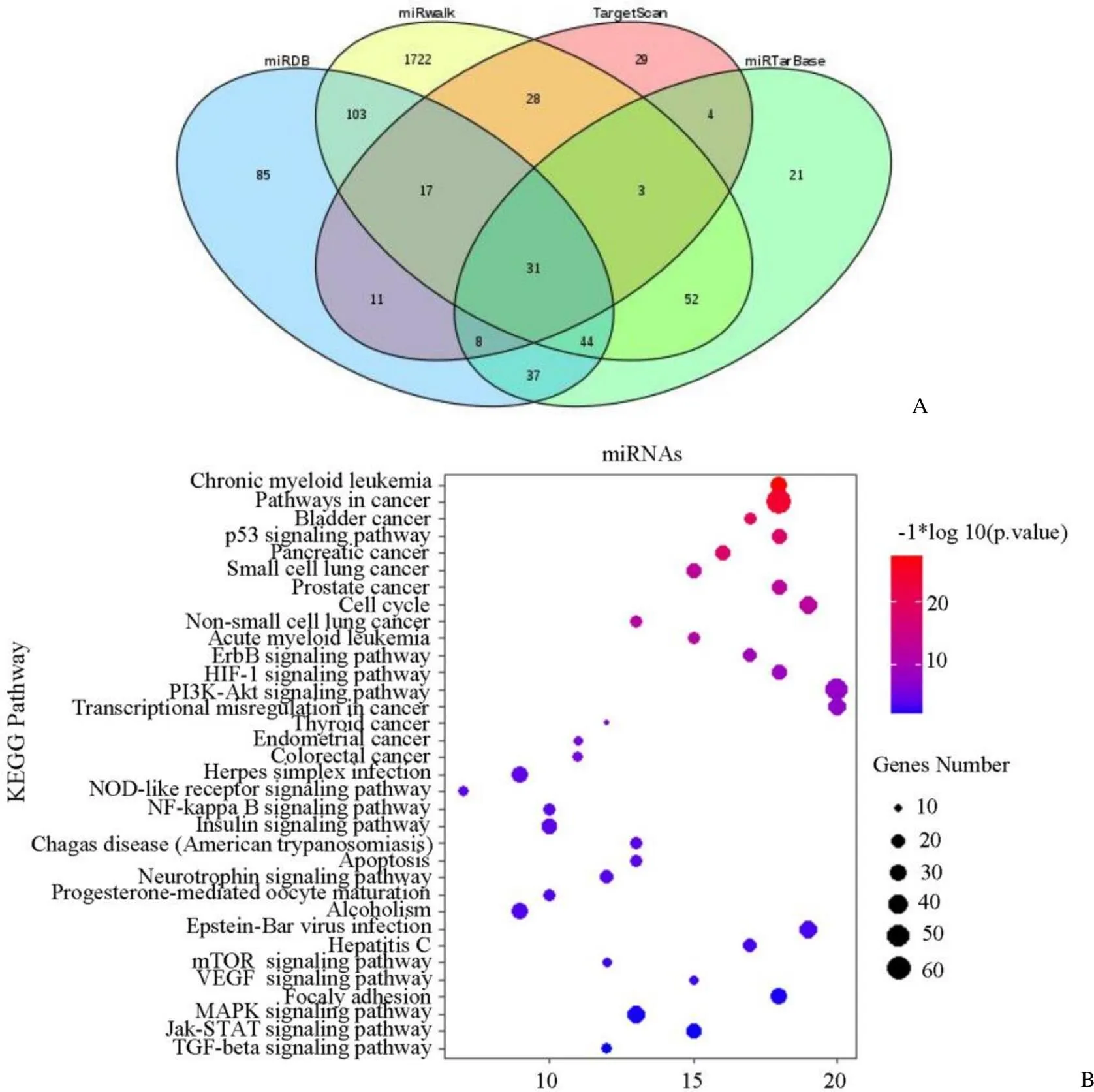
图4 胰腺癌中YOD1 上游 miRNA 分析(A:miRDB、miRWalk、TargetScan和miRTarBase 网站预测与 YOD1 相关miRNA 的韦恩图;B:韦恩图筛选出 31 种miRNA 的 KEGG 通路富集分析)
Figure 4 Upstream miRNA analysis of YOD1 in pancreatic adenocarcinoma (A: Veen maps of YOD1-associated miRNAs predicted by miRDB, miRWalk, TargetScan and miRTarBase; B: KEGG pathway enrichment analysis of 31 miRNAs which were screened out by Venn diagram)
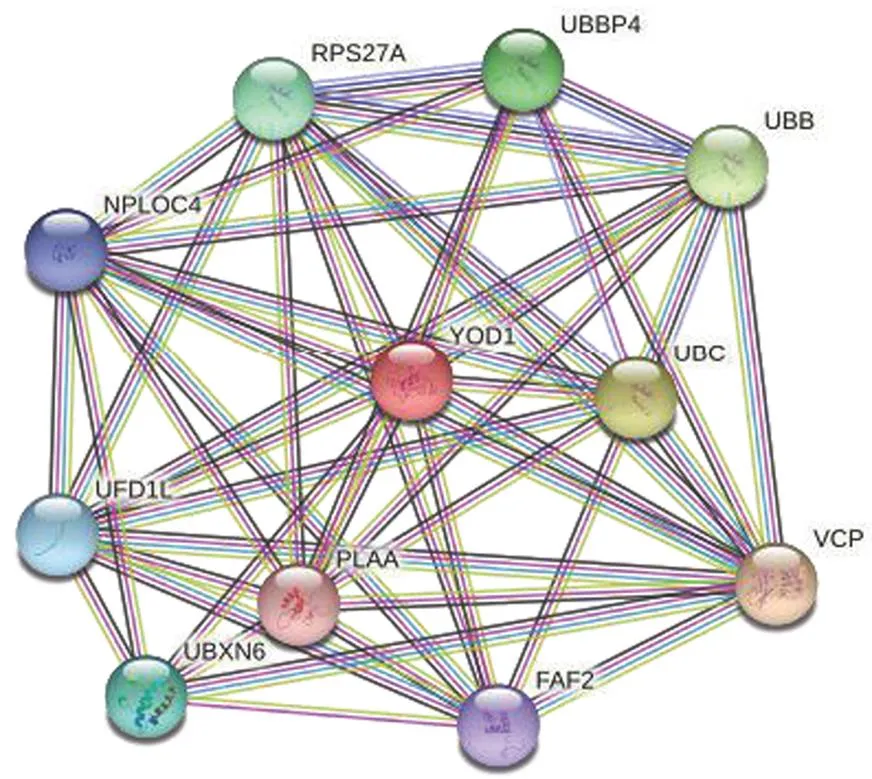
图5 YOD1 基因的 PPI 网络分析(已知相互作用:蓝色和紫色线条;预测相互作用:绿色、深蓝色和红色线条;其他:浅绿色、黑色和浅蓝色线条)
Figure 5 PPI network analysis of YOD1 gene (Known interactions: Blue and purple lines; Predicted interactions: Green, dark blue and red lines; Others: Light green, black and light blue lines)

表2 与 YOD1 具有相互作用的蛋白评价
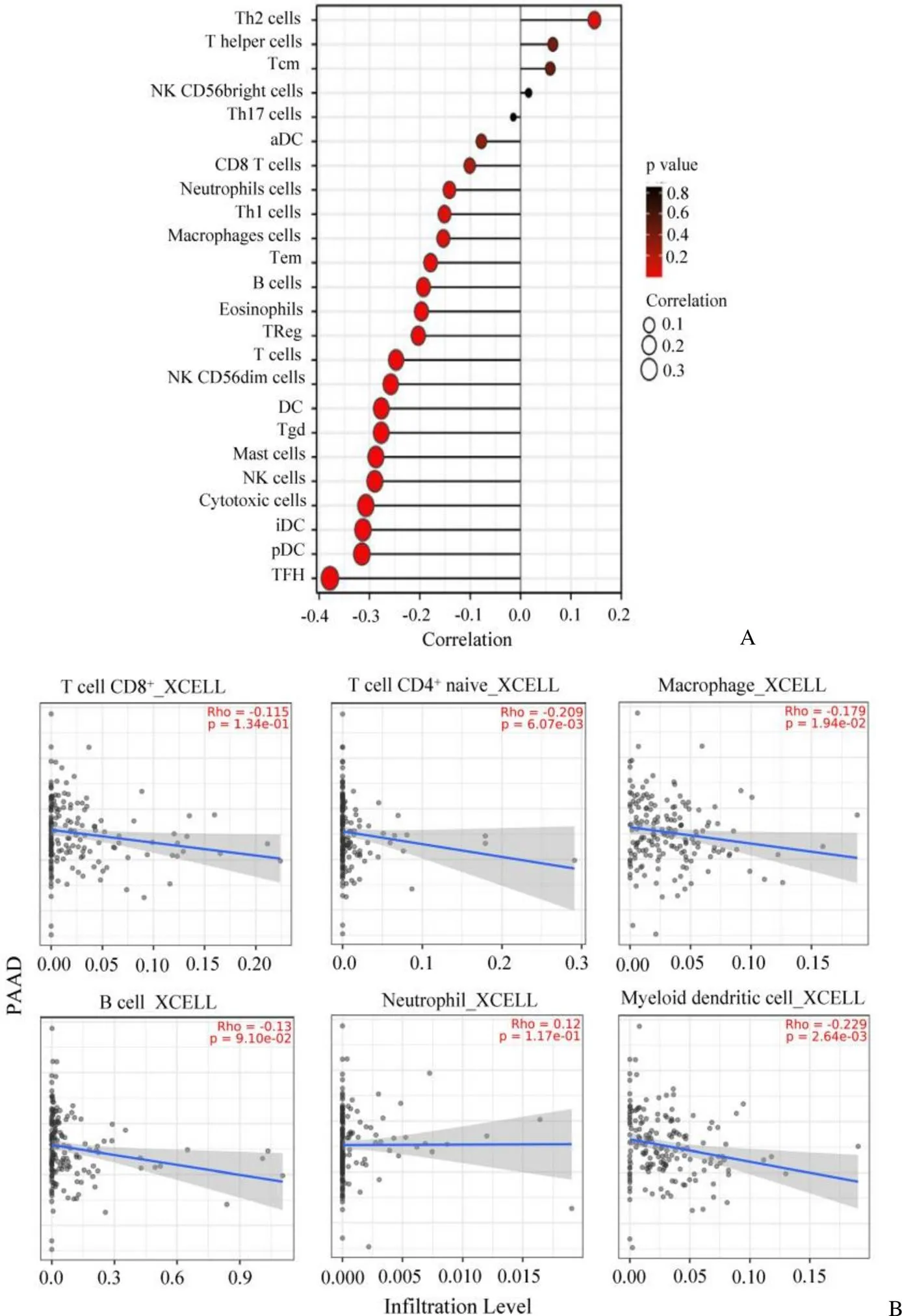
图6 YOD1 与胰腺癌组织中免疫细胞浸润情况的相关性(A:ssGSEA 免疫浸润分析;B:TIMER2.0 预测免疫细胞浸润情况)
Figure 6 Correlation between YOD1 and immune cells infiltration in pancreatic adenocarcinoma (A: Analysis of immunoinfiltration by ssGSEA; B: TIMER2.0 predicted the infiltration of immune cells)
2.5 YOD1 在免疫微环境中的作用
为了探索 YOD1 与胰腺癌免疫微环境的关系,使用ssGSEA 分析,评估了 24 种免疫细胞与 YOD1 的关系。分析发现 YOD1 与 Th2 细胞在肿瘤微环境中的浸润中成正相关(< 0.05),与细胞毒性细胞、肥大细胞、滤泡辅助性 T 细胞(TFH)细胞呈现显著负相关(< 0.001、Pearson < –0.3)(图6A)。进一步通过 TIMER2.0 数据库进行预测,发现 YOD1 与巨噬细胞、CD4+T 和树突细胞呈现负相关(< 0.05)(图6B),提示 YOD1 可能参与免疫应答,影响免疫细胞的浸润。
2.6 YOD1 的功能验证
对比了正常胰腺细胞 HPDE6-C7 和 6 种胰腺癌细胞系中 YOD1 的表达水平,发现 YOD1 在6 种胰腺癌细胞系中均过表达(图7A)。随后分别在 MIA-PaCa-2 和 AsPC-1 中成功高表达和下敲了 YOD1(图7B)。通过 transwell(图7C)实验我们发现,使用 siRNA 敲低 YOD1 后,AsPC-1 细胞的迁移能力降低,在 MIA-PaCa-2 细胞中高表达 YOD1 后,细胞的迁移能力增加。EdU是一种胸苷类似物,在 DNA 复制中取代胸腺嘧啶,与特定的染料反应后,用于反映细胞的增殖水平,如图7D 所示,敲低 YOD1,降低了 AsPC-1 细胞的增殖水平,高表达 YOD1,促进了 MIA-PaCa-2 细胞的增殖。将瞬时转染 pCMV6 和 YOD1 后的细胞上清转移到 RAW264.7 细胞中,结果发现过表达 YOD1 后的细胞上清抑制小鼠巨噬细胞的增殖(图7E)。
胰腺癌微环境中,肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)更倾向于向 M2 型转化,促进胰腺癌恶性病变。而调控 M2 型向 M1 型极化,可明显抑制胰腺癌的进展[23]。LPS 和 IFN-γ 细胞因子可诱导巨噬细胞转化为 M1 型,结果显示过表达 YOD1 细胞株的上清能够逆转巨噬细胞向 M1 型的极化并促进向 M2 型极化(图7F)。提示 YOD1 可能通过调控巨噬细胞的增殖与极化来影响胰腺癌的病程。
综上所述,实验结果与生物信息学分析结果提示,YOD1 可能通过促进胰腺癌的增殖与转移,抑制肿瘤微环境,最终促进胰腺癌的发生发展。
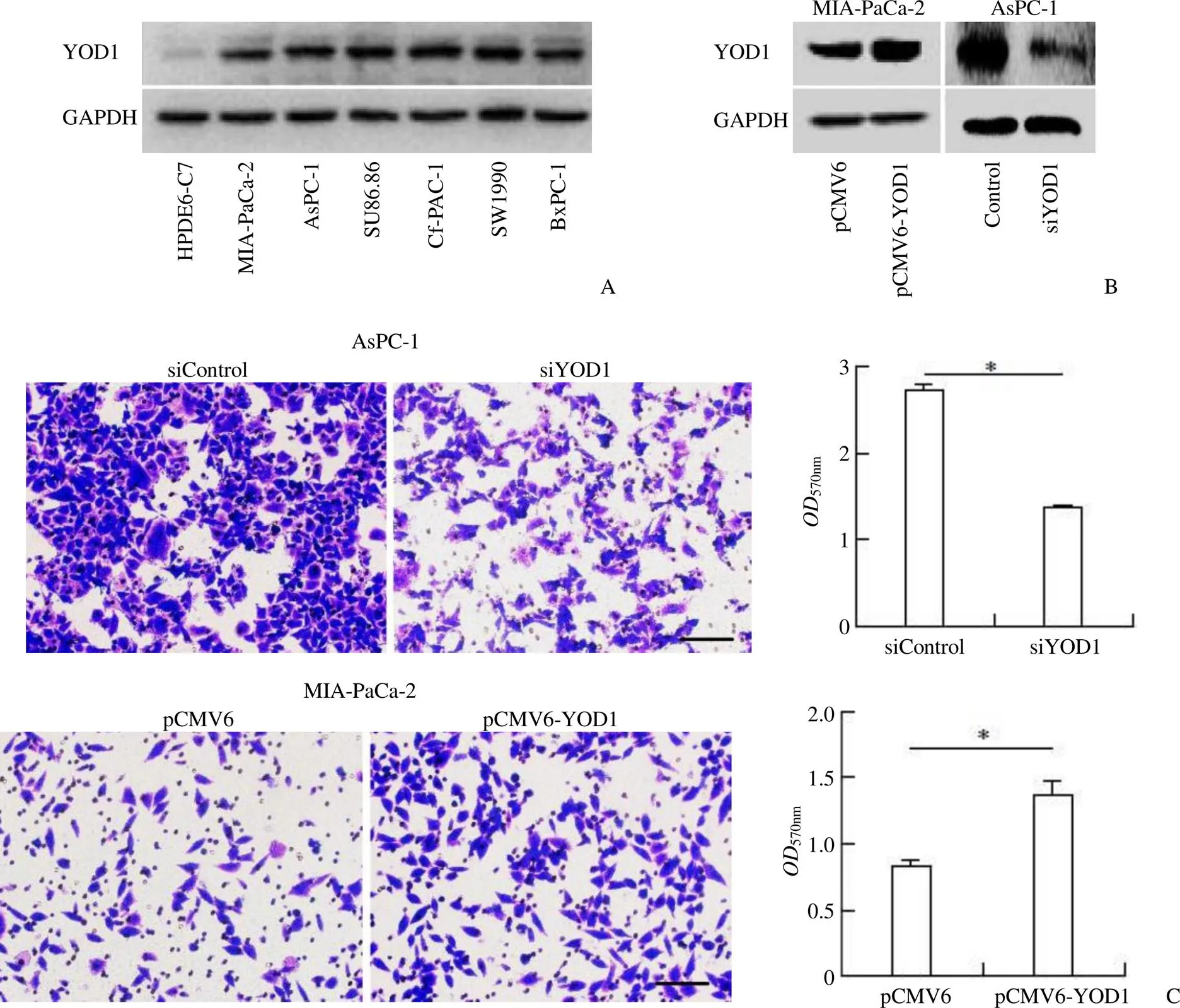
Figure 7 YOD1 promotes metastasis and proliferation of pancreatic adenocarcinoma and regulates the proliferation and polarization of macrophages (A: Expression of YOD1 in normal pancreatic cells HPDE6-C7 and six pancreatic adenocarcinoma cell lines; B: Western blot was used to verify the knockdown and over expression of YOD1 in AsPC-1 and MIA-PaCa-2 cells; C: Transwell experiment verified the effect of YOD1 on AsPC-1 and MIA-PaCa-2 cell migration, Scale bar = 100 μm; D: EdU experiment verified the effect of YOD1 on AsPC-1 and MIA-PaCa-2 cell proliferation, Scale bar = 50 μm; E: MTT experiment verified the effect of YOD1 on macrophage proliferation; F: Western blot experiment tested the effect of YOD1 on macrophage polarization;*< 0.05,**< 0.01,***< 0.001)
3 讨论
近年来,胰腺癌的死亡率逐年上升,致死率在所有癌症中位居第四。在早期,胰腺癌不易被发现,具有侵袭性和转移性强的特征。由于大部分患者发现时已是晚期,所以 5 年生存率很低。临床上主要治疗方案是手术、化疗、靶向治疗和免疫疗法。但胰腺癌患者常出现癌症的远端转移,其一线用药吉西他滨等化疗药物也存在严重的副作用,因此手术和化疗手段具有较高的局限性。近年来,越来越多的研究聚焦于胰腺癌的靶向治疗,但存在问题众多以致不能应用到临床治疗中。如针对 PI3K/Akt 通路开发了 idelalisib 和 buparlisib 两种 PI3K 抑制剂,但由于在 I 期临床试验中存在严重的毒性而被终止[24];针对酪氨酸激酶受体或 MAP 激酶的靶向疗法,由于胰腺癌患者基因组的异质性和耐药问题导致疗效很差[25];90% 的胰腺癌患者具有 KRAS位点突变,但由于 KRAS 与其活性位点 GTP 具有极高的亲和力,无法设计竞争性抑制剂[26],所以胰腺癌相关基因突变的药物开发停滞不前[27]。对于新靶点及新预后标志物的研究可能是提高癌症生存率的重要突破口,改善患者的预后,为患者提供更加精准和全面的治疗方案。
本研究通过多种数据库分析了卵巢肿瘤蛋白酶亚型 YOD1 在胰腺癌中作用。在 TCGA 数据库和 GEO 数据库的胰腺癌数据集中,比对了 YOD1 的差异表达,发现 YOD1 在胰腺癌中高表达,且 KM plotter 分析得出 YOD1 与患者的不良预后正相关,通过 ROC 模型也进一步验证 YOD1 对胰腺癌的诊断价值。通过 GO 和KEGG 富集分析,发现 YOD1 调控黏附分子表达和紧密连接等进程,而上述过程是促肿瘤转移和侵袭的关键[28]。miRNA是一类高度保守的组织特异性非蛋白编码 RNA[29],一般通过负调控靶基因影响细胞的功能和疾病的表型[30],其水平的变化可以作为诊断的标志之一[31]。近年来,紫杉醇已成为癌症化疗的首选用药,但其耐药性通常会降低后期治疗效果。Lin 等[32]发现通过lncRNA DBH-AS1 调节下游miR-21 进而调控YOD1 的表达,可有效改善紫杉醇化疗耐药的问题。此外,也有许多研究表明,上游miRNAs 对YOD1 的调控对于骨肉瘤、卵巢癌等癌症的发生发展起重要作用[12, 33]。随后,通过4 个数据库富集筛选了 31 个与 YOD1 有关的 miRNAs 进行 KEGG 富集分析,发现主要富集在癌症进展、p53 信号通路和胰腺癌进展等,因此,通过miRNAs 来调控YOD1 的表达有望成为胰腺癌的新治疗策略。免疫抑制型肿瘤微环境促进肿瘤转移,从而不利于预后[34]。Sehrawat 等[35]提出,抗原提呈细胞(antigen presenting cells,APCs)YOD1 失活表达会促进APCs 更有效的抗原呈递,从而促进CD8+T 细胞的激活。据文献报道,M2 型巨噬细胞可借助细胞外囊泡通过miR-21-5p/YOD1/YAP/β-catenin 轴影响肝细胞癌中CD8+T 细胞的衰竭,进而调控肝癌的进展[36]。然而现有研究主要集中于YOD1 对APCs 的抗原交叉呈递的影响,缺乏YOD1 对免疫细胞的调控研究。ssGSEA 分析 YOD1 与免疫细胞浸润的关系,结果显示,YOD1 与 TFH 在 TME 中的浸润呈负相关,与 Th2 型细胞的浸润呈正相关。采用 TIMER2.0 的 Xcell 算法进行分析,发现 YOD1 与巨噬细胞、CD4+T 和树突细胞呈负相关(< 0.05)。以上提示我们,YOD1 可能能够作为胰腺癌潜在的分子诊断靶点,可通过靶向上游 miRNA 间接影响 YOD1 或通过 YOD1 影响胰腺癌免疫微环境进而具有治疗作用。我们的分析结果则对YOD1 影响胰腺癌免疫微环境的深入研究提供了一定的理论依据。该结论拓宽了治疗策略,也为多靶点治疗提供了新的思路。
在 YOD1 的功能验证中,我们首先通过 Western blot 验证了 YOD1 在 6种胰腺癌细胞系中的表达均高于正常胰腺细胞,随后使用 transwell和 EdU 实验证明了 YOD1 影响胰腺癌细胞的增殖与转移。同时发现,YOD1 能够调控巨噬细胞的增殖与极化。体外实验初步证实 YOD1 的促癌作用。
综上所述,YOD1 可能影响胰腺癌免疫微环境,促进胰腺癌发生、发展及转移,影响其预后,是胰腺癌潜在的分子标志物。本研究为胰腺癌治疗以及预后诊断试剂开发提供新的研究思路,也为 YOD 在胰腺癌中的功能研究提供了一定的理论依据。
[1] Wang H, Lu L, Liang X, et al. Identification of prognostic genes in the pancreatic adenocarcinoma immune microenvironment by integrated bioinformatics analysis. Cancer Immunol Immunother, 2022, 71(7): 1757-1769.
[2] Chi H, Peng G, Wang R, et al. Cuprotosis programmed-cell-death-related lncRNA signature predicts prognosis and immune landscape in PAAD patients. Cells, 2022, 11(21):3436.
[3]Rahib L, Smith BD, Aizenberg R, et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Res, 2014, 74(11):2913- 2921.
[4] Rodríguez Gil Y, Jiménez Sánchez P, Muñoz Velasco R, et al. Molecular alterations in pancreatic cancer: transfer to the clinic. Int J Mol Sci, 2021, 22(4):2077.
[5] Tang X, Sui X, Weng L, et al. SNAIL1: Linking tumor metastasis to immune evasion. Front Immunol, 2021, 12:724200.
[6] Vlachostergios PJ, Voutsadakis IA, Papandreou CN. The shaping of invasive glioma phenotype by the ubiquitin-proteasome system. Cell Commun Adhes, 2013, 20(5):87-92.
[7] Rahimi N. The ubiquitin-proteasome system meets angiogenesis. Mol Cancer Ther, 2012, 11(3):538-548.
[8] Sahtoe DD, Sixma TK. Layers of DUB regulation. Trends Biochem Sci, 2015, 40(8):456-467.
[9] Mevissen TE, Hospenthal MK, Geurink PP, et al. OTU deubiquitinases reveal mechanisms of linkage specificity and enable ubiquitin chain restriction analysis. Cell, 2013, 154(1):169-184.
[10] Kim Y, Kim W, Song Y, et al. Deubiquitinase YOD1 potentiates YAP/TAZ activities through enhancing ITCH stability. Proc Natl Acad Sci U S A, 2017, 114(18):4691-4696.
[11] Bartel DP. MicroRNAs: target recognition and regulatory functions. Cell, 2009, 136(2):215-233.
[12] Zhu YM, Chen P, Shi L, et al. MiR-4429 suppresses the malignant development of ovarian cancer by targeting YOD1. Eur Rev Med Pharmacol Sci, 2020, 24(17):8722-8730.
[13] Tang Z, Li C, Kang B, et al. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses. Nucleic Acids Res, 2017, 45(W1):W98-W102.
[14] Vasaikar SV, Straub P, Wang J, et al. LinkedOmics: analyzing multi-omics data within and across 32 cancer types. Nucleic Acids Res, 2018, 46(D1):D956-D963.
[15] Bindea G, Mlecnik B, Tosolini M, et al. Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer. Immunity, 2013, 39(4):782-795.
[16] Li T, Fu J, Zeng Z, et al. TIMER2.0 for analysis of tumor-infiltrating immune cells. Nucleic Acids Res, 2020, 48(W1):W509-W514.
[17] Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol, 2010, 17(6):1471-1474.
[18] Fang C, Zhang X, Zhang L, et al. Identification of palmitoylated transitional endoplasmic reticulum atpase by proteomic technique and pan antipalmitoylation antibody. J Proteome Res, 2016, 15(3):956- 962.
[19] Li W, Huang Y, Sargsyan D, et al. Epigenetic alterations in TRAMP mice: epigenome DNA methylation profiling using MeDIP-seq. Cell Biosci, 2018, 8:3.
[20] Li L, Liu H, Hu X, et al. Identification of key genes in non‑alcoholic fatty liver disease progression based on bioinformatics analysis. Mol Med Rep, 2018, 17(6):7708-7720.
[21] Kim KH, Yeo SG, Yoo BC, et al. Identification of calgranulin B interacting proteins and network analysis in gastrointestinal cancer cells. PLoS One, 2017, 12(2):e0171232.
[22] Tian Y, Ding W, Wang Y, et al. Ubiquitin B in cervical cancer: critical for the maintenance of cancer stem-like cell characters. PLoS One, 2013, 8(12):e84457.
[23] Yang S, Liu Q, Liao Q. Tumor-associated macrophages in pancreatic ductal adenocarcinoma: Origin, polarization, function, and reprogramming. Front Cell Dev Biol, 2021, 8:607209.
[24] Borazanci E, Pishvaian MJ, Nemunaitis J, et al. A phase Ib study of single-agent idelalisib followed by idelalisib in combination with chemotherapy in patients with metastatic pancreatic ductal adenocarcinoma. Oncologist, 2020, 25(11):e1604-e1613.
[25] Rémond MS, Pellat A, Brezault C, et al. Are targeted therapies or immunotherapies effective in metastatic pancreatic adenocarcinoma? ESMO Open, 2022, 7(6):100638.
[26] Ostrem JM, Peters U, Sos ML, et al. K-Ras(G12C) inhibitors allosterically control GTP affinity and effector interactions. Nature, 2013, 503(7477):548-551.
[27] Ariyama J. Detection and prognosis of small pancreatic ductal adenocarcinoma. Nihon Geka Gakkai Zasshi, 1997, 98(7):592-596.
[28] Nallanthighal S, Heiserman JP, Cheon DJ. The role of the extracellular matrix in cancer stemness. Front Cell Dev Biol, 2019, 7:86-100.
[29] Krol J, Loedige I, Filipowicz W. The widespread regulation of microRNA biogenesis, function and decay. Nat Rev Genet, 2010, 11(9):597-610.
[30] Mollaei H, Safaralizadeh R, Rostami Z. MicroRNA replacement therapy in cancer. J Cell Physiol, 2019, 234(8):12369-12384.
[31] Mirzaei H, Momeni F, Saadatpour L, et al. MicroRNA: Relevance to stroke diagnosis, prognosis, and therapy. J Cell Physiol, 2018, 233(2): 856-865.
[32] Lin ZX, Zhu LH, Huang JY, et al. Paclitaxel-resistant related lncRNA DBH-AS1 promotes the proliferation and invasion of esophageal cancer. Eur Rev Med Pharmacol Sci, 2022, 26(23):8903-8913.
[33] Yan R, Jin S, Liu H, et al. Dexmedetomidine inhibits cell malignancy in osteosarcoma cells via miR-520a-3p-YOD1 interactome. Biochem Biophys Res Commun, 2021, 543:56-64.
[34] Bear AS, Vonderheide RH, O'hara MH. Challenges and opportunities for pancreatic cancer immunotherapy. Cancer cell, 2020, 38(6):788-802.
[35] Sehrawat S, Koenig PA, Kirak O, et al. A catalytically inactive mutant of the deubiquitylase YOD-1 enhances antigen cross-presentation. Blood, 2013, 121(7):1145-1156.
[36] Pu J, Xu Z, Nian J, et al. M2 macrophage-derived extracellular vesicles facilitate CD8+T cell exhaustion in hepatocellular carcinoma via the miR-21-5p/YOD1/YAP/β-catenin pathway. Cell Death Discov, 2021, 7(1):182.
Bioinformatics analysis for the role of YOD1 gene in pancreatic adenocarcinoma
XI Xiao-ming, ZHAO Wen-xia, LI Yang, ZHANG Zhi-shuo, SHAO Rong-guang
Author Affiliations:Department of Oncology, Institute of Medicinal Biotechnology, Peking Union Medical College and Chinese Academy of Medical Sciences, Beijing 100050, China (XI Xiao-ming, ZHAO Wen-xia, LI Yang, SHAO Rong-guang); Department of Emergency, Xinhua Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200092, China (ZHANG Zhi-shuo)
The potential of YOD1 as a prognostic marker of pancreatic adenocarcinoma and its effects on tumor immunity were analyzed by RNAseq of pancreatic adenocarcinoma in the TCGA database to provide the clinical basis for the diagnosis and prognosis of pancreatic adenocarcinoma.RNA data set was available from TCGA data. R survminer package was used for data visualization and survival package was used to analyze the effects of YOD1 on the survival of pancreatic adenocarcinoma. For RNAseq data in TPM format of TCGA and GTEx, ggplot2 package was used to visualize the data and pROC package was utilized to analyze the data and draw the ROC curve. GO and KEGG analyses of differential genes were performed by linkedomics. miRNAs which may regulate the expression of YOD1 were analysed by miRWalk, TargetScan, miRDB and miRtarBase. To explore the effect of YOD1 on immune microenvironment, GSVA package in R-project was used to visualize the data, the effect of YOD1 on immune cells was analyzed by the immunoinfiltration algorithm ssGSEA (built-in algorithm in GSVA package), and the effect of YOD1 on immune cell infiltration was analyzed by TIMER2.0 online database. Finally, the effect of YOD1 on the migration and proliferation of pancreatic adenocarcinoma cells were verified through EdU and transwell experiments, the effect of YOD1 on the proliferation of macrophages was verified through MTT experiments, and the effect of YOD1 on the polarization of macrophages was verified through Western blot experiment.The differential analysis showed that YOD1 was highly expressed in pancreatic adenocarcinoma. High expression of YOD1 predicted significantly poorer overall survival (= 0.028, HR = 1.59) and relapse-free survival (= 0.036, HR = 1.52) for patients. ROC curve demonstrated the potential of YOD1 as a diagnostic marker for pancreatic adenocarcinoma (= 0.953, 95%CI = 0.931 - 0.975). According to the prediction of different websites, there were 31 kinds of miRNAs that negatively regulated the expression of YOD1. KEGG enrichment analysis showed that the above 31 miRNAs were mainly enriched in influencing cancer progression, p53 signaling pathway and pancreatic adenocarcinoma progression. PPI network analysis predicted that YOD1 mainly exhibited protein-protein interaction with VCP, UBC, UBB, UBP4, RPS27A, UBXN6, UFD1L, NPLOC4, FAF2, PLAA. Immune-related analysis showed that the expression of YOD1 in PAAD tissue was positively correlated with Th2 immune cell infiltration (< 0.05), and negatively correlated with TFH cell infiltration (< 0.05). Thenexperiment verified that YOD1 promoted the migration and proliferation of pancreatic adenocarcinoma cells, inhibited the proliferation of macrophages and reversed the polarization of macrophages from M2 to M1.As a deubiquitinase, YOD1 may promote the occurrence and development of pancreatic adenocarcinoma by affect the tumor microenvironment to influence the prognosis of patients with pancreatic adenocarcinoma. YOD1 shows the potential to be a molecular marker for the prognosis of pancreatic adenocarcinoma.
pancreatic adenocarcinoma; YOD1; bioinformatics; tumor molecular markers
SHAO Rong-guang, Email: shaor@imb.pumc.edu.cn
10.3969/j.issn.1673-713X.2023.05.003
“重大新药创制”国家科技重大专项(2014ZX09201042);中国医学科学院医学与健康科技创新工程(2021-I2M-1-030)
邵荣光,Email:shaor@imb.pumc.edu.cn
2023-05-04
*同为第一作者

