污泥燃烧中H2O、SO2 和CO2 对PbO 在CaO 表面吸附的影响
史一林,何学富,王彦霖,乔晓磊,贾 里,金 燕
(太原理工大学 电气与动力工程学院,山西 太原 030024)
随着中国城市化进程的加快和人民生活水平的提高,污水排放量不断增加。污泥作为污水处理过程中的副产品,其产量也迅速增加。据统计,2019 年中国污泥产量已超过6000 万吨(以含水率80%计),预计2025 年中国污泥年产量将突破9000 万吨[1]。污泥成分复杂、不稳定、易腐化、有恶臭,并且含有大量的病原微生物(病原菌、寄生虫等)、难降解有机物(苯系物、多环芳烃、二噁英等)以及重金属(Cu、Pb、Zn、Cd、Cr、Ni、As...)等有毒有害物质。因此,需要对污泥进行合理安全的处置[2]。在众多的处理方法中,焚烧法是最普遍且最彻底的污泥处理方法之一。
污泥在燃烧过程中,重金属不会生成和破坏,只会发生迁移和转化。Pb 作为半挥发性重金属,毒性大,具有生物富集特性,在燃烧过程中主要转化为气态PbO,易对环境造成二次污染和危害人体健康[3-6]。同时,污泥作为一种高灰燃料,燃烧后的灰分中含有多种矿物质(如CaO)。在实际燃烧过程中,污泥中的矿物质会与重金属发生反应,转化为更大、更容易捕获的颗粒。Wang 等[7]研究表明,CaO 可与PbO 反应生成难挥发性物质(如Ca2PbO4)。刘忠等[8]和孙晓等[9]研究指出,CaO 对重金属Pb 的富集有积极的促进作用。郭帅等[10]研究发现,污泥中高含量的CaO 会与As 结合形成难挥发的Ca3(AsO4)2。此外,灰分中的矿物质除了对重金属产生影响外,还会和燃烧过程中生成的烟气组分发生相互作用。Han 等[11]研究发现,CaO 可以在污泥焚烧过程中固定SO2。Folgueras等[12]的研究表明,污泥中的CaO 可与SO2反应生成CaSO4,从而降低SO2的排放。由此可见,烟气组分可能与重金属存在着竞争吸附关系,烟气组分的存在会对矿物质捕获重金属产生一定的影响。程运等[13]研究发现,水蒸气对高岭土吸附PbO 有抑制作用。温武斌等[14]研究发现,高温下烟气中存在O2、SO2和少量 H2O 时会促进凹凸棒石类吸附剂吸附PbCl2气体。Chen 等[15]研究发现,不同的温度下,SO2对氧化钙捕获As 的影响也有所不同。在较低的温度下(特别是在1023 K),SO2的存在抑制了As 的捕获。然而,所形成的硫酸钙在高温下能够吸收As2O3(g),在一定程度上刺激了As 的捕获。Yu 等[16]研究发现,CO2和SO2抑制CaO 吸附As,且在700 ℃时SO2抑制强度大于CO2。一般污泥经机械脱水后其含水率约为80%,因此,污泥在实际燃烧过程中烟气中将存在一定浓度的水蒸气,水蒸气对焚烧过程中重金属的挥发会产生一定的影响。同时烟气中存在许多酸性气体,如SO2和CO2,它们很容易与CaO 等矿物质发生反应,从而抑制了重金属的吸附。因此,研究H2O、SO2和CO2对矿物质脱除重金属很有必要。
目前,有关污泥燃烧过程中烟气组分对矿物质与重金属相互作用的研究主要基于实验系统,具有一定的局限性,分子层面的微观机理尚未明确;其次,烟气组分条件下,CaO 与PbO 相互作用的机理更是鲜有研究报道。近年来,量子化学计算被引入燃烧领域[17]。密度泛函分析作为一种有效的模拟方法,通过计算吸附能、电荷转移和态密度等参数可以揭示燃烧过程中发生反应的微观机理[18-20]。基于此,本工作利用密度泛函理论,研究PbO 分子和H2O/SO2/CO2分子单独吸附在CaO(001)表面的吸附构型作为参考。通过对比PbO 分子在洁净CaO(001)表面和在预吸附有H2O/SO2/CO2分子的CaO(001)表面的稳定吸附构型,研究H2O、SO2和CO2对CaO 与Pb 相互作用的影响,揭示烟气组分对CaO 与Pb 相互作用的影响。
1 计算方法和模型
本工作基于密度泛函理论,利用Materials Studio 软件中的CASTEP(Cambridge Serial Total Energy Package)模块进行研究[21,22]。交换相关泛函使用广义梯度函数GGA[23](Generalized Gradient Approximation)中的PBE[24](Perdew Burke Ernzerhof)方法,电子波函数用平面波基组展开,借助超软赝势描述电子与离子的相互作用,优化算法选取BFGS(Broyden Flechter Goldfarb Shanno)对模型进行几何结构优化。考虑到计算的效率和精度,截断能(Cut off Energy)设置为450eV,k 点布里渊区为3×3×1。结构和能量收敛标准如表1 所示。
CaO 晶体空间群为FM-3M,为了方便描述,CaO 表面的O 原子用Osurf原子表示。利用上述优化参数对CaO 晶体和各分子进行几何优化,优化后的键长和键角如表2 所示。
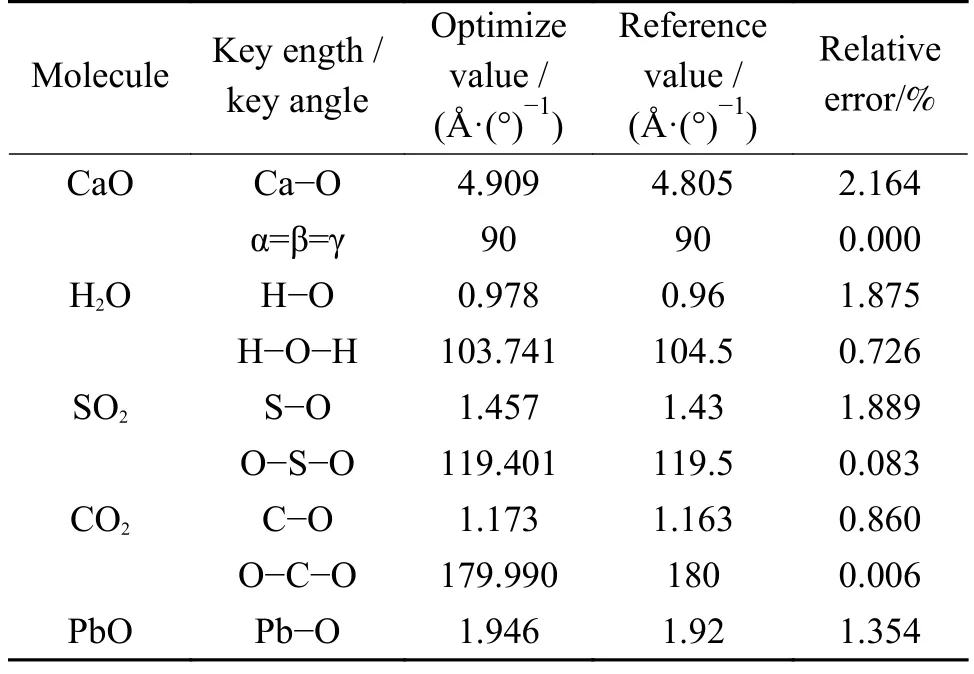
表2 各分子优化后的键长和键角Table 2 Optimized bond length and bond angle for each molecule
CaO 晶体与实验值相比,相对误差为2.164%;各优化值与参考值[25]相比,相对误差均小于2%,表明几何优化结果是可靠的。
对某污水处理厂获得的污泥进行烘干后进行XRD 表征分析,发现CaO 主要暴露的面为(001)晶面。Fan 等[26,27]也研究发现,(001)晶面是CaO在自然状态下暴露最多且较为常见的晶面,同时该晶面的稳定性最好,因此,选择(001)晶面作为吸附基底。
为了方便吸附分子的吸附和消除相邻周期性结构对计算结果的影响,选择(2×2)的CaO(001)表面,并在晶面上方加12 Å的真空层使不同原子层之间不存在实际相互作用。为了减少计算量,提高计算效率,在计算过程中选择原子层面为四层,只有表面的两层原子驰豫,余下两层原子固定。在计算优化过程中考虑了CaO(001)表面的四种吸附位点,分别是O 顶位、Ca 顶位、Ca-O 桥位和表面空位。CaO(001)周期性板块模型的正视图和俯视图分别如图1(a)和(b)所示。
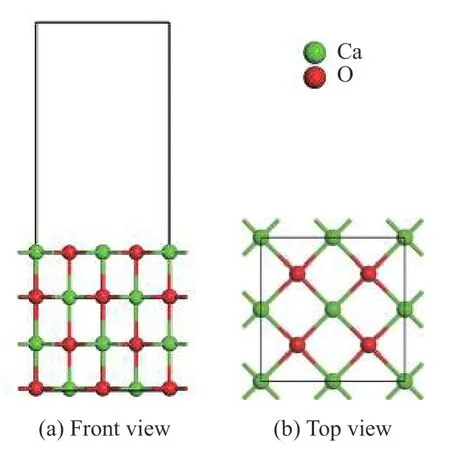
图1 CaO(001)周期性板块模型Figure 1 CaO (001) periodic plate model
吸附能[28,29]定义为:
式中,Eads—吸附能,kJ/mol;Efinalsystem—吸附后体系的总能量,kJ/mol;Eslab—吸附前表面基底的能量,kJ/mol;Eadsorbate—被吸附物质的能量,kJ/mol。
当Eads>0 时,说明反应不能自发进行。当Eads<0时,说明反应可以自发进行,且数值越大表示吸附作用越强。一般吸附能在(-30)-(-10)kJ/mol时,认为发生了物理吸附,吸附能在(-960)-(-50)kJ/mol 时,认为发生了化学吸附。
2 结果与讨论
2.1 单分子组分在CaO(001)表面上的吸附
2.1.1 PbO 在CaO(001)表面的吸附
考虑单个PbO 分子在CaO(001)表面吸附位点上多种初始吸附结构,分子与表面的初始距离均为3 Å。图2 所示为四种典型的初始吸附结构优化前后主视图和俯视图。

图2 PbO 在CaO(001)表面优化前后的吸附结构示意图Figure 2 Adsorption structure of PbO before and after optimization on CaO(001) surface
表3 所示为PbO 分子在CaO(001)表面优化后吸附结构的参数。
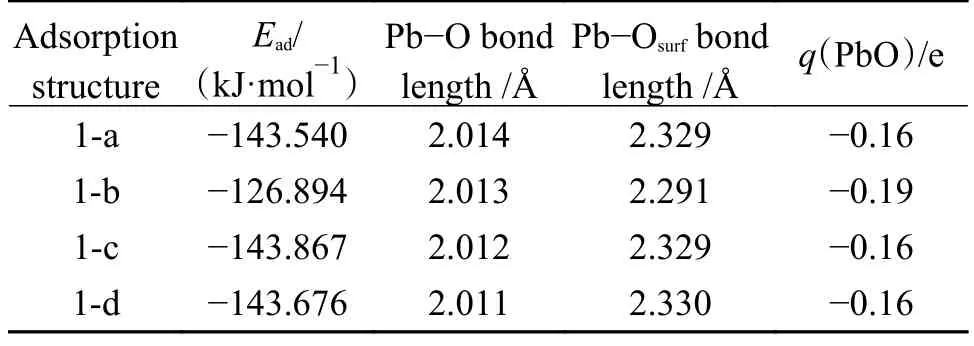
表3 PbO 在CaO 表面吸附的参数Table 3 Parameters of PbO after adsorption on CaO surface
由表3 可知,四种吸附过程均为化学吸附,PbO 分子的Pb-O 键均变长,键长在2.012 Å左右。对于结构1-c,吸附能最大为-143.867 kJ/mol,同时有0.16 e 的电子从CaO(001)表面转移到了PbO 分子中。由图2 可知,PbO 分子在CaO(001)表面的稳定吸附结构主要有两种类型,一种是PbO 分子平行吸附于Ca-O 桥位上,其中,Pb 原子位于Osurf原子上,而O 原子位于CaO 原子顶部附近;另一种是PbO 分子平行吸附表面空位,其中,Pb原子位于Osurf原子上,而O 原子位于表面空位中心。
为了进一步分析PbO 分子和CaO(001)表面活性位点的电子结构变化,对吸附能最大的结构1-c 的电子密度图和PDOS(Partial Density of State)进行分析,如图3 所示。

图3 PbO 分子在CaO(001)表面吸附的电子密度和PDOS 谱图Figure 3 Electron density map and PDOS of PbO molecules on the surface of CaO(001)
由图3(a)可知,PbO 分子中Pb 原子的电子云与CaO(001)表面中O 原子的电子云都存在大面积重叠,说明Pb 原子与Osurf原子之间形成了新的化学键。从图3(b)中可以看出,在发生吸附反应前Pb 原子和Osurf原子的轨道没有明显的重叠,说明Pb、Osurf原子之间没有相互作用。在吸附后Pb 原子的s轨道在-6.75 eV 处与O 原子的轨道态密度峰发生重叠,Pb 原子的p轨道和O 原子的p轨道在-2.83、-0.32、2.03 和3.58 eV 处轨道有明显的重叠,Pb 原子的d轨道和O 原子的s轨道在-14.24 eV 处产生共振,Pb、Osurf原子之间存在多处轨道杂化,两原子发生了相互作用,生成了新的化学键。整个分波态密度图向能量更低的方向移动,说明生成了更稳定的结构。因此,PbO 与CaO之间可能发生了反应:PbO+CaO→CaPbO2。综上所述,CaO(001)表面的O 原子是PbO 分子吸附的活性位点,同时也是Pb 原子吸附的活性位点。
2.1.2 H2O 在CaO(001)表面的吸附
考虑单个H2O 分子在CaO(001)表面吸附位点上多种初始吸附结构,图4 所示为四种典型的初始吸附结构优化前后的主视图和俯视图。
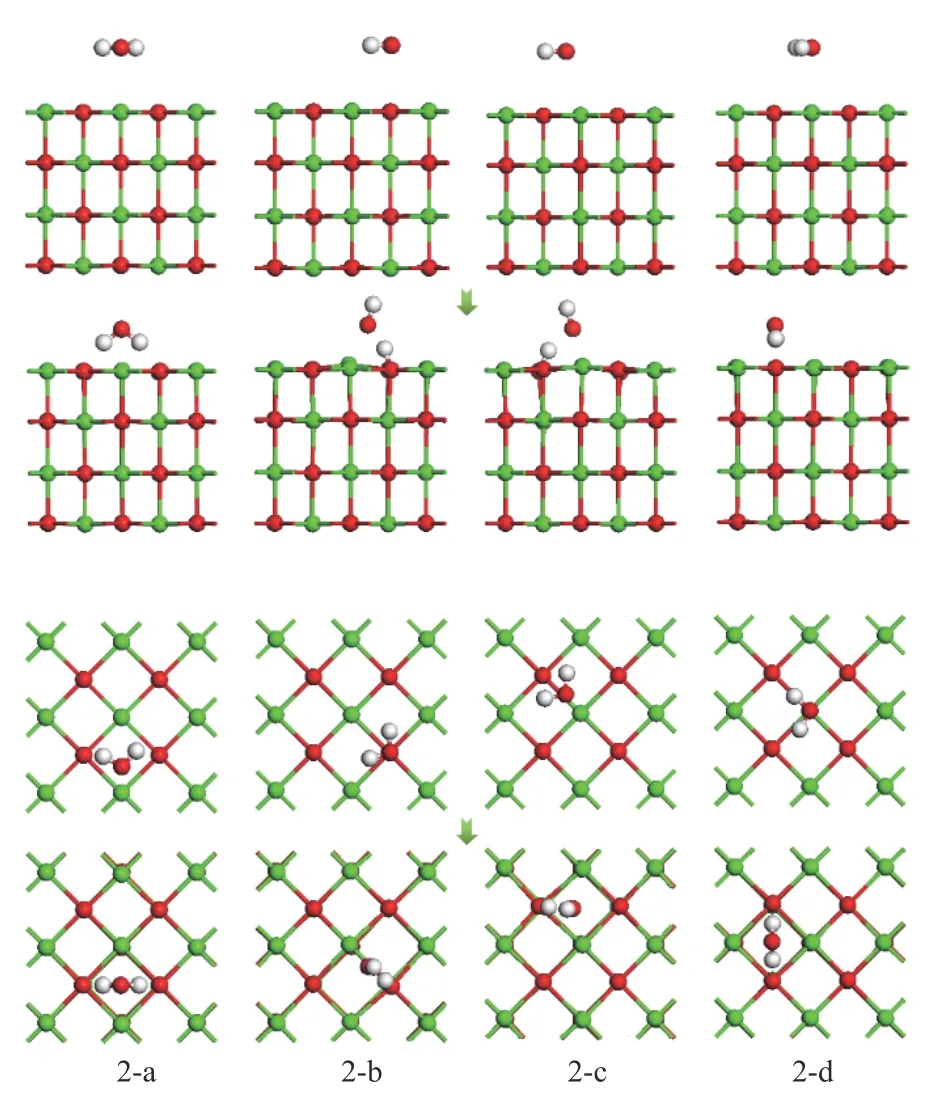
图4 H2O 在CaO(001)表面优化前后的吸附结构示意图Figure 4 Adsorption structure of H2O before and after optimization on the surface of CaO (001)
表4 所示为H2O 分子在CaO(001)表面优化后吸附结构的参数。
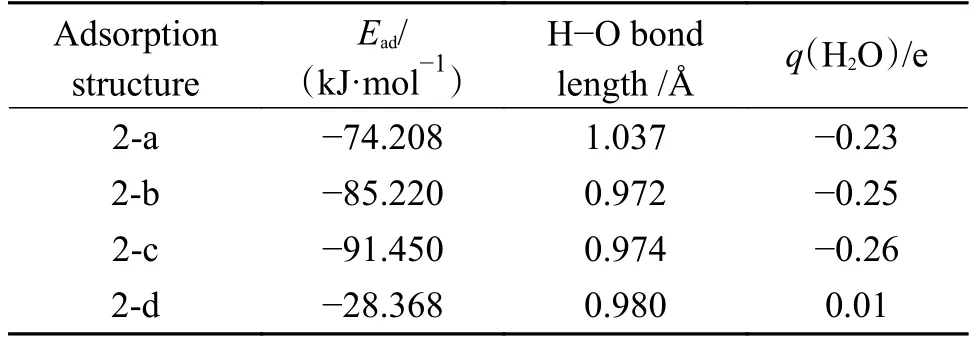
表4 H2O 分子在CaO(001)表面吸附的参数Table 4 Parameters of H2O after adsorption on CaO surface
从吸附能的结果中可以看出,结构2-a、2-b 和2-c 为化学吸附,结构2-d 为物理吸附。对于结构2-a、2-b 和2-c,在吸附过程中,分别有0.23、0.25和0.26 e 的电子从CaO(001)表面转移到了H2O 分子中,而对于结构2-d,仅有0.01 e 的电子从H2O分子中转移到了CaO(001)表面,这与吸附能的计算结果一致。总的来说,H2O 分子在CaO(001)表面的稳定吸附结构主要有两种类型,一种是H2O 分子整体垂直吸附于CaO(001)表面的表面空位;另一种是H2O 分子中的一个H-O 键断裂,形成一个H 基团和一个OH 基团,其中,H 基团和CaO(001)表面的O 原子结合形成H-Osurf键。这与闫广精等[30]的研究一致。
图5 为H2O 分子整体吸附于CaO(001)表面稳定吸附结构2-a 的电子密度图和差分电荷密度图(红色区域表示失去电子,蓝色区域表示得到电子)。
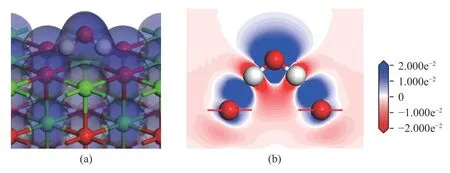
图5 H2O 分子稳定吸附于CaO(001)表面的电子密度和差分电荷密度Figure 5 Electron density map and differential charge density map of H2O molecules stably adsorbed on the surface of CaO(001)
从图5(a)中可以看出,H2O 分子的电子云和CaO(001)表面的O 原子的电子云存在大面积重叠。由图5(b)可以看出,H 原子和Osurf原子之间有明显的电子富集,说明原子间存在较强的相互作用,使得H2O 分子稳定吸附于CaO(001)表面。综上,CaO(001)表面的O 顶位是H2O 分子吸附的活性位点。
2.1.3 SO2 在CaO(001)表面的吸附
考虑单个SO2分子在CaO(001)表面吸附位点上多种初始吸附结构,图6 所示为四种典型的初始吸附结构优化前后的主视图和俯视图。
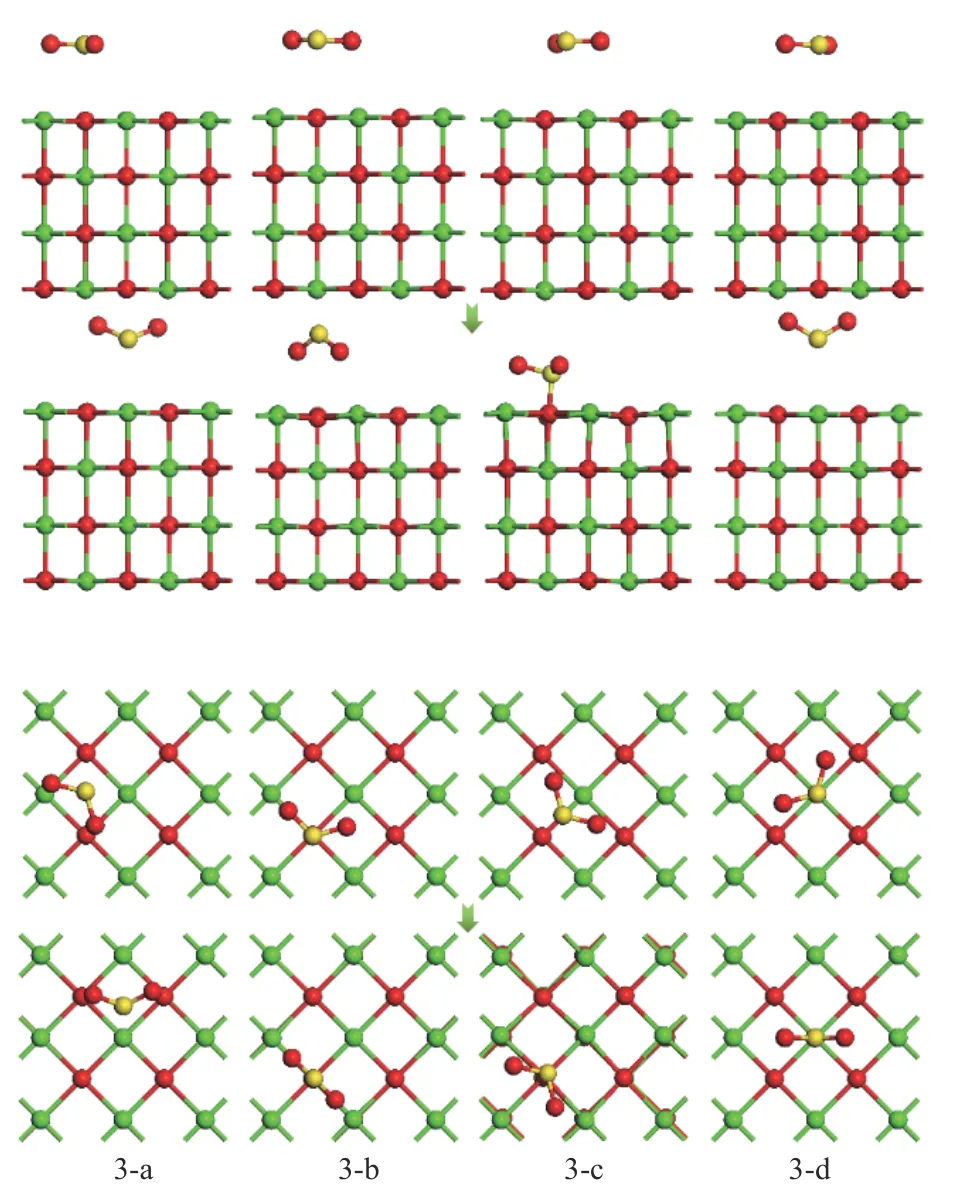
图6 SO2 在CaO(001)表面优化前后的吸附结构示意图Figure 6 Adsorption structure of SO2 before and after optimization on CaO(001) surface
表5 所示为SO2分子在CaO(001)表面优化后吸附结构的参数。

表5 SO2 在CaO(001)表面吸附的参数Table 5 Parameters of SO2 after adsorption on CaO surface
由表5 可知,电荷转移量和吸附能值呈正相关关系。从吸附能的结果中可以看出,四种吸附结构均为强化学吸附。在进行结构优化的过程中,四种吸附结构均有电子从CaO(001)表面转移到了SO2分子中。对于结构3-a、3-b 和3-d,吸附能在(-235.952)-(-228.541)kJ/mol,相比于初始构型,SO2分子中S 原子与CaO(001)表面之间的距离均变大,且三种结构中SO2分子均以一定的键角垂直吸附在CaO(001)表面。对于结构3-c,SO2分子中的S 原子与CaO(001)表面的O 原子形成了S-Osurf键,键长为1.697 Å,形成了类似亚硫酸根的结构,其对应的吸附能最大为-396.992 kJ/mol,并且有0.28 e 的电子从CaO(001)表面转移到了SO2分子中。
选择吸附能最大的稳定结构3-c 进行电子密度图和差分电荷密度图分析,如图7 所示。
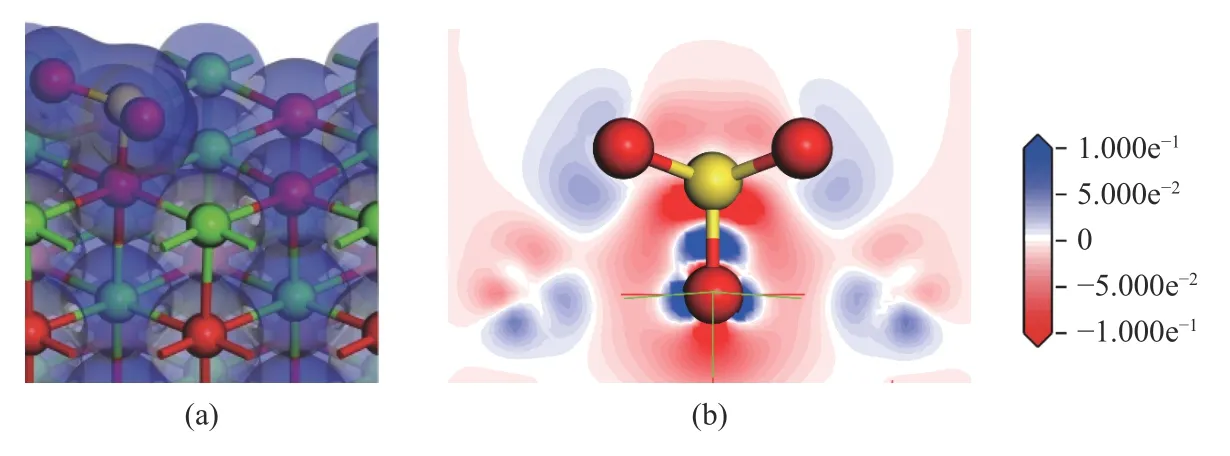
图7 SO2 分子稳定吸附于CaO(001)表面的电子密度和差分电荷密度Figure 7 Electron density map and differential charge density map of SO2 molecules stably adsorbed on the surface of CaO(001)
由图7(a)可知,SO2分子中S 原子的电子云与Osurf原子的电子云产生重叠。由图7(b)可知,S 原子周围流失了大量电荷,Osurf原子周围积累有大量电荷,S 原子和Osurf原子之间的电荷密度明显增加,两原子间存在相互作用,形成了S-Osurf键,说明CaO(001)表面的O 顶位是SO2分子吸附的活性位点。
2.1.4 CO2 在CaO(001)表面的吸附
考虑单个CO2分子在CaO(001)表面吸附位点上多种初始吸附结构,图8 所示为四种典型的初始吸附结构优化前后的主视图和俯视图。
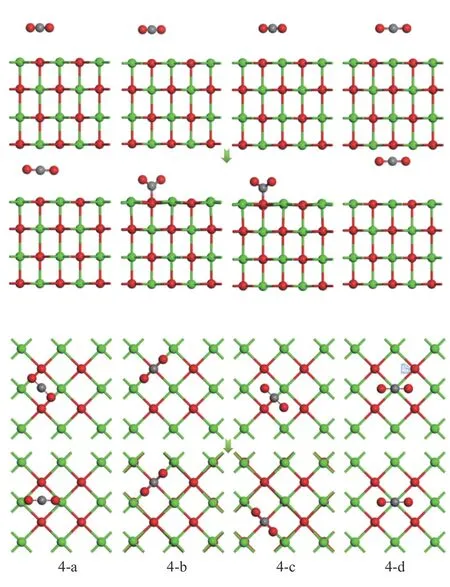
图8 CO2 在CaO(001)表面优化前后的吸附结构示意图Figure 8 Adsorption structure of CO2 before and after optimization on CaO(001) surface
表6 所示为CO2分子在CaO(001)表面优化后吸附结构的参数。
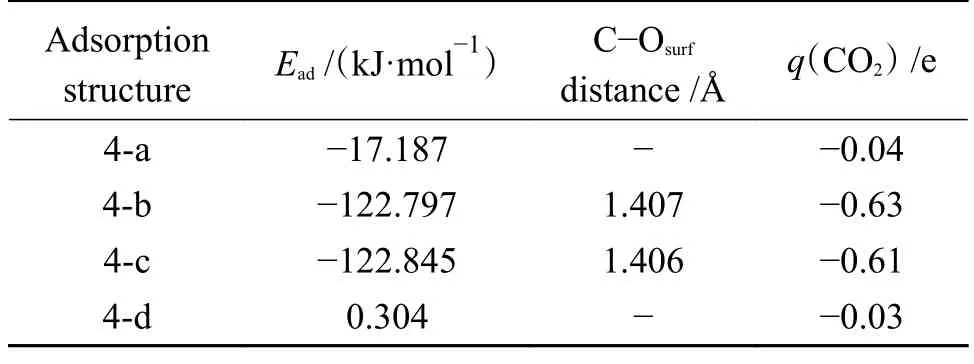
表6 CO2 在CaO(001)表面吸附的参数Table 6 Parameters of CO2 after adsorption on CaO surface
由表6 可知,结构4-d 的吸附能为正值,该反应不能自发进行,说明CaO(001)表面的Ca 顶位不是CO2分子吸附的活性位点。结构4-a 的吸附能为-17.187 kJ/mol,属于物理吸附,仅有0.04 e 的电子从CaO(001)表面转移到了CO2分子中,说明CO2分子与表面空位的相互作用较弱。对于结构4-b 和4-c,吸附类型均属于强烈的化学吸附,吸附能分别为-122.797 和-122.845 kJ/mol,两原子之间形成了C-Osurf键,键长分别为1.407 和1.406 Å,O-C-O 键角分别为128.437°和128.443°,同时分别有0.63 e 和0.61 e 的电子从CaO(001)表面转移到了CO2分子中。CO2分子在CaO(001)表面的稳定吸附结构是以C 端垂直吸附于CaO(001)表面的O 顶位,O 原子远离CaO(001)表面。
选择吸附能最大的稳定结构4-c 进行电子密度图和差分电荷密度图分析,如图9 所示。

图9 CO2 分子稳定吸附于CaO(001)表面的电子密度和差分电荷密度Figure 9 Electron density map and differential charge density map of CO2 molecules stably adsorbed on the surface of CaO(001)
从图9(a)可以看出,CO2分子中的C 原子的电子云和CaO(001)表面的O 原子的电子云产生重叠部分。由9(b)可以看出,C 原子附近有电荷的流失,Osurf原子附近有电荷的积累,C 原子和Osurf原子之间富集有大量的电子,因而形成了C-Osurf键。由此可见,CaO(001)表面的O 顶位是CO2分子吸附的活性位点。
2.2 烟气组分对PbO 在CaO 表面吸附的影响
2.2.1 H2O 对PbO 在CaO(001)表面吸附的影响
由2.1.1 和2.1.2 节分析可知,结构1-c 的吸附能最大,结构2-a 中H2O 分子整体稳定吸附于表面,且吸附能最大。因此,以结构2-a 为吸附基底,PbO 分子的初始吸附位置为以Pb 端平行吸附于Ca-O 桥位,O 原子位于Ca-O 桥位,探究H2O 分子对PbO 在CaO(001)表面吸附的影响,如图10 所示。吸附后的电子密度图如图11 所示。表7 所示为PbO 在预吸附有烟气组分的CaO(001)表面的吸附能、键参数和电荷转移。
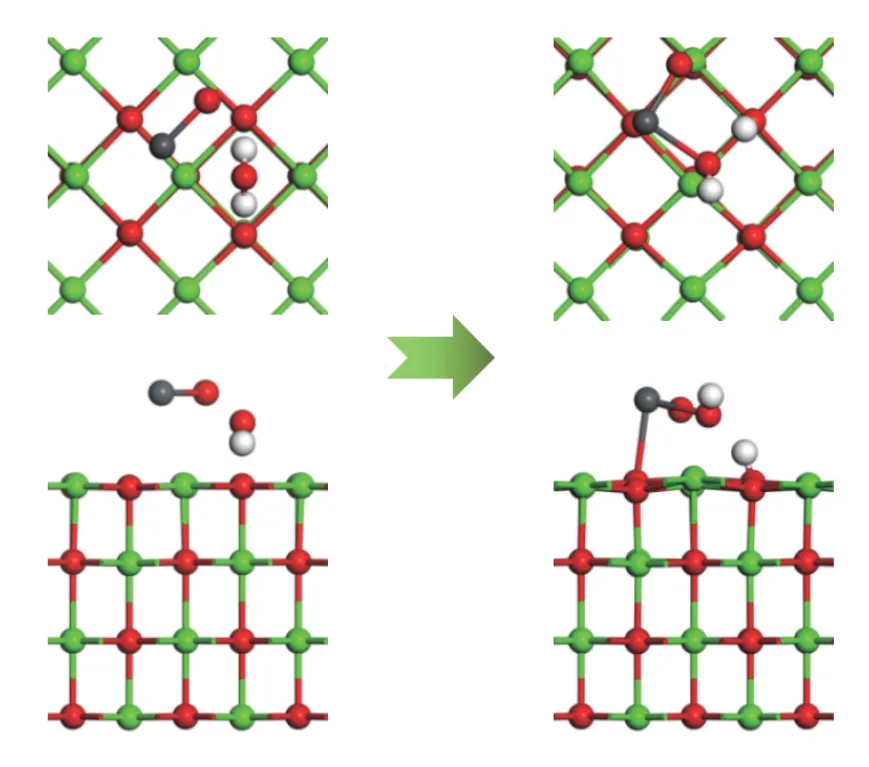
图10 H2O 对PbO 在CaO 表面吸附的影响Figure 10 Effect of H2O on the adsorption of PbO on CaO surface
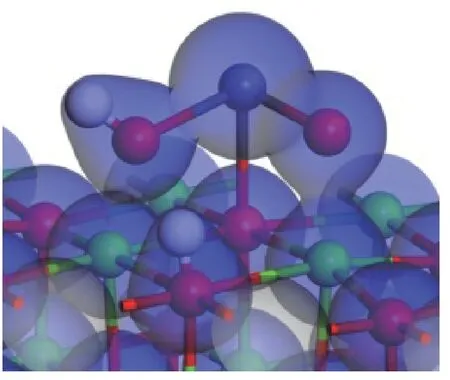
图11 PbO 分子在H2O+CaO(001)表面吸附后的电子密度Figure 11 Electron density diagram of PbO molecules after adsorption on the surface of H2O+CaO(001)
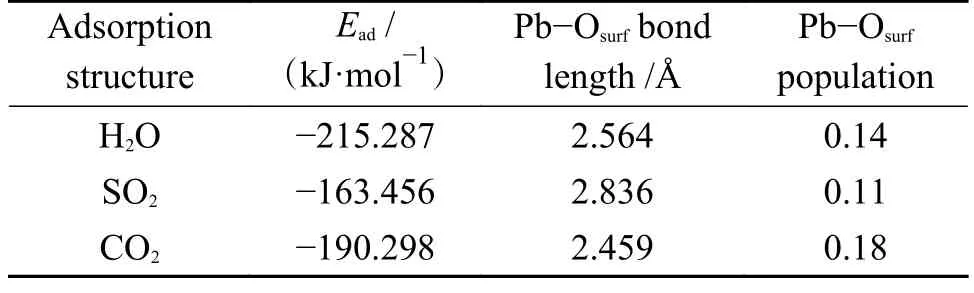
表7 PbO 在H2O/SO2/CO2+CaO(001)表面吸附的吸附能、键参数和电荷转移Table 7 Adsorption energy,bond parameters and charge transfer of PbO adsorption on the surface of H2O/SO2/CO2 +CaO(001)
从图10 中可以看出,当PbO 在H2O+CaO(001)表面吸附时,PbO 会使H2O 分子向能量更低的结构转变,即H2O 中的一个H-O 键断裂,形成的H 基与CaO(001)表面的O 原子形成H-O 键,断裂的H-O 基团和PbO 分子结合形成HPbO2基团。因此,H2O 分子中的H 原子会占据CaO(001)表面的O 活性位点,导致PbO 分子不会与CaO(001)表面直接发生反应。从图11 也可以看出,H-O 基团的电子云与Pb 原子的电子云发生了重叠,说明形成了新的化学键,脱离的H 基团与CaO(001)表面的O 原子的电子云有重叠,说明H-Osurf原子之间发生了相互作用,形成了类似Ca(OH)2的局部表面结构。在吸附的过程中有0.17 e 的电子转移到了PbO 分子中。吸附能为-215.287 kJ/mol,明显大于PbO 分子在洁净CaO(001)表面的吸附能,说明H2O 分子的存在会促进PbO 分子在CaO(001)表面的吸附。综上,虽然H2O 分子会占据PbO 吸附的活性位点,但生成的H-O 基团对PbO 具有更好的吸附作用,有利于PbO 分子在CaO(001)表面上的固定。推测三者之间发生了反应:H2O+PbO +CaO→Ca(HPbO2)2+OH-。
2.2.2 SO2 对PbO 在CaO(001)表面吸附的影响
由2.1.1 和2.1.3 节分析可知,结构1-c 和结构3-c 的吸附能最大。因此,以结构3-c 为吸附基底,PbO 分子的初始吸附位置为以Pb 端平行吸附于Ca-O 桥位,O 原子位于Ca-O 桥位,探究SO2分子对PbO 在CaO(001)表面吸附的影响,如图12 所示。SO2分子中靠近Pb 原子的O 原子命名为OS。吸附后Pb 原子、OS原子和Osurf原子的PDOS 如图13。
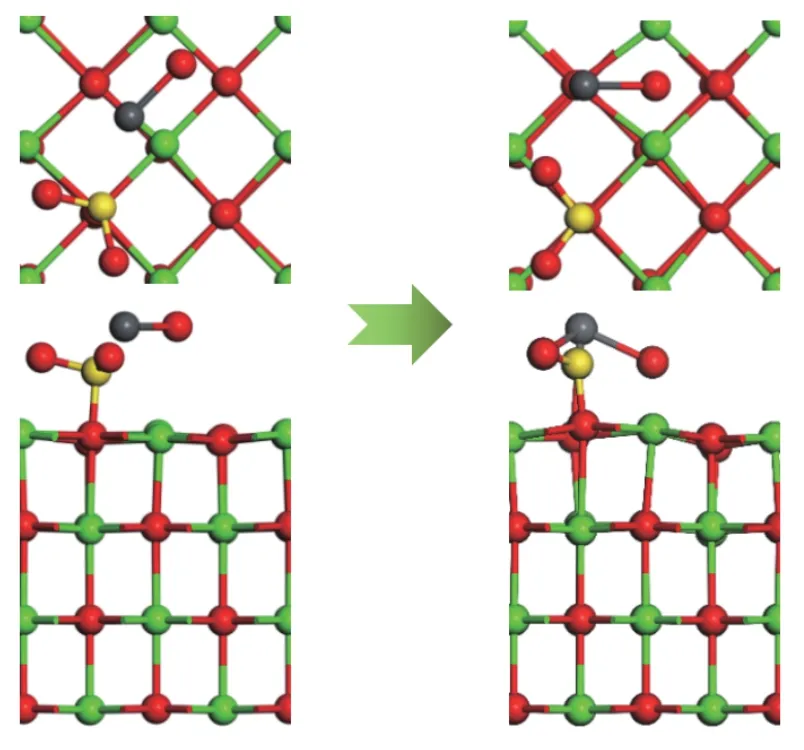
图12 SO2 对PbO 在CaO 表面吸附的影响Figure 12 Effect of SO2 on the adsorption of PbO on CaO surface
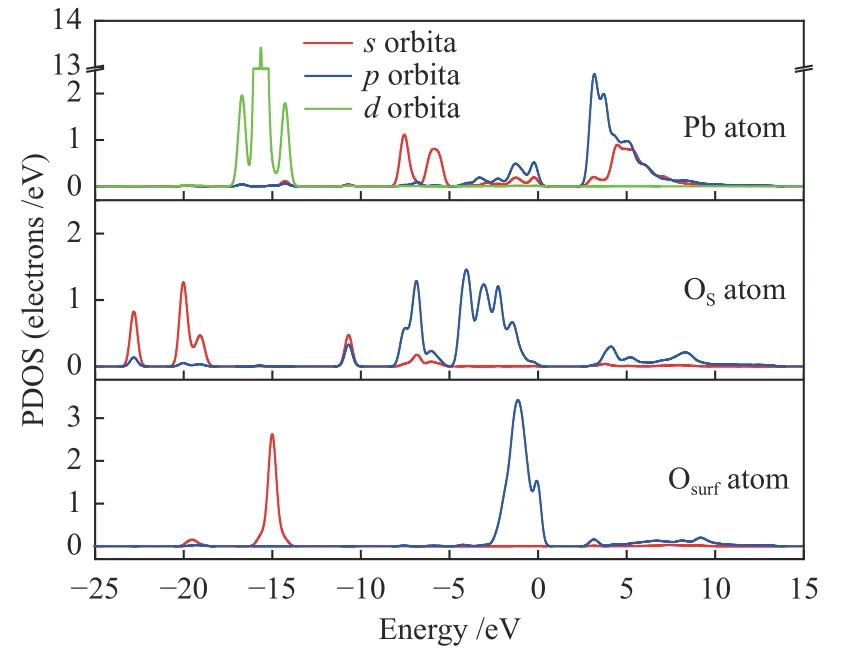
图13 Pb、OS 原子和Osurf 原子的PDOSFigure 13 PDOS of Pb,OS atom and Osurf atom
从图12 可以看出,PbO 分子在预吸附有SO2分子的CaO(001)表面吸附后,SO2分子中的S 原子将CaO(001)表面的O 原子向上拉伸了一定的距离,形成了SO3基团。SO2分子发生了一定角度的偏转,PbO 分子中的Pb 原子同时向OS原子和Osurf原子附近移动,说明了CaO(001)表面的O 原子和SO2分子中的O 原子均对PbO 分子有吸附作用。虽然SO2分子的存在占据了Pb 原子吸附的活性位点,但双重的吸附作用使得吸附后的吸附能为-163.456 kJ/mol 大于洁净表面的吸附能。从图13 也可以看出,Pb 原子的轨道与OS原子和Osurf原子的电子轨道都有一定的重叠,说明了Pb、OS原子和Pb、Osurf原子之间存在轨道杂化作用,形成了新的化学键Pb-OS键和Pb-Osurf键。此外,Pb 原子和OS原子之间的轨道重叠度大于Pb 原子和Osurf原子,说明了Pb、OS原子之间的相互作用比Pb、Osurf原子之间的相互作用大。
2.2.3 CO2 对PbO 在CaO(001)表面吸附的影响
由2.1.1 和2.1.4 节分析可知,结构1-c 和结构4-c 的吸附能最大。因此,以结构4-c 为吸附基底,PbO 分子的初始吸附位置为以Pb 端平行吸附于Ca-O 桥位,O 原子位于Ca-O 桥位,探究CO2分子对PbO 在CaO(001)表面吸附的影响,如图14 所示。CO2分子中的O 原子命名为OC。吸附后的Pb 原子和Osurf原子的分波态密度图如图15 所示。
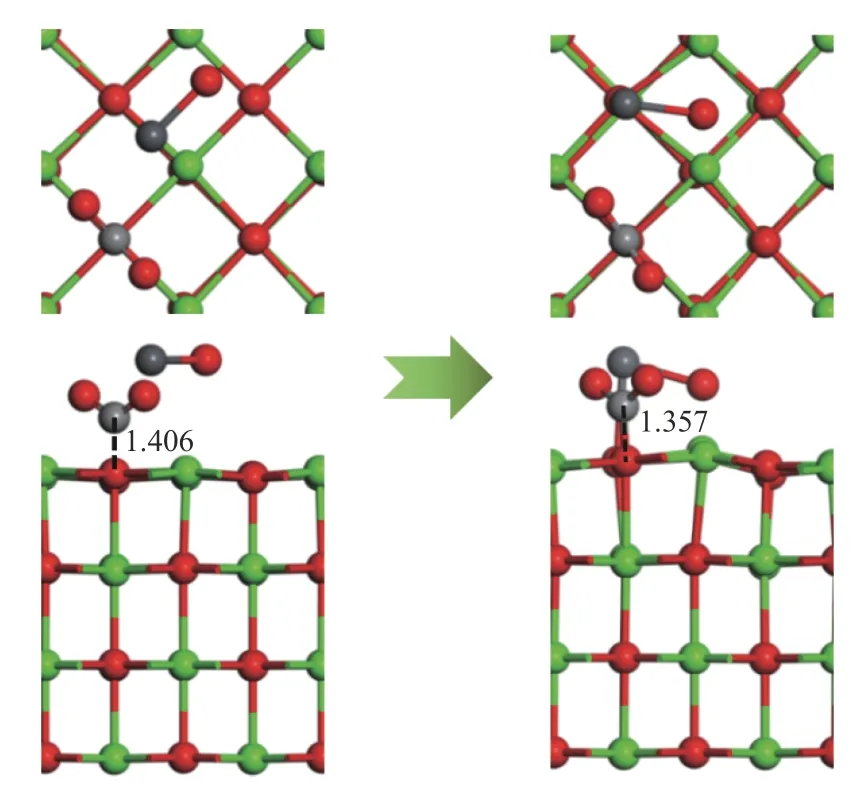
图14 CO2 对PbO 在CaO 表面吸附的影响Figure 14 Effect of CO2 on the adsorption of PbO on CaO surface
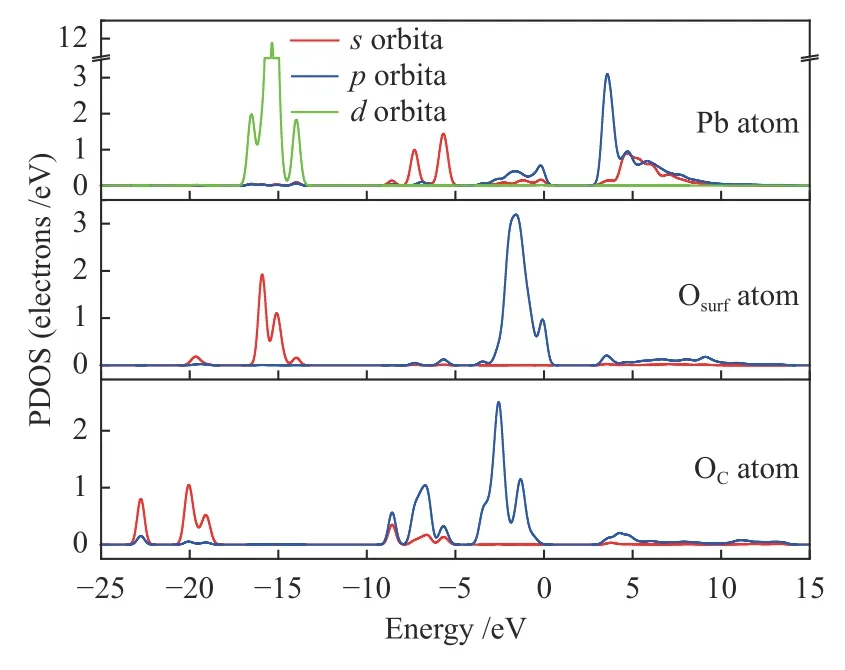
图15 Pb、Osurf 原子和OC 原子的PDOSFigure 15 PDOS of Pb,Osurf atom and OC atom
从图14 可以看出,吸附后的结构中,CO2分子中的C-Osurf键长由1.406 Å减小到1.357 Å,相应的C-Osurf布局数也由0.61 增大为0.71,PbO 分子的存在使得CO2分子与CaO(001)表面的相互作用变强,生成的CO3基团更稳定。PbO 分子仍倾向于吸附在CaO(001)表面的O 顶位,Pb-Osurf键长由2.329 Å增大到2.459 Å,Pb-Osurf布局数由0.20 减小到0.11,由图3 和图15 对比可知,CO2的存在使得态密度图整体向能量更高的方向移动,Pb 原子和Osurf原子的轨道重叠度较在洁净表面减少,说明CO2的存在使得PbO 分子与CaO(001)表面的相互作用减弱。但吸附后的吸附能为-190.298 kJ/mol大于洁净表面的吸附能,可能是由于生成的CO3基团对PbO 分子存在吸附作用。因此,分析了CO2分子中的O 原子与Pb 原子的分波态密度如图15。
从图15 可以看出,Pb 原子的s轨道与OC原子的轨道在-8.59 和-5.68 eV 处态密度峰发生重叠,Pb 原子的p轨道和OC原子的轨道在-3.93-0.34 和2.97-13.71 eV 处有重叠,说明Pb 原子和OC原子之间存在轨道杂化作用,两原子之间存在强相互作用。
3 结论
PbO 分子稳定吸附在CaO(001)表面的O 活性位点。
CaO(001)表面的O 顶位是H2O 分子吸附的活性位点。在预吸附有H2O 分子的表面的吸附能(-215.287 kJ/mol)明显大于PbO 分子在洁净CaO(001)表面的吸附能(-143.867 kJ/mol),H2O 分子的存在有利于PbO 分子的吸附。
SO2分子稳定吸附于CaO(001)表面的O 顶位,占据了PbO 吸附的活性位点,但形成的类似亚硫酸根的结构对PbO 的吸附作用更强,吸附能由-143.867 kJ/mol 增大为-163.456 kJ/mol,表现为促进PbO 分子的吸附。
CO2分子在CaO(001)表面的稳定吸附结构是以C 端垂直吸附于CaO(001)表面的O 顶位,生成CO3基团。CO2分子一方面通过占据PbO 分子的吸附活性位点,抑制其CaO(001)表面吸附;另一方面通过自身为PbO 分子提供了更强的活性位使得吸附能增大了46.431kJ/mol,有利于PbO 分子的吸附。
本研究深化了CaO 脱除PbO 的微观机理认识,此外对污泥燃烧过程中同时脱除酸性污染气体(SO2和CO2)和重金属化合物(PbO)指明了方向,对实现污泥的稳定清洁燃烧具有重要意义。

