山苍子精油对白假丝酵母菌细胞膜屏障影响的机理
孙 月,曾朝懿,李梓钰,熊海波,林籽汐,车振明,唐 洁*
(西华大学食品与生物工程学院,四川 成都 610039)
白假丝酵母菌(Candida albicans)作为一种条件致病菌,常见于宿主的胃、肠道、口腔、皮肤和泌尿系统,其具有表型可塑性,以不同形态在营养菌丝和芽殖酵母间切换,使其能够定植并感染宿主从而引起疾病[1]。白假丝酵母菌虽被长期认为是通过临床感染,但在抗生素广泛应用的背景下,白假丝酵母菌抗药性增加,导致其感染发生转移。近年来已有研究发现,白假丝酵母菌能够引起传统发酵蔬菜及奶制品腐败[2-3],从而引起食品安全风险。目前,抗白假丝酵母菌的药物主要包括多烯类和唑类等[4]。然而,这类常见的抗真菌药物会产生肝毒性、肾毒性等副作用[5],因此,亟待寻找一种天然、安全的替代药物。
植物精油含有丰富的天然生物碱、黄酮类化合、单萜类、倍半萜类等物质,具有良好的广谱杀菌性和不易造成耐药性等特点。但不同精油由于化学组分和含量不同,其作用机制不同[6-8]。Azeredo等[9]研究发现不同生化成分组成的精油组合可显著提高抗菌效力。Lü Fei等[10]评估比较了4 种化学成分差异很大的精油,通过协同作用测试,证实4 种精油组合可以在低浓度下有效抑制食品中的相关微生物。此外,Santiesteban-López等[11]研究了精油组合抑菌协同作用机制,结果表明,协同作用机制包括共同生化途径的连续抑制以及保护性酶的抑制等。但不同抗菌特性的精油对不同微生物的具体抑菌机制还需明确。
山苍子精油是一种高附加值产品,主要从山苍子的新鲜果实中提取[12-13],具有广泛的生物和药理活性,包括抗肿瘤、抗菌、抗炎、抗氧化作用等[14]。GB/T 2760——2014《食品安全国家标准 食品添加剂使用标准》中提到山苍子精油还可作为食品调味剂使用,与食品基质作用,从而改善食物感官品质。有研究表明,山苍子精油及其活性化合物具有良好的抑菌活性,可广泛抑制食源性病源菌,延长食品保质期[15]。戴锦铭[16]发现山苍子精油的主要成分柠檬醛可以破坏大肠杆菌DNA结构,减少胞内DNA含量;此外,将山苍子精油应用于4 种不同果蔬汁中均能够抑制大肠杆菌繁殖。李欣越等[17]的研究表明山苍子精油能够有效抑制沙门菌生物被膜的形成;王轶楠[18]发现山苍子精油会抑制辣椒疫霉菌菌丝生长、孢子囊形成、孢子囊萌发和孢子萌发。虽然山苍子精油的抗菌活性已在很多研究中得到证实,但山苍子精油应用于白假丝酵母菌的研究还鲜有报道,限制了山苍子精油在食品工业中的进一步应用。
本研究选用山苍子精油作为天然抗菌剂,分析其主要活性成分,通过不同质量浓度的山苍子精油处理筛自“生花”泡菜中的白假丝酵母菌,观察处理前后白假丝酵母菌细胞形态、表面疏水性、表面电荷、胞内核酸和蛋白质泄漏变化情况,探究山苍子精油对白假丝酵母菌抗菌活性及其对细胞膜屏障影响的机理,以期为山苍子精油及其生物活性化合物在食品工业中应用提供理论参考。
1 材料与方法
1.1 菌株、材料与试剂
白假丝酵母菌由中国(成都)西华大学四川食品微生物学重点实验室提供;山苍子精油(纯度≥85%)上海源叶生物科技有限公司;YPD培养基 杭州微生物试剂有限公司;吐温20、戊二醛(体积分数25%)成都市科隆化学品有限公司;正十六烷 上海麦克林生化科技有限公司。
1.2 仪器与设备
BPH-9082恒温培养箱 上海一恒科技有限公司;ZWY-2102C双层恒温培养振荡器 上海智城分析仪器制造有限公司;GI54DWS全自动高压灭菌锅 厦门致微仪器有限公司;FDU-1100真空冷冻干燥机 东京理化器械株式会社;5 8 0 4 R 冷冻离心机 德国Eppendorf公司;GCMS-QP2020 NX气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪日本岛津公司;AR8011电导率测试仪 苏州罗伯克测控技术有限公司;Zetasizer Nano ZS激光粒度仪 英国马尔文帕纳科公司;CSUOP0600荧光倒置显微镜 重庆重光实业有限公司。
1.3 方法
1.3.1 山苍子精油成分测定
取3 mL的样品于顶空萃取瓶中,盖上瓶盖,置于60 ℃水浴保温30 min后,将萃取头旋转于2 cm处,插入顶空萃取瓶,压入纤维头,吸附30 min,吸附结束后,取出萃取头重新旋转到3 cm处,从GC-MS进样口进样解吸5 min后取出萃取头。
色谱条件:Rtx-5MS色谱柱,载气为高纯度氦气,柱箱温度55 ℃,进样口温度220 ℃,分流比50∶1,总流量67.4 mL/min,柱流量1.00 mL/min,压力119.8 kPa。升温程序:55 ℃保持4 min,随后以10 ℃/min升至130 ℃,保持3 min,再以6 ℃/min升至240 ℃,保持15 min,检测器温度为240 ℃。
MS条件:离子化电子电离源,电离电压70 eV,离子源温度280 ℃,接口温度240 ℃,溶剂延迟时间2 min。
1.3.2 最低抑菌浓度和最低杀菌浓度的测定
山苍子精油对白假丝酵母菌最低抑菌浓度(minimum inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration,MFC)的测定采用Zhang Yunbin等[19]的方法。将山苍子精油用5%(质量分数,下同)吐温20配制成质量浓度为32 mg/mL的母液,以二倍稀释法将精油依次稀释为质量浓度16、8、4、2、1、0.5、0.25 mg/mL。每个样品加入2%(以体系体积计)白假丝酵母菌菌悬液(使实验终体系菌悬液浓度为1×107CFU/mL)30 ℃培养24 h,以添加5%吐温20的YPD培养基作为阴性对照,以不接菌的不同质量浓度山苍子精油作为阳性对照,测定OD600nm,其中与阳性对照组光密度值最接近的最低处理精油质量浓度为MIC。吸取100 μL苍子精油浓度不低于MIC的菌悬液并涂布在YPD平板上,在30 ℃下孵育24 h后,相应的菌落数小于5的平板所对应最低质量浓度被认作山苍子精油对白假丝酵母菌的MFC[20]。
1.3.3 抑菌动力学的测定
4.4.2 个体化镇痛:结合文献学习及我院临床工作经验,对于健康初产妇推荐使用椎管内吗啡与非甾体类药物和/或对乙酰氨基酚。对于全麻剖宫产,扩大皮肤切口,已知有慢性疼痛病史的产妇,需改变常规镇痛方案,或者加大用药剂量,可采用持续伤口浸润阻滞镇痛,持续腹横肌平面阻滞镇痛。对于二次剖宫产经产妇推荐使用椎管内吗啡,围术期低剂量舒芬太尼复合特耐(帕瑞昔布钠)及地塞米松。对于爆发痛患者建议口服或者静脉应用阿片类药物,也可以给予“拯救性”腹横肌平面阻滞。口服阿片类药物推荐:羟考酮、氢可酮、曲马多。对于更严重的爆发痛或者不耐受口服时,可使用静脉阿片类药物。
以二倍稀释法配制含不同质量浓度山苍子精油(0、MIC、MFC)的YPD培养基,接种100 μL处于对数生长期的菌悬液于5 mL无菌YPD培养基中(使实验终体系菌悬液浓度为1×107CFU/mL),分别于培养0、2、4、6、8、10、12、16、20、24 h时测定OD600nm。
1.3.4 微观形态特征观察
扫描电子显微镜可以观察山苍子精油在MIC和MFC下对白假丝酵母菌的影响。将处于对数期的白假丝酵母菌用冷冻离心机6 000 r/min离心10 min,用无菌生理盐水洗涤3 次并悬重至菌悬液浓度为1×107CFU/mL,以二倍稀释法加入山苍子精油,使其终质量浓度达到0(对照)、MIC、MFC,在30 ℃下摇床培养3 h,6 000 r/min离心10 min,加入体积分数2.5%戊二醛溶液固定3 h,离心10 min并用磷酸盐缓冲液(phosphate buffered saline,PBS)(0.02 mol/L pH 7.2)洗涤3 次,涂抹于载玻片上,用体积分数20%、40%、60%、80%、100%的乙醇溶液依次冲洗,进行梯度脱水,裹上扎好孔的保鲜膜,于-20 ℃下预冻12 h,再放入冷冻干燥机中冷冻干燥24 h,最后将有细胞的载玻片进行喷金处理,镜检拍照。
1.3.5 表面电荷的测定
将处于对数期的白假丝酵母菌加入含不同质量浓度山苍子精油(0、MIC、MFC)的YPD培养基中,于30 ℃下培养15 h后用冷冻离心机6 000 r/min离心10 min,以PBS(0.01 mol/L pH 7.2)洗涤3 次并重悬至菌悬液浓度为1×107CFU/mL后,用激光粒度仪测细胞表面电荷。
1.3.6 细胞膜完整性的测定
用荧光倒置显微镜检测细胞膜的完整性。调整对数生长期的白假丝酵母菌菌悬液浓度为1×107CFU/mL,分别加入不同质量浓度的山苍子精油,使其终质量浓度分别为0、MIC、MFC。在30 ℃的摇床培养箱中培养4 h,混匀,取1 mL的培养液6 000 r/min离心10 min,用PBS(0.01 mol/L pH 7.2)洗涤3 次并悬重,于96 孔板中分别加入190 μL稀释100 倍的菌悬液和10 μL按照体积比1∶3混合的SYBR Green I和PI染料,25 ℃避光孵育25 min,在20×物镜、10×目镜荧光倒置显微镜下观察并拍照记录。
1.3.7 电导率的测定
1.3.8 分子物质泄漏情况分析
参照柏梅[21]的方法对山苍子精油作用后大分子物质泄漏情况进行分析。将培养至对数周期的白假丝酵母菌于6 000 r/min下离心10 min,获得的菌体沉淀用无菌PBS(0.01 mol/L pH 7.2)清洗,此过程重复3 次后获得菌体沉淀用无菌PBS(0.01 mol/L pH 7.2)重悬至菌悬液的浓度为1×107CFU/mL。将白假丝酵母菌菌悬液与不同质量浓度山苍子精油(0、MIC、MFC)混合并在30 ℃下振荡培养,每4 h使用紫外分光光度计测定OD260nm和OD280nm,以添加等量5%吐温20的实验组作为对照组。
1.4 数据处理与分析
实验设置3 个重复,采用Excel 2021软件进行数据统计,采用Origin 2021软件作图。
2 结果与分析
2.1 山苍子精油主要活性成分
采用GC-MS对山苍子精油进行成分分析,所得分析谱图如图1所示,与NIST质谱标准品进行比对后的结果列于表1。

表1 山苍子油精主要成分分析Table 1 Analysis of major components in Litsea cubeba essential oil

图1 山苍子精油GC-MS总离子流色谱图Fig.1 Gas chromatography-mass spectrometry total ion current chromatogram of Litsea cubeba essential oil
由图1可以得出,山苍子精油经GC-MS分析,共检测出90 种物质,其中(Z)-柠檬醛(13.28%)、柠檬醛(12.52%)、D-柠檬烯(12.45%)、甲基庚烯酮(7.13%)、芳樟醇(6.57%)、香茅醛(6.47%)含量较高(表1)。成分分析结果表明,山苍子精油主要成分为单萜类化合物及其氧化物,如D-柠檬烯、月桂烯、柠檬醛、芳樟醇等,总质量分数为59.0361%。有研究表明,D-柠檬烯、柠檬醛、芳樟醇具有抑菌杀菌的作用[20,22-23],在食品中可用作天然防腐保鲜剂。但也有研究者认为植物精油中存在的微量成分对抑菌活性的影响比植物精油中的主要成分更重要,主要成分与其他活性较弱的微量成分的组合可能会达到协同效应[10],这表明与植物精油的主要成分相比,植物精油的抗菌活性更强。
2.2 山苍子油对白假丝酵母菌的抗菌活性
通过二倍稀释法确定山苍子精油对白假丝酵母菌的MIC为0.25 mg/mL,通过不同质量浓度山苍子精油处理后白假丝酵母菌的残菌数如图2A所示,确定MFC为1 mg/mL,这与吴均等[24]报道的山苍子抑菌活性的MFC有一定的差异,这种差异可能是菌株的特异性造成的。山苍子精油对白假丝酵母菌0~24 h的抗菌活性如图2B所示,阴性对照组白假丝酵母菌在8~24 h内生长状况良好,处于对数生长期。当山苍子精油质量浓度达到MIC(0.25 mg/mL)和MFC(1 mg/mL)时,则完全抑制白假丝酵母菌的生长。其中,在山苍子精油质量浓度为0.25 mg/mL条件下处理4 h,白假丝酵母菌生长已停滞。
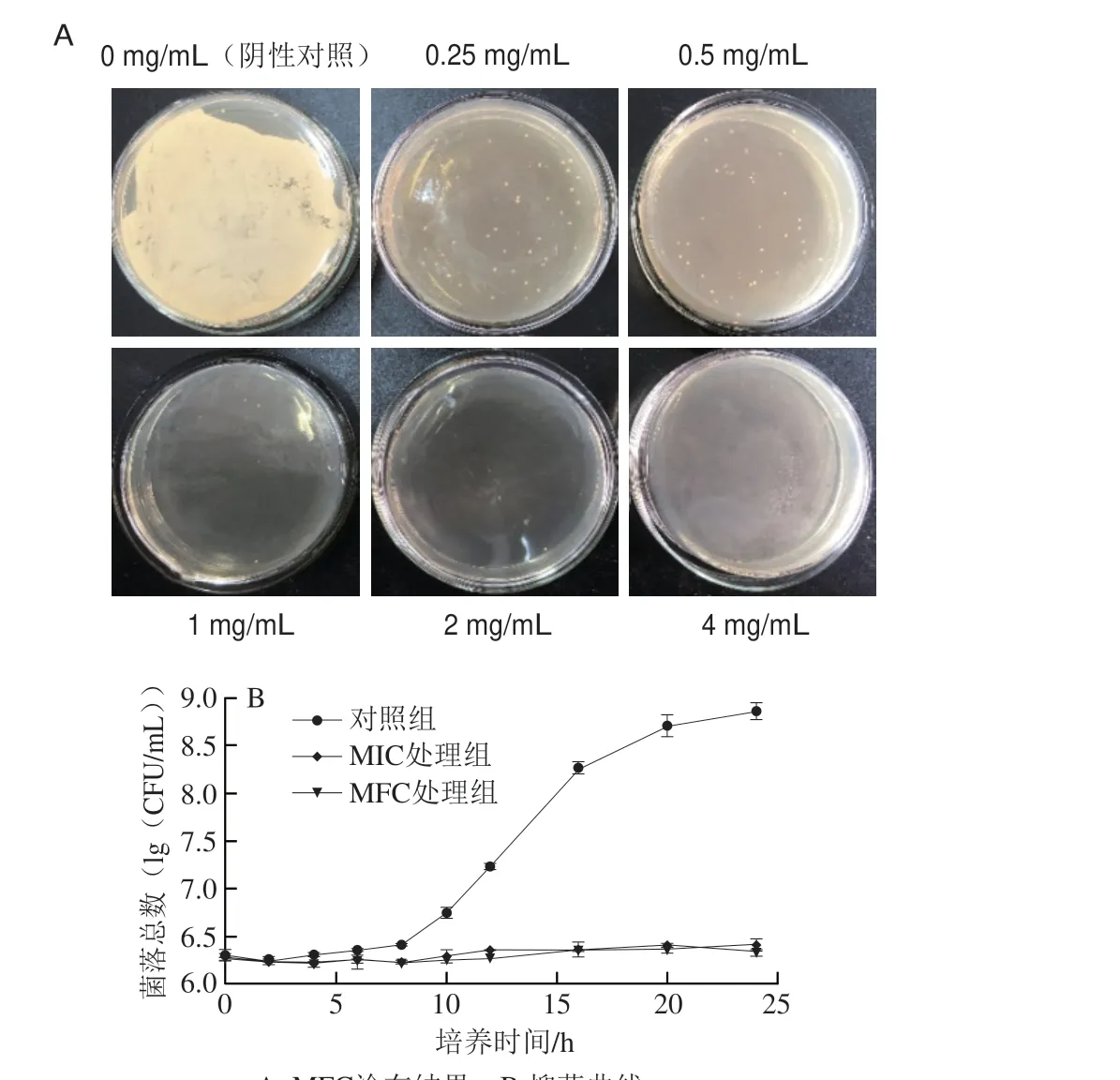
图2 山苍子精油对白假丝酵母菌的抗菌活性Fig.2 Antimicrobial activity of Litsea cubeba essential oil against Candida albicans
2.3 山苍子精油对白假丝酵母菌的抑菌机制
2.3.1 山苍子精油作用前后白假丝酵母菌菌体微观形态分析
用扫描电子显微镜观察山苍子精油处理前后白假丝酵母菌的微观结构变化。未经山苍子精油处理的白假丝酵母菌具有完整真菌的独特特征,边界光滑完整,呈椭圆形(图3A)。与之相反,经MIC-山苍子精油处理后的白假丝酵母菌呈下凹、扭曲、褶皱状(图3B)。当白假丝酵母菌暴露于MFC的山苍子精油时,细胞明显破裂,附着成团(图3C)。结果表明,山苍子精油对白假丝酵母菌的细胞壁有明显的损伤作用,细胞形态发生改变,这些细胞结构的变化可能是由于膜的溶解和转化。Bajpai等[25]证实了蜡样芽孢杆菌形态的改变是细胞壁表面恶化、细胞肿胀、膜破裂所致。

图3 扫描电子显微镜观察白假丝酵母菌细胞形态Fig.3 Scanning electron microscopic observation of Candida albicans cell morphology
2.3.2 山苍子精油对白假丝酵母菌细胞表面特性的影响
细胞膜的表面电荷在细胞的聚集与黏附、物质合成分解与运输、信息的传递等过程中起重要作用[26],表面电荷的改变被认为是细胞对外部刺激最快的反应之一[27]。山苍子精油作用前后细胞表面电荷绝对值变化如图4所示,与对照组相比较,经MIC和MFC山苍子精油处理后,菌体表面电荷绝对值均有所减少。结果表明,当菌体暴露在一定量的山苍子精油中,其表面电荷会减少,使细胞更易聚沉、成团,从而影响菌体正常生长繁殖。

图4 山苍子精油对白假丝酵母菌表面电荷的影响Fig.4 Effect of Litsea cubeba essential oil on surface charge of Candida albicans
2.3.3 山苍子精油对白假丝酵母菌细胞膜完整性的影响
细胞膜是保护细胞免受细胞外环境影响、维持细胞内平衡的重要屏障。绿色荧光探SYBR Green I和红色荧光染料PI可用于评价细胞膜的完整性。绿色荧光探针SYBR Green I可以被水解为荧光素,然后荧光素只在细胞膜完整的活细胞中积累。但PI只能通过受损的细胞膜进入细胞,随后对核酸进行染色,并发出红色荧光[28]。本研究中未经山苍子精油处理的白假丝酵母菌细胞发出明亮的绿色荧光(图5A),表明细胞膜完整;相反,白假丝酵母菌经MIC山苍子精油处理后,绿色荧光强度明显减弱,红色荧光强度增强(图5B),表明部分细胞受到了损伤,而在未受损伤的细胞中,SYBR Green I的水解性受到了一定程度的抑制。白假丝酵母菌经MFC山苍子精油处理后,几乎没有绿色荧光发射(图5C),表明几乎所有白假丝酵母菌的细胞膜都被破坏,致使细胞失活死亡。Liu Xue等[29]证实了芳樟醇可以穿过细胞膜,改变膜组成,增加膜流动性,最终破坏细胞膜完整性。
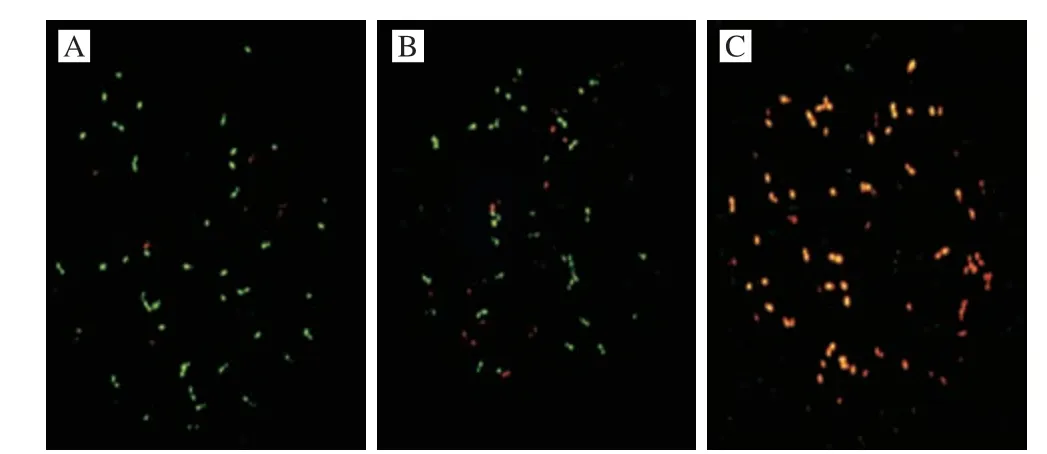
图5 山苍子精油对白假丝酵母菌细胞膜完整性的影响Fig.5 Effect of Litsea cubeba essential oil on the cell membrane integrity of Candida albicans
2.3.4 电解质泄漏情况分析结果
细胞膜具有选择透过性,即使膜结构受到轻微损伤,膜的通透性也会显著增加,导致离子稳态被破坏,渗透压调节失控,从而使细胞产生毒性[30]。如图6所示,经MIC和MFC山苍子精油处理后的白假丝酵母菌细胞膜受到破坏,相对电导率明显高于对照组。这是因为电解质从细胞泄漏到测试液中,并且随山苍子精油的浓度从MIC到MFC的增加,菌体细胞质泄漏量升高。说明山苍子精油能够破坏菌体细胞膜结构,导致胞内电解质流出,致使细胞生长受到抑制或死亡。与本研究结果类似,Ziaee等[20]用何首乌精油弯曲乳杆菌,Cui Haiying等[31]用牛至精油处理耐甲氧西林金黄色葡萄球菌,Diao Wenru[32]用茴香籽油处理痢疾杆菌,发现细胞膜通透性增加引起电解质泄漏是导致弯曲乳杆菌、耐甲氧西林金黄色葡萄球菌、痢疾菌死亡的重要原因之一。
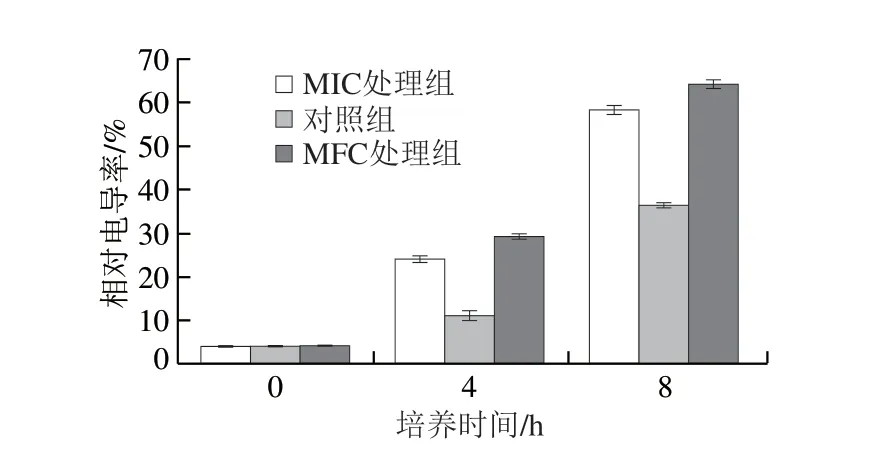
图6 山苍子精油对白假丝酵母菌电导率的影响Fig.6 Effect of Litsea cubeba essential oil on the electrical conductivity of Candida albicans
2.3.5 胞内大分子泄漏情况分析结果
细胞膜系统遭到损伤,便会造成细菌内部多种重要生物大分子(核酸、蛋白质、糖类等)泄漏,从而影响正常的合成代谢功能[33],胞内核酸和蛋白质分别在OD260nm和OD280nm有最大吸收峰[34]。山苍子精油处理后核酸和蛋白质泄漏情况如图7所示,与对照组相比,经MIC和MFC的山苍子精油处理后,胞外菌液中核酸(图7A)和蛋白质(图7B)的泄漏量明显增加,其泄漏量与山苍子精油的质量浓度、处理时间成呈正相关。表明山苍子精油能够破坏菌体细胞膜,增加其通透性,造成胞内大分子物质流出,从而导致菌体死亡。张梅等[35]证实了植物源防腐剂能够使大肠杆菌、金黄的色葡萄球菌、白假丝酵母菌的胞内大分子核酸通过细胞膜渗漏到胞外,增加细胞膜的通透性,使细胞受到不可修复的破坏。

图7 山苍子精油对白假丝酵母菌胞内大分子泄漏的影响Fig.7 Effect of Litsea cubeba essential oil on intracellular macromolecule leakage from Candida albicans
3 结 论
本研究通过GC-MS组分分析鉴定出山苍子精油由90 种化合物组成,主要为单萜类化合物和单萜氧化物,其含量最高的化合物依次是(Z)-柠檬醛(13.28%)、柠檬醛(12.52%)、D-柠檬烯(12.45%)、甲基庚烯酮(7.13%)、芳樟醇(6.57%)、香茅醛(6.47%)。山苍子精油对白假丝酵母菌具有良好的抗菌活性,当山苍子精油质量浓度为0.25 mg/mL处理4 h时,白假丝酵母菌生长已停滞。通过扫描电子显微镜观察菌体的微观结构发现,山苍子精油处理白假丝酵母菌菌体后,后者细胞壁受损,细胞变形、萎缩,随着山苍子精油量的增加,对细胞膜的损伤作用增强。此外,山苍子精油处理后白假丝酵母菌细胞膜完整性被破坏,通透性增加,胞内离子动态失衡,大分子物质泄漏,导致白假丝酵母菌代谢紊乱,菌体裂解死亡。本研究初步探究了山苍子精油对白假丝酵母菌细胞膜屏障影响的机理,可为将山苍子精油添加在发酵蔬菜汁和奶制品中抑制白假丝酵母菌提供理论依据,并对评估山苍子精油及其生物活性化合物在食品加工与保存中的进一步研究开发利用具有一定的意义。

