基于虚拟筛选、分子对接和分子互作解析两种大球盖菇十肽的呈味特性和ACE 抑制活性作用机制
李 文,陈万超,马海乐,吴 迪,张 忠,杨 焱,
(1.上海市农业科学院食用菌研究所,上海 201403;2.江苏大学食品与生物工程学院,江苏镇江 212013)
大球盖菇,又名赤松茸,是以稻秸秆为主要栽培基质生长的草腐菌,在上海郊区广泛种植,为农业废弃物的循环利用提供了新途径。大球盖菇子实体滋味鲜美,富含蛋白质、肽及氨基酸等营养物质,不仅能带来愉悦的味觉感受,在保障人体健康中也发挥着重要的营养作用和生物活性。成熟的大球盖菇子实体中蛋白含量可达到40%~50%干重,游离肽含量可达到11%~14%干重[1]。大球盖菇是开发天然风味基料和营养健康产品的优质原料。
血管紧张素转化酶(angiotensin-I converting enzyme,ACE)在诱导体内血压升高中起到关键作用,是治疗高血压、心力衰竭等疾病的理想药物靶点[2]。ACE 抑制肽能够抑制ACE 的活性,从而起到降血压的作用。食源性ACE 抑制肽具有高生物活性、低毒性,且易于在体内代谢,不会表现出抗高血压药物常见的副作用,对患高血压、心血管疾病等特殊人群有着重要的利用价值[3]。前期研究发现,多模式超声提取和辅助酶解制备的大球盖菇肽基料具有较好的降血压、抗氧化等生物活性,愉悦的咸鲜味呈味特性[1,4-5]。将味觉活性与食盐相当的咸鲜味呈味肽,以部分替代食盐的方式应用到食品领域,可降低因食盐摄入过量引发的高血压、冠心病等心血管疾病患病风险;同时,在不影响食品风味品质与保质期等前提下减少食盐的添加量,将天然食源性咸鲜味肽作为食盐的替代品,达到“减盐不减咸”目的,在国家倡导的减盐策略执行上,有着重要的研究意义。目前,以大球盖菇为原料开发兼具ACE 抑制功能活性及愉悦呈味特性的风味活性肽研究较少,肽的功能活性和呈味特性联动作用机制尚未有报道。因此,进一步挖掘大球盖菇风味活性肽,解析其活性、呈味机制,推进其在食品、药品领域的应用,仍然十分有必要。
近年来,肽组学及生物信息学方法在食品科学中的重要性与日俱增[6-7]。国内外学者已有较多的应用肽组学分析方法解析食源性肽功能活性或呈味结构基础,利用分子对接、分子互作等技术手段探究食源性肽活性作用机制[8-11]或呈味感知机制[12-15]。本研究基于前期采用肽组学等方法构建的大球盖菇十肽肽谱库(94 种,http://139.224.23.107),以二级质谱峰面积排名前十、峰面积相当的两种大球盖菇十肽RIEDNLVIIR(质谱峰面积2.58×10-7)和SLPIKPRVPF(质谱峰面积2.17×10-7)为研究对象,采用虚拟筛选、分子对接和分子互作技术探究两种大球盖菇十肽的呈味特性、ACE 抑制活性作用机制,为大球盖菇风味活性肽开发利用提供理论依据。
1 材料和方法
1.1 材料与仪器
DOJINDO 同仁化学ACE Kit-WST 试剂盒上海宥露生物科技有限公司;ACE 受体蛋白 北京艾普希隆生物科技有限公司;Genemore G-MMIGT 生物素化试剂盒 江苏博美达生命科学有限公司;两种大球盖菇十肽 委托吉尔生化(上海)有限公司对两种大球盖菇十肽RIEDNLVIIR(RR-10)和SLPIKPRVPF(SL-10)进行合成,合成肽纯度大于98%;柠檬酸、蔗糖、异亮氨酸、氯化钠、谷氨酸钠北京索莱宝科技有限公司;其他试剂(分析纯)国药集团化学试剂有限公司。
TS-5000Z Insent 电子舌味觉分析系统 北京盈盛恒泰科技有限责任公司;Bio-Tek Epoch 2 酶标仪 美国BioTek 公司;Allegra 25R 高速冷冻离心机 美国Beckman 公司;MS3002TS/02 电子天平 梅特勒-托利多国际贸易(上海)有限公司;TA NANO ITC 等温滴定量热仪 沃特世科技(上海)有限公司;ForteBio Octet Red96e Biolayer Interferometry(BLI)实时无标记分子相互作用仪 美国ForteBio 公司;GE PD MiniTrap G-25 预装脱盐柱 GE 公司。
1.2 实验方法
1.2.1 大球盖菇十肽呈味特性及活性预测 利用BIOPEP-UWM(https://biochemia.uwm.edu.pl/biopepuwm/)的Sensory peptide and amino acids 模块,预测RR-10 和SF-10 的呈味特性及呈味肽片段[5]。利用BIOPEP-UWM 的Bioactive peptide 模块,预测RR-10 和SF-10 是否是潜在的ACE 抑制剂及其潜在的活性肽片段[16-17]。利用BIOPEP-UWM 的Enzyme(s)action 模块,预测RR-10 和SF-10 经胃肠蛋白酶消化后潜在的活性肽片段及其抑制率[18]。采用admetSAR(http://lmmd.ecust.edu.cn/admetsar1/predict/)预测肽的血脑屏障穿透性、肠道上皮细胞Caco-2 细胞穿透性和AMES toxic 急性口服毒性[19]。
1.2.2 大球盖菇十肽呈味特性分析 采用TS-5000Z Insent 电子舌味觉分析系统对RR-10 和SF-10 的呈味特性及呈味强度进行分析。准确称取0.1 g 合成肽,加入100 mL 纯水溶解,逐级稀释为浓度梯度1.0、0.75、0.5、0.375 和0.25 mg/mL 的肽溶液。以同浓度梯度的氯化钠(NaCl)和谷氨酸钠(MSG)做呈味对照[5]。
1.2.3 大球盖菇十肽体外ACE 抑制活性分析 准确称取0.1 g 合成肽,加入50 mL 纯水溶解,逐级稀释为浓度梯度2.0、0.4、0.08、0.016 和0.0032 mg/mL的肽溶液。采用DOJINDO ACE Kit-WST 试剂盒对肽溶液的ACE 抑制活性进行测定,分析方法同试剂盒方法。以样品浓度和抑制率做ACE 抑制活性曲线,计算抑制率50%时的样品浓度(IC50)。
1.2.4 大球盖菇十肽ACE 抑制机制预测 从PDB数据库中获得ACE 受体蛋白(1O8A)的晶体结构作为靶标蛋白。利用分子对接技术,分析大球盖菇十肽与ACE 受体结合程度。以肽-受体结合打分值、成键数量及氨基酸残基结合能为指标,筛选紧密结合的肽-受体复合物,解析肽-受体结合方式和结合位点,预测大球盖菇十肽的ACE 抑制作用机制[4]。
1.2.5 大球盖菇十肽ACE 抑制机制验证 采用ITC和BLI 分子相互作用仪分析十肽和ACE 受体之间的结合模式。
将PBS 缓冲液配制的ACE 受体蛋白溶液注射到ITC 样品池中,样品池温度25 ℃,搅拌器转速1000 r/min,开始至第一次滴定间隔时间60 s,总注射次数20 次,单次注射缓冲液配制的肽配体溶液2 μL,两次滴定时间间隔150 s,单次注射时间2 s。测量受体蛋白、肽分子结合过程中反应体系温度变化情况,ITC Nano 分析软件计算受体配体结合亲和力(KD)、化学计量(N)、焓(ΔH)和熵(ΔS),对受体、配体是否有相互作用进行验证。
将PBS 缓冲液配制的ACE 受体蛋白溶液进行蛋白生物素化。蛋白生物素化孵育30~60 min 后进行脱盐处理。BLI 的4 根SSA 传感器固化生物素化的蛋白,4 根传感器做参比电极。设置基线平衡时间60 s,负载样本时间800 s,基线平衡时间60 s 程序固化受体蛋白。设置基线平衡时间60 s,结合时间120 s,解离时间120 s 生物分子互作循环程序进行受体蛋白与肽分子结合、解离互作反应。使用BLI 分析程序获取受体与肽配体间结合常数Kon、解离常数Koff、亲和力KD等动力学相关信息,确定ACE 受体与肽配体互作结合模式。
1.3 数据处理
采用电子舌味觉分析系统软件进行肽段呈味强度数据采集及处理,试验所得数据以3 次测定结果的平均值±标准差表示。肽段抑制活性采用Excel 软件处理和分析。采用MOE 2019 进行分子对接、结合方式和结合位点分析。采用GraphPad Prism 9 软件绘制ITC 和BLI 分析程序获得的热力学和动力学数据。
2 结果与分析
2.1 大球盖菇十肽呈味特性及活性预测分析结果
BIOPEP-UWM 分析预测的大球盖菇十肽呈味及活性片段结果显示,RR-10 具有呈咸鲜味的ED 肽片段,SF-10 具有呈咸味提升的RV 肽片段。RR-10和SF-10 均是潜在的ACE 抑制剂。RR-10 具有的ACE 抑制活性肽片段为IE;SF-10 具有的ACE 抑制活性肽片段为IKP、PR、VP、KP 和LP。
由BIOPEP-UWM 虚拟酶切位点分析结果可知,RR-10 经胃蛋白酶和胰蛋白酶连续消化后,理论水解度为11.11%。RR-10 存在一个胃蛋白酶酶切位点L-V。RR-10 及胃蛋白酶酶切片段RIEDNL、VIIR 不能进一步被胰蛋白酶酶切,由此推测RR-10 及其消化肽片段通过细胞旁转运和跨胞途径被小肠上皮细胞完整吸收。SF-10 存在一个胃蛋白酶酶切位点L-P,两个胰蛋白酶酶切位点K-P 和R-V。SF-10 经胃蛋白酶和胰蛋白酶消化理论水解度为40%,产生的潜在抑制ACE 活性肽片段PR。SF-10模拟消化后产生的活性肽片段分子量低,可通过载体介导(PepT1 介导)转运到细胞内部发挥活性作用[20]。基于admetSAR 预测结果可知,RR-10 和SF-10 均无毒(Non AMES toxic,评价数值分别为0.6671 和0.7318),血脑屏障透过性(评价数值分别为0.8235 和0.9928)和Caco-2 细胞穿透性(评价数值分别为0.7015 和0.7849)良好。
2.2 大球盖菇十肽呈味特性验证结果
大球盖菇十肽电子舌呈味分析结果显示,RR-10 具有咸味和浓厚感呈味特性,SF-10 具有鲜味和浓厚感呈味特性。RR-10 在1.0 mg/mL 时开始呈现较优的咸味呈味强度,等同于同浓度NaCl 呈咸强度的1.86 倍。SF-10 在低浓度下即可达到较好的呈鲜效果,与同浓度MSG 呈鲜强度相当;随着肽段浓度增加,呈鲜效果反而减弱(表1)。相较于MSG 在一定浓度范围(0.25~1.0 mg/mL)内呈鲜强度与剂量浓度正相关的呈味特性,电子舌评价结果显示SF-10 与MSG 呈味机制明显不同,SF-10 的呈鲜机制有待进一步解析。因此,在一定配比浓度下,RR-10 可作为增咸剂、SF-10 作为增鲜剂,应用于天然调味品开发。

表1 大球盖菇十肽RR-10 和SF-10 呈味特性评价结果Table 1 Evaluation results of the taste characteristics of the decapeptides RR-10 and SF-10 from Stropharia rugosoannulata
2.3 大球盖菇十肽体外ACE 抑制活性分析结果
RR-10 在配制浓度0.4 mg/mL 时,其体外ACE抑制率可达到92.61%±0.51%;SF-10 在2.0 mg/mL时,体外ACE 抑制率为83.41%±0.49%;RR-10 和SF-10 均具有体外ACE 抑制活性。从两种十肽体外ACE 抑制率拟合曲线计算可知,RR-10 和SF-10 的ACE 抑制IC50值分别0.012 mg/mL 和0.221 mg/mL。一定浓度范围内(0.0032~2.0 mg/mL),RR-10 体外ACE 抑制效果优于SF-10。
2.4 大球盖菇十肽ACE 抑制机制分析结果
两种十肽与ACE 受体分子对接结果图1~图3所示。RR-10 和SF-10 均可进入ACE 受体的活性空腔(图1)。RR-10 与ACE 受体对接得分-15.05(同一肽段-受体不同构象结合得分越低,形成的复合物越稳定),RR-10 与ACE 的氨基酸残基GLU403、GLU411、GLU384 等形成14 个氢键和5 个离子键。RR-10 中R1、I2、E3、N5 和R10 是与受体形成相互作用的氨基酸残基,其中,R1 和R10 与受体之间形成的结合键数量多,结合键能量均较低,在维持肽-受体形成的复合物稳定性中发挥重要作用(图2A,图3A)。SF-10 与ACE 受体对接得分-14.69。SF-10与ACE 受体形成9 个氢键和8 个离子键相互作用。ASP415、LYS454、GLU403、ARG124 等是ACE 受体中结合到SF-10 的关键氨基酸残基。肽段中S1、I4、K5、R7、V8 和F10 均与ACE 受体产生相互作用,其中,S1、R7 和F10 与ACE 受体氨基酸残基之间形成的结合键能量低,成键数量多,是SF-10 中发挥主要结合作用的氨基酸残基(图2B,图3B)。综上所述,氢键和静电相互作用是两种十肽与ACE 受体的主要作用方式。肽段C、N 端氨基酸残基及肽段中的R 残基,易被受体识别形成结合能量较低的作用键。两种十肽可与ACE 受体活性口袋氨基酸残基(ALA354、GLU384 和HIS353)[19,21]、锌离子(Zn701,2.98 Å和2.08 Å)或结构域上的关键氨基酸强结合,是肽段具有ACE 抑制活性的主要原因。RR-10 与ACE 受体活性口袋氨基酸残基、锌离子之间的结合键数量及结合强度,均高于SF-10,说明RR-10 的氨基酸序列组成及空间结构,更易被ACE受体识别及结合,这可能是RR-10 的ACE 抑制活性高于SF-10 的主要原因。
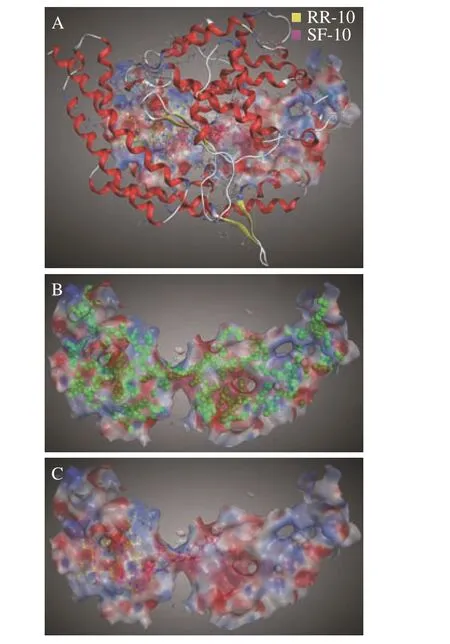
图1 大球盖菇十肽与ACE 相互作用3D 图Fig.1 3D interaction plots between peptides and ACE receptor
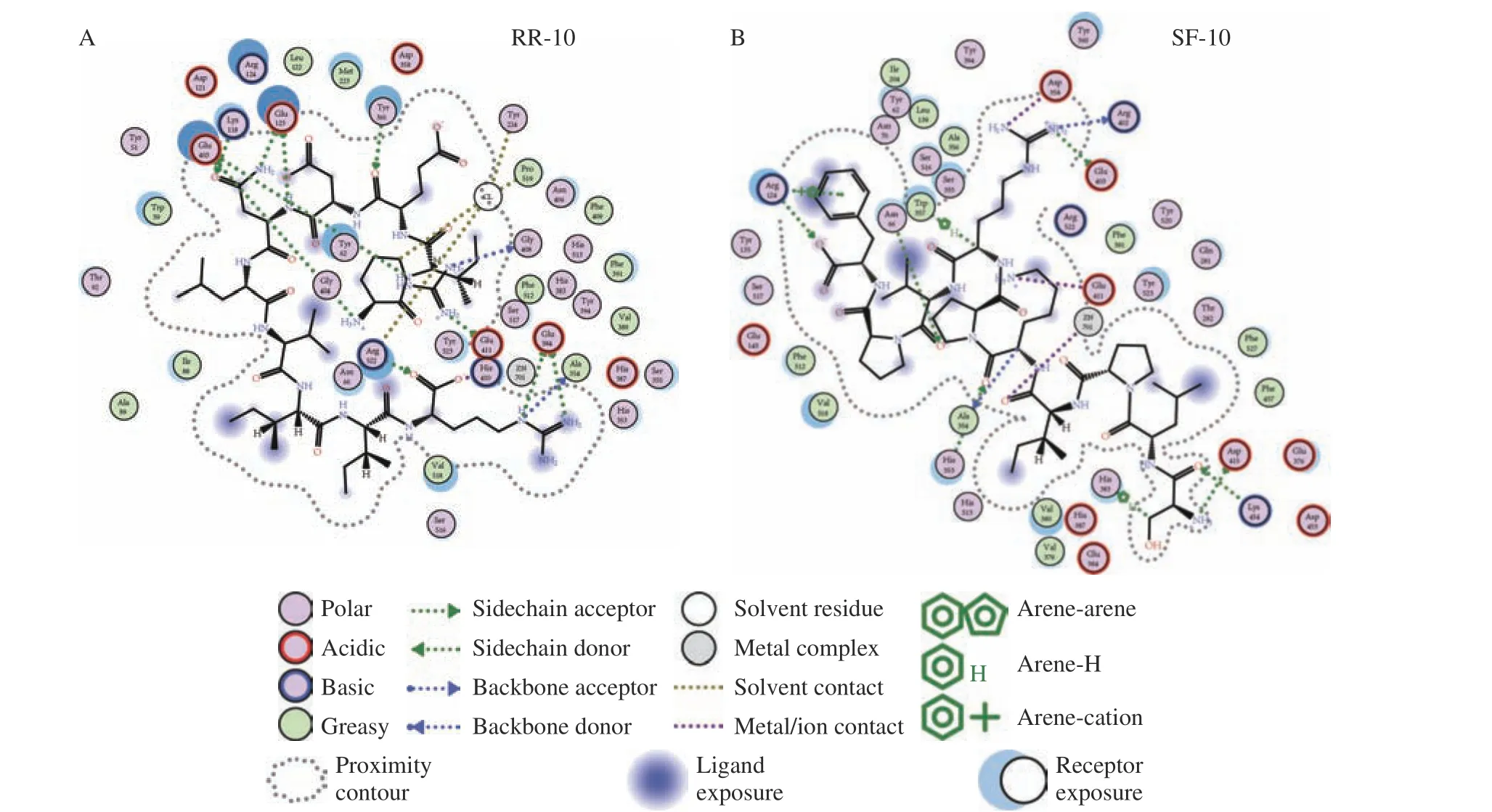
图2 大球盖菇十肽与ACE 受体互作2D 图Fig.2 2D interaction plots between peptides and ACE receptor
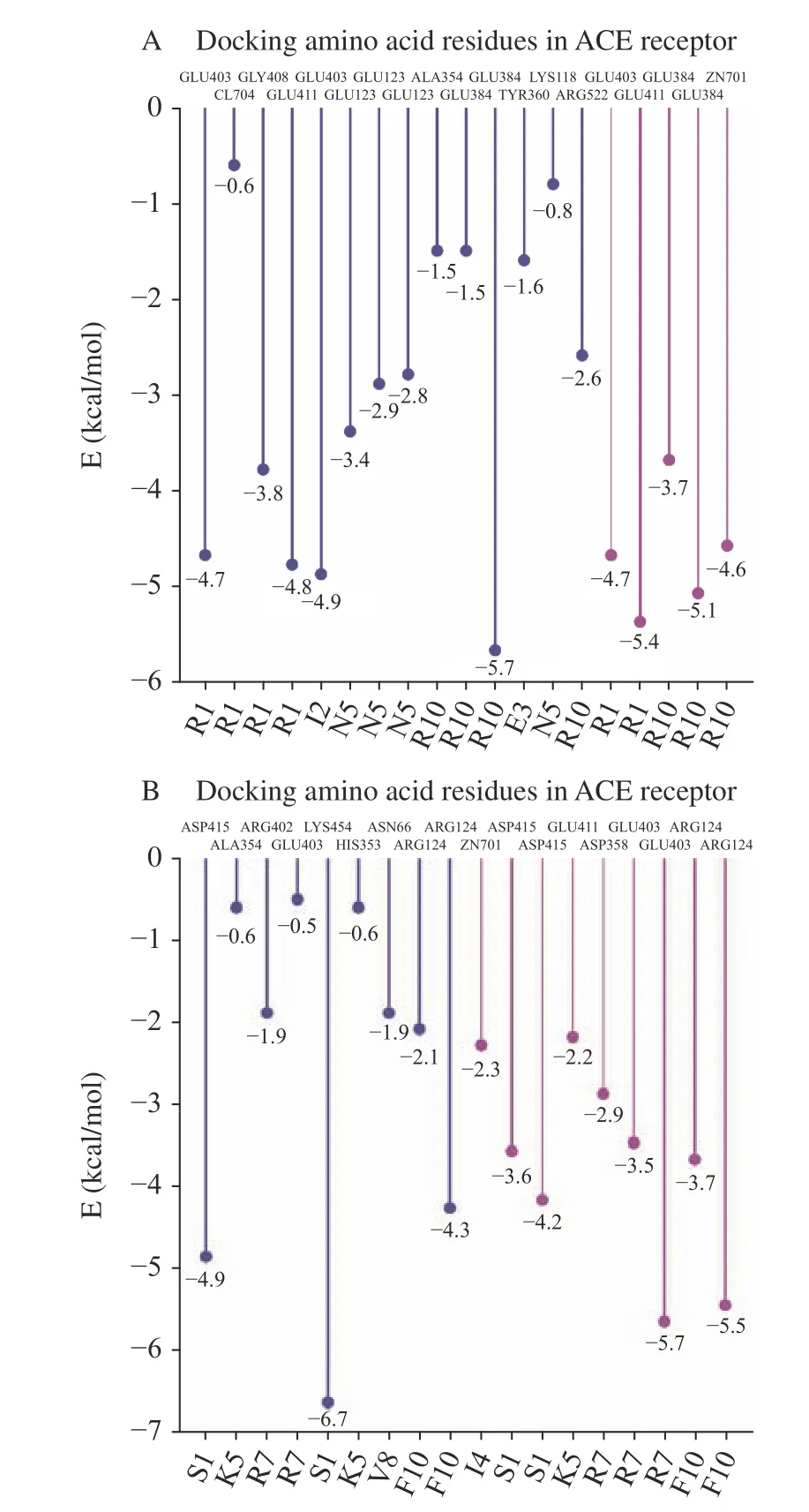
图3 大球盖菇十肽与ACE 受体互作结合能量图Fig.3 Docking amino acids and binding emerge between peptides and ACE receptor interactions
考虑到大球盖菇十肽RR-10 体外ACE 抑制活性、分子对接预测的ACE 受体结合抑制作用效果更好,采用RR-10 进行分子互作热力学和动力学层面的ACE 抑制机制研究。大球盖菇十肽RR-10 与ACE 受体之间结合反应热力学结果如图4 所示。在RR-10 与ACE 受体的结合反应中,热力学结合常数为1.471×10-4,焓值(ΔH)和熵值(ΔS)的变化均为负值,表明RR-10 与ACE 受体的结合反应是焓驱动反应。研究表明,焓驱动反应比熵驱动反应更有利于活性肽对ACE 的抑制作用[9]。RR-10 和ACE 受体之间结合反应动力学结果显示(图5),RR-10 与ACE受体之间属于特异性结合,动力学结合常数为5.61×10-4。分子互作热力学和动力学结果表明,焓驱动反应的RR-10 与ACE 受体特异性结合,是生物分子基团之间的氢键和静电结合,这与分子对接结果具有一致。
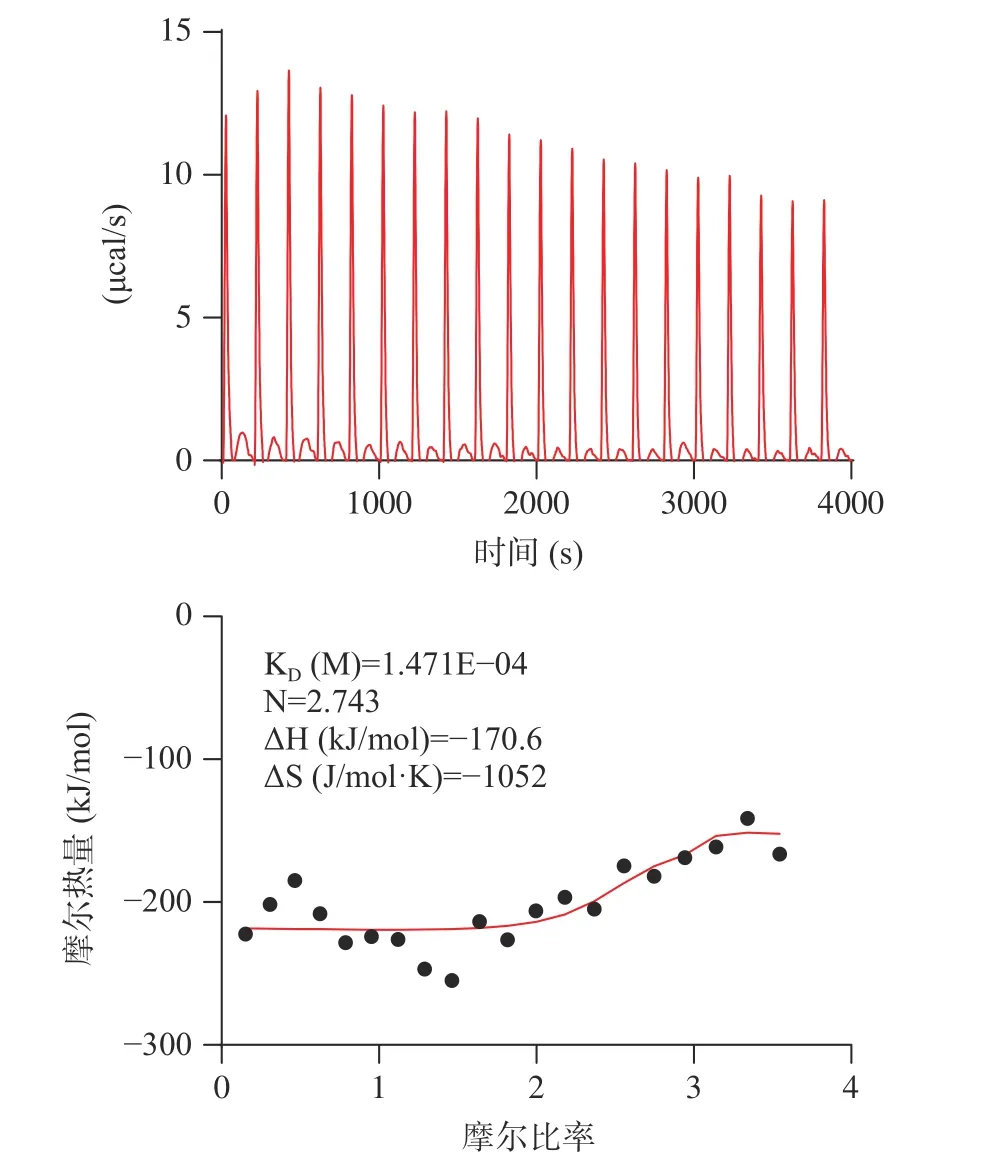
图4 大球盖菇十肽RR-10 与ACE 受体相互作用分子热力学图Fig.4 Molecular thermodynamics diagram of RR-10 interacting with ACE receptors
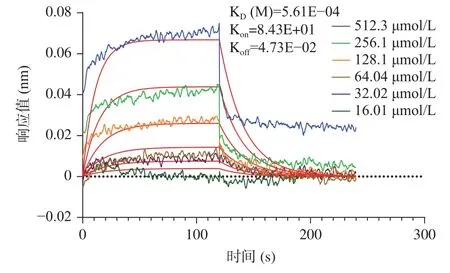
图5 大球盖菇十肽RR-10 与ACE 受体相互作用分子动力学图Fig.5 Molecular dynamics diagram of RR-10 interacting with ACE receptors
3 讨论与结论
食源性活性肽因来源广泛,安全性高,靶向效果好,近十年在临床及临床前研究中比例大幅度提升[22]。活性肽在降血压[9,23-26]、降血糖[27-30]、降血脂[8,31]等保健食品和药物开发上具有良好潜力和应用前景。基于肽组学、分子对接等技术开展的食源性功能肽、肽与靶标受体蛋白互作机制研究,已取得突破性进展。Li 等[25]从郫县豆瓣酱中获得的ACE抑制肽RGLSK,可与ACE 受体的ALA354,TYR523和GLU384 形成氢键、与Zn2+形成配位键相互作用。Ma 等[32]从纹鳢水解产物中筛选出潜在的ACE抑制肽,氢键、静电和疏水相互作用是肽段与ACE受体的主要作用方式。Wei 等[26]从酒糟中鉴定得到的IC50值较好(50.01 μmol/L)且含量较高的ACE 抑制肽PR,与ACE 受体结合为竞争性抑制结合方式。Fu 等[33]从牛胶原蛋白中分离得到的ACE 抑制肽,未与ACE 受体口袋活性氨基酸残基结合,主要通过非竞争机制显示ACE 抑制活性。本研究基于BIOPEP-UWM 肽谱库等虚拟筛选及预测,获得了两种大球盖菇十肽RR-10 和SF-10 的特征性呈味和活性肽片段、消化特性、毒理性等理论评价结果。体外呈味及活性验证结果表明,RR-10 和SF-10 在一定浓度配比下,可呈现愉悦咸鲜味呈味特性;RR-10具有较优的ACE 抑制活性(IC50,0.012 mg/mL)。两种大球盖菇十肽可与ACE 靶标蛋白受体结合形成氢键和静电相互作用,与已报道文献研究结果具有一致性。基于分子互作热力学和动力学技术解析的大球盖菇十肽RR-10,与ACE 靶标受体焓驱动反应特异性结合发挥ACE 抑制活性,为食源性肽ACE抑制机制验证及解析提供方法和思路。
风味肽分子量低,能带来愉悦的味觉感受,可与食盐、谷氨酸钠等相互作用提升食品咸鲜味醇厚口感,增强滋味丰富度和协调性[34-36]。开发兼具功能活性和呈味特性的风味活性肽产品,既可在保障人体健康中发挥重要的营养作用和生物活性,亦可满足消费者对天然高品质呈味基料、风味休闲食品的需求,具有广阔的应用前景。本研究基于虚拟筛选、体外呈味及活性评价、分子对接和分子互作技术解析的大球盖菇十肽呈味特性和ACE 抑制作用机制,还未与真正的味觉传感、生理作用产生直接联系。考虑到不同技术的检测原理不同,检测结果之间的相同趋势是值得关注的。未来仍需进一步开展基于感官受体、胃肠受体分子互作过程中的呈味机制和活性作用机制解析,为开发兼具功能活性及风味特性的大球盖菇风味活性肽提供理论支撑。

