甲维盐注干施药对马尾松内生真菌和细菌多样性的影响
刘鹏,姜壮,初楚,毛赟来,张绍勇
(1. 安吉县人民政府孝源街道办事处,浙江 湖州 313000;2. 浙江农林大学 生物农药高效制备技术国家地方联合工程实验室,浙江 杭州 311300;3. 湖州师范学院 生命科学学院,浙江省媒介生物学与病原传播控制重点实验室,浙江 湖州 313000 )
植物体内生菌包括真菌、细菌及放线菌,可定殖于植物器官、组织内部以及细胞间隙中[1-2]。内生菌与宿主植物协同进化、互利共生,宿主植物为内生菌提供营养物质和生存空间,内生菌经代谢途径产生如生长激素、抗生素、蛋白酶等代谢产物,进一步促进宿主植物的生长发育或抑制其他外来生物侵害[3-4]。内生菌还协助参与植物某些活性成分和次生代谢产物的合成,同时代谢产物还可提高宿主植物对外界恶劣环境的抗逆性和抗病性[5]。Wu 等[6]证实了三七Panaxnotoginseng内生菌的丰富度可影响宿主植物的正常发育,Fadaei 等[7]发现杜鹃Rhododendronsimsii内生菌增强了宿主植物的耐盐性。植物内生菌群落结构与植物健康存在关联,植物内生菌的筛选和利用将为生物防治提供新的方向,也可作为评估植物健康状态的依据。
马尾松Pinusmassoniana内生菌研究和松材线虫Bursaphelenchusxylophilus病相关联。袁文婷[8]首次在马尾松上分离得到20 株内生细菌,通过平板对峙试验筛选出了NSM-05、NSM-17、NSM-17 三株对病原菌有良好拮抗作用的益生细菌;从马尾松上分离筛选出对松材线虫有活性的益生菌还有解淀粉芽孢杆菌Bacillus amyloliquefaciens、短小芽孢杆菌B.pumilus、蜡样芽孢杆菌B.cereus、寡养单胞菌Stenotrophomonassp.、芽孢杆菌Bacillussp.、铜绿假单胞菌Pseudomonasaeruginosa等[9-12]。松材线虫能取食大多数内生真菌,从而完成其生活史[13-14];从健康马尾松树上分离到的内生菌芽孢杆菌,其代谢产物可致使衰弱松树产生与松材线虫病类似的症状[15]。故而马尾松内生菌的多样性变化将影响松材线虫种群的变化,进而影响病害的发生。
甲维盐注干施药是目前防治松树松材线虫病的有效方法,且对松树和生态环境安全。与传统施药方式相比,甲维盐注干防治可减少药剂浪费、降低环境污染,从而提高利用率,不仅防治效果显著且对非靶标生物较为安全[16-18]。目前,有关甲维盐注干施药后的防治效果、残留检测和传导分布方面的报道较多[19-21],但针对树体微环境上,注干施药影响下的马尾松树体内真菌和细菌多样性的研究报道较少。为评价甲维盐树干注射在马尾松林中的生态安全性,OUYANG 等[22]从宏观上研究了树干注射不同时期土壤节肢动物和飞行昆虫的群落多样性和群落组成,结果表明甲维盐对总土壤节肢动物和飞行昆虫(膜翅目Hymenoptera 昆虫)多样性指数无显著影响,但对土壤节肢动物的有害动物多样性指数有显著影响,表明甲维盐注干施药对生态环境的影响是积极的。
本文基于高通量测序技术对马尾松主干内生真菌的rDNAITS1 基因和内生细菌的16srRNA基因进行提取并测序,首次对甲维盐注干前后马尾松树的内生真菌和内生细菌多样性、群落组成特征进行研究,以期为马尾松生长健康评价、生态安全评价、真菌和细菌的多样性资源保育以及森林可持续经营管理等方面提供科学参考。
1 材料与方法
1.1 样本采集
试验样地于浙江省杭州市临安区(30°29′ N,119°75′ E)海拔89 ~ 114 m 的针阔混交林内,面积约为0.33 hm2,当年无松材线虫病致死的枯死木,相邻山头有松材线虫病发生,马尾松死亡率小于0.1%。随机选择20 株健康马尾松,于2022 年4 月20 日打孔注干2.3%甲维盐微乳剂(浙江钱江生物化学股份有限公司),其余健康马尾松为对照。采样时间为2022 年9 月20 日,随机采集注药处理3 株,依次编号为EB1、EB2 和EB3;对照3 株,依次编号为CK1、CK2 和CK3,采集样品信息如表1。所采集马尾松样本均为20 ~ 35 年生,胸径为14 ~ 25 cm,树高为6.0 ~ 8.5 m。采集前对包装袋、柴刀等采集工具进行灭菌,采集时先用柴刀劈掉钻孔点树皮,每次钻孔前均用75%酒精对钻孔点和钻头消毒20 ~ 30 s。同一株马尾松随机钻孔三个点,钻孔点距地面分别为0.5 m、1.0 m、1.5 m,钻孔深度为10 cm,孔直径为7 mm,取三个点的木屑混合均匀为一个样本,立即密封冰盒保存,放于-80℃冰箱保存,待测。用高枝剪取6 株马尾松样株的枝条,枝长为20 cm,直径为4 ~ 6 cm,向阳和背阴向各一枝,同时用斧头劈开树皮取主干质量约20 g 木屑,并做好标记,密封带回。于室内剪碎取同等质量木屑,采用贝尔曼漏斗法进行线虫分离,镜检并统计松材线虫头数。经检测,所有样本中均未检出松材线虫,如表1。

表1 马尾松各样本采集信息Tab. 1 Sampled P. massoniana in the sample plot
1.2 马尾松内生真菌和内生细菌的高通量测序及分析
1.2.1 DNA 提取和PCR 扩增 基因组DNA 提取:使用TGuide S96 磁珠法土壤基因组DNA 提取试剂盒[天根生化科技(北京)有限公司,型号:DP812]分别提取6 个样本的总DNA,具体操作参照使用说明书。DNA 经1.8%琼脂糖凝胶电泳检测其浓度和纯度。
聚合酶链式反应(Polymerase chain reaction, PCR)扩增:以基因组DNA 为模板进行PCR 扩增。细菌16s rDNAV3+V4高变区使用通用扩增引物为338F-5’-ACTCCTACGGGAGGCAGCA-3’和806R-5’-GGACTACHVGG GTWTCTAAT-3’;真菌ITS 扩增引物为ITS1F-5’-CTTGGTCATTTAGAGGAAGTAA-3’和ITS2-5’-GCTGCGTT CTTCATCGATGC-3’。采用TransStart FastPfu Fly DNA Polymerase,PCR 扩增(10 μL 反应体系:95 ℃预变性5 min,95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸40 s,25 个循环,最后72 ℃延伸7 min;20 μL 反应体系:98 ℃预变性30 s,98 ℃变性10 s,65 ℃退火30 s,72 ℃延伸30 s,10 个循环,最后72 ℃延伸5 min),扩增产物经电泳检测、定量及混样、纯化后,利用Monarch DNA 胶回收试剂盒对目标片段进行回收。
1.2.2 上机测序 6 个样本DNA 委托北京百迈克生物科技有限公司完成测序,测序平台为Illumina NovaSeq 6 000 高通量测序仪。
1.2.3 序列处理与分析 使用 Trimmomatic v0.33 软件和Cutadapt 1.9.1 软件对原始测序序列Raw Reads 进行质量过滤得到高质量序列Clean Reads;使用QIIME2 2020.6[23]中的dada2[24]方法聚类或去噪,经双端序列拼接、去除嵌合体序列得到最终序列;在相似性97%水平上聚类,获得运算分类单位(operational taxonomic units, OTUs),细菌以SILVA 为参考数据库,真菌以UNITE 为参考数据库,使用朴素贝叶斯分类器对特征序列进行分类学注释,得到特征对应的物种分类信息,统计各样品群落组成,利用QIIME 软件生成不同分类水平上的物种丰度表,再利用R 语言等工具对物种丰度分布、Alpha 多样性指数、稀释性曲线、等级丰度曲线、主成分分析、相关性分析。以上分析均在北京百迈克生物科技有限公司BMKCloud 云平台网站(http://console.biocloud.net/)完成。
1.3 数据处理
应用Excel 2016 软件整理和汇总常规数据,用SPSS 20.0 软件处理和统计分析相应数据。
2 结果与分析
2.1 高通量测序数据分析
2.1.1 高通量测序深度和OTUs 分析 对6 个样本的高通量测序共获得细菌480 050 对测序序列(Reads),经双端Reads 质控、拼接后共产生479 354 条Clean Reads,每个样品至少产生79 734 条,平均产生79 892 条。物种聚类结果为1 界27 门52 纲126 目206 科340 属368 种细菌。共获得真菌2 798 314 对Reads,经双端Reads质控、拼接后共产生2 784 536 条Clean Reads,每个样品至少产生396 521 条,平均产生464 089 条,物种聚类结果为1 界15 门48 纲117 目271 科594 属941 种。
聚类共得到OTUs 细菌1 169 个、真菌7 250 个。未注药组(Group 1,记为G1)为CK1、CK2 和CK3,注药组(Group 2,记为G2)为EB1、EB2 和EB3。各样本OTUs、共有数和组间共有数统计如表2。其中,细菌G1、G2 的OTUs 总数分别为686 个和623 个,共有OTUs 数分别为26 个和29 个,共有OTUs 数占总数的百分比分别为20.41%和22.47%,共有数组间变化不明显,两组共有OTUs 数为140 个;真菌G1、G2 的OTUs 总数分别为4 206 和3 595 个,共有OTUs 数分别为316 个和89 个,共有OTUs 数占总数的百分比分别为13.1%和15.33%,两组共有OTUs 数为551 个。表明马尾松不同样本间的内生菌群落组成结构复杂,都具有特有的微生物多样性。细菌OTUs、特有数和共有数在数量上无明显差异,但在真菌中,注药组G2 的OTUs、特有数和共有数在数量上明显少于未注药组G1,G1 的共有数是G2 的3.5 倍,与对照组相比,注药处理组共有OTUs 数减少71.84%。表明注药处理组对马尾松内生细菌OTUs 数量影响不明显,但注药降低了马尾松内生真菌中OTUs 共有数。

表2 各样本OTUs 统计Tab. 2 OTUs of each sample
2.1.2 马尾松主干内微生物群落的物种组成比较
(1)门水平的物种相对丰度。马尾松样本内生菌中优势细菌和真菌在门水平的物种相对丰度如图1。

图1 门水平马尾松细菌(A)和真菌(B)的相对丰度柱状图Fig. 1 Relative abundance of bacteria (A) and fungi (B) at phylum level in P. massoniana
由图1 可知,6 个样本中的微生物群落多样性均较高,细菌和真菌的优势门均达10 个门以上。细菌(图1A)优势菌门为蓝藻门Cyanobacteria、细菌未分类门unclassified Bacteria、变形菌门Proteobacteria、厚壁菌门Firmicutes、放线菌门Actinobacteriota、酸杆菌门Acidobacteriota、拟杆菌门Bacteroidota、绿弯菌门Chloroflexi、芽单胞菌门Gemmatimonadota 和梭杆菌门Fusobacteriota,10 类菌门占细菌门总数相对丰度的96%以上。其中,蓝藻门的相对丰度最高,占92.32% ~ 95.12%,其次是变形菌门,占2.33% ~ 2.84%。可见,蓝藻门和变形菌门是所有样本中的主要细菌类群,且注药前后其相对丰度无明显差异。真菌(图1B)优势菌门包括子囊菌门Ascomycota、担子菌门Basidiomycota、真菌未分类门unclassified Fungi、被孢霉门Mortierellomycota、隐菌门Rozellomycota、壶菌门Chytridiomycota、毛霉门Mucoromycota、球囊菌门Glomeromycota、油壶菌门Olpidiomycota 和梳霉门Kickxellomycota,10 类菌门占真菌门总数相对丰度的90%以上。其中,子囊菌门的相对丰度最高,占56.69% ~64.27%,其次为担子菌门,占19.11% ~ 25.82%。可见,子囊菌门和担子菌门是所有样本中的主要真菌类群,且注药前后相对丰度无明显差异。
(2)属水平的物种相对丰度。马尾松样本内生菌中优势细菌和真菌在属水平的物种相对丰度如图2。
样本中优势细菌属(图2A)包括蓝细菌目未分类属unclassified Cyanobacteriales、细菌未分类属unclassified Bacteria、变形菌门未分类属unclassified Proteobacteria、念珠藻科未分类属(unclassified Nostocaceae)、α-变形菌纲未分类属unclassified Alphaproteobacteria、大肠杆菌属-志贺氏菌属Escherichia-Shigella、肠杆菌科未分类属unclassified Enterobacteriaceae、拟杆菌属Bacteroides、奈瑟菌属Neisseria和蓝细菌纲未分类属unclassified Cyanobacteriia。其中,蓝细菌目未分类属的相对丰度最高,占89.3% ~ 93.5%,其次为细菌未分类属、变形菌门未分类属、念珠藻科未分类属和α-变形菌纲未分类属。6 个样本在各细菌属水平下的相对丰度变化不明显。真菌(图2B)优势菌属包括真菌未分类属unclassified Fungi、色二孢属Diplodia、被孢霉属Mortierella、子囊菌门未分类属unclassified Ascomycota、腐质霉属Humicola、镰刀霉属Fusarium、古根菌属Archaeorhizomyces、枝孢霉属Cladosporium、粪壳菌纲未分类属unclassified Sordariomycetes 和青霉属Penicillium。其中,色二孢属的相对丰度在对照株样品中最高,占8.9% ~ 14.6%,但在注药处理株中仅占0.000 5% ~ 1.31%;被孢霉属、镰刀霉属、古根菌属、枝孢霉属、青霉属在所有样品中分别占2.4% ~ 9.3%、1.3% ~ 5.2%、0.4% ~ 3.7%、0.8% ~ 5.5%、1.1% ~ 3.9%。可见色二孢属、被孢霉属、镰刀霉属、古根菌属和枝孢霉属是所有样本中的主要真菌类群。
2.2 马尾松主干内真菌和细菌α多样性分析
2.2.1 α 多样性及OTUs 丰度分析 将所有序列在97%的相似度水平进行OTUs 分类。经统计,各样本在不同OTUs 中的丰度信息,即真菌和细菌群落Alpha 多样性指数统计表(表3)。

表3 Alpha 多样性指数统计Tab. 3 Alpha diversity index
由表3 和表4 可知,经Student t 检验,P值均大于0.05,G1 组(CK1、CK2、CK3)和G2 组(EB1、EB2、EB3)组间细菌和真菌的ACE、Chao1、辛普森指数、香农指数和多样性指数差异不明显,说明组间样本真菌和细菌多样性无明显差异,主干施药对马尾松内生真菌和细菌多样性影响不大。6 个样本的覆盖度均在0.999 9 以上,表明测序数据基本覆盖6 个样本中所有真菌和细菌的生物信息,测序结果能够客观真实地反映样本中真菌和细菌的群落组成结构。

表4 属水平Metastats 统计分析组合Tab. 4 Metastats analysis at genus level

表4 Alpha 多样性指数组间差异分析Tab. 4 Difference analysis on Alpha diversity index
2.2.2 稀释性曲线和等级丰度曲线分析 稀释性曲线可用来检验测序数据量能否反映样本中物种多样性和丰富程度,等级丰度曲线解释样品所含物种的丰富度和均匀度。由图3A 和3B 显示,随着样本测序条数增加,稀释性曲线急剧上升,当细菌测序条数达40 000 条左右时,真菌测序条数达124 000 条左右时,稀释曲线趋于平缓,当测序数量再增加时,OTUs 数量增加不明显。表明所测序样本中已涵盖绝大多数的微生物物种信息,测序结果可以反映马尾松主干内真菌群落结构。由细菌的等级丰度曲线显示(图4A),6 个样品曲线宽度、平坦度均相近,表明样品中(细菌)物种的组成丰富度、均匀度相似。但图4B 显示,注药组EB1 和EB2 的曲线宽度、平坦度均低于未注药组和EB3,说明注药马尾松整体在真菌上的物种组成丰富度、均匀度低于未注药马尾松。

图3 细菌(A)和真菌(B)的Alpha 指数稀释性曲线Fig. 3 Alpha index dilution curve of bacteria (A) and fungi (B)

图4 细菌(A)和真菌(B)的等级丰度曲线Fig. 4 Rank abundance curve of bacteria (A) and fungi (B)
2.3 马尾松主干内真菌和细菌Beta 多样性分析
主坐标分析(PCoA)主要展现多个样品间的分类关系,基于杰卡德距离(Binary jaccard)算法,在所采集的6 个样本中的细菌(图5A)和真菌(图5B)中,PC1 和PC2 两个主坐标轴分别累计解释了物种变异信息的42.45%和46.78%。由图5A 显示,G1 样本间相对离散,G2 样本间相对聚集,表明G1 组样本间细菌群落差异明显,而G2 组样本间细菌群落差异不明显。由图5B 显示,G1 样本间相距较近,G2 样本间相对离散,表明G1 马尾松中内生真菌群落差异不明显,相似性高,但G2 马尾松中内生真菌群落差异较大。另外,G1 与G2 分别分布在PCoA 左轴和右轴,两组数据簇完全分开,并相距较远,说明注药马尾松与未注药马尾松真菌群落结构存在明显差异。
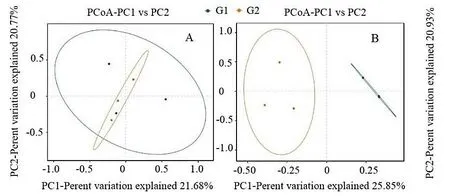
图5 细菌(A)和真菌(B)的PCoA 分析Fig. 5 Principal component analysis on bacteria (A) and fungi (B)
2.4 马尾松主干内真菌和细菌群落结构与胸径和生长状况的关系
RDA(Redundancy analysis)基于线性模型分析微生物群落与环境因子胸径(Diameter at Breast Height, DBH)和注药(Drug injection, DI)之间的变化相关性,如图6。
由图可知,细菌RDA 分析得出前2 个排序轴累积贡献率为35.58%,真菌RDA 分析得出前2 个排序轴累积贡献率为51.63%。在细菌群落结构中(图6A),DI(R2=0.970 5,P=0.1)与变形菌门未分类属呈正相关,但与大肠杆菌属-志贺氏菌和α-变形菌纲未分类属呈负相关;DBH(R2=0.974 8,P=0.01)与奈瑟菌属呈负相关。在真菌群落结构中(图6B),DBH(R2=0.891 8,P=0.03)与Humicola属和Mortierella属呈正相关,但与粪壳菌纲未分类属、真菌未分类属和芽枝霉属呈负相关;DI(R2=0.992 0,P=0.1)与镰刀霉属和青霉属呈正相关,但与色二孢属和子囊菌未分类属呈负相关。整体来说,影响马尾松主干内真菌和细菌群落结构的主要因素是DI和DBH,DBH 影响差异显著。
2.5 马尾松主干内真菌和细菌物种间相关性分析
6 个马尾松主干样本物种相关性分析结果显示(图7A、7B),内生细菌中,丰度较高的蓝细菌未分类属与细菌未分类属和念珠藻科未分类属呈负相关,但与大肠杆菌属-志贺氏菌属、鞘氨醇单胞菌属Sphingomonas和CandidatusUdaeobacter 属呈正相关,细菌未分类属与鲸杆菌属Cetobacterium和乳杆菌属Lactobacillus呈负相关,但与MND1 属和unclassified Vicinamibacteraceae 呈正相关。卷毛菇属Floccularia与色二孢属呈正相关,嗜热真菌属Thermomyces与被孢霉属呈负相关,Comoclathris与镰刀霉属呈正相关,汉纳酵母属Hannaella与枝孢菌属正相关,裂壳菌属Schizothecium与青霉属呈负相关,索状霉属Hormonema与Pezoloma呈正相关。
2.6 组间微生物群落Metastats 分析
利用Metastats 软件对组间的物种丰度数据进行t 检验,得到P值。属分类学水平下的组间差异显著性分析统计结果如表4。从表4 可知,在真菌群落中,二叉毛壳属Dichotomopilus、Cystodendron、Leptospora、刺孢菌属Subulicystidium、Pseudosigmoidea、亚侧耳属Hohenbuehelia和Microscypha只存在于G1 中。属水平丰度最高的色二孢属,在G1 中的丰度为12.1%,在G2 中丰度为0.44%,组间差异极显著。在细菌群落中,肠球菌属Enterococcus、拟普雷沃菌属Alloprevotella和理研菌科RC9 肠道群RikenellaceaeRC9 gut group 在两组间存在极显著差异,表现为肠球菌属和理研菌科RC9 肠道群在G2 中相对丰度较高,而拟普雷沃菌属则在G1 中相对丰度较高。整体表明注药马尾松中的真菌在属水平上的相对丰度显著低于未注药马尾松,而在细菌群落中影响相对较小。
3 结论及讨论
本文基于高通量测序研究了甲维盐注干使用后马尾松内生真菌和细菌群落结构的变化。甲维盐注干使用后,松树内生细菌和真菌在门、属水平上群落结构差异不明显,但显著降低了松树中真菌色二孢属的相对丰度。
研究发现,甲维盐注干使用后对松树中的色二孢属致病真菌有显著影响。色二孢属是世界性分布的病原真菌,是包括松树在内的木本植物的主要病原菌,在松树上可导致新梢枯死、坏死、小枝枯萎、冠层稀疏透光和树干溃疡等症状[25]。娄德钊[26]发现致病菌相对丰度升高与感病程度和发病阶段显著相关。甲维盐注干施药后,真菌群落组成中色二孢属的相对丰度显著降低,推测是甲维盐的间接作用。赵晓佳等[27]发现单独使用甲维盐对松材线虫携带致病细菌的AMA3-1 没有抑制作用,但甲维盐和高效抗生素环丙沙星、米诺环素混合使用可提高松材线虫病的防治效果。内生菌群落组成和其相对丰度等的变化将直接或间接影响植物的健康[3-7]。松树致病菌相对丰度降低,有利于松树健康。
采用高通量测序方法,更利于得到马尾松主干内生真菌和细菌真实的群落结构。魏珂[28]采用室内平板分离培养法分离鉴定了可培养的真菌和细菌,共鉴定出细菌12 属、真菌16 属,发现健康马尾松优势种群细菌为芽孢杆菌,真菌为拟盘多毛孢和青霉;温晓健等[29]共鉴定出细菌11 属、真菌19 属,发现优势菌群细菌为肠杆菌属Enterobacter,真菌为木霉属Trichoderma。本研究采用高通量测序鉴定出细菌340 属、真菌594 属,属水平的数量上远远高于室内平板分离鉴定所得到的,并发现优势内生菌为蓝细菌目未分类属和色二孢属真菌,补充了室内不可培养的真菌和细菌类群,但蓝细菌目细菌相对丰度占比高于90%,推测部分物种注释特征来源于树干质体和叶绿体的基因。
甲维盐注干施用一定程度上改变了松树内的微生物多样性,降低了松树致病菌色二孢属真菌的相对丰度,有助于提高松树抗病能力,有利于松树健康。

