安五脂素改善大鼠肝纤维化的效果及机制Δ
何秀义 ,安祯祥 ,何远利 ,刘义 ,何松 (.贵州中医药大学第一临床医学院,贵阳 55000;2.贵州中医药大学第一附属医院消化内科,贵阳 55000)
肝纤维化是多种致病因素(乙醇、药物、毒素等)导致的慢性肝损伤,以细胞外基质的异常沉积为主要特征,若患者得不到及时治疗,可能会引起肝硬化、肝癌等疾病,严重时还会威胁生命[1]。当肝脏受到损伤时,肝细胞发生凋亡,进而诱导肝星状细胞(hepatic stellate cells,HSC)、巨噬细胞、库普弗细胞产生促纤维化因子来促进HSC的反式分化和肌成纤维细胞的激活,导致肝纤维化[2]。因此,抑制肝细胞凋亡可减少HSC的激活,从而延缓肝纤维化的进程。
南五味子,也叫华中五味子,属木兰科,其药用部位为成熟的干燥果实,味酸,五行属木,入肝经,可滋肝阴、补肝体,具有收敛、益气生津、补肾安神、保肝等功效[3]。安五脂素是从南五味子中提取的一种木脂素类化合物,具有保肝、抗氧化、抗炎、抑制肝细胞坏死等作用[4]。现代药理学研究表明,安五脂素具有多种药理活性,是一种潜在的肝损伤治疗药物[5]。前期研究发现,安五脂素可通过调节胱天蛋白酶3和B细胞淋巴瘤2(B-cell lymphoma 2,Bcl-2)/Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)发挥抗细胞凋亡的作用[6],但其是否可通过上述途径抑制肝细胞凋亡导致的肝纤维化尚不清楚。因此,本课题拟对安五脂素对肝纤维化的作用及机制进行研究,旨在为该药的进一步开发提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括AUW-220D型电子分析天平(日本岛津公司)、ZS-2型板式酶标仪(北京新风机电技术公司)、TGL-20M型台式高速冷冻离心机(长沙湘仪贝克仪器仪表有限公司)、Scientz-ⅡD型超声波细胞粉碎机(宁波新芝生物科技股份有限公司)、LIDE 200型扫描仪[佳能(中国)有限公司]、ST60-4型微孔板恒温振荡器(杭州米欧仪器有限公司)、Mini Trans-Blot型蛋白转印系统(美国Bio-Rad公司)、4600SF型凝胶成像仪(上海天能科技有限公司)、CX23型光学显微镜(济南博坤科学仪器有限公司)等。
1.2 主要药品及试剂
安五脂素对照品(批号AFBH2603,纯度≥98%)购自成都埃法生物科技有限公司;秋水仙碱片(国药准字H53020166,批号20211203,规格0.5 mg)购自云南植物药业有限公司;CCl4(批号20200522)购自天津市优谱化学试剂有限公司;橄榄油(批号20221001)购自上海嘉里食品工业有限公司;丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)试剂盒(批号分别为C009-2-1、C010-2-1)均购自南京建成生物工程研究所有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(货号9054-89-1)购自湖北日昇昌科技有限公司;丙二醛(malondialdehyde,MDA)试剂盒(货号XY-SHSJH-1017)购自上海烜雅生物科技有限公司;苏木精-伊红(HE)染色液(批号20220825)购自武汉呵尔医疗科技发展有限公司;Masson染色液(批号20221230)购自南京建成科技有限公司;蛋白酶抑制剂、BCA蛋白定量试剂盒(批号分别为60345、30324)均购自北京康为世纪生物科技有限公司;ECL高灵敏度化学发光检测试剂盒(货号WE0308)购自北京百奥莱博科技有限公司;兔源磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抗体、蛋白激酶B(protein kinase B,Akt)抗体、磷酸化Akt(p-Akt)抗体、Bax抗体(批号分别为GR3360941-5、1010423-7、GR3360948-18、GR1008474-3)均购自英国Abcam公司;兔源Bcl-2抗体(货号A-01209)购自上海齐天生物科技有限公司;鼠源多克隆抗体甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH,货号ybs-2188R)购自上海研谨生物科技有限公司;辣根过氧化物酶标记的山羊抗兔IgG二抗(货号C86-SSA005)购自上海创赛科技有限公司;水为蒸馏水。
1.3 实验动物
SPF级健康雄性SD大鼠50只,体重180~220 g,由北京华阜康生物科技股份有限公司提供,生产许可证号为SCXK(京)2019-0008。大鼠由贵州中医药大学实验动物中心饲养,自行进食和饮水。本研究通过贵州中医药大学动物伦理委员会批准(批件号20220094)。
2 方法
2.1 动物分组及造模
将50只雄性SD大鼠在实验前喂养1周后,随机分为正常组,模型组,秋水仙碱片组,安五脂素高、低剂量组,每组10只。除正常组大鼠腹腔注射等量橄榄油和生理盐水外,其余各组大鼠均腹腔注射50% CCl4橄榄油混合溶液(1.5 mL/kg),每周2次,持续8周,以复制肝纤维化大鼠模型[7]。造模结束后,分别抽取正常组和模型组1只大鼠处死,取肝脏进行HE病理检测,以METAVIR评分为依据评估造模是否成功[8]。
2.2 动物给药及取材
大鼠造模结束后,从第9周开始灌胃给药或蒸馏水,每组灌胃体积为10 mL/kg,每日1次,连续灌胃4周。其中,正常组和模型组大鼠给予等量蒸馏水;安五脂素高、低剂量组参照文献方法[9],经等效剂量折算为低剂量组大鼠给药0.7 mg/kg,按照4倍剂量设置高剂量组,故予安五脂素高剂量组2.8 mg/kg;秋水仙碱片组大鼠给药剂量为0.1 mg/kg[10]。上述干预结束后,各组大鼠禁食不禁水12 h,称重后,麻醉大鼠,腹主动脉取血,离心后分离出血清,保存至-80 ℃冰箱;摘取新鲜肝脏,称定肝脏质量后将新鲜的肝右叶组织固定于4%多聚甲醛溶液中,用于后续的HE染色和Masson染色;其余肝组织冻存于-80 ℃冰箱中,用于Western blot检测。
2.3 大鼠一般情况观察
实验期间每天观察大鼠的一般情况,包括饮食、毛发光泽度、活动度、呼吸、体重、有无鼻出血、死亡等情况。
2.4 大鼠肝指数的计算
根据“2.2”项下各组大鼠体重和肝脏质量结果,计算肝指数。肝指数=大鼠肝脏质量(g)/大鼠体重(g)×100%。
2.5 大鼠血清中ALT、AST、SOD、MDA含量的测定
取“2.2”项下血清,按照试剂盒说明书,采用比色法检测大鼠血清中ALT、AST、SOD、MDA的含量。
2.6 大鼠肝组织病理形态学和肝纤维化程度的观察
取“2.2”项下固定于4%多聚甲醛溶液中的肝组织,经脱水、石蜡包埋、脱蜡、切片、烤片后进行组织学染色,即HE染色和Masson染色,在光学显微镜下观察每组大鼠肝纤维化的病理情况。从Masson染色图片里每组取3张图片,利用Image J软件计算胶原容积分数。胶原容积分数(%)=胶原阳性的蓝色面积/总面积×100%。
2.7 大鼠肝组织中PI3K/Akt通路及凋亡相关蛋白表达水平的测定
采用Western blot法进行测定。每组取3只冻存于-80 ℃冰箱中的大鼠肝组织,经RIPA裂解液裂解后,提取蛋白。采用BCA法进行定量后,对蛋白进行加热变性处理,经制胶、电泳、转膜后,以10%牛血清白蛋白封闭1 h,洗膜,分别加入PI3K、Akt、p-Akt、Bcl-2、Bax、GAPDH一抗(稀释比例分别为1∶3 000、1∶30 000、1∶3 000、1∶2 000、1∶3 000、1∶10 000),于4 ℃孵育过夜;洗膜后,加入相应二抗(稀释比例为1∶2 000),室温孵育1 h后,用洗液漂洗3次,向PVDF膜上滴加化学发光试剂进行显影、拍照。采用Gel-Pro Analyzer软件测定并分析目标蛋白条带的灰度值,以目标蛋白与内参蛋白(GAPDH)条带的灰度值比值表示上述蛋白的表达水平。
2.8 统计学方法
采用SPSS 26.0软件进行统计分析。计量资料以±s表示,多组间差异比较采用单因素方差分析。方差齐性时,组间比较采用LSD检验;不满足方差齐性时,以Tamhane’sT2检验进行组间对比。检验水准α=0.05。
3 结果
3.1 各组大鼠的一般情况
正常组大鼠饮食正常,被毛浓密有光泽,活动有力,呼吸正常,鼻部无出血,体重稳定增长;与正常组大鼠比较,模型组大鼠饮食量下降,被毛稀疏、蓬乱,反应迟钝,体重增长速率减慢或体重降低;其余各组与模型组比较,上述各种情况均有所改善。实验期间,正常组和模型组大鼠无死亡,秋水仙碱片组、安五脂素高剂量组大鼠各死亡3只,安五脂素低剂量组大鼠死亡2只,共死亡8只大鼠。
3.2 安五脂素对各组大鼠肝指数的影响
与正常组比较,模型组大鼠肝指数显著上升(P<0.01);与模型组比较,秋水仙碱片及安五脂素高、低剂量组大鼠肝指数均显著下降(P<0.01)。结果见表1。
表1 各组大鼠体重、肝脏质量和肝指数的检测结果(±s)
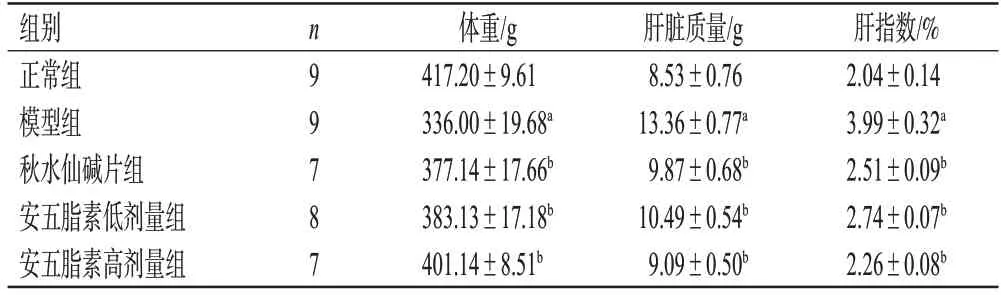
表1 各组大鼠体重、肝脏质量和肝指数的检测结果(±s)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.01。
组别正常组模型组秋水仙碱片组安五脂素低剂量组安五脂素高剂量组肝指数/%2.04±0.14 3.99±0.32a 2.51±0.09b 2.74±0.07b 2.26±0.08b n9 9 7 8 7体重/g 417.20±9.61 336.00±19.68a 377.14±17.66b 383.13±17.18b 401.14±8.51b肝脏质量/g 8.53±0.76 13.36±0.77a 9.87±0.68b 10.49±0.54b 9.09±0.50b
3.3 安五脂素对各组大鼠血清中ALT、AST、SOD、MDA含量的影响
与正常组比较,模型组大鼠血清中ALT、AST、MDA含量均显著升高,SOD含量显著降低(P<0.01);与模型组比较,秋水仙碱片组及安五脂素高、低剂量组大鼠血清中ALT、AST、MDA含量均显著降低,SOD含量均显著升高(P<0.01)。结果见表2。
表2 安五脂素对各组大鼠ALT、AST、SOD、MDA含量的影响(±s)

表2 安五脂素对各组大鼠ALT、AST、SOD、MDA含量的影响(±s)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.01。
组别正常组模型组秋水仙碱片组安五脂素低剂量组安五脂素高剂量组MDA/(nmol/mL)3.55±0.44 16.80±1.00a 5.56±0.47b 5.37±0.35b 4.07±0.64b n9 9 7 8 7 ALT/(U/L)11.41±1.99 65.43±2.98a 26.09±2.56b 23.18±1.95b 20.52±1.90b AST/(U/L)16.32±2.19 85.29±4.13a 33.13±2.21b 32.20±2.43b 23.52±2.26b SOD/(U/mL)414.68±4.67 296.30±6.25a 388.81±7.87b 383.92±5.47b 397.13±4.87b
3.4 安五脂素对各组大鼠肝组织病理形态和肝纤维化的影响
HE染色结果(图1)显示,正常组大鼠肝组织结构完整,肝索排列成放射状,无纤维组织增生,无肝细胞脂肪变性及炎症细胞浸润;与正常组比较,模型组大鼠肝组织结构紊乱,有大量胶原纤维组织增生,肝索排列紊乱,汇管区域可见大量的炎症细胞浸润、肝细胞变性和坏死;与模型组比较,秋水仙碱片组及安五脂素高、低剂量组的肝纤维化程度均有所减轻。Masson染色结果(图1)显示,正常组大鼠在肝组织汇管区域可见少量的蓝染胶原纤维;模型组大鼠肝组织中见大量蓝染胶原纤维,纤维间隔变宽,纤维增生明显;与模型组比较,秋水仙碱片组及安五脂素高、低剂量组蓝染胶原纤维明显变细,肝纤维化程度均有不同程度的改善。正常组、模型组、秋水仙碱片组和安五脂素高、低剂量组大鼠的胶原容积分数分别为(2.68±0.96)%、(38.96±4.40)%、(19.75±1.85)%、(13.84±1.59)%、(18.48±1.17)%。与正常组比较,模型组大鼠胶原容积分数显著升高(P<0.01);与模型组比较,秋水仙碱片组及安五脂素高、低剂量组大鼠胶原容积分数均显著降低(P<0.01)。
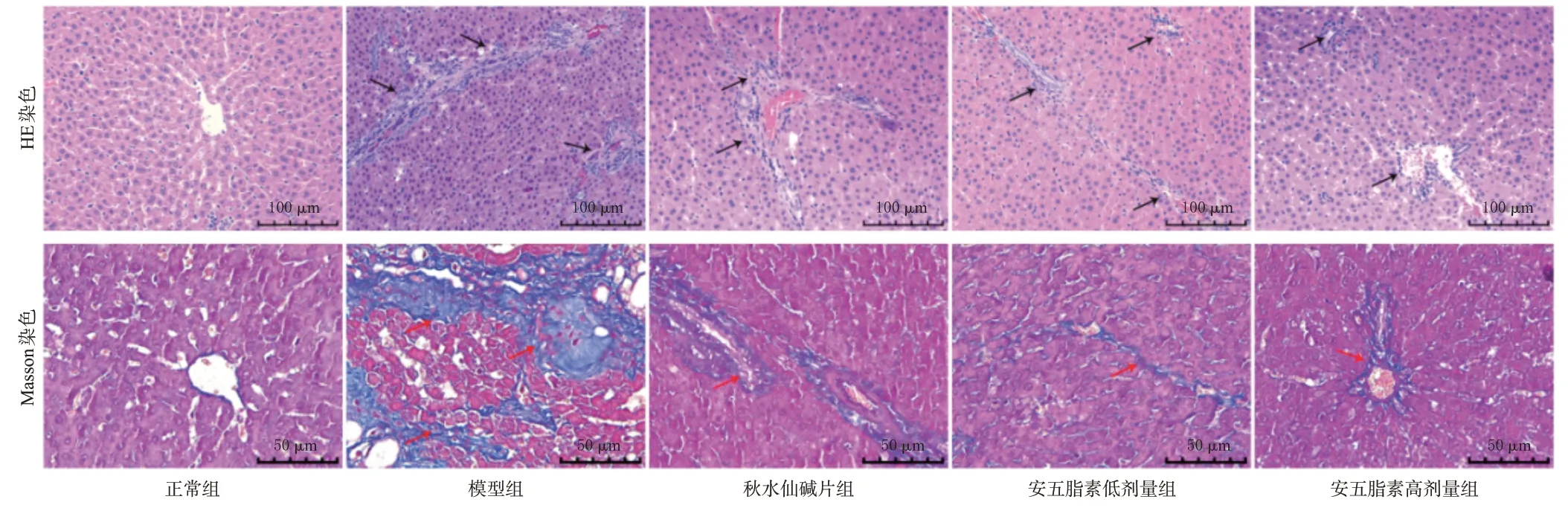
图1 各组大鼠肝组织病理形态及纤维化显微图
3.5 安五脂素对大鼠肝组织中PI3K/Akt通路相关蛋白表达水平的影响
与正常组比较,模型组大鼠肝组织中PI3k、Akt、p-Akt蛋白表达水平均显著下调(P<0.01);与模型组比较,秋水仙碱片组及安五脂素高、低剂量组大鼠肝组织PI3k、Akt、p-Akt蛋白表达水平均显著上调(P<0.01或P<0.05)。结果见图2。
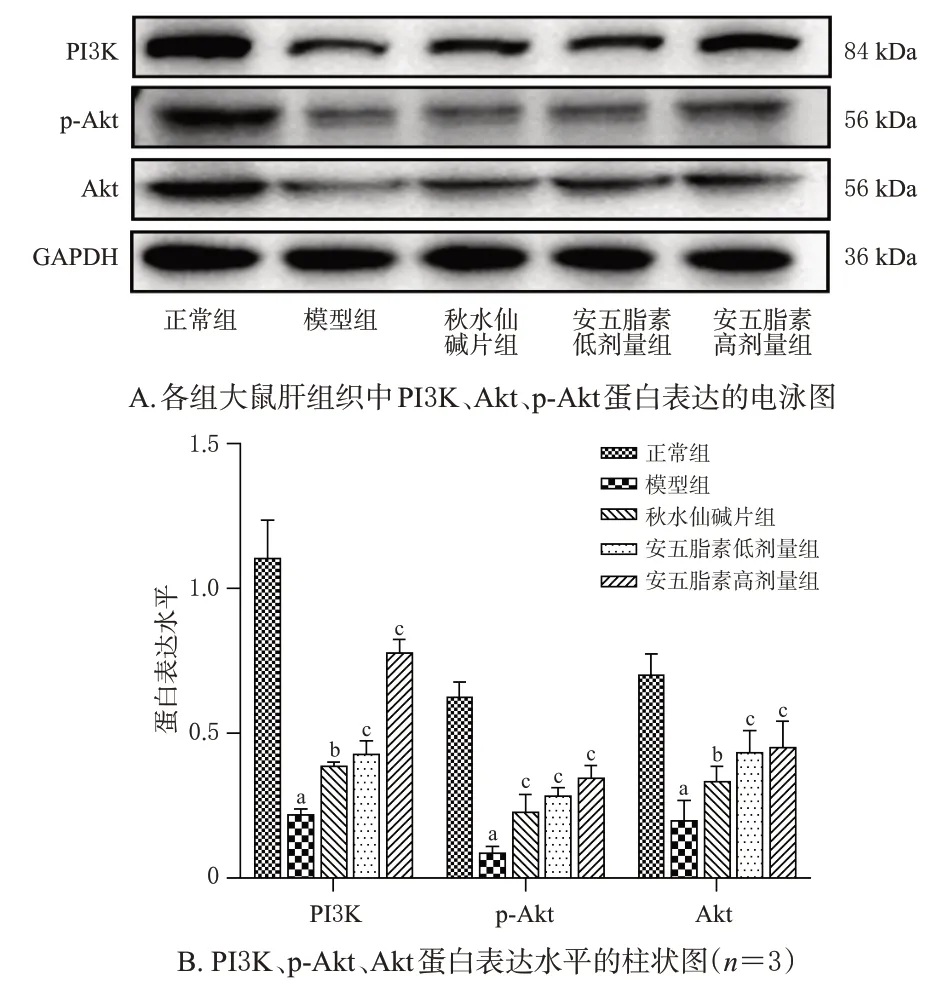
图2 安五脂素对各组大鼠肝组织中PI3K/Akt通路相关蛋白表达的影响
3.6 安五脂素对大鼠肝组织中凋亡相关蛋白表达水平的影响
与正常组比较,模型组大鼠肝组织中Bax蛋白表达水平升高(P<0.01),Bcl-2蛋白表达水平显著下降(P<0.01);与模型组比较,秋水仙碱片组及安五脂素高、低剂量组大鼠Bax蛋白表达水平均显著下降(P<0.01)、Bcl-2蛋白表达水平均显著升高(P<0.01或P<0.05)。结果见图3。
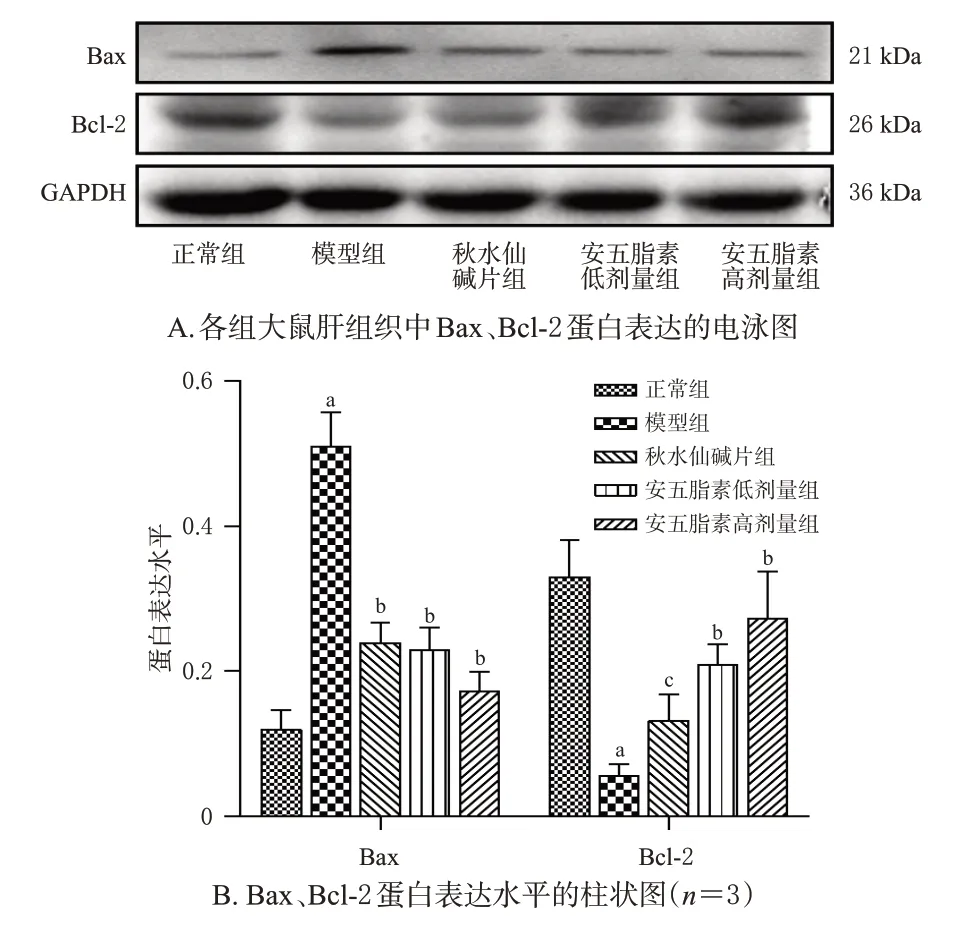
图3 安五脂素对各组大鼠肝组织内凋亡相关蛋白表达的影响
4 讨论
肝纤维化是各种慢性肝病发展为肝硬化或肝癌的重要环节,是各种肝损伤的共有病理过程[11]。CCl4是经典的肝纤维化诱导剂,可引起肝损伤,导致肝细胞的反复、持续性坏死,进而发展为肝纤维化。肝纤维化存在进展为肝硬化的危险性,因此,在肝纤维化早期采取积极有效的措施防止病情进一步恶化具有重要意义。安五脂素是近年来研究发现具有保肝、抗细胞凋亡、抗氧化的中药单体,安全性可靠[4],在本次实验过程中给药组大鼠出现死亡现象,考虑与环境、大鼠自身因素(攻击、大鼠习性)等有关。
当肝细胞受到损伤时,血清中ALT、AST含量明显升高[12],因此本研究将血清中ALT、AST作为肝纤维化导致肝损伤的检测指标。结果发现,经CCl4诱导后的肝纤维化模型大鼠血清中ALT、AST含量明显高于正常组;经不同剂量的安五脂素干预后,大鼠血清中ALT、AST含量降低,表明安五脂素具有保肝作用。氧化应激反应是导致肝纤维化发生的主要机制之一,而脂质过氧化反应的代谢物中含有MDA[13],MDA可诱导脂质过氧化而发生细胞凋亡[14];SOD可清除活性氧,抑制脂质过氧化反应。本实验结果显示,与正常组比较,模型组大鼠血清中MDA含量升高、SOD含量降低;予安五脂素干预后,大鼠血清中MDA含量降低、SOD含量升高,提示安五脂素可能通过提高抗氧化能力、抑制氧化应激反应而发挥抗肝纤维化的作用。本研究结果还表明,在病理层面上,模型组大鼠肝组织结构紊乱、有大量胶原纤维组织增生、炎症细胞浸润、胶原容积分数明显升高等;经安五脂素干预后,大鼠肝纤维化程度改善、胶原容积分数降低,由此推测安五脂素可保护肝细胞受损、减缓肝纤维化的发展进程。
肝纤维化的发生、发展与细胞凋亡有着密切的关系。Bcl-2家族蛋白是细胞凋亡的主要调节因子,是一种至少带有1个Bcl-2同源区域的典型蛋白家族,其中包括抗细胞凋亡蛋白Bcl-2和促细胞凋亡蛋白Bax。Bax可以作为同源二聚体存在,也能与Bcl-2形成异源二聚体,两者对细胞凋亡具有调控作用——Bcl-2/Bax比值升高抑制细胞凋亡,Bcl-2/Bax比值降低则促进细胞凋亡[15]。本研究结果表明,模型组大鼠肝组织中Bax蛋白表达水平升高,Bcl-2蛋白表达水平下降;经安五脂素干预后,Bax蛋白表达水平下降,Bcl-2蛋白表达水平升高,提示安五脂素可通过抑制肝细胞凋亡发挥抗肝纤维化的作用。
PI3K/Akt信号通路广泛存在于多种细胞中,可介导氧化应激反应,导致血清中SOD水平升高、MDA水平下降,抑制肝细胞凋亡,减轻氧化应激反应[16—17];同时,PI3K/Akt信号通路还可促进细胞增殖,当该通路被激活时,PI3K可催化其下游靶蛋白Akt磷酸化成为p-Akt,而p-Akt能使糖原合成酶激酶-3β磷酸化而失活,从而抑制细胞凋亡[18]。Bcl-2是PI3K/Akt信号通路下游的重要底物蛋白之一,可抑制细胞凋亡,当Akt被激活后,磷酸化的Bcl-2基因相关启动子与Bcl-2发生解聚,使Bcl-2游离而发挥抗凋亡作用[19]。本实验结果表明,模型组大鼠肝组织中PI3K、Akt及p-Akt的蛋白表达水平均降低,提示在肝纤维化过程中PI3K/Akt信号通路被抑制;经安五脂素干预后,PI3K、Akt及p-Akt的蛋白表达水平均升高,提示安五脂可通过激活PI3K/Akt通路起到抗肝纤维化的作用。
综上所述,安五脂素可能是通过激活PI3K/Akt号通路降低肝纤维化氧化应激反应、抑制肝细胞凋亡来发挥抗肝纤维化作用。但本研究尚处于动物实验阶段,相关更深层次的机制有待进一步研究探讨。

