基于肝脏转录组学探究发花红茶降血糖作用的潜在机制
曾鸿哲,彭丽媛,万丽玮,刘昌伟,方雯雯,王阔飞,张欣仪,文帅,黄建安,刘仲华
基于肝脏转录组学探究发花红茶降血糖作用的潜在机制
曾鸿哲,彭丽媛,万丽玮,刘昌伟,方雯雯,王阔飞,张欣仪,文帅,黄建安*,刘仲华*
湖南农业大学茶学教育部重点实验室,国家植物功能成分利用工程技术研究中心,植物功能成分利用省部共建协同创新中心,农业农村部园艺作物基因资源评价利用重点实验室,湖南 长沙 410128
EGCG作为茶叶中保护血糖稳态的主要活性成分,发花红茶中的EGCG等低分子量多酚含量极低,并且少见发花红茶的降血糖作用研究。为探究发花红茶的降血糖作用及潜在机制,采用自发性高血糖GK大鼠,给予280 mg·kg-1发花红茶提取物(相当于人体每日饮用9 g发花红茶)灌胃干预,检测其对高血糖大鼠体重、血糖稳态、血糖稳态相关调控因子、糖尿病并发症以及肝脏转录谱等的影响。结果表明,发花红茶能够明显降低高血糖大鼠的空腹血糖值、随机血糖值;改善高血糖大鼠糖代谢异常现象,保护高血糖大鼠的血糖稳态;减轻高血糖大鼠糖尿病并发症损伤。此外,转录组学分析表明,发花红茶的降血糖作用可能与调控肝脏等基因的表达密切相关。本研究发现发花红茶可作为一种潜在的降血糖功能饮品,为发花红茶等发酵茶的开发利用提供理论依据。
红茶;降血糖;糖尿病并发症;转录组;GK大鼠
随着生活水平不断提高,人们的膳食模式也发生了变化,由传统的高碳水化合物、低脂肪的膳食结构逐步向低碳水化合物、高脂肪结构转变;同时环境改变、工作压力增加及运动量减少等因素会导致机体新陈代谢紊乱、大量代谢废物堆积,影响人体的正常稳态[1]。据国际糖尿病联盟预测,到2045年,全球糖尿病患者将增加到7亿[2]。糖尿病是一种以长期高血糖为主要特征的慢性内分泌代谢性疾病,表现为胰岛素含量绝对不足、相对不足或胰岛素生物作用缺陷,从而导致高血糖症状[3]。当机体长期处于高血糖状态时,会导致肾脏、心脏、血管等多种器官严重的损伤,以及一系列的糖尿病并发症[4]。因此,维持血糖稳态是管理糖尿病患者病情的关键。目前,针对糖尿病患者缺乏有效的根治方法,而临床实践表明,长期服用降糖药会导致不利的毒副作用,因此使用天然产物进行饮食干预辅助降血糖,从而减少药物的摄入,对糖尿病患者病情的控制以及提高糖尿病患者的生活质量具有积极效应[5]。
茶是世界三大无酒精饮料之一,具有减肥、降血糖等多种健康功能[6]。绿茶中的多酚类物质,尤其是表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG),已被广泛用于糖尿病的替代疗法[7]。发花红茶是以红毛茶为原料,通过控制一定的温湿度,促进冠突散囊菌的生长,冠突散囊菌的生长会进一步促进多酚类化合物氧化及淀粉转化等。从理论上分析,发花红茶中的EGCG等低分子量多酚含量较低[8-10],且目前发花红茶的降血糖研究较少,消费者无法从现有资料了解发花红茶的降血糖作用效果及其机制。GK大鼠(Goto-Kakizaki大鼠)属于非肥胖、自发性2型糖尿病大鼠模型,是目前使用最广泛的自发性高血糖大鼠模型,主要表现为高随机血糖、高空腹血糖,且不伴随肥胖[11]。因此,本研究通过采用自发性高血糖GK大鼠模型,探究发花红茶能否通过调节肝脏转录谱维护高血糖大鼠的血糖稳态,以期为发花红茶等发酵茶的开发利用提供理论依据。
1 材料与方法
1.1 试验材料
发花红茶由湖南农业大学茶学系提供,每克发花红茶冠突散囊菌含量约为5.17×107个。血糖试纸、血糖仪购于罗氏公司(中国上海),总胆固醇(Total cholesterol,TC)、低密度脂蛋白(Low-density lipoprotein cholesterol,LDL-C)、丙二醛(Malondialdehyde,MDA)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)、糖化血清蛋白、-葡萄糖苷酶、总蛋白定量测定试剂盒等试剂盒购于南京建成生物工程研究所,胰岛素、胰高血糖素、糖化血红蛋白、脂多糖(Lipopolysaccharide,LPS)等试剂盒购于武汉华美生物工程有限公司。通用型RNA提取试剂盒、反转录试剂盒(用于qPCR)以及预混型qPCR试剂盒购于湖南艾科瑞生物工程有限公司,用于qPCR试验的引物购于擎科生物科技股份有限公司。
1.2 发花红茶提取物制备及剂量选择
发花红茶提取物制备参照Zhu等[12]方法,按茶水比(∶,g·mL-1)1∶20的比例90 ℃恒温浸提2 h,提取发花红茶茶汤,过滤收集上清液后通过真空冷冻干燥成粉末,获得发花红茶提取物,用于后续试验。按照成人(60 kg)每日饮用9 g发花红茶进行换算,根据体表面积归一化方法推算[13],相对于大鼠发花红茶提取物剂量约为280 mg·kg-1(浸提率以30%计算)。
1.3 动物实验
从江苏常州卡文斯实验动物有限公司采购SPF级9~11周龄的雄性GK大鼠16只以及7~8周龄健康Wistar大鼠8只,实验动物生产许可证号为SCXK(苏)2021-0013。动物实验经湖南农业大学动物实验委员会批准[批准号:伦审科2021第(2137)号],动物房温度24~26 ℃,光照黑暗时间为12 h/12 h循环,自由饮水进食。雄性GK大鼠及Wistar大鼠适应性喂养2周后,随机分为正常对照组(Normal,Wistar大鼠)、高血糖组(Model,GK大鼠)和发花红茶组(FFBT,GK大鼠)。大鼠在整个实验过程中自由进食与饮水,Wistar大鼠进食实验鼠维持饲料,GK大鼠进食60%高脂饲料,饲养笼的垫料每隔24 h更换1次以保持笼内整洁卫生。发花红茶连续干预4周,每天灌胃1次发花红茶水提物。实验开始前以及结束前通过罗氏血糖仪尾尖取血测定随机血糖值、空腹血糖值以及糖耐量试验。实验结束时,大鼠禁食12 h后腹腔注射戊巴比妥钠(30 mg·kg-1)。采集血液样本、肝组织、十二指肠样本,并立即储存在–80 ℃,以供进一步研究。
1.4 发花红茶的化学成分检测
根据GB/T 8313—2018测定茶多酚含量;根据GB/T 8314—2013测定游离氨基酸含量;使用蒽酮比色法测定可溶性糖含量;使用系统分析法检测茶黄素、茶红素、茶褐素含量;参照Zhou等[14]的HPLC方法测定EGGC、表没食子儿茶素(Epigallocatechin,EGC)、表儿茶素没食子酸酯(Epicatechin gallate,ECG)、表儿茶素(Epicatechin,EC)、没食子儿茶素没食子酸酯(Gallocatechin gallate,GCG)、儿茶素(DL-catechin,DL-C)、没食子酸和3种生物碱(咖啡碱、可可碱和茶碱)的含量。
1.5 糖耐量试验及生化指标检测
空腹12 h后剪尾取血,通过罗氏血糖仪测定空腹血糖值。在不禁食情况下剪尾取血,通过罗氏血糖仪测定随机血糖值。空腹12 h后按2 g·kg-1的剂量灌胃无水葡萄糖,分别于灌胃后0、30、60、90、120 min时尾尖取血测定大鼠血糖值,记录血糖数值和检测时间,并计算曲线下面积(Area under curve,AUC)。大鼠主动脉取血后,血液室温静止2 h,使用冷冻离心机(Eppendorf AG 22331 Hamburg)4 ℃、3 500 r·min-1离心10 min,收集血清,置于–80 ℃冰箱保存。准确称取组织质量,按质量(g)∶体积(mL)=1∶9的比例加入生理盐水,低温条件下机械匀浆,4 ℃、2 500 r·min-1离心10 min,取上清液再用生理盐水按1∶9稀释成1%组织匀浆。TC、LDL-C、MDA、GSH-Px、ALT、AST、LPS、糖化血清蛋白、-葡萄糖苷酶、胰岛素、胰高血糖素、糖化血红蛋白等指标严格按照相关试剂盒说明书检测。
1.6 脏器组织切片观察
大鼠经戊巴比妥钠(30 mg·kg-1)麻醉处死后,将肝组织、十二指肠置于4%多聚甲醛溶液中固定,在经过脱水、包埋、切片、苏木精-伊红染色(Hematoxylin-eosin staining,H&E染色)后,使用显微镜进行脏器组织切片观察。
1.7 大鼠肝脏转录组学分析
收集大鼠肝脏组织,每组设置4个生物学重复,于液氮中冷冻,委托华大基因公司进行RNA提取和RNA-Seq测序,并使用Dr.Tom多组学数据挖掘系统进行分析(biosys.bgi.com)。使用TRIzol法提取肝脏组织的总RNA,将测序得到的raw data使用华大自主研发的过滤软件SOAPnuke(v1.5.6)(github.com/BGI-flexlab/ SOAPnuke)进行过滤,得到clean data。后续使用Dr.Tom多组学数据挖掘系统进行数据分析、绘图及挖掘。使用HISAT2(v2.1.0)(www.ccb.jhu.edu/software/hisat/index.shtml)软件将clean data比对到大鼠的参考基因组上(,GCF_000001895.5_Rnor_6.0)。使用DESeq2 v1.4.5(www.bioconductor.org/ packages/release/bioc/html/DESeq2.html)进行差异基因检测,条件为Q值(Adjustedvalue)≤0.05且|log2FC|≥0.585,并对差异基因进行KEGG(www.kegg.jp)富集分析。
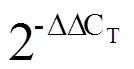

表1 qPCR相关引物序列
1.8 数据处理
数据以平均数±标准误差表示。采用SPSS 20.0软件进行单因素方差分析和LSD检验分析不同组间的数据差异,<0.05表示具有统计学显著性差异(*,<0.05)。使用GraphPad Prism 9.3作图。
2 结果与分析
2.1 发花红茶主要成分分析
发花红茶的主要成分含量如表2所示,图1为发花红茶代表性HPLC图谱。由表2和图1可知,发花红茶中的EGCG等低分子量多酚含量极低(<1%)。此外,本研究发现发花红茶中的茶褐素含量较高(14.937%)。
2.2 糖脂代谢稳态分析
由图2A可知,正常对照组大鼠在实验过程中,体重明显持续增长,而高血糖大鼠体重增长缓慢,发花红茶干预对高血糖大鼠体重无明显影响。血清中的TC、LDL-C水平升高常见于糖尿病、动脉粥样硬化等心血管疾病[15]。由图2B可知,与正常对照组相比,高血糖组血清中的TC水平显著增加(<0.05),而发花红茶干预显著降低了高血糖大鼠血清中的TC水平(<0.05),并将其降至正常对照组水平。由图2C可知,与正常对照组相比,高血糖组血清中的LDL-C水平显著增加(<0.05),而发花红茶干预显著降低了高血糖大鼠血清中的LDL-C水平(<0.05),并将其降至正常对照组水平。这些结果表明,发花红茶干预能够显著改善高血糖大鼠的脂代谢紊乱,具有潜在降低心血管疾病发生风险的的作用。
随机血糖值、空腹血糖值是直接反映机体真实血糖水平的重要指标。由图2D、图2F可知,发花红茶干预前,发花红茶组和高血糖组大鼠的初始随机血糖值、初始空腹血糖值无显著差异。图2E表明,在经过4周的发花红茶连续干预后,高血糖大鼠在早上、下午、晚上3个时间段的随机血糖值均出现了显著降低,降糖效果依次为33%、34%、25%,但未恢复到正常对照组水平。由图2G可知,发花红茶干预显著降低了干预4周后的高血糖大鼠空腹血糖值(<0.05),降糖效果为36%,高血糖大鼠的空腹血糖值降至正常对照组水平。
糖化血红蛋白是红细胞中的血红蛋白与血清中的葡萄糖通过非酶促反应相结合的产物,该反应具有持续、缓慢、不可逆的特点,糖化血红蛋白浓度可有效反映过去8~12周平均血糖水平[16]。糖化血清蛋白与糖化血红蛋白相似,能够反映过去2~3周平均血糖水平。由图2H可知,发花红茶干预显著降低了高血糖大鼠的糖化血红蛋白水平(<0.05),降糖效果为58%,并且将高血糖大鼠的糖化血红蛋白水平降至正常对照组水平。图2I表明,发花红茶干预显著降低了高血糖大鼠的糖化血清蛋白水平(<0.05),降糖效果为42%。图2J~图2M表明,发花红茶干预前,发花红茶组和高血糖组的糖耐量曲线以及糖耐量曲线下面积无明显差别(图2J和图2K),而发花红茶干预4周后明显降低了各个时间点的血糖值。以上结果表明,发花红茶干预显著降低了高血糖大鼠的血糖值,并维持其健康的血糖稳态,提示发花红茶可作为一种潜在的降血糖功能饮品。
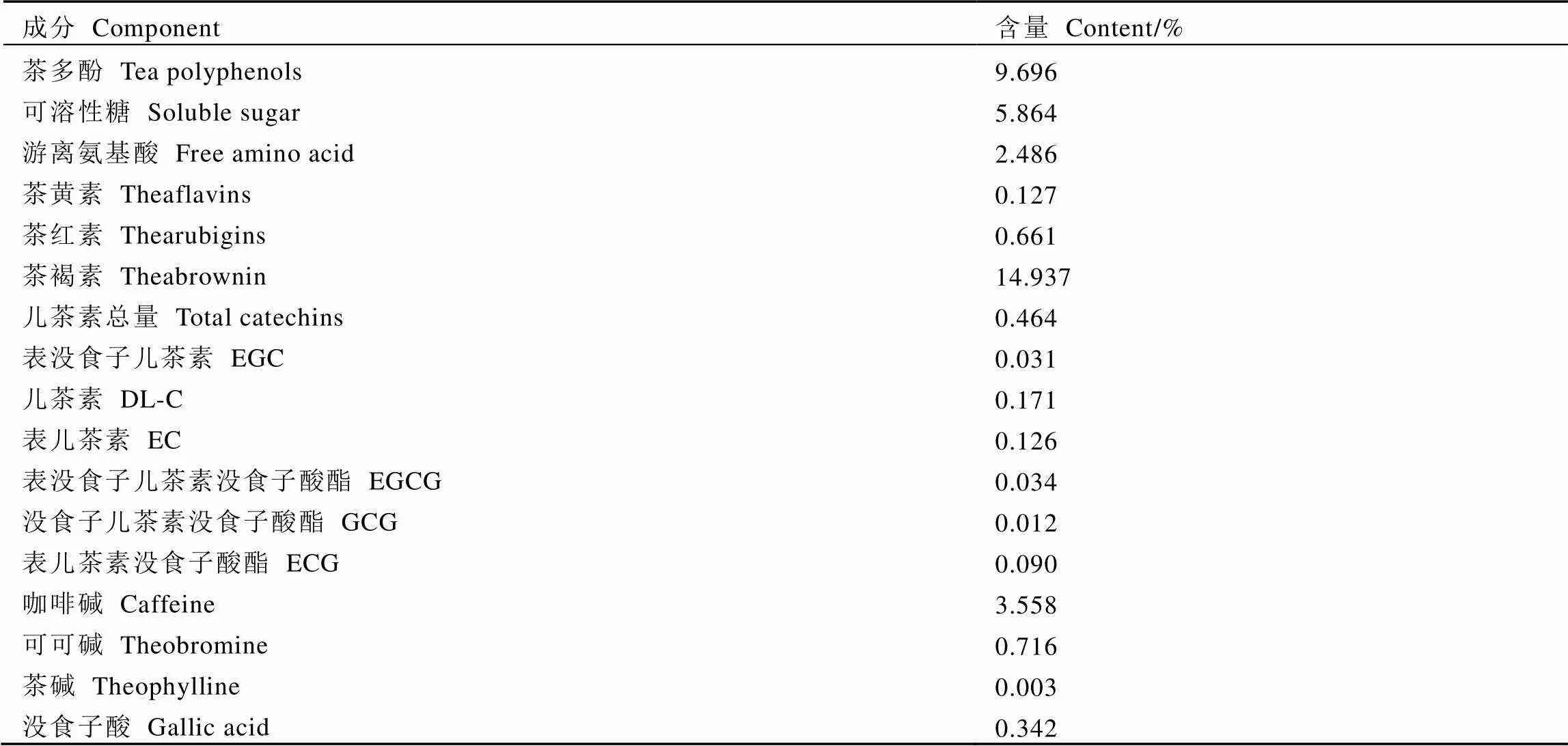
表2 发花红茶主要成分含量
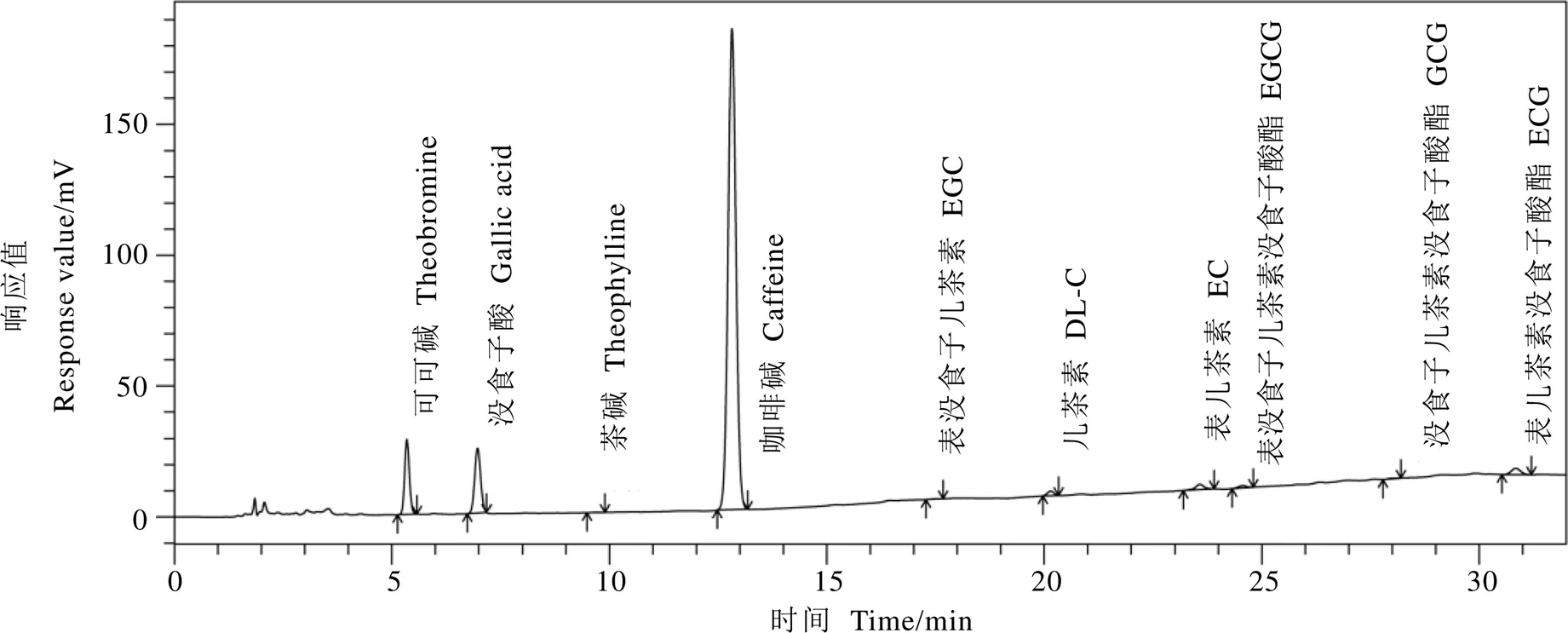
图1 发花红茶代表性HPLC图谱
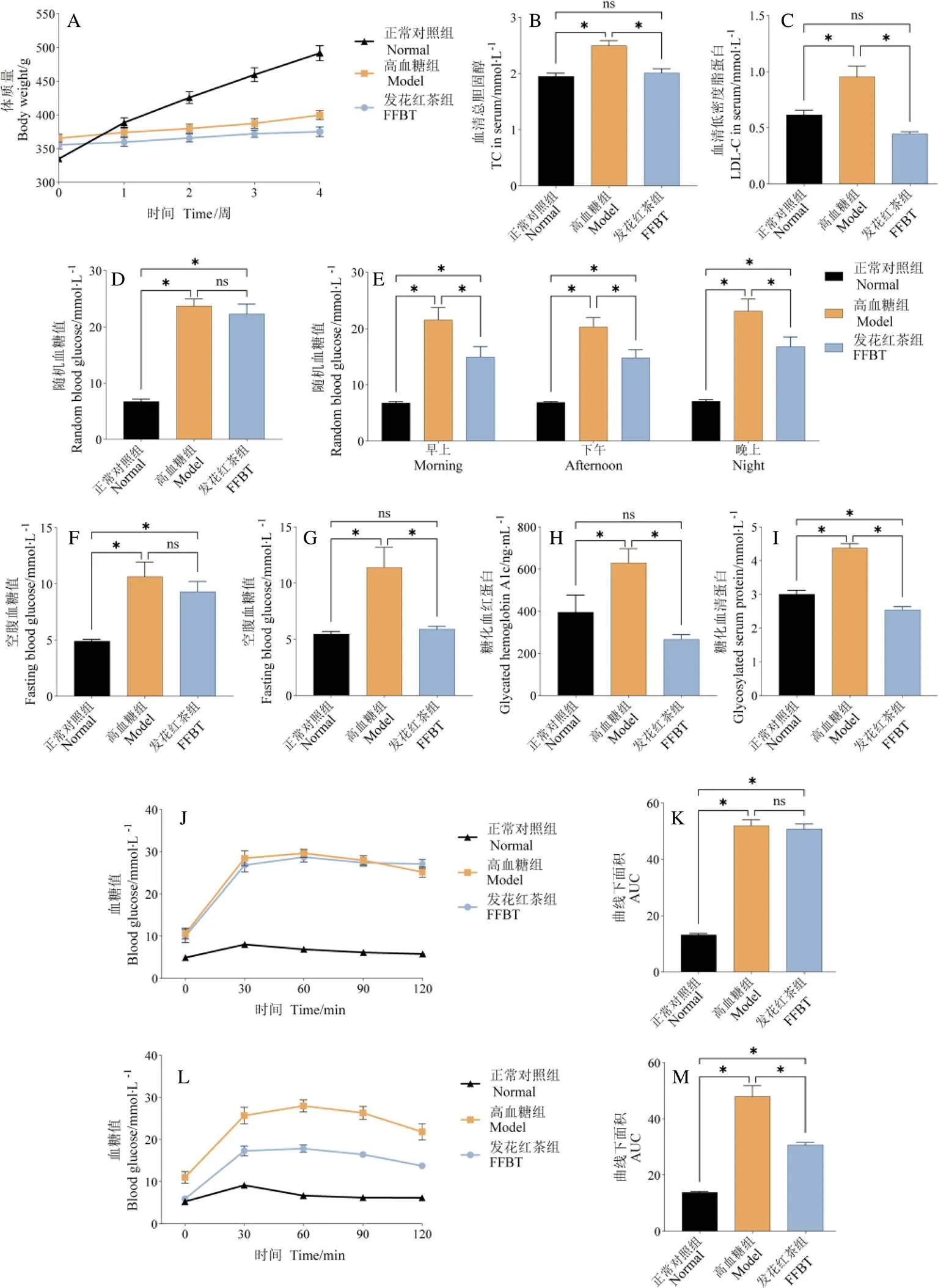
注:A为体重曲线;B为血清中TC水平;C为血清中LDL-C水平;D为发花红茶干预前的随机血糖值;E为发花红茶干预4周后的随机血糖值;F为发花红茶干预前的空腹血糖值;G为发花红茶干预4周后的空腹血糖值;H为糖化血清红蛋白水平;I为糖化血清蛋白水平;J为发花红茶干预前的糖耐量曲线;K为发花红茶干预前的糖耐量曲线下面积;L为发花红茶干预4周后的糖耐量曲线;M为发花红茶干预4周后的糖耐量曲线下面积。* P<0.05,下同
2.3 血糖稳态相关调控因子及血清氧化应激指标分析
胰岛素与胰高血糖素由胰岛细胞分泌,是调节血糖稳态的重要激素[17]。由图3A和图3B可知,发花红茶干预显著提高了高血糖大鼠血清中的胰岛素、胰高血糖素水平,表明发花红茶可能具有作为胰岛素促泌剂以及胰高血糖素促泌剂的潜力。-葡萄糖苷酶的主要作用是水解碳水化合物中的-葡萄糖苷键,生成葡萄糖等单糖,供人体肠道直接吸收[18],它能够控制碳水化合物的消化和吸收速度,从而减少血糖的积累,对于糖尿病患者十分重要。由图3C可知,发花红茶干预对高血糖大鼠十二指肠中的-葡萄糖苷酶水平无明显影响,表明发花红茶的降血糖功能可能不是通过调控碳水化合物的消化吸收这一途径实现的。
LPS是革兰氏阴性细菌细胞壁最外层组成成分,血清中的LPS水平升高,通常预示着肠道菌群紊乱,肠道屏障损伤[19]。由图3D可知,与正常对照组相比,高血糖组血清中的LPS水平显著升高(<0.05),而发花红茶干预4周显著降低了高血糖大鼠血清中的LPS水平(<0.05),表明发花红茶具有潜在的修复肠道屏障损伤的作用。MDA是膜脂过氧化最重要的产物之一,因此可通过测定血液中的MDA水平了解全身细胞膜系统受损程度,进而推测机体全身性的氧化应激损伤情况[20]。由图3E可知,与正常对照组相比,高血糖组血清中的MDA水平显著升高(<0.05),而发花红茶干预4周显著降低了高血糖大鼠血清中的MDA水平(<0.05)。GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,糖尿病模型动物血清中的GSH-Px水平常代偿性升高[21]。由图3F可知,与正常对照组相比,高血糖组血清中的GSH-Px水平显著增加(<0.05),而发花红茶干预4周显著降低了高血糖大鼠血清中的GSH-Px水平(<0.05),并将其降至正常对照组水平。ALT主要位于肝细胞的细胞质中,而AST主要位于肝细胞的线粒体中,如果出现肝细胞的损伤破坏等,肝细胞中的ALT和AST会进入到血液,因此可将血液中ALT和AST水平作为判断肝细胞有无损伤的标准[22]。由图3G、图3H可知,与正常对照组相比,高血糖组血清中的ALT和AST水平显著增加(<0.05),而发花红茶干预显著降低了高血糖大鼠血清中的ALT和AST水平(<0.05),达正常对照组水平。以上结果表明,发花红茶干预能够显著改善高血糖大鼠全身性的氧化应激损伤,特别是改善高血糖导致的肝损伤,因而具有潜在降低糖尿病并发症发生风险的作用。
2.4 十二指肠、肝脏形态分析
十二指肠是小肠的第一段,上端连接胃,是葡萄糖等营养物质吸收的主要场所,而十二指肠绒毛长度的增加与营养物质吸收效率增加密切相关[23]。由图4A可知,与正常对照组相比,高血糖组大鼠的十二指肠绒毛长度明显增加,而隐窝深度和管壁厚度无明显差别。与高血糖组相比,发花红茶干预4周后明显缩短了高血糖大鼠十二指肠的绒毛长度,而对隐窝深度和管壁厚度无明显影响。由图4B可知,正常对照组大鼠肝细胞排列整齐紧密,细胞形态清晰,细胞质丰富,细胞核染色均匀。而高血糖组大鼠肝细胞水肿明显,细胞质疏松,呈空泡状。与高血糖组相比,发花红茶干预后,肝细胞水肿变性以及细胞质疏松现象得到明显缓解。
2.5 肝脏转录谱分析
肝脏是机体糖代谢的中心[24]。肝脏RNA-Sep分析共鉴定到17 282个基因,图5A表明高血糖组转录水平和发花红茶组转录水平有明显差别。以Q值(Adjustedvalue)≤0.05且|log2FC|≥0.585为阈值,在发花红茶组和高血糖组间共筛选到差异基因565个,其中上调的差异基因242个,下调的差异基因323个,差异基因散点图如图5B所示,差异基因表达量热图如图5C所示。将差异基因中的上调基因和下调基因分别进行KEGG富集分析,Q值≤0.05为显著富集。如图5D和图5E所示,与高血糖组相比,发花红茶组中的上调基因主要富集在类固醇激素生物合成、化学致癌、DNA复制、视黄醇代谢、维生素B6代谢、谷胱甘肽代谢、昼夜节律信号通路;发花红茶组中的下调基因主要富集在PPAR信号通路,糖酵解/糖异生,碳代谢,半胱氨酸和蛋氨酸代谢,丙酮酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,氨基酸生物合成,癌症中心碳代谢。其中19个基因与PPAR信号通路、糖酵解/糖异生、碳代谢密切相关,可能与发花红茶发挥降血糖活性密切相关。进一步分析发现,这19个基因除了与PPAR信号通路,糖酵解/糖异生,碳代谢相关,还与2型糖尿病密切相关(图5F)。其中,19个基因中的、及直接与2型糖尿病密切相关,这3个基因的表达量热图如图5G所示。qPCR结果表明,发花红茶干预显著抑制了高血糖大鼠肝脏的、、基因的表达,与转录组结果吻合(图5H)。

注:A,血清中胰岛素水平;B,血清中胰高血糖素水平;C,十二指肠中的α-葡萄糖苷酶水平;D,血清中LPS水平;E,血清中MDA水平;F,血清中GSH-Px水平;G,血清中ALT水平;H,血清中AST水平

注:A为十二指肠H&E染色结果(50×);B为肝脏H&E染色结果(400×)
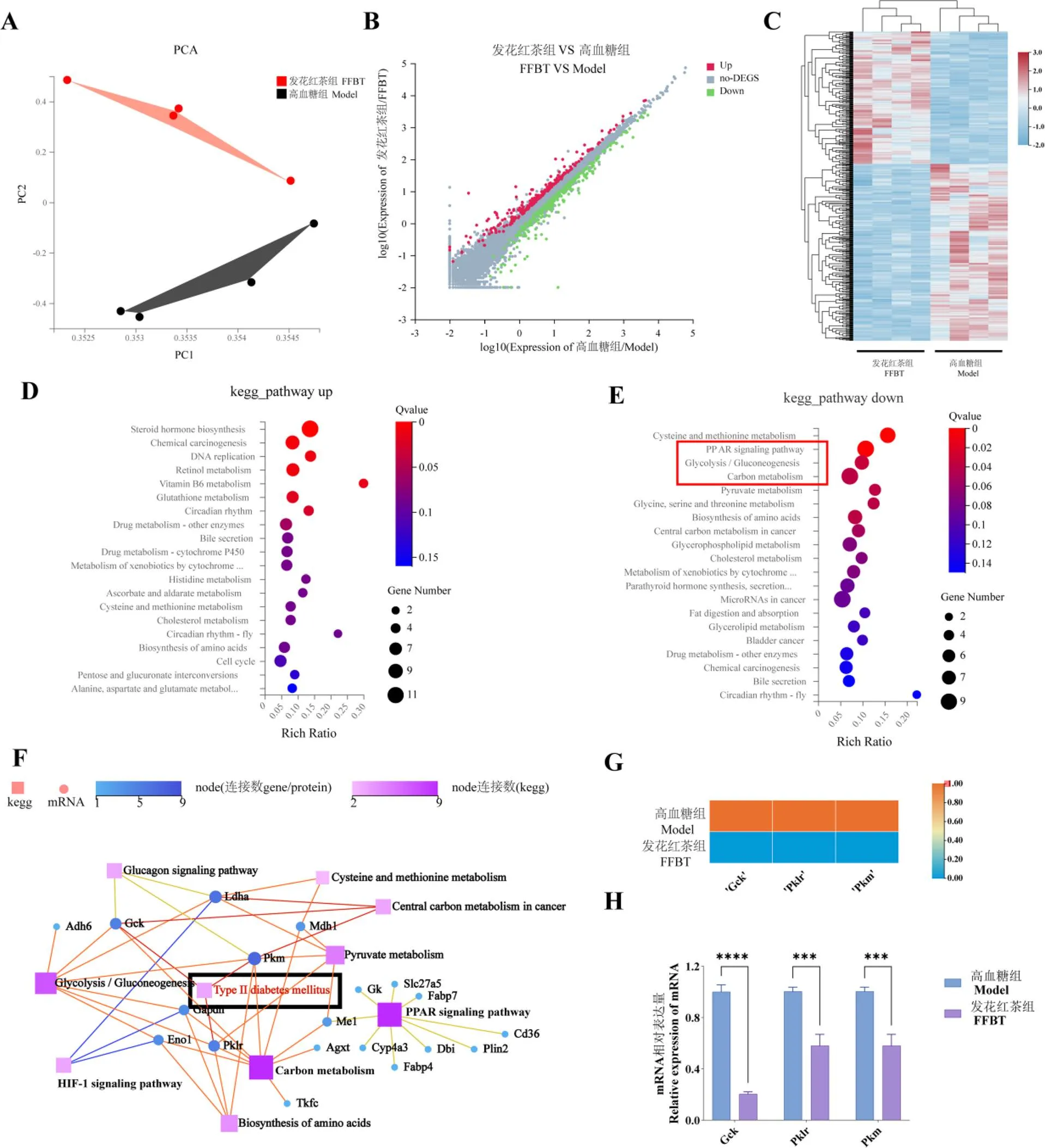
注:A为大鼠肝脏组织转录谱的主成分分析;B为差异基因散点图;C为差异基因表达量热图;D为差异上调基因的KEGG富集分析;E为差异下调基因的KEGG富集分析;F为与关注通路密切相关的19个基因的KEGG通路分析,正方形表示KEGG通路,圆圈代表基因;G为与2型糖尿病密切相关的3个基因的表达量热图;H为qPCR验证转录组结果
3 讨论
2型糖尿病的病因复杂,目前认为主要与遗传、肥胖、年龄及个人的生活方式等因素密切相关[25]。鉴于2型糖尿病病因的复杂性,选择模拟人体2型糖尿病的模型动物尤为重要,这不仅有利于清晰了解2型糖尿病的诱因,更有利于潜在的降血糖活性成分从动物模型到人体临床的转化效率。本研究选择的高血糖动物模型为GK大鼠,GK大鼠属于非肥胖、自发性2型糖尿病大鼠,主要表现为高空腹血糖,高随机血糖,且不伴随肥胖,表现与人类糖尿病相似的代谢、内分泌和血管疾病[11]。
血糖控制是糖尿病管理中的重要组成部分,本研究采用280 mg·kg-1发花红茶提取物干预高血糖大鼠4周后,反映真实血糖水平指标(随机血糖值、空腹血糖值)、反映平均血糖水平指标(糖化血清蛋白水平、糖化血红蛋白水平)、糖代谢异常现象(糖耐量试验)等均得到明显改善,表明发花红茶干预能够维持高血糖大鼠的血糖稳态,发花红茶可作为一种潜在的降血糖功能饮品。虽然茶叶中EGCG的降血糖功能已得到公认[7],但考虑到发花红茶中EGCG等低分子量多酚含量低(<1%),因而推测发花红茶中存在其他发挥降血糖活性的功能成分。在发花过程中,冠突散囊菌分泌出的胞外酶促进了发花茶样独特色香味的形成,使EGCG等多酚类物质发生进一步氧化,有利于茶褐素等大分子物质的积累。本研究表明,发花红茶中含有高含量的茶褐素(14.94%),而茶褐素在近些年被发现具有降脂减肥[26]、降血糖[27]、缓解肠道炎症[28]等功能,因而推测发花红茶的降血糖功能可能与高含量的茶褐素密切相关。
胰岛素等降糖药能够促进血液中过多的葡萄糖进入组织,并以脂肪的形式储存起来,从而发挥降血糖功能[29]。本研究发现,发花红茶干预显著降低了高血糖大鼠血清中TC和LDL-C水平,增加了血清中的胰岛素含量,但并未显著影响高血糖大鼠的体重,表明发花红茶的降血糖功能可能不是通过促进血液中过多的葡萄糖转化为脂肪这一途径实现的。减缓葡萄糖在十二指肠中的吸收速度,是缓解餐后高血糖的重要策略。本研究发现,虽然发花红茶干预对高血糖大鼠十二指肠中的-葡萄糖苷酶水平无明显影响,但明显缩短了十二指肠的绒毛长度,表明发花红茶干预可能通过减缓高血糖大鼠十二指肠吸收葡萄糖等营养物质的速度,从而保护血糖稳态。当机体长期处于高血糖状态,会造成机体发生氧化应激,从而导致肝脏等多种器官损伤,严重影响患者的生存质量[3]。本研究发现,发花红茶干预明显缓解了高血糖大鼠体内的氧化应激反应,减轻了机体内的氧化应激损伤,尤其是缓解了肝脏损伤,具有潜在的降低糖尿病并发症发生风险的作用。
过氧化物酶体增殖因子活化受体(Peroxisome proliferators-activated receptors,PPARs)属于核激素受体超家族,PPARs的激活被认为与体内多种代谢过程密切相关,研制开发以PPARs为靶点的新型抗糖尿病药物已成为药物研究的一大热点[30]。糖酵解/糖异生过程属于碳代谢,是葡萄糖代谢的重要途径,因此,调节糖酵解/糖异生代谢过程对于控制糖尿病的发展和治疗具有重要意义[31]。在本研究筛选到的565个差异基因中,19个差异基因与PPAR信号通路、糖酵解/糖异生、碳代谢密切相关,其中、及直接与2型糖尿病密切相关,因此,这3个基因()被认为是发花红茶通过调控肝脏转录水平,发挥降血糖活性的潜在靶点。未来仍需要通过siRNA干扰试验或者基因敲除试验深入研究验证转录组学的推测,找到更多证据揭示发花红茶通过调控肝脏转录水平发挥降血糖功能的分子机制。
[1] 林海, 丁钢强, 王志宏, 等. 新营养学展望:营养、健康与可持续发展[J]. 营养学报, 2019, 41(6): 521-529. Lin H, Ding G Q, Wang Z H, et al. The prospective in new nutrition science: nutrition, health and sustainable development [J]. Acta Nutrimenta Sinica, 2019, 41(6): 521-529.
[2] Saeedi P, Petersohn I, Salpea P, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: results from the International Diabetes Federation Diabetes Atlas [J]. Diabetes Research and Clinical Practice, 2019, 157: 107843. doi: 10.1016/j.diabres.2019.107843.
[3] Chatterjee S, Khunti K, Davies M J. Type 2 diabetes [J]. Lancet, 2017, 389(10085): 2239-2251.
[4] Defronzo R A, Ferrannini E, Groop L, et al. Type 2 diabetes mellitus [J]. Nature Reviews Disease Primers, 2015, 1: 15019. doi: 10.1038/nrdp.2015.19.
[5] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版) [J]. 中华内分泌代谢杂志, 2021, 37(4): 311-398. Chinese Diabetes Society. Guideline for the prevention and treatment of type 2 diabetes mellitus in China (2020 edition) [J]. Chinese Journal of Endocrinology and Metabolism, 2021, 37(4): 311-398.
[6] Shang A, Li J H, Zhou D D, et al. Molecular mechanisms underlying health benefits of tea compounds [J]. Free Radical Biology and Medicine, 2021, 172: 181-200.
[7] Wan C P, Ouyang J, Li M X, et al. Effects of green tea polyphenol extract and epigallocatechin-3--gallate on diabetes mellitus and diabetic complications: recent advances [J]. Critical Reviews in Food Science and Nutrition, 2022: 1-29. doi: 10.1080/10408398.2022.2157372.
[8] Ito A, Yanase E. Study into the chemical changes of tea leaf polyphenols during Japanese black tea processing [J]. Food Research International, 2022, 160: 111731. doi: 10.1016/j.foodres.2022.111731.
[9] Liu Z H, Gao L Z, Chen Z M, et al. Leading progress on genomics, health benefits and utilization of tea resources in China [J]. Nature, 2019, 566(7742): S15-S19.
[10] Xiao Y, Li M Y, Liu Y, et al. The effect of Eurotium cristatum (MF800948) fermentation on the quality of autumn green tea [J]. Food Chemistry, 2021, 358: 129848. doi: 10.1016/j.foodchem.2021.129848.
[11] Portha B. Programmed disorders of-cell development and function as one cause for type 2 diabetes? The GK rat paradigm [J]. Diabetes/Metabolism Research and Reviews, 2005, 21(6): 495-504.
[12] Zhu J X, Wu M R, Zhou H, et al. Liubao brick tea activates the PI3K-Akt signaling pathway to lower blood glucose, metabolic disorders and insulin resistance via altering the intestinal flora [J]. Food Research International, 2021, 148: 110594. doi: 10.1016/j.foodres.2021.110594.
[13] Nair A B, Jacob S. A simple practice guide for dose conversion between animals and human [J]. Journal of Basic and Clinical Pharmacy, 2016, 7(2): 27-31.
[14] Zhou F, Zhu M Z, Tang J Y, et al. Six types of tea extracts attenuated high-fat diet-induced metabolic syndrome via modulating gut microbiota in rats [J]. Food Research International, 2022, 161: 111788. doi: 10.1016/j.foodres.2022.111788.
[15] 贾建普, 王丽轩, 张乐国, 等. 血清胱抑素C与颈动脉狭窄程度的相关性研究[J]. 中国动脉硬化杂志, 2014, 22(6): 607-612. Jia J P, Wang L X, Zhang L G, et al. Correlation between serum cystatin C and the degree of carotid stenosis [J]. Chinese Journal of Arteriosclerosis, 2014, 22(6): 607-612.
[16] 王皓晨. 联合测定空腹血糖和糖化血清蛋白在糖尿病检测中的临床疗效分析[J]. 糖尿病新世界, 2021, 24(12): 44-47. Wang H C. Analysis of clinical efficacy of combined determination of fasting blood glucose and glycosylated serum protein in diabetes detection [J]. Diabetes New World, 2021, 24(12): 44-47.
[17] 张传龙, 李奕, 庞博, 等. 基于《黄帝内经》脾之生理多维度探讨胰腺癌治脾策略[J]. 世界中西医结合杂志, 2023, 18(3): 445-448. Zhang C L, Li Y, Pang B, et al. Treatment strategy of pancreatic cancer from multiple dimensions of spleen physiology in Huangdi's internal classic (Huang Di Nei Jing) [J]. World Journal of Integrated Traditional and Western Medicine, 2023, 18(3): 445-448.
[18] 童俊, 刘红兵, 刘颖伟, 等. 基于HPLC-ESI-QTOF-MS技术的金桂花降糖活性物质基础研究[J]. 药学学报, 2023, 58(3): 750-759. Tong J, Liu H B, Liu Y W, et al. Research on hypoglycemic activity ofvar.extract [J]. Acta Pharmaceutica Sinica, 2023, 58(3): 750-759.
[19] 曾鸿哲, 周方, 刘昌伟, 等. 茶及其功能成分对肠道菌群调节作用的研究进展[J]. 中国茶叶加工, 2022(1): 5-10. Zeng H Z, Zhou F, Liu C W. Research progress on the regulatory effect of tea and its functional components on intestinal flora [J]. China Tea Processing, 2022(1): 5-10.
[20] 王旭红, 史捷, 张暮盈, 等. 基于“肺肠同治”的清肺化痰逐瘀汤治疗COPD的作用机制[J/OL]. 中国实验方剂学杂志, 2023: 1-12 [2023-07-05]. doi: 10.13422/j.cnki.syfjx. 20231107. Wang X H, Shi J, Zhang M Y. Mechanism of Qingfei Huatan Zhuyu Decoction in treatment of COPD based on "Lung and Intestinal Syntherapy" [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2023: 1-12 [2023-07-05]. doi: 10.13422/j.cnki.syfjx.20231107.
[21] 舒毅, 钟历勇, 石立. 褪黑素、维生素E和还原型谷胱甘肽对四氧嘧啶糖尿病大鼠氧化应激影响的比较研究[J]. 东南大学学报(医学版), 2006, 25(2): 88-92. Shu Y, Zhong L Y, Shi L, et al. Comparative analysis of effects of melatonin, vitamin E and glutathione on oxidative stress in alloxan-induced diabetic rats [J]. Journal of Southeast University (Medical Science Edition), 2006, 25(2): 88-92.
[22] Newsome P N, Cramb R, Davison S M, et al. Guidelines on the management of abnormal liver blood tests [J]. Gut, 2018, 67(1): 6-19.
[23] Taylor S R, Ramsamooj S, Liang R J, et al. Dietary fructose improves intestinal cell survival and nutrient absorption [J]. Nature, 2021, 597(7875): 263-267.
[24] Al-Mrabeh A, Zhyzhneuskaya S V, Peters C, et al. Hepatic lipoprotein export and remission of human type 2 diabetes after weight loss [J]. Cell Metabolism, 2020, 31(2): 233-249
[25] 柳剑, 蓝绍颖. 2型糖尿病危险因素的流行病学研究进展[J]. 南通大学学报(医学版), 2006, 26(3): 230-232. Liu J, Lan S Y. Epidemiologic review of risk factors for type 2 diabetes mellitus [J]. Journal of Nantong University (Medical Sciences), 2006, 26(3): 230-232.
[26] Huang F J, Zheng X J, Ma X H, et al. Theabrownin from Pu-erh tea attenuates hypercholesterolemia via modulation of gut microbiota and bile acid metabolism [J]. Nature Communications, 2019, 10(1): 4971. doi: 10.1038/s41467-019-12896-x.
[27] Yue S J, Shan B, Peng C X, et al. Theabrownin-targeted regulation of intestinal microorganisms to improve glucose and lipid metabolism in Goto-Kakizaki rats [J]. Food & Function, 2022, 13(4): 1921-1940.
[28] Yang W Q, Ren D Y, Shao H J, et al. Theabrownin from Fu brick tea improves ulcerative colitis by shaping the gut microbiota and modulating the tryptophan metabolism [J]. Journal of Agricultural and Food Chemistry, 2023, 71(6): 2898-2913.
[29] Petersen M C, Shulman G I. Mechanisms of insulin action and insulin resistance [J]. Physiological Reviews, 2018, 98(4): 2133-2223. doi: 10.1152/physrev.00063.2017.
[30] 何勇, 彭家志, 李家明, 等. 基于PPARs为靶点的抗糖尿病药物研究进展[J]. 亚太传统医药, 2009, 5(3): 129-131. He Y, Peng J Z, Li J M, et al. Research progress of anti-diabetic drugs based on PPARs as targets [J]. Asia-Pacific Traditional Medicine, 2009, 5(3): 129-131.
[31] 魏爽, 李冀, 韩东卫, 等. 基于网络药理学探讨黄芪-葛根药对对T2DM模型大鼠PI3K/Akt/FoxO1信号通路的调节作用[J]. 中国实验方剂学杂志, 2022, 28(5): 157-168. Wei S, Li Y, Han D W, et al. Regulatory effect of herbal pair astragali radix-puerariae lobatae radix on P13K/Akt/FoxO1 signaling pathway in rats with T2DM based on network pharmacology [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(5): 157-168.
Exploring the Potential Mechanism of Hypoglycemic Effect of Fungus Fermented Black Tea Based on Liver Transcriptomics
ZENG Hongzhe, PENG Liyuan, WAN Liwei, LIU Changwei, FANG Wenwen, WANG Kuofei, ZHANG Xinyi, WEN Shuai, HUANG Jian'an*, LIU Zhonghua*
Key Lab of Education Ministry of Hunan Agricultural University for Tea Science, National Research Center of Engineering and Technology for Utilization of Botanical Functional Ingredients, Co-Innovation Center of Education Ministry for Utilization of Botanical Functional Ingredients, Key Laboratory for Evaluation and Utilization of Gene Resources of Horticultural Crops, Ministry of Agriculture and Rural Affairs of China, Changsha 410128, China
EGCG is often regarded as the main active ingredient in tea to protect blood glucose homeostasis. The content of low molecular weight polyphenols such as EGCG in fungus fermented black tea (FFBT) is extremely low, and there are few studies on the hyperglycemic effect of FFBT. To explore the hypoglycemic effects and potential mechanisms of FFBT, GK rats with spontaneous hyperglycemic were given 280 mg·kg-1FFBT extract (equivalent to 9 g of FFBT for daily human consumption) by gavage intervention. The study assessed the effects of FFBT on body weight, glucose homeostasis, regulatory factors related to glucose homeostasis, diabetic complications and liver transcription profiles in hyperglycemic rats. The results indicated that FFBT could obviously reduce the fasting blood glucose level and random blood sugar level of hyperglycemic rats, improve the abnormal glucose metabolism in hyperglycemic rats, maintain glucose homeostasis and alleviate the damage caused by diabetic complications in hyperglycemic rats. In addition, transcriptome analysis revealed that the hypoglycemic properties of FFBT might be related to the regulation of gene expression in the liver, such as. This study found that FFBT may be a potential hypoglycemic functional beverage, providing a theoretical basis for the development and utilization of fermented tea such as FFBT.
black tea, hypoglycemic effect, diabetic complication, transcriptomics, GK rats
S571.1;R587.1
A
1000-369X(2023)05-645-12
2023-07-05
2023-08-07
国家现代茶叶产业技术体系(CAS-19)、陈玖金花茶健康功效及作用机制研究(2022xczx-252)
曾鸿哲,男,博士研究生,主要从事茶叶功能成分利用与深加工方面研究。*通信作者:jian7513@sina.com;larkin-liu@163.com

