低分子量硫酸软骨素体外酵解特征及其对肠道菌群的调节作用
田伟功,王琳琳,杜茜茜,王立龙,艾春青,闫春红,宋爽
(大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁大连 116034)
肠道菌群由高度复杂和多样化的微生物群落组成,参与有机体的各种生理功能,对有机体的健康至关重要[1]。此外,肠道菌群能够降解多糖并代谢形成多种生物活性物质,如短链脂肪酸等,通过促进相关细胞的增殖,调节氧化应激等因子的水平,来保护肠道上皮细胞,从而改善肠道的屏障功能[2]。因此调节肠道菌群,促进肠道中短链脂肪酸生成,对保障肠道功能具有重要的意义。多糖作为肠道菌群中能量和营养的主要来源,具有调节肠道菌群的作用[3],其中多糖的分子量和聚合度是影响其调控肠道菌群结构的可能因素,会直接或间接地影响机体对营养物质的摄取、能量吸收以及免疫系统等机体反应[4],因此多项研究通过控制多糖降解的程度得到不同聚合度的降解片段来探究其益生活性的不同,例如,Li 等[5]用β-甘露聚糖酶降解桑葚多糖产生桑葚低聚糖,并发现桑葚低聚糖对鼠李糖乳杆菌的增殖效果更为显著。李煜[6]对酶解和微波裂解方法制备的低分子量魔芋葡甘聚糖进行体外发酵培养。结果表明低分子量的魔芋葡甘聚糖对乳杆菌属生长有很好的促进作用,可以看出经过降解后得到的低分子量多糖的益生活性更强。
硫酸软骨素(Chondroitin Sulfate,CS)是由交替的(1→3)-O-β-N-乙酰基半乳糖胺与(1→4)-O-β-葡萄糖醛酸重复单位连接而成,广泛分布于动物软骨中,是结缔组织的重要组成部分[7]。研究证明硫酸软骨素可通过促进小鼠肠道有益菌的生长来调节胰岛素的分泌[8],但低分子量硫酸软骨素(Low Molecular Weight Chondroitin Sulfate,LWCS)对其益生活性的影响研究较少。目前,常见的硫酸软骨素降解方法包括物理降解法(超声波降解、微波降解)、化学降解法(氧化降解、酸水解、酶法降解)等方式[9]。但是,酸水解法的反应条件比较激烈,对多糖中的硫酸基团破坏较大,影响产物活性[10];酶法降解过程较复杂且生产成本高[11];超声波辅助降解、微波辅助降解等方法均对仪器设备有较高要求,大幅提高了多糖降解的成本[12,13];由于氧化降解对硫酸基团的破坏程度小[14],因此非常适合用于制备低分子量硫酸化多糖。常见的芬顿氧化降解由于依赖金属离子,后期脱除金属离子操作较为繁琐,还可能会造成环境的污染。光催化降解是一种高级氧化降解的方法,它可以利用光敏半导体材料在光辐射照射下产生·OH、O2-·等自由基[15]。课题组前期研究发现经过6 h 光催化降解硫酸软骨素分子量由55.49 ku 降至5.01 ku 左右,且硫酸基含量没有显著性变化[16],降解产物的还原端多为葡萄糖醛酸或其衍生物阿拉伯糖醛酸,表明光催化反应中自由基主要攻击葡萄糖醛酸的糖苷键。但与芬顿氧化降解不同,光催化降解没有在还原端生成二羧酸类。因此光催化降解是一种环保、低成本、高效且能够保留硫酸基团的降解硫酸软骨素方法。
本研究通过光催化降解的方法得到低分子量硫酸软骨素,并且基于体外发酵模型评价硫酸软骨素和低分子量硫酸软骨素对肠道菌群结构和多样性的影响,为硫酸软骨素的进一步开发利用提供科学基础。
1 材料与方法
1.1 材料与试剂
牛骨硫酸软骨素,武汉东康源生物有限公司;甲醇、乙腈(均为色谱纯),美国Spectrum 公司;乙酸铵、甲酸、乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸(均为色谱纯),阿拉丁试剂(上海)有限公司;二硝基水杨酸(分析纯),大连博诺有限公司;二甲基亚甲基蓝(分析纯),Sigma 股份有限公司;三羟甲基氨基甲(分析纯),生工生物工程(上海)。
1.2 仪器与设备
光催化氙气光源系统,北京中教金源科技有限公司;高效液相色谱仪,美国Waters 公司;LXQ 液相色谱-线性离子阱质谱仪,赛默飞世尔科技有限公司;气相色谱-质谱联用仪,美国安捷伦公司;厌氧工作站,英国ELECTROTEK 公司;pH 计,美国METTLER公司;CF16RX II 高速冷冻离心机,日本日立公司;高压灭菌器,日本TOMY 公司;多功能酶标仪,瑞士Tican 公司。
1.3 方法
1.3.1 低分子量硫酸软骨素的制备
光催化反应在光催化氙气光源系统中进行。在室温下,将TiO2(0.5 g)加入均匀的硫酸软骨素溶液(5 mg/mL)中。打开氙灯,并加入质量分数为30%的H2O2溶液(终浓度为400 mmol/L)反应6 h,离心除去TiO2,取上清液透析除去H2O2,之后透析后的溶液浓缩冻干得到低分子量硫酸软骨素粉末。
1.3.2 相对分子质量的测定
相对分子质量的测定采用高效凝胶渗透色谱法(High Performance Gel Permeation Chromatography,HPGPC)。使用TSK-gel G5000PWxl(7.5 mm×30.0 cm)凝胶色谱柱,柱温为30 ℃,配备示差折光检测器。流动相为0.1 mol/L 乙酸铵缓冲液(pH 值6.0),流速为0.4 mL/min。以葡聚糖(相对分子质量分别为5、12、25、50、150、410 和670 ku)为标准品,以标准品的保留时间为横坐标,标准样品分子量的对数为纵坐标得到标准曲线。将样品用流动相配制成质量浓度为5 mg/mL 的溶液或取200 µL 质量浓度5 mg/mL 的发酵上清液,使用0.22 µm 聚醚砜水系滤头(天津津腾)过滤后采用HPGPC 分析,进样量为10 µL,测定其色谱峰的保留时间。根据标准曲线计算各个样品的相对分子质量。
1.3.3 多糖体外酵解
1.3.3.1 主要培养基和缓冲液
基础营养培养基(1 L):2 g 蛋白胨、2 g 酵母提取物、0.02 g 血红素、0.5 g L-半胱氨酸、0.5 g 胆酸盐、0.1 g NaCl、0.04 g K2HPO4、0.04 g KH2PO4、0.01 g MgSO4·7H2O、0.01 g CaCl2·6H2O、2 g NaHCO3、1 mL刃天青(1%,m/V)、2 mL Tween-80和10 µL vitamin K1,调节pH 值到6.5。
改性磷酸缓冲盐溶液(PBS):0.8 g/L NaCl、0.2 g/L KCl、1 g/L Na2HPO4、0.2 g/L KH2PO4、0.5 g/L 半胱氨酸盐酸盐、0.04 g/L 刃天青,调pH 值(6.6±0.1)。121 ℃灭菌15 min。
1.3.3.2 人体粪便接种液的制备
收集4 名志愿者(2 男2 女,摄入正常的饮食,没有消化疾病,至少3 个月没有服用抗生素)的新鲜粪便,将粪便样品与改性PBS 配制成10%(m/V)的混合粪便菌液,上述操作在厌氧工作站内完成。得到的混合物离心5 min(500 r/min)后,取上清,作为粪便菌群接种液。
1.3.3.3 粪便发酵液接种
将1.2 mL 的10%(m/V)的混合粪便菌液与10 mL基础培养基混合放入培养瓶中,混合后于厌氧培养箱培养48 h(37 ℃)。不加碳源的基础培养基作为空白对照组(Blank),硫酸软骨素为唯一碳源作为CS 组(CS),低分子量硫酸软骨素为唯一碳源作为LWCS组(LWCS),培养0、6、12、24、48 h 后分别取样,10 000 r/min 离心10 min 后用于进一步实验。
1.3.4 pH、相对含量、还原糖含量的测定
使用pH 计测定发酵0、6、12、24、48 h 后不同组发酵上清液的pH 值。使用二甲基亚甲基蓝法(Dimethylmethylene Blue,DMMB)法[17]分析发酵0 h 和48 h 的发酵上清液中的相对含量,分别使用硫酸软骨素和低分子量硫酸软骨素作为标准样品。使用二硝基水杨酸法(3,5-Dinitrosalicylic Acid,DNS)[18]检测发酵0、6、12、24、48 h 的发酵上清液还原糖的含量,使用葡萄糖作为标准品。
1.3.5 短链脂肪酸的测定
1.3.5.1 混标的制备
配制含有1.0 mg/mL 的乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸混合标准溶液,随后稀释为5、50、100、200、300、400 和500 µg/mL 的标准溶液,同时加入100 µL 的内标(2-乙基丁酸,1.0 mg/mL)。
1.3.5.2 样品前处理
准确吸取500 µL发酵液上清加入20 µL稀硫酸酸化(50%,V/V),加入900 µL 乙醚和100 µL 的内标(2-乙基丁酸),涡旋振荡后在-20 ℃下静置一段时间,4 ℃离心(12 000 r/min)。收集上清液并加入250 mg无水Na2SO4,充分涡旋,4 ℃离心(12 000 r/min),取上清液使用0.22 µm尼龙66有机相滤头(天津津腾)过滤,供上机分析。
1.3.5.3 气相色谱质谱条件
使用仪器配有 HP-INNOWAX 气相色谱柱(30 mm×0.25 mm,0.25 μm)的Agilent 7890B-5977B GC/MSD 系统。色谱条件:进样量1 µL,初始温度为80 ℃,升温速度为40 ℃/min,最终温度为230 ℃,保持3 min。质谱条件:电子轰击离子源(Electron Impact Ion,EI),离子源温度230 ℃,四级杆温度150 ℃,传输管温度250 ℃,在70 eV 电压下以m/z30~300 的全扫描模式下进行质谱检测。
1.3.6 人体粪便微生物群分析
微生物多样性测序由百迈客生物科技有限公司完成。用TGuide S96 磁珠法粪便基因组DNA 提取试剂盒完成核酸的提取,然后通过琼脂糖凝胶电泳检测DNA 的纯度和浓度。对基因组DNA 中的16S rRNA基因V3-V4 区扩增,引物选用806R 和338F。文库通过Qsep-400 方法进行质检,满足如下指标即可上机检测。对于构建好的文库使用illumina novaseq 6000(novaseq 6000,illumina)进行上机测序。测序完成后,根据通用标准对原始序列进行筛选。所有的结果都基于序列读取和操作分类单元(Operational Taxonomic Units,OTUs),肠道菌群主成分分析、花瓣图、聚类分析、菌群的相对丰度和热图等在网站上操作得出(https://international.biocloud.net/zh/article/index)。
1.3.7 数据分析
采用SPSS 17.0软件进行实验数据分析,GraphPad Prism 8.3 进行作图。所有数据均表示为平均值±标准误差。两组或两个样本间的比较使用Student'st-test检验。检验三组之间的差异使用单因素方差分析(Analysis of Variance,ANOVA)中Duncan's range检验。P<0.05 被认为具有统计学意义。
2 结果与讨论
2.1 肠道菌群利用情况分析
首先利用光催化降解的方法降解硫酸软骨素,在降解时间为0 h、6 h 时测定样品的分子质量。如图1所示,随着降解时间的延长,色谱峰明显向右偏移,说明光催化降解能够使硫酸软骨素分子质量显著下降。硫酸软骨素和低分子量硫酸软骨素分子质量分别为88.42 ku 和4.48 ku。

图1 硫酸软骨素和低分子量硫酸软骨素的高效凝胶渗透色谱图Fig. 1 HPGPCof chondroitin sulfate (CS) and low molecular weight chondroitin sulfate (LWCS)
然后利用体外发酵模型分析评估肠道菌群的利用情况。使用HPGPC 法分析发酵上清液中分子量的变化情况,通过使用空白发酵液作为对照且对比发酵起点和发酵终点(图2a),发酵后的色谱图显示硫酸软骨素和低分子量硫酸软骨素的峰面积减少,保留时间发生后移。进一步使用DMMB 法检测两者在发酵上清液中含量发现(图2b)经过48 h 厌氧发酵后,两者含量均显著降低。图2c 为整个发酵过程中pH 值的变化,发酵期间Blank 组呈现先降低后升高的趋势,而CS 组和LWCS 组pH 值在0~24 h 一直显著降低。然而,发酵24 h 后,CS 组的pH 值显著升高,LWCS组的pH 值仍保持在较低水平。图2d 显示在发酵过程中CS 组和LWCS 组的还原糖含量,在0~6 h 期间分别从 3.21 mg/mL 和 5.56 mg/mL 显著增加至3.44 mg/mL 和5.96 mg/mL,然后在6~48 h 期间显著降低至1.62 mg/mL 和3.79 mg/mL。

图2 在体外发酵中分子量(a)、多糖相对利用率(b)、pH(c)和还原糖含量(d)的变化Fig. 2 Changes in molecular weight (a),relative utilization of polysaccharide (b),pH (c) and reducing sugar content (d) in vitro fermentation
上述结果显示发酵48 h 后,发酵液上清中的硫酸软骨素、低分子量硫酸软骨以及还原糖含量下降,相对分子质量发生了变化。证明肠道菌群能够降解利用硫酸软骨素和低分子量硫酸软骨素,并且均会降低发酵液中的pH 值,而低分子量硫酸软骨素可以维持较长时间的酸性环境,多项研究发现发酵产物中短链脂肪酸的产生和微生物菌群的变化都与pH 值的变化相关[19],因此低分子量硫酸软骨素更有利于有益菌的生长和短链脂肪酸的生成。同时在发酵过程中还原糖含量的变化同鼠尾藻多糖[20]和菠萝蜜多糖[21]的体外发酵结果一致,都呈现出先增高后降低的变化,这可能是由于菌群降解多糖过程中会首先破坏糖苷键释放更多的还原端,使还原糖含量增高,而后期这些短链还原糖又被菌群逐步分解利用。而王鑫纯等[22]报道野皂荚多糖在体外发酵过程中的还原糖浓度持续下降,而降解后野皂荚多糖中酵解液中的还原糖先降低再增高,之后又降低,推测这与肠道菌群优先利用寡糖并分泌降解酶有关。
2.2 肠道菌群结构分析
2.2.1 多样性分析
利用IlluminaNovaseq 6000 平台对体外发酵样品中细菌16S rRNA V3-V4 区域进行高通量测序,研究不同分子量硫酸软骨素对肠道菌群的影响。在Alpha多样性指数分析中(表1),Chao1 指数和Ace 指数用于评估肠道微生物群的丰富度,Shannon 指数和Simpson 指数代表肠道微生物群的多样性。结果表明,CS 组Chao1、Ace 指数显著低于Blank 组,Shannon、Simpson 指数显著高于Blank 组,表明硫酸软骨素降低了肠道微生物群的丰富性而增加了其多样性。LWCS 组的Chao1、Ace 指数与Blank 组和CS 组均没有显著性差异,但Shannon、Simpson 指数显著高于Blank 组和CS 组,表明低分子量硫酸软骨素不会丰富肠道微生物群,但会使肠道微生物群多样性显著增加。但Liu 等[23]研究发现硫酸软骨素对肠道微生物总体多样性没有显著影响,而Tuncil 等[24]将硫酸软骨素作为唯一碳源,发现不同志愿者粪便样本中的Shannon 多样性指数不同,而这可能与志愿者的个体差异、不同来源的硫酸软骨素以及小鼠性别等有关[25]。主坐标分析(PCoA)评分图用于表示来自不同样品的肠道菌群组成的差异性或相似性[26],如图3 所示,同一组样品之间聚集在一起而不同组之间都存在明显差异,表明不同分子量硫酸软骨素能够对菌群结构产生明显的调控作用,但调控结果存在差异。
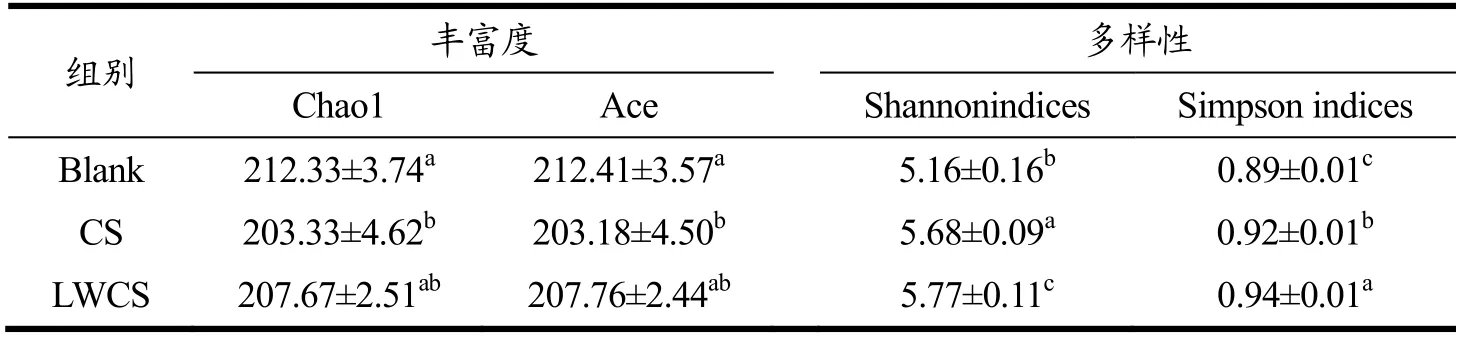
表1 不同组间肠道微生物的Alpha 多样性分析Table 1 Alpha diversity analysis of gut microbiota in different groups
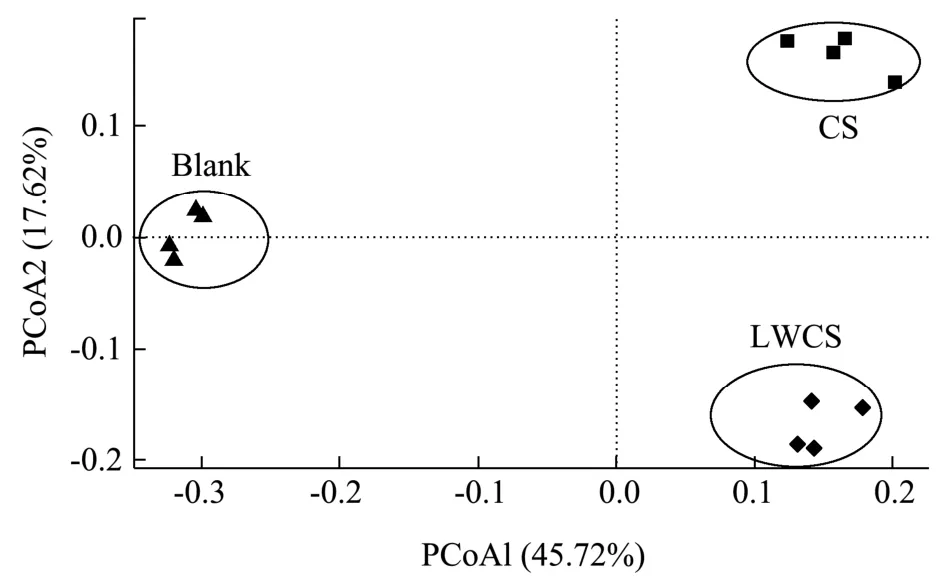
图3 不同组间肠道菌群的PCoA 分析图Fig. 3 Structural modulation of gut microbiotain different groups
2.2.2 肠道微生物相对丰度显著差异分析
为了研究不同分子量硫酸软骨素对人体粪便菌群组成的影响,分析了不同组之间的菌群在门和属的水平上的差异。如图4 所示,在门水平上,肠道菌群主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)组成。与Blank 组相比,CS 组和LWCS 组均显著增加了Bacteroidetes 相对丰度,Firmicutes 和Proteobacteria 的相对丰度以及Firmicutes/Bacteroidetes 的比例均显著减少。值得注意的是,与硫酸软骨素相比,低分子量硫酸软骨素促进Bacteroidetes 增殖的作用更强。

图4 不同组间肠道菌群在门水平上的影响Fig. 4 The effects of different groups on gut microbiota at the phylum level
据报道,Firmicutes 和Bacteroidetes 均含有编码硫酸软骨素利用位点和水解酶的基因,且Bacteroidetes基因组具有高度特异性,能够将其降解代谢从而降低肠道菌群中有害菌群的相对丰度[2],且低聚糖更容易被Bacteroidetes 利用[27]。而虽然由于Firmicutes 基因组中编码位点较少,同时Bacteroidetes 会争夺周围的可用营养物质[28],从而导致Firmicutes 减少。因此,推测粪便菌群中的Bacteroidetes 能够优先利用硫酸软骨素导致相对丰度增加,且更容易利用分子量更低的硫酸软骨素,从而降低Firmicutes/Bacteroidetes 的比值。有研究发现硫酸软骨素改变肠道菌群中的Bacteroidetes 和Firmicutes 的丰度及比例,最终改善了高脂饮食引发的炎症反应[29,30]。表明不同分子量硫酸软骨素均可通过调节肠道菌群从而改善宿主代谢健康。Proteobacteria 中含有大肠杆菌等多种有害病原体,通常被认为是肠道菌群失调的微生物标志,Proteobacteria 增加会导致人类许多疾病的发生[31]。研究显示硫酸软骨素可以显著降低小鼠体内Proteobacteria 的丰度而发挥其抗炎活性[23]。本实验结果也证明不同分子量硫酸软骨素均可以通过抑制Proteobacteria 增殖,具有改善宿主肠道健康的潜力。
为了进一步确定不同分子量硫酸软骨素之间有显著差异的特定细菌类型,图5 展示了体外发酵后的物种丰度前15 的菌属。相对于Blank 组,发酵后CS 组和LWCS 组的拟杆菌属(Bacteroides)、副拟杆菌属(Parabacteroides)、考拉杆菌属(Phascolarctobacterium)、霍尔德曼氏菌属(Holdemanella)、巨单胞菌属(Megamonas)显著增加,从毛单胞菌属(Comamonas)、双歧杆菌属(Bifidobacterium)、毛螺菌科 UCG_004(Lachnospiraceae_UCG_004 )、链球菌属(Streptococcus)、嗜胆菌属(Bilophila)显著降低。与CS 组相比,LWCS 组显著降低了埃希氏-志贺氏菌属(Escherichia-Shigella)、毛螺菌科 UCG-004(Lachnospiraceae_UCG_004 )、链球菌属(Streptococcus),显著增加了Lachnoclostridium菌属、嗜胆菌属(Bilophila)、副拟杆菌属(Parabacteroides)的丰度。基于微生物属水平的相对含量,使用LEfSe分析(LDA>4)进一步分析各个样品之间的差异(图6)。CS 组和LWCS 组分别促进了粪便拟杆菌(Bacteroides stercoris)和吉氏拟杆菌(Parabacteroides merdae)的富集,LWCS 组的拟杆菌纲(Bacteroidetes)细菌、坦纳菌科(Tannerellaceae)细菌和Parabacteroides细菌(图6)相对含量远高于CS 组。而CS 组的Escherichia-Shigella相对含量高于LWCS 组。

图5 属水平的细菌相对丰度Fig. 5 Relative abundance of gut microbiota at the genus level

图6 CS 组和LWCS 组微生物群的LEfSe 分析(LDA>4)Fig. 6 LEfSe analysis of microbial composition in CS and LWCS groups (LDA>4)
Bacteroides属和Parabacteroides属微生物能够降解多种复杂碳水化合物,是短链脂肪酸的主要生产者[32-34]。其中Bacteroides作为人类肠道中的最丰富的细菌属,有助于维持免疫系统的稳定[28]。但在缺乏多糖的情况下,Bacteroides会破坏肠道上的黏液蛋白,从而导致肠道炎症[25]。而硫酸软骨素可以被Bacteroides编码的软骨素酶裂解为不饱和二糖,经胞内硫酸酯酶脱硫后,被胞内葡萄糖醛酸酶分解成单糖利用[35],起到保护肠道屏障作用[23]。Parabacteroides在机体中可以产生细菌素防御外来微生物侵袭[36]。实验结果证实了CS 组和LWCS 组中主要菌群Bacteroides、Parabacteroides的丰度增加,而LWCS 组的肠道菌群经过厌氧发酵后在菌中检测到更多的Parabacteroides细菌,因此,Parabacteroides细菌可能是肠道菌群中降解利用低分子量硫酸软骨素的关键细菌。Streptococcus、Bilophila和Escherichia-Shigella等是潜在的致病菌[37,38],CS 组和LWCS 组促进了有益菌的增长,而有益菌及产物所具有的抗菌活性可以对于肠道内病原菌发挥消灭作用,使肠道生态平衡得以重新建立[39],因此,Streptococcus、Bilophila和Escherichia-Shigella等致病菌的丰度显著降低。Liu 等[23]也发现硫酸软骨素抑制了有害菌的增殖并缓解了应激小鼠中的肠道炎症。综上所述,与硫酸软骨素相比,低分子量硫酸软骨素能够更好的促进有益菌并且抑制致病菌的生长。
2.2.3 发酵产生的代谢产物分析
短链脂肪酸是肠道菌群发酵硫酸软骨素等多糖产生的主要代谢产物之一[23],也是评价益生作用的重要指标之一。本文测定了发酵后不同组发酵液中乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸的含量,从而了解肠道菌群的代谢情况。结果如图7 所示,乙酸、丙酸和丁酸是主要的代谢产物,与CS 组相比,LWCS组能够显著地促进乙酸、丙酸和总短链脂肪酸水平,分别是CS 组的1.15、1.03 和1.09 倍,显著降低了戊酸的水平。而CS 组的异丁酸和异戊酸的浓度显著低于Blank 组和LWCS 组。

图7 短链脂肪酸含量测定结果Fig. 7 Results of shortchain fatty acids content determination
乙酸和丙酸主要由Bacteroidetes 产生[40],而丁酸的合成途径较多,除了Firmicutes 产生,肠道微生物还可以利用乳酸和乙酸来合成[41]。乙酸在短链脂肪酸中占比最多,可通过神经系统来降低食欲,进而发挥抗肥胖作用。丙酸可参与并调节脂质代谢、减少促炎因子的形成,作为结肠上皮细胞的直接能量来源,具有抗炎特性,并且能够调控肠黏膜上皮细胞等维持肠道稳态[42]。实验结果证明不同分子量硫酸软骨素均能显著促进Bacteroidetes 的富集,因此产生了较多的乙酸、丙酸和丁酸。这与众多结果研究一致,硫酸软骨素可以通过促进短链脂肪酸的生成发挥其益生作用,例如,Liu 等[23]研究显示硫酸软骨素增加了小鼠粪便中总短链脂肪酸和丁酸水平,其中丁酸水平增加了2倍以上,并改善了应激小鼠的炎症水平。Yu 等[43]研究发现来源于罗非鱼头的硫酸软骨素调节了小鼠的肠道菌群平衡并显著增加小鼠体内短链脂肪酸的含量缓解高脂饮食诱导的非酒精性脂肪肝。不同的是,实验结果显示戊酸含量显著减少,猜测可能是不同分子量硫酸软骨素不能被少量戊酸产生菌,例如埃氏巨型球菌(Megasphaera elsdenii),巨型球菌种(Megasphaerasp)等利用[42]。异丁酸、异戊酸是肠道细菌发酵蛋白质或氨基酸中的支链氨基酸产生的特征产物,常作为一些疾病的标记物[44]。与Blank 组相比,CS 组可以显著抑制异丁酸和异戊酸的产生,而LWCS 组对异丁酸的抑制作用减弱且不会抑制异戊酸的生成。但由于戊酸、异丁酸、异戊酸含量在总短链脂肪酸中占比较少,猜测可能对机体产生的影响较为有限。因此,上述结果说明低分子量硫酸软骨素不仅能够更好的调控菌群的组成结构,而且能够影响短链脂肪酸的含量。
但研究发现硫酸软骨素的分子量和硫酸化程度可对肠道菌群的调控结果造成影响,肠道菌群需要产生不同的酶来利用不同的硫酸软骨素异构体[45],进而影响其丰度。此外,不同的模型也会影响其降解速率及其干预效果[24]。因此,硫酸软骨素的益生活性与结构之间的关系有待于进一步深入研究。
3 结论
本文使用体外发酵模型和16S rRNA 基因测序技术评价了硫酸软骨素和低分子量硫酸软骨素体外酵解特征及其对肠道菌群的调节作用。结果表明,低分子量硫酸软骨素具有更好的益生特性,不仅可以为肠道菌群提供较长时间的酸性环境,并且能够更好的调整菌群结构,具体表现在低分子量硫酸软骨素显著提高了肠道菌群多样性,与硫酸软骨素组相比,Shannon指数增加了1.58%,Simpson 数增加了2.17%,拟杆菌门比例显著提高了8.08%,并显著增加拟杆菌属,副杆菌属的相对含量,显著降低了致病菌埃希氏-志贺氏菌属的相对含量(P<0.05),从而显著促进乙酸、丙酸等短链脂肪酸生成(P<0.05),最终,总短链脂肪酸含量提高了69.76%,而硫酸软骨素组仅为55.19%。因此表明降低硫酸软骨素的分子量能够提高肠道菌群的益生作用,为硫酸软骨素的进一步开发与应用提供科学依据。

