基于CT 图像的胰腺癌智能辅助诊断模型研究
郭冰冰, 谷雪莲, 胡秀枋, 孙运文, 徐秀林
(上海理工大学 健康科学与工程学院, 上海 200093)
0 引 言
胰腺癌是预后最差的恶性肿瘤之一,其具有侵袭性强、隐匿度高、病程短的特点。 据全球癌症统计数据显示,胰腺癌在癌症的死亡原因里位居前列,且有研究预测未来10 年内胰腺癌相关死亡人数将上升至所有癌种的第2 位,仅次于肺癌[1-2]。 胰腺癌IV 期患者确诊后生存期小于1 年,5 年平均生存率小于1%[3]。 同时,由于大部分胰腺癌患者在被确诊时就已错过最佳治疗时期,因此寻找到一种有助于早期诊断的方法显得尤为重要,可大幅提升患者的生存时间[4]。 目前,病理切片依然被视为确诊的“金标准”,但总体上依赖的是医生的经验,不同的医生可能生成不同的诊断结果。 随着人工智能在医学领域的深入应用,计算机辅助诊断(Computer-Aided Diagnosis,CAD)技术的优势不断显现出来,其可以有效减少医生的阅片工作量,也可为医生提供诊断决策支持,有助于医生减少临床实践中的误诊率和误治率[5],甚至能预测病灶迁移位置,以便为临床疗效评估提供参考。
机器学习是人工智能的重要研究内容之一,机器学习算法是一类从数据中自动分析获得规律,并利用规律对未知数据进行预测的算法。 针对不同的问题需要不同的学习方式,主要的学习方式为有监督学习和无监督学习。 有监督学习常用于分类和回归的问题,其特点是所有数据都有标签;无监督学习常用于聚类的问题,其特点为所有数据都没有标签。常用的机器学习算法有支持向量机、逻辑回归、随机森 林、 Lasso 回 归、 Ada Boost (adaptive boosting,AdaBoost)等。 近年来,由于医疗数据不断增长,因此机器学习的优势得到充分的体现。
2006 年,Hinton 教授及其团队提出了一种新的网络结构——深度置信网络(Deep Belief Net,DBN)[6],至此深度学习开始出现在研究者视野里。深度学习常被应用于图像识别,但随着技术的不断推进,在医疗诊断、医用机器人控制、搜索引擎等领域均有不俗的表现。 目前,最经典的深度学习网络还是卷积神经网络(Convolutional Neural Network,CNN),Lecun[7-8]等在神经网络中创造性的代入了传播算法,并以此为基础构建了卷积神经网络。 此外,其它常用的学习模型有Inception[9]、ResNet[10]、AlexNet、VGG 等。 早期诊断是改善胰腺癌患者预后的关键因素之一,若能提升早期诊断率,就能极大改善胰腺癌的预后并延长生存时间。 本文主要研究CT 分层图像对胰腺癌的早期良恶性诊断的有效性,通过构建AdaBoost 等5 种机器学习模型和经典深度学习网络模型VGG16,分别获得胰腺癌良恶性分类的准确率,同时对不同模型进行对比分析,进一步验证CT 图像在VGG16 的应用性能。
1 资料与方法
1.1 数据集预处理
本研究使用的数据来自医院的胰腺癌病人CT图像,将其分成APT、DPT、NPT、VPT 4 期的扫描图像,并对图像进行去噪处理,去除相应体数据的绝对位置、数据密度等信息,4 个数据集存在交集。 其中,APT(静脉期)包含786 张图像;DPT(延迟期)包含757 张图像;VPT(动脉期)包含1 382 张图像;NPT(平扫期)包含1 368 张图像。
在对数据集进行训练时,将数据集分成训练集、验证集、测试集3 部分。 训练集用于训练模型,验证集用来验证模型的效能,测试集用来对模型进行评估。 实践中,测试集和验证集采用同一批数据,在分配时将所有数据的80%分配给训练集,20%分配给测试集。
1.2 模型训练方法
VGGNet[11]是2014 年ImageNet Challenge 图像识别比赛的亚军,其不仅在图像识别应用非常广泛,在目标分割、人脸识别等方面的应用也会使用VGGNet 作为基础模型,其证明了增加网络的深度能够在一定程度上影响网络最终的性能。 VGG16有16 层网络,能不断提取学习从低级到高级的特征,卷积核大小为3×3,逐层增加卷积核的数量以增强非线性表达能力[12]。 本文深度学习模型选用VGG16 对已有数据集进行训练学习。
AdaBoost[13]是机器学习工具箱中最强有力的工具之一,其基分类器一般是单层决策树,决策树在分裂的时候会选择最优属性进行分裂,最优属性为误差最小的属性,AdaBoost 在每次迭代时会选择误差最小的那棵树。 其优势在于Adaboost 提供了一种能使用其他方法构建子分类器的框架,不仅能显著提高学习精度,且可以根据子分类器的反馈,对假定的错误率进行自适应调整。
1.3 模型评价指标
在对模型进行学习训练时,本文采用的评价指标为模型的训练集和测试集的准确率(Accuracy)及其损失函数(Loss Function)。
准确率的计算公式为
本文选择的损失函数为交叉熵损失函数(categorical_crossentropy),可评估当前训练得到的概率分布与真实分布的差异情况。 交叉熵的值越小,概率分布与真实分布就越接近。 其具体公式为:
其中,y为期望的输出,a为神经元的实际输出。
2 基于深度学习良恶性分类诊断模型
首先基于Keras 搭建VGG16 模型,其中最后一个全连接层的激活函数为softmax,其优点是计算简单且计算量较小,能把数据的值映射到0 ~1 区间,保证概率为非负值;其次将输入的数据集图片调整尺寸大小为(224,224)的单通道灰度图像,以加快模型训练速度。 本实验目标是识别胰腺癌肿瘤的良恶性,属于二分类问题,设置训练次数为160 次,优化函数为Adam[14],是一种对随机梯度下降法的扩展,其优点在于效率高、内存小、且超参数具有直观的解释,通常只需要较少的调谐。
本文分别从APT、DPT、VPT、NPT 的数据集中随机提取20%的图像作为验证集,将4 组图像数据分别导入搭建好的VGG16 模型进行训练,经过不断对参数调优,最终训练集和验证集的训练结果如图1 所示,其对应训练集和验证集的损失函数图像如图2 所示:
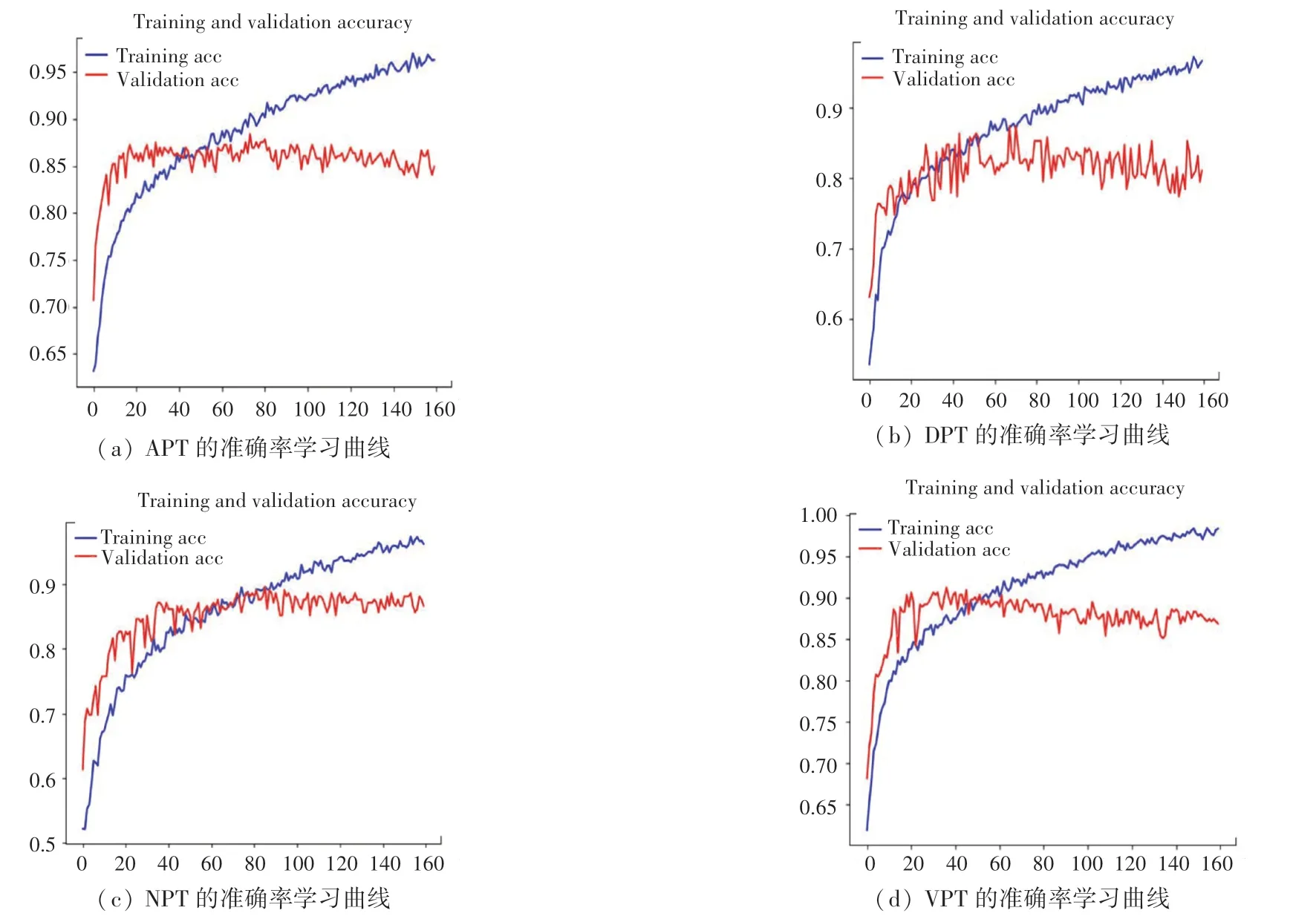
图1 4 组数据集的准确率学习曲线Fig.1 Learning curve of accuracy of four datasets
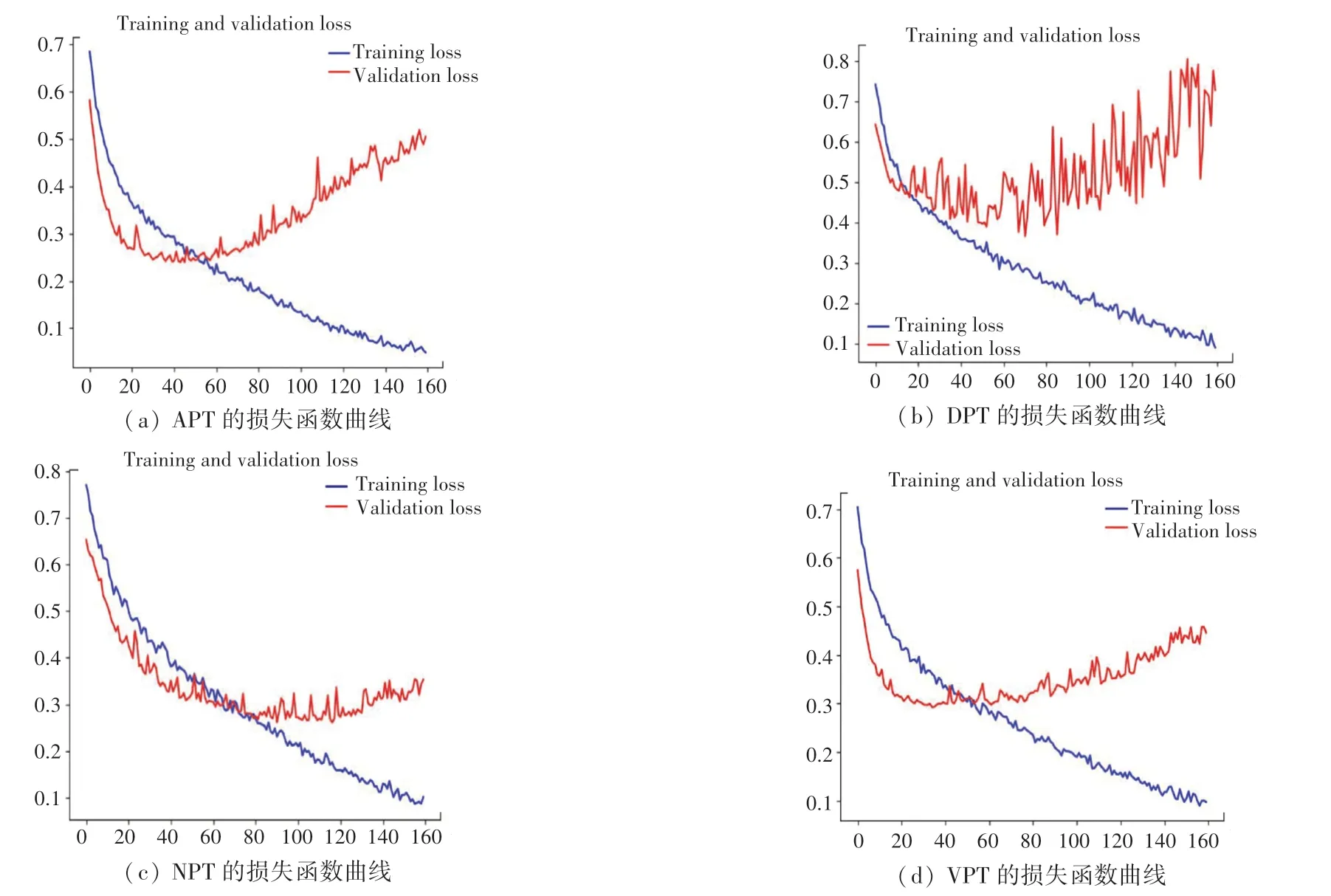
图2 4 组数据集的损失函数曲线Fig.2 Loss curves of four datasets
根据以上训练和验证结果,得到如表1 所示的混淆矩阵。
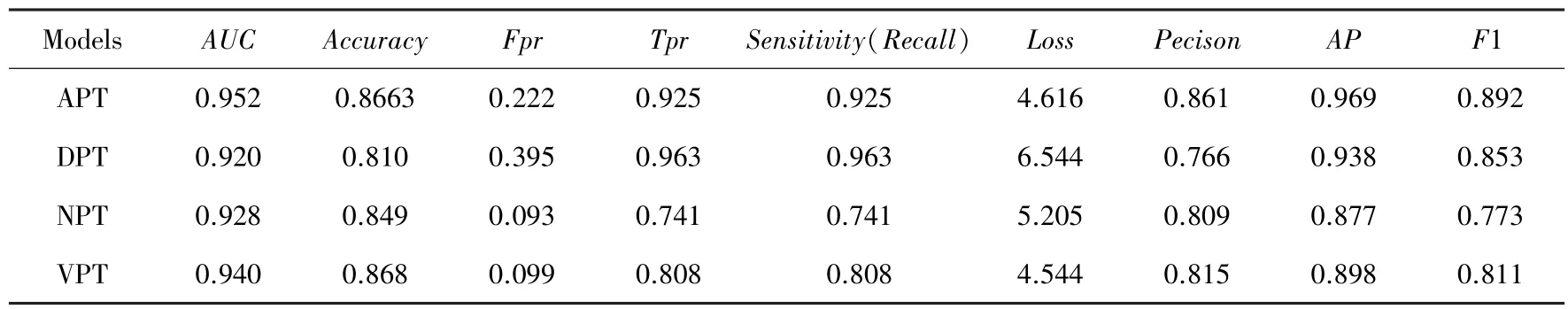
表1 4 组数据集训练后的混淆矩阵Tab.1 Confusion matrix after training on four datasets
由表1 不难看出,VGG16 模型对于APT、DPT数据集的灵敏度最好,APT、VPT 数据集的AUC和精确度较高。
为了进一步验证模型的准确率,本研究分别将上述4 期的测试集导入已训练好的VGG16 模型,对患者进行肿瘤良恶性分类诊断。 其中包含202 张APT 的胰腺癌图像,190 张DPT 的胰腺癌图像,345张NPT 的胰腺癌图像,342 张VPT 的胰腺癌图像,预测与真实值的对比结果见表2:
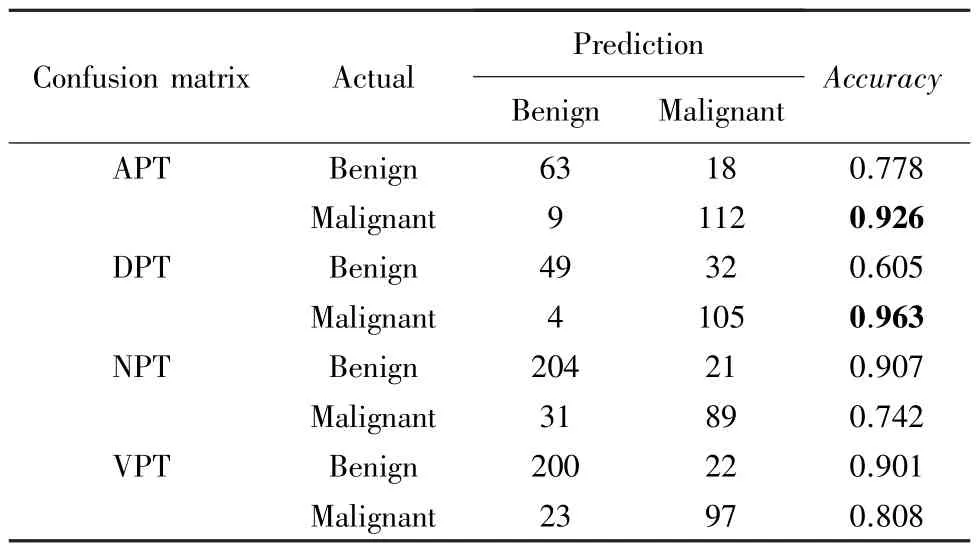
表2 4 组数据集预测值与真实值结果对比Tab.2 Comparison of prediction results and ground truth on four datasets
由表2 可知,APT、DPT 对胰腺癌恶性肿瘤的识别率高达0.92 以上,而NPT、VPT 对良性肿瘤识别率也超过了0.90。
3 基于机器学习模型的良恶性分类诊断
为了建立识别胰腺癌CT 图像良恶性分类最佳的机器学习模型,本文将4 组数据集分别导入支持向量机、逻辑回归、随机森林、K 近邻、AdaBoost 5 个模型进行训练学习,同时从原数据集提取20%作为测试集以验证模型训练效果。 各模型对比结果见表3。
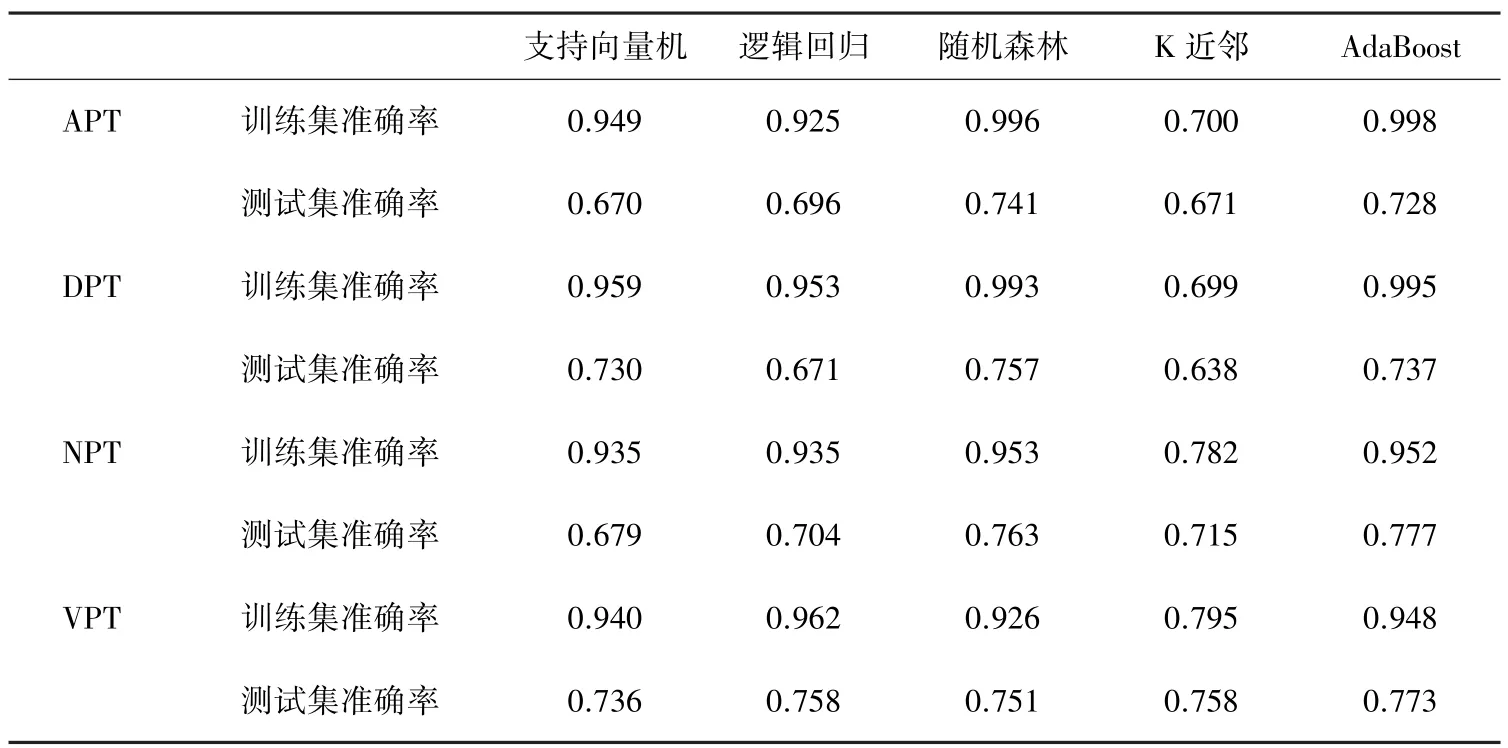
表3 5 种机器学习模型对于4 组数据集的训练结果对比Tab.3 Comparison of prediction results of five machine learning models on four datasets
由表3 可知,随机森林和AdaBoost 训练集和测试集准确率较好,对于APT、DPT、NPT、VPT 4 个数据集的训练效果均达到90%以上,测试集准确率达到70%以上。 随机森林的学习曲线如图3 所示,AdaBoost 的学习曲线如图4 所示。
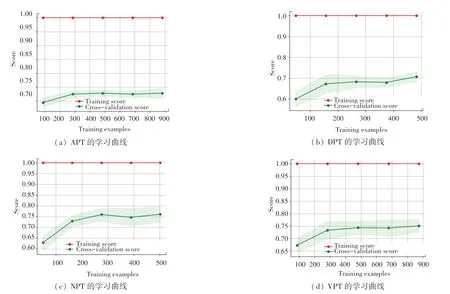
图3 4 组数据集在随机森林模型下的学习曲线Fig.3 Learning curves of random forest model on four datasets
4 结束语
随着人工智能技术的蓬勃发展,机器学习和深度学习在医疗辅助诊断领域的应用也在不断深入,基于CT 图像的胰腺癌良恶性分类的问题已经证明了其具有良好的可行性,获得了很好的分类效果[15]。
使用机器学习进行训练学习的优势在于网络较简单,速度快,但对于诊断CT 图像良恶性准确率不高;训练集与测试集的差距超过20%,因此可能存在过拟合现象。
深度学习对于图像的识别率很高,CNN 对于4期的CT 图像的AUC均可以达到90%以上,但其不足在于网络模型较为复杂,训练时间长,对电脑配置要求较高。
本文分别将胰腺癌患者的APT、DPT、NPT、VPT 4 期CT 图像导入深度学习和机器学习的网络模型训练,虽然不同网络在准确率上有较为明显的差距,但基于深度学习模型的良恶性分类诊断中,综合得分和识别率较高的是APT 和VPT 时期;基于深度学习模型的良恶性分类诊断中,综合得分和识别率较高的是VPT 和NPT 时期。
综上,不论使用深度学习还是机器学习的方法,良恶性特征较为明显的时期是VPT,即动脉期。
虽然本文的研究取得了一定成果,但依然存在一些不足。 如:4 期的CT 图像数据虽然存在交集,但并不是完全重合的数据;由于深度学习网络模型耗时较长,只选取了经典的VGG16 导入数据训练等。 后续可尝试ResNet、Inception 等其他网络模型进行进一步研究。

