DNA介导荧光铜纳米簇的合成及表征
——推荐一个研究型综合化学实验
李俊彬,李承麟,骆嘉琪,陈惠,卿志和
长沙理工大学化学化工学院,长沙 410114
1 引言
2021年5月28日,习近平总书记在中国科学院第二十次院士大会、中国工程院第十五次院士大会、中国科协第十次全国代表大会上强调:“当今世界的竞争说到底是人才竞争、教育竞争。要更加重视人才自主培养,更加重视科学精神、创新能力、批判性思维的培养培育[1]。”高校是人才培养的主要阵地,而化学实验课是高校化学类及相关专业人才培养过程中的重要课程,对强化学生专业基础知识和提升学生专业技能具有重要作用。目前,在高校基础化学实验教学中存在着与社会和国家实际需求相脱节、缺乏前沿科研成果的融入等问题,导致学生对实验的兴趣不浓,实验报告以及作业草草应付。为了进一步激发学生的创新意识,培养高素质的科研人才,化学实验教学在实验内容的设计上要体现新颖性,要将一些化学实验的新方法、新原理、新物质、新功能引入到实验教学中,全面提高实验的新颖性、实用性和趣味性,使实验教学内容更多地贴近实际生活、贴近科学前沿,对接学生未来就业和发展需要。通过紧紧围绕以学生为中心,以创新能力培养为导向,采用研究性教学模式,将前沿的科研成果引入到高校综合实验教学中,多方位培养化学类专业本科学生发现问题、思考问题、分析问题的能力,以及提升他们综合运用知识的能力[2,3]。
目前,金属纳米材料因其具有特异的光学、催化性能,在化学化工、生物医药、环境监测等诸多领域备受关注,而纳米材料的合成则是该前沿领域的研究基础[4]。DNA分子由于具有良好的纳米线性几何结构以及与金属离子的高结合作用,在还原剂存在下,DNA分子可作为模板介导和稳定金属纳米材料的合成[5]。此外,以DNA为模板合成金属纳米材料还具有低成本、重现性好、反应速度快的特点,为生化分析与生物传感等提供了有效工具[6]。在上述前提下,将科研中DNA介导荧光铜纳米簇的合成设计成研究型综合化学实验,引导学生了解并掌握光学纳米材料设计与制备的相关知识,训练学生的化学、生物交叉创新思维,感受纳米科技的魅力所在。具体实验教学内容包括:通过设计不同的DNA序列,在含有还原剂的缓冲液中,将铜离子还原生成铜纳米簇;通过荧光分光光度计检测铜纳米簇的荧光性能,考察不同环境下铜纳米簇的合成效果。学生在纳米材料合成和荧光分析实验中,不仅可以掌握荧光光谱仪的结构和测量原理及其测试的基本操作流程,而且锻炼了学生设计实验方案、分析和处理数据的能力,能够培养学生创新能力、批判性思维,激发学生学习兴趣。
2 实验部分
2.1 实验目的
1) 掌握以DNA为模板介导荧光铜纳米簇合成的原理和方法,加深对功能纳米材料制备及其性质的认识。
2) 掌握荧光光谱仪的结构和测量原理及其测试的基本操作流程。
3) 提升化学化工相关专业本科生方案设计、开展实验和数据处理能力。
2.2 实验原理
2.2.1 荧光及荧光纳米材料
荧光是物质吸收光照或其他电磁辐射后发出的光。当光照射到荧光物质时,光的能量使原子核周围的一些电子由原来的轨道跃迁到能量更高的轨道,即从基态跃迁到激发态。当电子由激发态恢复到基态时,能量会以光的形式释放,产生荧光。
而纳米微粒因其具有小尺寸效应、表面与界面效应、量子尺寸效应、宏观量子隧道效应和介电限域效应的基本特征,导致纳米材料在熔点、蒸气压、光学性质、化学活性、磁性、超导及塑性形变等方面,显示出特殊的物理和化学性能,为荧光纳米材料的设计与开发提供了理论基础。如,二硫化钼量子点、金纳米簇、铜纳米簇、石墨相氮化碳及其纳米复合材料等荧光纳米材料[7]。
荧光分光光度法是根据物质的荧光谱线位置及其强度进行物质鉴定和含量测定的方法。由于不同的物质其组成与结构不同,所吸收光的波长也不同,将未知物的激发光谱和荧光光谱图的形状、位置与标准物质的光谱图进行比较,即可对其进行定性分析。
2.2.2 DNA介导的荧光铜纳米簇
DNA作为模板分子在功能纳米材料的制备中,展现出了明显优势。2013年,卿志和等发现聚胸腺嘧啶寡核苷酸(poly(T))能够特异性介导荧光铜纳米簇的合成[8,9]。如图1所示,室温下,在含有还原剂抗坏血酸钠的MOPS缓冲液(pH在7.5-8.5之间为较佳范围)中,poly(T)上的T碱基N3与铜离子的选择性配位结合,在还原剂作用下生成铜原子,再以种子生长方式高效稳定地合成荧光铜纳米簇,并且该纳米材料具有优良的荧光性质,在340 nm左右具有最大的吸收,而在625 nm左右具有最大发射。此外,据文献报道,荧光铜纳米簇的荧光量子产率与其尺寸成正相关[10]。
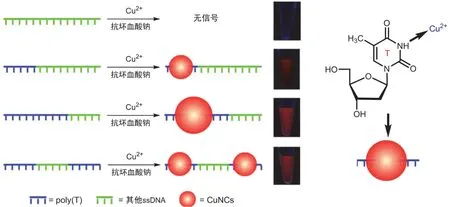
图1 DNA介导的荧光铜纳米簇合成的原理
2.3 试剂或材料
本实验使用的所有试剂或材料的纯度及制造商信息见表1及表2。

表1 实验使用的试剂或材料
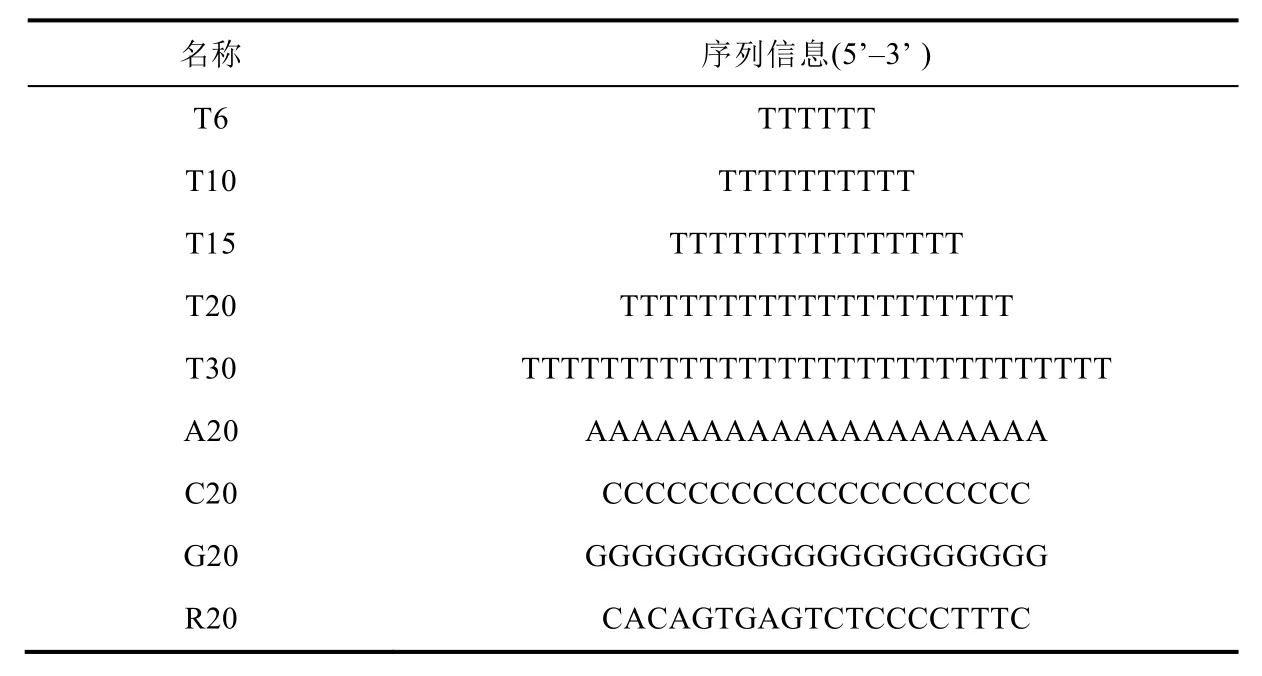
表2 实验所使用的DNA序列信息
所有DNA序列放在-20 °C的冰箱中保存。
2.4 仪器和表征方法
本实验使用的所有仪器的型号及制造商信息见表3。

表3 实验使用的仪器
表征方法:荧光分光光度法、透射电子显微镜成像法。
2.5 实验步骤/方法
2.5.1 溶液的配制
DNA储存液:将装有DNA序列的离心管从冰箱中取出,静置约30 s待试管外冰层融化后,放入离心机中,在4000 r·min-1的转速下,离心2 min。离心结束后,缓慢取出并放在离心管架上,按照制造商在离心管壁上的标签提示,依次加入适量的超纯水,将DNA溶解至10 μmol·L-1。
100 mmol·L-1抗坏血酸钠溶液:使用电子分析天平称取198.1 mg抗坏血酸钠,放入试剂管中,加入10 mL超纯水溶解。
10 mmol·L-1CuSO4溶液:使用电子分析天平称取250.0 mg五水合硫酸铜,放入试剂管中,加入10 mL超纯水溶解。从中取1 mL溶液,加入9 mL超纯水稀释,备用。
MOPS缓冲液:使用电子分析天平分别称取209.0 mg MOPS和876.6 mg氯化钠,放入试剂管中,加入100 mL超纯水溶解,并用饱和NaOH溶液将其pH调至7.6。
以上溶液若非现配现用,须放在4 °C的冰箱中保存。
2.5.2 荧光分光光度计设置
根据实验原理和文献[8,9],本实验在使用荧光分光光度计时,激发波长设定为340 nm,扫描范围设定为500-660 nm,扫描速度为1200 nm·min-1,激发狭缝和发射狭缝分别设置为5 nm和10 nm,响应时间设置为2 s。
2.5.3 DNA介导的荧光铜纳米簇合成与筛选
取五支离心管置于离心管架上,做好标记(T20、A20、C20、G20、R20),向其各加入83 μL MOPS缓冲液后,分别加入5 μL 10 μmol·L-120个碱基长度的不同的DNA (T20、A20、C20、G20、R20)。随后在上述溶液中分别加入2 μL 100 mmol·L-1的抗坏血酸钠溶液作为还原剂,混合均匀。继续加入10 μL 10 mmol·L-1的CuSO4溶液,充分混匀,反应5 min。在室温下,使用荧光分光光度计测量荧光铜纳米簇的荧光光谱,并确定荧光发射峰值。再用荧光时间扫描法,考察加入铜离子前1 min和后5 min,荧光铜纳米簇合成的动力学情况。
2.5.4 Poly(T)浓度对荧光铜纳米簇合成的影响
取五支离心管置于离心管架上,做好标记(0、0.05、0.10、0.30、0.50 μmol·L-1),向其分别加入88、87.5、87、85、83 μL的MOPS缓冲液后,分别加入0、0.5、1、3、5 μL 10 μmol·L-1的T30储存液。随后在上述溶液中分别加入2 μL 100 mmol·L-1的抗坏血酸钠溶液作为还原剂,混合均匀。继续加入10 μL 10 mmol·L-1的CuSO4溶液,充分混匀,反应5 min。在室温下,使用荧光分光光度计测量荧光铜纳米簇的荧光光谱。
2.5.5 铜离子浓度对荧光铜纳米簇合成的影响
取四支离心管置于离心管架上,做好标记(0、50、100、150 μmol·L-1),向其分别加入93、88、83、78 μL的MOPS缓冲液后,分别加入5 μL 10 μmol·L-1的T30储存液。随后在上述溶液中分别加入2 μL 100 mmol·L-1的抗坏血酸钠溶液作为还原剂,混合均匀。分别加入0、5、10、15 μL 10 mmol·L-1的CuSO4溶液,充分混匀,反应5 min。在室温下,使用荧光分光光度计测量荧光铜纳米簇的荧光光谱。
2.5.6 Poly (T)长度对荧光铜纳米簇合成的影响
取五支离心管置于离心管架上,做好标记(T6、T10、T15、T20、T30),向其各加入83 μL MOPS缓冲液后,分别加入5 μL 10 μmol·L-1不同长度的Poly(T) (T6、T10、T15、T20、T30)。随后在上述溶液中分别加入2 μL 100 mmol·L-1的抗坏血酸钠溶液作为还原剂,混合均匀。继续加入10 μL 10 mmol·L-1的CuSO4溶液,充分混匀,反应5 min。在室温下,使用荧光分光光度计测量荧光铜纳米簇的荧光光谱。
2.5.7 电镜表征纳米结构
将8 μL不同长度的poly(T)介导合成的荧光铜纳米簇溶液分别滴在做好标记的碳支持膜上,室温干燥后,采用透射电子显微镜考察Poly(T)介导合成的铜纳米簇的纳米结构。
3 结果与讨论
3.1 荧光铜纳米簇合成与筛选
本实验以五种20个碱基长度的DNA序列为原料去筛选能够作为模板稳定合成荧光铜纳米簇的DNA序列。通过图2可观察到,在相同的反应条件下,只有存在T20的时候,反应产物在625 nm处呈现明显的荧光发射峰,这说明T碱基上N3与铜离子的选择性配位结合,在还原剂作用下生成铜原子,再以种子生长方式高效稳定地合成荧光铜纳米簇。而A20、C20、G20、R20存在时反应产物并没有出现荧光发射峰,则表明其不具备高效稳定地合成荧光铜纳米簇的能力。

图2 不同DNA序列在加入铜离子反应5 min后的荧光光谱图
接着,通过时间扫描考察荧光信号变化,考察荧光铜纳米簇合成的动力学情况。通过图3可观察到,在未加入铜离子时,溶液的背景信号很低,在加入铜离子之后,T20上稳定合成的荧光铜纳米簇能被迅速检测到,并且很快趋于平稳,这说明该荧光铜纳米簇合成速度快且现象明显。
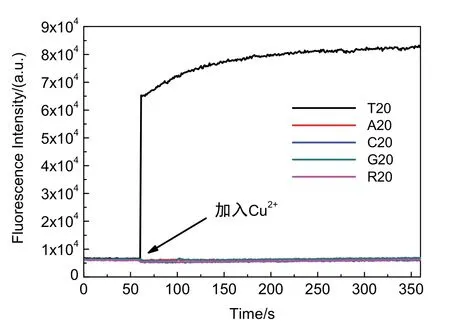
图3 不同DNA在加入铜离子前后的荧光强度变化的时间扫描图
3.2 Poly(T)浓度对荧光铜纳米簇合成的影响
在poly(T)被筛选为作为荧光铜纳米簇合成的有效模板后,我们进一步考察了poly(T)浓度对荧光铜纳米簇合成的影响。通过图4可观察到,poly(T)的浓度在0-500 nmol·L-1之间时,随着poly(T)的浓度的上升,合成的荧光铜纳米簇荧光强度增加,这表明随着poly(T)浓度的增大,荧光铜纳米簇的粒径增大,量子产率升高。

图4 Poly(T)浓度对荧光铜纳米簇合成的影响
3.3 铜离子浓度对荧光铜纳米簇合成的影响
为了进一步探究poly(T)稳定的荧光铜纳米簇的合成影响因素,我们考察了铜离子浓度对荧光铜纳米簇合成的影响。通过图5可观察到,在poly(T)浓度相同,铜离子的浓度在0-150 μmol·L-1之间时,随着铜离子浓度的增大,合成的荧光铜纳米簇荧光强度增加,表明合成的荧光铜纳米簇粒径增大,量子产率升高。
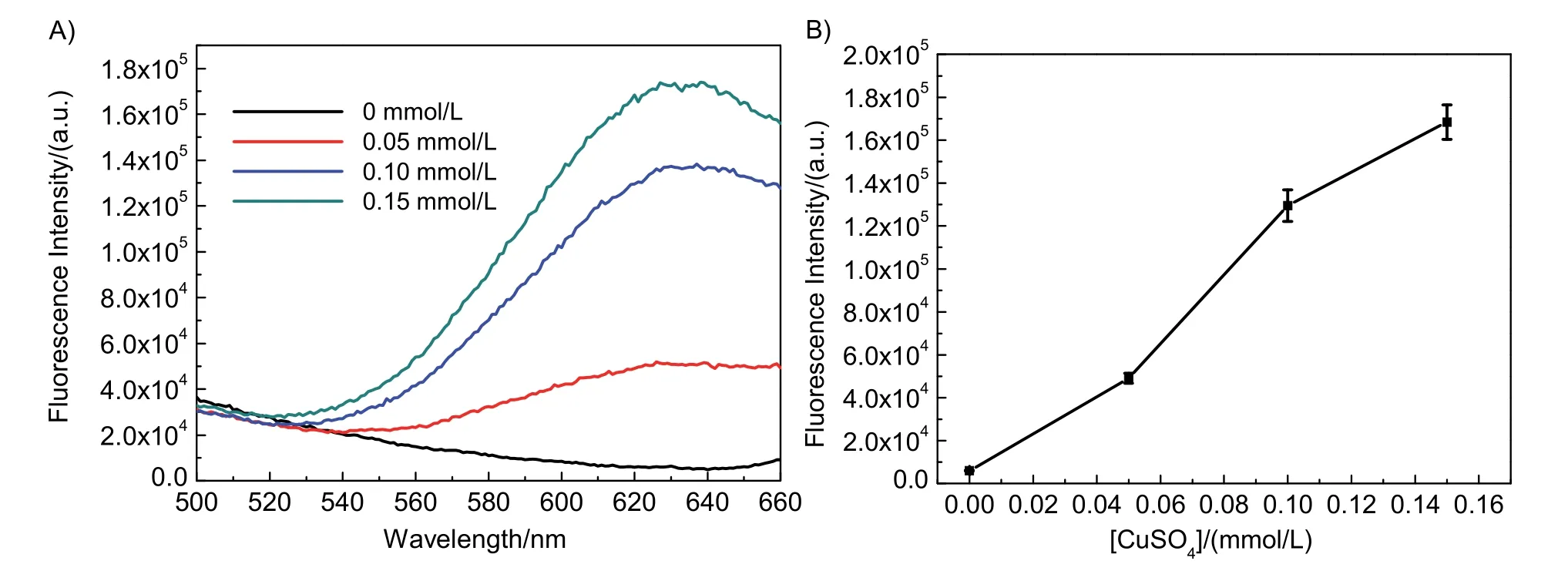
图5 铜离子浓度对荧光铜纳米簇合成的影响
3.4 Poly(T)长度对荧光铜纳米簇合成的影响
通过设计不同poly(T)长度的DNA序列,进一步考察poly(T)长度对荧光铜纳米簇合成的影响。图6可观察到,随着模板poly(T)的延长,合成的荧光铜纳米簇荧光强度增加,这表明荧光铜纳米簇的粒径增大,量子产率升高。并且DNA中连续T碱基数少于15时,荧光发射峰并未出现,表明在实验条件下荧光铜纳米簇的合成效率显著下降或不能稳定合成。
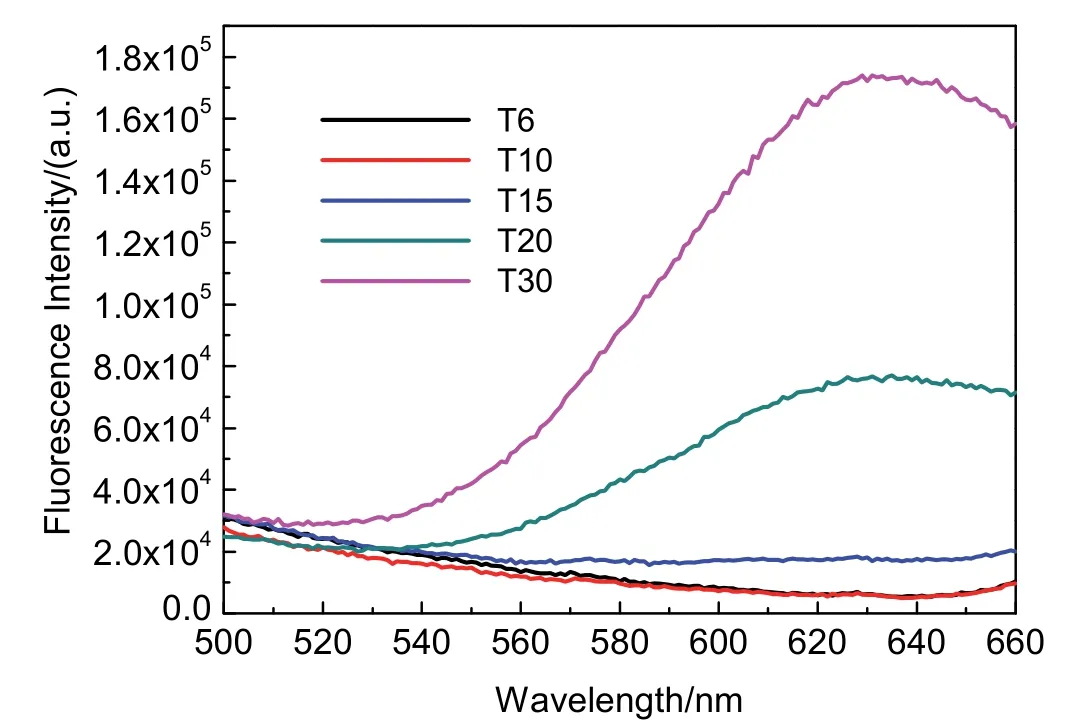
图6 不同长度poly(T)合成铜纳米簇的荧光光谱图
3.5 电镜表征纳米结构
采用透射电子显微镜对poly(T)介导合成的铜纳米簇进行了结构表征。如图7所示,poly(T)稳定合成的铜纳米簇具有明显的纳米颗粒结构。随着poly(T)长度的增加,其稳定合成的铜纳米簇的尺寸也变大。T20介导合成的铜纳米簇尺寸约为2 nm,T40介导合成的铜纳米簇尺寸约为5 nm。电镜成像实验验证了poly(T)介导合成的荧光铜纳米簇是一种尺寸在数纳米的材料,且不同长度的poly(T)会介导合成不同尺寸的荧光铜纳米簇。

图7 T20 (A)、T40 (B)介导合成的荧光铜纳米簇的透射电镜图
4 实验教学特点
本实验结合多学科前沿科学研究,综合多种基础理论和实验技术,全面培养学生的综合科研能力,同时培养学生的科研兴趣。具有如下特点:
(1) DNA介导荧光铜纳米簇的合成属于常温反应,所用试剂环境友好,安全性高,耗材价廉易得。铜纳米簇合成快速,且反应时长对纳米簇的荧光性质影响不大。整个实验现象明显且重现性好,符合本科生实验教学要求。
(2) DNA介导荧光铜纳米簇的合成受到多种因素影响,如DNA种类、反应物(包括DNA,铜离子)浓度、Poly(T)长度等。因此,实验方案设计灵活,可探索不同实验条件下荧光铜纳米簇的合成效果,分析影响规律,提升学生独立思考能力。
(3) 本实验涉及简单的光谱数据处理,通过完整的实验数据分析,可提高学生数据处理能力。此外,实验涉及移液枪、荧光分光光度计等仪器的使用,有利于拓展本科生的视野,培养学生的科研兴趣。本实验所合成的铜纳米簇还可进一步应用于化学测量学的前沿领域,对此感兴趣的本科生可加入导师团队参与科研项目研究。
5 思考题
(1) 荧光纳米材料具有哪些应用领域?
(2) DNA介导合成的荧光铜纳米簇具有哪些不一样的优点?
(3) 考察铜离子浓度对荧光铜纳米簇合成的影响时,进一步加大铜离子浓度会出现什么现象?
6 教学运行方式与教学方法
(1) 实验学时安排和教学运行方式。
该实验从属于大三学生的“综合化学实验”课程,关联课程目标包括:了解纳米材料的制备方法和技术,学习材料性能的测试;培养学生分析实验数据、处理数据的基本能力;拓展学生的知识面,增强民族自豪感和自信心;将多学科知识融会贯通,深入学习,培养国家建设需要的专业型、创新型人才。该实验项目在化学化工学院应用化学专业大三学生的综合化学实验课程中,作为选修项目,经过前期试行,取得良好效果。学生加深了对功能纳米材料制备及材料性能测试的认识;掌握了荧光光谱仪的结构和测量原理及其测试的基本操作流程;提升了设计方案、开展实验和数据处理能力。实验总时长约为3.5小时(教学讲解约0.5小时,实验教师可统一提供实验所需溶液,荧光铜纳米簇合成与筛选约1.5小时,poly(T)浓度、铜离子浓度、poly(T)长度对荧光铜纳米簇的影响各约0.5小时)。建议2-3人一组进行实验。一次实验课的学生人数为12-15人。
(2) 线上线下混合式教学方法。
提前录制课程指导性短视频,包括DNA试剂的取用、荧光分光光度计的操作流程等,上传至网络教学平台,供学生线上预习,以直观地了解实验用到的试剂、仪器设备及操作方法等。教师在通知学生做好预习的同时可提出问题,如为什么需要用到缓冲溶液?引导学生思考并探索得出结论:核酸分子之间、核酸分子与其他物质之间的作用往往受到外界环境因素的影响,例如温度、pH、离子强度等。进一步引导学生查阅相关文献资料,以小组为单位设计实验方案,考察几种外界因素(温度、pH、离子强度等)对铜纳米簇荧光的影响。学生设计的实验方案可以预习报告的形式交教师查阅,经得教师同意后,学生在完成基本实验内容后,可对教师审阅后的实验方案进行实施。现场教学时,注意组内学生分工合作,注意采用启发式引导学生自主思考,培养创新意识。实验结束后,同组得出的数据可与其他组进行对比,求得测量结果(如荧光强度)的相对标准偏差并体现在数据处理上。通过一批次学生的实验结果,引导学生得出总的规律和实验结论,组织学生进行实验汇报。考虑到荧光铜纳米簇的尺寸很小(数纳米),同时电镜操作难度大,电镜的表征学生可以10人一组表征一种条件下的荧光铜纳米簇,整个实验下来的电镜数据合在一起供学生进行数据分析。有兴趣的学生可进一步参加导师的相关课题研究,并在课外开放实验中继续探索。
7 结语
本文设计了一个研究型综合化学实验。通过以DNA分子为模板合成荧光铜纳米簇及采用荧光分光光度计等对荧光铜纳米簇合成条件进行筛选,并综合分析实验数据得出结论。作为实验课程教学,本实验紧跟前沿科学研究,交叉融合生物化学、分析化学、纳米科学等多学科知识。完整的铜纳米簇合成及荧光光谱测试等不仅提升了学生使用基本光谱分析仪器的能力,同时也加深了学生对荧光、铜纳米簇相关原理的理解。此外,灵活的实验设计方案能进一步激发学生的研究兴趣,培养学生的科学精神、创新能力与批判性思维。更重要的是,本实验涉及的铜纳米簇合成快速,现象明显且重现性好;整个实验过程安全性高,对环境友好;所用耗材价廉易得,总时长约3.5小时,满足实验教学的各项要求,具有很好的实验教学推广价值。

