尿素电氧化反应
——推荐一个电化学综合实验
杨甫林,李家欣,冯立纲
扬州大学化学化工学院,江苏 扬州 225002
1 实验教学背景
电化学在日常生活中的应用无处不在,例如电镀、化学电源、电催化等。在本科化学教学中,电化学也是整个基础化学知识体系的重要组成部分,在无机化学(氧化还原反应)、分析化学(电分析)和物理化学(电化学热力学与动力学)中均有体现,甚至在高年级本科生教学和研究生教学中逐渐成为了一门独立的学科,如电催化、电极过程动力学、应用电化学等。正因为电化学所包含的内容十分丰富,而各二级学科课程所教授电化学知识的侧重点有所不同,学生较难构建全面、系统的电化学知识框架。综合实验课程的开设能够很好地弥补这一问题,然而目前电化学相关的基础性综合实验多以电分析为主,较少同时涉及电极过程以及化学动力学相关的物理化学内容,如传递系数、反应级数等[1,2]。因此有必要进一步设计电化学综合实验课程来整合各电化学相关知识点,帮助学生将电化学基础知识融会贯通,并引导学生将之加以应用。
对此,本文推荐一个基于尿素电氧化反应(urea oxidation reaction,UOR)的电化学综合实验,该实验同时涉及了分析化学中电分析、物理化学中化学动力学以及电解与极化作用等相关知识,内容丰富但整体操作较为简便,具有易普及、易重复的特点,适合作为基础性综合实验进行大规模开设。UOR是通过电极反应将尿素分子氧化的过程,产物一般为CO2、N2和H2O,可用于燃料电池、污水治理等领域[3-6]。近年来,采用富含尿素的废水作为电解质,通过尿素电解(CO(NH2)2+ H2O = CO2+ N2+3H2)的方法可在持续产氢的同时实现污水治理,因而受到了广泛的关注,是目前科研领域内的重点与热点之一[4]。此外,以UOR替代电解水制氢(2H2O = 2H2+ O2)过程中动力学缓慢的阳极氧析出反应(碱性电解质中的氧析出半反应方程式:4OH-= O2+ 2H2O + 4e-),可有效降低槽电压(图1),理论上可显著提高能源转换效率并降低制氢成本[5]。目前,Ni基材料被认为是碱性条件下催化UOR的最佳催化剂之一[6,7],因此将其作为本实验的模型电极,凸显了一定的科研前沿性。从实验教学的角度来看,本实验首先基于三电极测试体系探讨UOR这一异相电催化反应的电化学行为及相关物理化学参数,包括:(1) 利用循环伏安法等电分析方法判断Ni自身氧化反应的可逆性,并结合Randles-Sevcik公式计算电极的电化学活性表面积(electrochemical surface area,ECSA);(2) 通过循环伏安法分析UOR的动力学参数,如尿素分子的扩散系数、UOR的传递系数等;(3) 通过改变反应物浓度,分析UOR速率方程中各反应物种的(表观)反应级数。该部分内容有助于学生理解三电极体系的搭建与实验方法,强化利用循环伏安图判断反应过程可逆性的能力,熟练掌握Randles-Sevcik公式及其运用,并了解电极过程动力学的相关知识。此外,该实验还基于两电极测试体系构建尿素辅助电解制氢装置,采用恒电流法电解并收集阴极室产生的H2,计算法拉第效率。该部分内容有助于学生理解两电极测试体系相对于三电极测试体系的异同,熟悉恒电流法和法拉第效率相关知识,激发学生的动手能力和科研兴趣。

图1 Ni电极在N2饱和的1 mol·L-1 KOH溶液(黑色)以及1 mol·L-1 KOH + 0.33 mol·L-1 CO(NH2)2溶液(红色)中的循环伏安曲线
综上所述,将尿素电氧化反应引入本科综合实验课程中,能较好地结合基础知识学习与科学前沿探索,充分体现了“基础知识-理论研究-实际应用”的实验教学思维模式,考查学生对所学基础知识的掌握情况,并有助于提高学生将所学知识应用于科学研究的能力,培养学生从事科研的兴趣,具有较高的教学价值。
2 实验设计思路及安排
本实验以Ni作为模型电极研究尿素电氧化反应,包括采用循环伏安法分析该反应的动力学参数(理论分析)和构建两电极电解池实现尿素电解辅助制氢(实际应用)。本实验的总体设计思路及相关安排如下:(1) 根据实验主题进行文献调研,培养学生的文献检索、阅读及总结能力,引导学生设计相关实验来求算尿素分子的扩散系数、UOR的传递系数以及表观反应级数;进行实验安全教育,确定实验方案;(2) 采用循环伏安法判断Ni自身氧化还原过程的可逆性,计算ECSA,并进一步分析UOR的传递系数和尿素分子扩散系数,掌握电分析方法在电极过程动力学中的应用;(3) 改变反应物浓度,采用循环伏安法分析UOR的反应级数,掌握电分析方法在化学动力学中的应用;(4) 构建基于两电极体系的尿素辅助电解制氢装置,并与电解水装置的制氢效率进行比较分析。上述各模块均需6学时,学生可分为4人左右的小组进行本综合实验。
3 实验目的
(1) 了解镍电极催化尿素氧化反应的化学原理及相关应用;
(2) 掌握基于三电极体系的电化学方法基本原理、操作过程及结果分析方法;
(3) 熟练运用Randles-Sevcik公式计算ECSA以及扩散系数;
(4) 学习通过实验手段获得传递系数、扩散系数、表观反应级数等物理化学参数的方法;
(5) 掌握基于两电极体系的测试方法,构建尿素辅助电解制氢装置。
4 实验原理
1) 尿素电氧化反应:碱性电解质中的UOR半反应方程式为:
其标准还原电势为0.37 Vvs.RHE (可逆氢电极)。然而,由于该反应包含6电子转移,反应动力学缓慢且反应历程复杂,故一般需要施加较大的阳极超电势(> 1 V)来驱动反应持续发生。
合适的催化剂可以有效降低超电势,减小额外的能耗。对于碱性条件下的UOR,Ni基材料通常具有优异的催化性能。一般认为,催化表面的+3价Ni物种(如NiOOH)是反应的真实活性组分,即在电势升高的过程中,低价Ni (0价或+2价)首先氧化为+3价的NiOOH,随后NiOOH将尿素分子氧化为CO2、N2和H2O,自身则还原为Ni(OH)2[8],符合偶联化学反应中的EC’过程(化学反应平行于电极反应)。具体如下:
因此,对比Ni电极在空白溶液和含尿素溶液中的循环伏安曲线,应观测到UOR循环伏安曲线的起始电势与Ni3+/Ni2+的氧化还原峰密切相关(图1)。
2) 循环伏安法:循环伏安法是最基础的电化学研究方法之一,通过控制电极电势以三角波的形式在相应电势区间范围内以特定扫速进行一次或多次扫描,使电极表面交替发生氧化/还原反应,来记录电流-电势关系曲线(即循环伏安曲线)[9,10]。利用循环伏安曲线可以判断电极过程的可逆性及反应机理等。
NiII在碱性电解质中发生的自身氧化还原反应属于(准)可逆反应,可通过伏安图来判断:一般认为当峰电势(Ep)与半波电势(Ep/2)之差大于57 mV/n(n为电子转移数)时,则可认为该反应为不可逆波电极反应。对于可逆反应,其峰电流ip与电势扫速v之间满足Randles-Sevcik公式[10],即
式中A为该电极的ECSA,c为OH-离子的浓度,D为OH-离子的扩散系数。据此可求得电极的ECSA。
在尿素电氧化体系中,尿素分子的氧化过程为扩散控制的不可逆过程,其正向扫描的氧化峰电势Epa随扫速v的增大而正移,相应的峰电流ipa则满足如下关系式[10]:
其中n为尿素氧化反应的电子转移数(n= 6),n0为决速步的电子转移数(一般n0= 1),α为传递系数,c为溶液中尿素的浓度,D为尿素分子的扩散系数。α值可由下式得出[10,11]:
式中K为常数。
可通过测量不同扫速下尿素氧化的Epa,将其对logv作图并进行线性拟合,根据斜率可求算出α。之后将α值带入式(5)中,将不同扫速下的ipa对v1/2作图并进行线性拟合,根据斜率可求算出D。
3) 反应级数:反应级数是指反应速率方程中各浓度项的指数的代数和(此处应注意区别复杂反应的反应级数和基元反应的反应分子数的概念),其在探讨反应机理的研究中具有重要意义[12]。对于复杂的非基元反应如尿素氧化,其速率方程可简单写为:
式中r为反应速率,k为反应速率常数,a、b分别为尿素分子和氢氧根离子的级数。通过控制变量法,固定溶液的pH而改变尿素分子浓度,将反应速率(电化学中通常以电流密度j表示)的对数对CO(NH2)2浓度的对数作图(logjvs.log[CO(NH2)2]),线性拟合后其斜率即为a;同理,固定溶液中尿素分子浓度而改变氢氧根离子浓度,将电流密度j的对数对KOH浓度的对数作图(logjvs.log [OH-]),线性拟合后其斜率即为b。
4) 尿素辅助电解制氢:三电极体系通常用于对单一半反应进行理论分析,从而规避对电极半反应的影响,而实际应用则多采用两电极体系进行[13]。本实验最后需基于两电极体系构建尿素辅助电解制氢装置模拟实际应用,阴极采用析氢超电势较低的Pt电极,阳极采用Ni电极。当电解质为不含尿素的碱性水溶液时,阳极发生氧析出反应(oxygen evolution reaction,OER),整体反应即为电解水产氢;当电解质中含有一定浓度的尿素时,阳极在过电势较低的情况下即可发生UOR,整体反应为尿素(辅助)电解产氢。可在恒电流测试下,采用排水法收集各条件下阴极氢析出反应(hydrogen evolution reaction,HER)产生的H2体积V,计算相应的法拉第效率(nV/(22.4 ×Fit) × 100%,其中n为单位H2分子产生所需的电子数,F为法拉第常数,i为恒电流,t为时间)。
5)iRu补偿:在电化学测试过程中,实际测量的电势通常包含可逆电势、不可逆电势(电极极化效应)以及iRu,其中最后一项iRu是由于电池内溶液、导线及其接触界面的电阻所引起的电压降,一般可用Luggin毛细管尽可能减小。当电流i较小时,该电压降对测量电势的影响较小,而当i较大时,须准确测出Ru进行电压降补偿(E=Emeasure-iRu)[14,15]。一般可采用电化学阻抗谱获得Ru值。
5 实验仪器及试剂
1) 试剂:氢氧化钾(分析纯,Aladdin试剂有限公司)、尿素(分析纯,国药集团化学试剂有限公司)、超纯水(18.25 MΩ)、盐酸(国药集团化学试剂有限公司)、镍箔(或镍泡沫,上海河森电气有限公司)、氩气或氮气(气瓶或气体发生器)。
2) 仪器:电化学工作站1台(Gamry Interface 5000E,美国Gamry Instruments Inc.)、常规电解池1个、H型电解池1个、工作电极夹2个、参比电极(Hg/HgO) 1个(天津艾达恒晟科技发展有限公司)、对电极(碳棒和Pt片) 1个(天津艾达恒晟科技发展有限公司)、100 mL容量瓶5个、100 mL烧杯3个、电子天平1台(BSA224S,赛多利斯科学仪器有限公司)、0.1 mL移液管1支、恒温水浴槽1台。
6 实验步骤
1) 电解质溶液配制。
称取5.6 g KOH,加入少量超纯水完全溶解后,转移至100 mL容量瓶中定容,配制成1.0 mol·L-1KOH溶液。
称取5.6 g KOH和2.0 g CO(NH2)2,加入少量超纯水完全溶解后,转移至100 mL容量瓶中定容,配制成1.0 mol·L-1KOH + 0.33 mol·L-1CO(NH2)2溶液。
固定CO(NH2)2质量为2.0 g不变,改变KOH质量分别为0.56 g、2.8 g以及11.2 g,加入少量超纯水完全溶解后,转移至100 mL容量瓶中定容,配制成xmol·L-1KOH + 0.33 mol·L-1CO(NH2)2溶液(x=0.1、0.5或2.0)。
固定KOH质量为5.6 g不变,改变CO(NH2)2质量分别为0.30、0.60以及4.0 g,加入少量超纯水完全溶解后,转移至100 mL容量瓶中定容,配制成1.0 mol·L-1KOH +ymol·L-1CO(NH2)2溶液(y= 0.05、0.1或0.66)。
2) 工作电极前处理。
裁剪出L型镍箔(或镍泡沫)作为工作电极,其下部面积为0.5 cm × 0.5 cm,上端与电极夹连接处的长度约为0.5 cm,宽度不超过0.2 cm。为除去其表面氧化层,量取浓盐酸0.1 mL于烧杯中,用超纯水稀释100倍,将Ni电极浸入30 s左右后取出,用超纯水清洗3遍以上,吹干备用。
3) 搭建三电极电解池测试装置(如图2所示)。
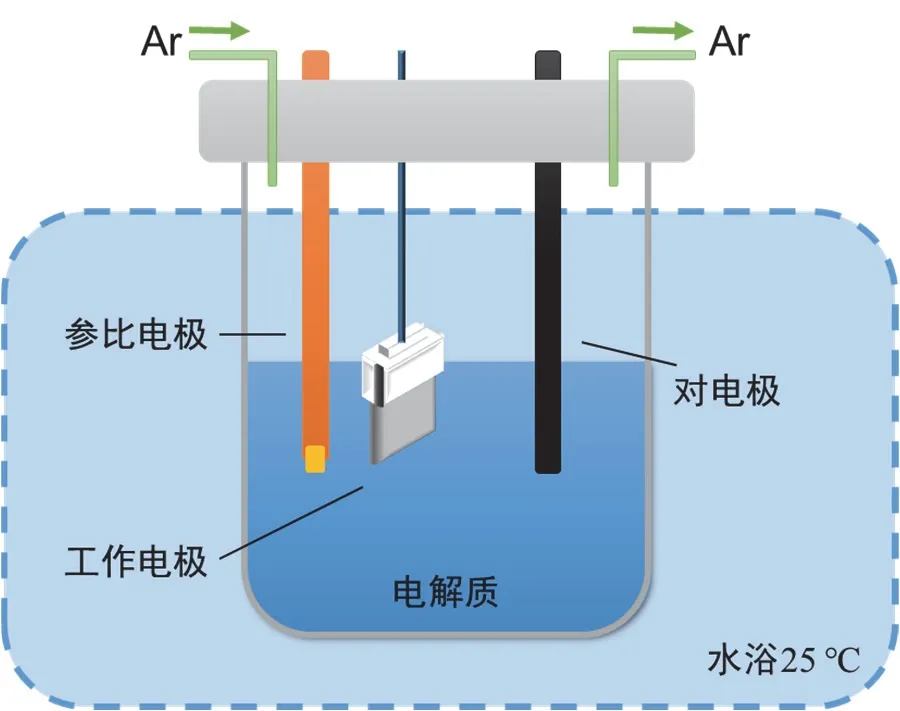
图2 三电极测试体系示意图
取适量电解质于电解池中,以Hg/HgO电极作为参比电极,以碳棒(或Pt片)电极作为对电极,取出干净的镍箔(或镍泡沫)夹于工作电极夹上作为工作电极(L型镍电极的突出部分夹于电极夹中,露出面积为0.5 cm × 0.5 cm),并连接上电化学工作站。为了规避温度对于电化学测量的影响,后续电化学测试过程均将电解池置于25 °C恒温水浴槽中进行。
4) 工作电极活化。
以1.0 mol·L-1KOH溶液作为电解质,通入氮气或氩气作为保护气(约20 min至饱和,后续实验中均进行惰性气体保护操作),在0-0.8 Vvs.Hg/HgO的电势区间内作循环伏安扫描,扫速为500 mV·s-1,直至获得稳定的循环伏安曲线,此时电极表面重构完成,表面结构不再发生变化(即Ni电极表面形成Ni(OH)2层)。
5) 循环伏安测试。
以1.0 mol·L-1KOH溶液作为电解质,在0-0.6 Vvs.Hg/HgO的电势区间内作不同扫速下(500、200、100、50、20、10 mV·s-1)的循环伏安测试,记录各循环伏安曲线。然后将电解质替换为1.0 mol·L-1KOH + 0.33 mol·L-1CO(NH2)2溶液,再次重复上述操作,记录各循环伏安曲线。
6)iRu补偿。
在上述步骤中记录伏安曲线后更换电解质之前,采用电化学阻抗谱获得未补偿电阻Ru,可通过等效电路拟合获得,也可粗略以1000 Hz所对应的阻值作为Ru进行iRu补偿(对于部分其他型号的电化学工作站,可在进行循环伏安测试时直接通过仪器进行iRu补偿,则该步骤可省略)。
7) 反应级数测定。
固定扫速为10 mV·s-1,改变电解质为xmol·L-1KOH + 0.33 mol·L-1CO(NH2)2溶液(x= 0.1、0.5或2.0),分别记录循环伏安曲线;改变电解质为1.0 mol·L-1KOH +ymol·L-1CO(NH2)2溶液(y= 0.05、0.1或0.5),分别记录循环伏安曲线。
上述实验所涉及的电化学工作站参数设置如表1所示。

表1 三电极测试系统中循环伏安法参数设置
8) 尿素辅助电解制氢。
搭建两电极H型电解池测试装置(图3),以Pt电极作为阴极,同时连接对电极和参比电极的电极夹,以Ni电极作为阳极(1 cm × 1 cm),连接工作电极电极夹,分别以1.0 mol·L-1KOH溶液以及1.0 mol·L-1KOH + 0.33 mol·L-1CO(NH2)2溶液作为电解质,在0-1.6 V电势区间内进行高扫速(500 mV·s-1)循环伏安测试直至获得稳定的极化曲线,然后在1-1.6 V电势区间内进行低扫速(5 mV·s-1)线性伏安测试。当使用Ni泡沫等多孔电极时,需进一步降低扫速(如1 mV·s-1)以减轻非法拉第过程的干扰。

图3 两电极尿素辅助电解制氢装置及排水法示意图
将电解池密封,设置电流为50 mA (根据电极面积大小可适当改变)进行恒电流测试1 h,从阴极室引出气路,通过排水法测量H2产生的体积V,据此可求出该过程的法拉第效率。
7 实验结果与讨论
1) 将实验中所获得的各循环伏安曲线中的电势栏数据均进行iRu补偿(E=Emeasure-iRu),用于后续数据处理。
2) 根据不同扫速下Ni电极在1 mol·L-1KOH溶液中的循环伏安曲线,获得其氧化/还原峰电势(Epa和Epc)、半波电势(Epa/2和Epc/2)以及峰电流(ipa和ipc)数值,列入表2中。由于各扫速v下的峰电势与半波电势之差均远小于57 mV (Ni(OH)2到NiOOH的氧化还原过程仅包含一个电子),且ipa和ipc较为对称,因此可认为该反应为可逆反应。将ipa和ipc分别对logv作图并进行线性拟合(如图4所示)获得斜率,查表获得OH-离子的扩散系数(5.273 × 10-5cm2·s-1),随后可根据Randles-Sevcik公式求出电极的有效ECSA为0.33 cm2。

表2 1 mol·L-1 KOH溶液中Ni电极的循环伏安测试数据表
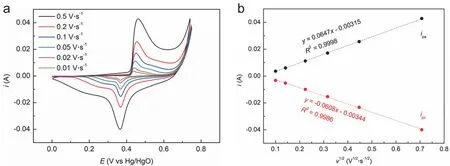
图4 不同扫速下Ni电极在N2饱和的1 mol·L-1 KOH溶液中的循环伏安曲线(a)以及峰电流与扫速平方根的线性关系图(b)
3) 根据不同扫速下Ni电极在1 mol·L-1KOH溶液中的循环伏安曲线(图5a),获得其正向扫描的氧化峰电势Epa、以及峰电流ipa,并将峰电流用ECSA归一化,获得峰电流密度jpa。将Epa对logv作图并进行线性拟合(如图5b所示),根据斜率可求算出传递系数α约为0.79。将jpa对v1/2作图并进行线性拟合(如图5c所示),根据斜率可求算出扩散系数D约为1.3 × 10-5cm2·s-1。详见实验原理。

图5 不同扫速下Ni电极在N2饱和1 mol·L-1 KOH + 0.33 mol·L-1 CO(NH2)2溶液中的循环伏安曲线(a)以及不同扫速下UOR循环伏安曲线(正向扫描)的峰电势(b)和峰电流(c)与扫速的关系
4) 将实验步骤(7)中获得的循环伏安曲线叠加进行比较,以logj对log[CO(NH2)2]作图(图6a),线性拟合获得直线的斜率即为速率方程中尿素分子的反应级数a,约为0.34;同理,以logj对log[OH-]作图(图6b),经线性拟合后直线斜率即为速率方程中氢氧根离子的反应级数b约为1.98。详见实验原理。

图6 UOR峰电流密度(正向扫描)与CO(NH2)2浓度(a)以及KOH浓度(b)的关系
5) 查找文献,将实现测得的α、D、a、b等参数与文献值进行比较,并分析所存在的差异及其成因。
6) 实验步骤(8)中基于两电极测试体系获得尿素辅助电解制氢及水电解制氢的极化曲线,如图7所示,可观测到要达到相同的产氢电流时,前者所需施加的电压更低,表明尿素辅助可显著降低能耗。经1 h恒电流测试后,共收集氢气22 mL,计算其法拉第效率约为96%。

图7 基于Pt (阴极)、Ni (阳极)两电极体系的电解制氢极化曲线
8 课后思考
1) 如果将UOR伏安曲线负向扫描的氧化峰电流及峰电势进行类似处理与分析,会有什么结果?为什么?
2) 根据表观反应级数,是否可求出UOR的反应速率常数?
3) 在两电极尿素辅助电解制氢测试中,如果继续延长测试时间,会出现什么结果?
4) 影响法拉第效率的原因可能有哪些?
5) 试分析影响尿素辅助电解制氢和碱性水电解制氢的成本因素,估算并比较产生单位体积的H2所需要的成本。
9 教学建议
1) 采用Ni泡沫这类多孔电极作为工作电极时,要保证电极的几何面积较小,否则在高扫速下电流可能超出量程。
2) 若条件允许,学生或教师可对测试后的Ni样品进行X射线衍射或拉曼光谱分析,以确认经UOR过程后材料表面的物相,并分析该结果是否可靠。
3) 该实验也可与纳米催化材料(如Ni基纳米颗粒、Ni(OH)2纳米片等)的合成实验相结合,采用玻碳电极涂布相应的纳米催化剂后进行电化学测试与分析。
10 结语
本文介绍了一个针对高年级本科生的综合化学实验:首先基于三电极测试系统,采用循环伏安法分析了Ni电极自身的氧化还原行为,判断其为可逆过程,并根据Randles-Sevcik公式求出电极的有效ECSA为0.33 cm2;然后在尿素体系中采用循环伏安法计算尿素分子的扩散系数为1.3 × 10-5cm2·s-1,传递系数α约为0.79;通过改变反应物浓度,分析出尿素电氧化反应速率方程中尿素分子和氢氧根离子的反应级数分别为0.34和1.98;最后基于两电极测试系统,构建了尿素辅助电解制氢装置模拟实际应用,采用恒电流法电解并收集阴极室产生的H2,计算其法拉第效率为96%。该实验紧密结合了目前的电催化研究前沿和本科基础知识,包括分析化学中的电分析部分、物理化学中的化学动力学以及电解与极化作用等相关知识,具有较强的综合性,在巩固学生的电化学基础知识的同时,能够充分引导学生运用这些基础知识解决科研问题,培养学生的动手实践能力,激发学生的科研热情。

