龙葵提取物对大肠杆菌、粪肠球菌及其生物膜形成的抑制作用
郭航帆, 王萍,2, 王颖
(1.东北林业大学林学院,哈尔滨 150040; 2.东北林业大学森林食品资源利用重点实验室,哈尔滨 150040;3.黑龙江省农垦科学院科研处,哈尔滨 150038)
龙葵(Solanum nigrumL.)别名黑天天、苦葵等,为茄科(Solanaceae)茄属(Solanum)1 年生草本植物,始载于《唐本草》,应用历史悠久,历代本草均有记载[1]。龙葵提取物中含有丰富的活性物质如甾醇、生物碱、皂苷、黄酮[2]、萜类、蒽醌[3]等,具有较好的生物活性。我国常见的龙葵有黑果龙葵、红果龙葵和黄果龙葵,据报道,黑果龙葵(Solanum nigrumLinnaeus)提取物具有保肝[4]、缓解胃溃疡[5]等作用,可以对MCF-7 乳腺癌细胞产生毒性[6]、抑制枯草芽孢杆菌生长[7]、抑制小鼠急性耳水肿炎症[8];红果龙葵[Solanum villosumMiller.或Solanum alatumMoench(东欧)][9]提取物具有保肝作用[10];黄果龙葵(Solanum diphyllumLinnaeus)提取物具有降糖、抗氧化等作用[11]。
生物膜是相互连接或附着在基质表面的微生物细胞群落[12],可避免宿主免疫系统产生免疫并阻碍抗生素进入致病菌细胞[13],可使其耐药性增加10~1 000倍[14]。细菌自聚集性、泳动性、疏水性与生物膜形成密切相关。生物膜的形成始于细胞的自聚集,细胞从浮游状态通过单细胞泳动、多细胞群集运动转变为表面附着状态形成细胞团,经细菌表面疏水性非特异性地黏附到各种基质表面,形成生物膜[15-16]。大量研究证明,植物提取物具有抑制细菌生长繁殖和生物膜形成的特性,主要是由于植物提取物含有萜类、皂苷、生物碱等生物活性成分[17]。
响应面分析法是通过回归方程确定最优工艺参数的统计方法,可评价因素之间的相互作用,具有试验周期短、回归方程精度高等优点[18]。植物源抑菌剂常用提取方法有溶剂萃取法、超声辅助提取法、微波辅助提取法、超临界CO2萃取法等,其中超声辅助提取法、微波辅助提取法和超临界CO2萃取法需要特殊设备[19],故本研究选择操作简单、条件易控制的溶剂萃取法提取龙葵提取物,对比3 种龙葵果及其茎叶提取物对常见致病菌大肠杆菌、粪肠球菌的抑制作用,确定具有最佳抑菌效果的部位并采用响应面分析法优化其提取工艺,研究该提取物对大肠杆菌、粪肠球菌生物膜形成的影响,为合理利用野生植物资源、缓解抗生素研发压力带来新的启示。
1 材料与方法
1.1 试验材料
龙葵采自黑龙江省哈尔滨市郊区田间;供试菌 种 大 肠 杆 菌(Escherichia coli)、粪 肠 球 菌(Enterococcus faecalis)由东北林业大学微生物实验室提供;牛肉膏、蛋白胨和琼脂粉购自北京奥博星生物技术有限公司;乙醇、盐酸、氢氧化钠、氯化钠等化学试剂均为分析纯,购自天津市天力化学试剂有限公司。
SW-CJ-2D 双人无菌操作台,上海尚道仪器制造有限公司;PC722s 分光光度计,上海佑科仪器仪表有限公司;303-00A 电热恒温培养箱,天津天泰仪器有限公司;YXQ-LS-18SI 手提式压力蒸汽灭菌锅,上海博迅医疗生物仪器股份有限公司;FD-1A-80 冷冻干燥机,上海比朗仪器有限公司;RE-2000A 旋转蒸发器、SHZ-DIII 循环水式多用真空泵,巩义市予华仪器有限公司。
1.2 龙葵不同部位提取物制备
黑果龙葵、黄果龙葵和红果龙葵的茎叶于阴凉处晾干,粉碎,过60目筛;选取成熟新鲜的黑果龙葵、黄果龙葵和红果龙葵果,清洗、沥干水分,储存于-20 ℃备用。用40%乙醇以液料比(mL·g-1)10∶1 将龙葵茎叶细粉及捣碎的龙葵果在20 ℃下浸提6 h,真空抽滤,滤液在60 ℃下真空浓缩至15 mL,冷冻干燥,所制备的黑果龙葵果提取物(SNF)、黑果龙葵茎叶提取物(SNS)、黄果龙葵果提取物(SDF)、黄果龙葵茎叶提取物(SDS)、红果龙葵果提取物(SVF)、红果龙葵茎叶提取物(SVS)储存在-20 ℃备用。
1.3 龙葵提取物抑菌试验
1.3.1 抑菌效果评价 参考张弘弛等[20]的方法并进行改进。无菌条件下用生理盐水配制0.5 麦氏菌悬液。在96 孔板中依次加入100 μL 液体培养基、10 μL 菌悬液、50 μL 200 mg·mL-1提取物或50 μL 20 μg·mL-1环丙沙星,以不加提取物为空白对照,37 ℃恒温培养箱中培养12 h。在600 nm 波长下测定吸光值,按公式(1)计算抑菌率(Y)。
式中,X1为空白组在600 nm 波长下的吸光值;X2为试验组在600 nm波长下的吸光值。
1.3.2 最小抑菌浓度测定 参考Moura等[21]的方法并改进。将龙葵提取物配制为12.5~200.0 mg·mL-1溶液,在96 孔板中依次加入100 μL 液体培养基、10 μL 菌悬液、50 μL 提取物,37 ℃培养12 h,600 nm 波长下测定吸光值。生长未能发生的最小浓度作为龙葵提取物的最小抑菌质量浓度(minimal inhibitory concentration,MIC)。
1.4 龙葵提取物活性成分定性
通过标准方法对不同龙葵不同部位提取物活性成分进行定性分析,以确定提取物中是否存在单宁、皂苷、蒽醌、甾醇、黄酮、萜类、生物碱[22]。①单宁,提取物中加入几滴1%的FeCl3,产生深绿色为阳性。②皂苷,向提取物中加入5 mL 蒸馏水剧烈振摇,产生泡沫持续10 min 则为阳性。③蒽醌,提取物中加入5 mL 氯仿,摇匀过滤,滤液加等量10% 氨水,氨化层出现红色则为阳性。④甾醇,取2 mL 提取物溶液,加入2 mL 浓硫酸,产生红色沉淀表示试验呈阳性。⑤黄酮,少量提取物溶于2 mL 甲醇,加入少量镁屑,再加入少量浓盐酸,产生红色为阳性。⑥萜类,少量提取物加入2 mL 氯仿和3mL 浓硫酸,产生1 层棕红色界面则为阳性。⑦生物碱,取3 mL 提取物加入5 mL 1%的盐酸,加热搅拌过滤,等分成2 份,分别加入少 量Wanger’s 试 剂(碘- 碘 化 钾 试 剂)和Dragendorff’s 试剂(碘化铋钾试剂),分别产生红棕色沉淀和橙色沉则为阳性。
1.5 龙葵果提取工艺优化
1.5.1 单因素试验 以黑果龙葵鲜果为原料,以乙醇含量40%、液料比(mL·g-1)10∶1、提取温度20 ℃、提取时间1 h 为固定水平,按照1.3 的试验方法考察乙醇含量(30%、35%、40%、45%、50%、55%)、液料比(3∶1、4∶1、5∶1、6∶1、7∶1)、提取温度(20、30、40、50、60 ℃)对龙葵提取物抑菌能力的影响。
1.5.2 响应面优化试验 在单因素试验基础上,通过Box-Behnken 设计,以抑菌率为响应值,对提取影响因素进行优化,自变量因素水平及编码如表1所示。
表1 因素水平编码Table 1 Factors and levels in the experimental design
1.6 大肠杆菌、粪肠球菌生物膜形成能力测定
参照李程程[23]的24 孔板法通过结晶紫对生物膜染色以研究黑果龙葵果提取物对大肠杆菌、粪肠球菌生物膜形成的影响。在含不同水平提取物(12、30 mg·mL-1)的液体培养基中接种1% 的0.5 麦氏菌悬液,以不加提取物为空白对照,37 ℃培养,无菌水除去游离细胞。用0.3%结晶紫溶液染色10 min,无菌水除去多余染料,静置晾干后用1 mL 95%乙醇溶解结晶紫。将溶剂转移至干净的96孔板中,595 nm处测定吸光值。
1.7 影响大肠杆菌、粪肠球菌生物膜形成因素
1.7.1 细菌泳动性的测定 参考Magnini 等[24]方法并进行改进。配制0.3%半固体培养基,在培养基中加入不同含量(12.5、25.0 mg·mL-1)的龙葵提取物,以不加提取物为对照,接种2 μL 0.5 麦氏菌悬液于平板中心,37 ℃培养12 h,测量细菌运动区域。
1.7.2 细菌表面疏水性的测定 参考Salaheen等[25]方法并进行改进。配制不同水平(12.5、25.0、50.0、100.0 mg·mL-1)的龙葵提取物液体培养基,加入100 μL 0.5 麦氏菌悬液,以不加提取物为对照,37 ℃培养12 h。将菌悬液5 000 r·min-1离心15 min,用0.01 mol·L-1PBS(pH 7.2)冲洗沉淀,加入1 mL十六烷分离两相,测量下层水相600 nm吸光值,按公式(2)计算细菌细胞表面疏水性(H)。
1.7.3 细菌自聚集性的测定 参考Salaheen等[25]方法并进行改进。配制不同水平(12.5、25.0 mg·mL-1)的龙葵提取物液体培养基,加入100 μL 0.5 麦氏菌悬液,以不加提取物为对照,37 ℃培养12 h。将培养物5 000 r·min-1离心15 min,用0.01 mol·L-1PBS(pH 7.2)重悬沉淀,600 nm 波长下测定吸光值,记为ODt0。将菌悬液在37 ℃培养2 h,测定吸光值,记为ODt2,按公式(3)计算细菌自聚集性(A)。
1.8 数据分析
试验数据采用平均值±SD 表示,采用SPSS 26.0 进行显著性分析,以P<0.05 为统计学差异显著。通过Design Expert 10 进行响应面设计及分析。采用Origin2021完成绘图及相关性分析。
2 结果与分析
2.1 3种龙葵不同部位提取物抑菌能力比较分析
龙葵不同部位提取物对大肠杆菌、粪肠球菌生长的影响如图1 所示,200 mg·mL-1龙葵果及茎叶提取物对大肠杆菌、粪肠球菌生长均有抑制能力,但均著性(P<0.05)低于抗生素环丙沙星。其中,SNF对大肠杆菌、粪肠球菌生长的抑制能力最强,抑制率分别为72.97%±1.73%、87.25%±0.16%;其次为SDF、SVF。与果实提取物相比,茎叶提取物抑菌能力较弱,其中SNS对大肠杆菌、粪肠球菌生长的抑菌率最高,抑菌率分别为55.49%±1.32%、55.61%±2.27%。故选择黑果龙葵果进行提取条件优化。
2.2 龙葵提取物活性成分定性分析
由表2 可知,6 种龙葵提取物中均含有单宁、皂苷、甾醇、黄酮、萜类、生物碱,不含蒽醌。其中,龙葵果提取物中皂苷、萜类含量比茎叶提取物含量高,与其抑菌效果相呼应。

表2 龙葵提取物活性成分Table 2 Phytochemical screening of Solanum nigrumL. extract
2.3 黑果龙葵果提取物单因素试验结果分析
从图2 可知,随着乙醇含量的增加,黑果龙葵果提取物抑菌率先增大后减小,当乙醇含量为45%时,抑菌率最高,对大肠杆菌和粪肠球菌的抑制率分别为76.01%±0.70%、83.50%±3.92%,具有较强的抑菌能力。当液料比(mL·g-1)为5∶1 时,抑菌率最大,对大肠杆菌、粪肠球菌的抑制率分别为74.47%±1.00%、78.29%±1.47%,且与其他液料比差异显著。在30 ℃下浸提,抑菌率最高,对大肠肝菌、粪肠球菌的抑制率分别为71.98%±3.49%、84.85%±0.64%,当提取温度高于30 ℃后,随着温度升高抑菌率降低。综上,选择乙醇含量40%~50%,提取温度20~40 ℃,液料比(mL·g-1)4∶1~6∶1进行响应面试验。

图2 单因素试验结果Fig. 2 Results of single factor experiments
2.4 响应面试验结果分析
2.4.1 回归模型与方差分析 利用Design-Expert 10 软件对提取温度、乙醇含量、液料比进行响应面试验设计,试验设计与结果见表3。

表3 Box-Behnken设计方案及结果Table 3 Programs and experiment results of the Box-Behnken design
通过对表3 试验数据进行拟合,可得到大肠杆菌(Y1)、粪肠球菌(Y2)分别以抑制率为响应值的模拟方程。
大肠杆菌、粪肠球菌抑菌率回归模型与方差分析如表4、表5 所示。由表4 可知,大肠杆菌抑菌率二次回归模型P<0.000 1,表明该模型达到极显著水平;失拟项P>0.05,表明该模型未产生失拟现象;模型相关系数R2=0.975 9,说明拟合度较好,校正决定系数R2adj=0.944 9,表明94.49%的响应值变化可用该模型来解释,并且R2和R2adj均接近1,说明模型准确性和通用性较高,可用该模型来分析和预测各因素对大肠杆菌抑菌率的影响。方差分析表明,乙醇含量对黑果龙葵提取物抑菌具有极显著影响(P<0.01),液料比对黑果龙葵提取物抑菌具有显著影响(P<0.05),提取温度对提取物的抑菌作用无显著差异。

表4 大肠杆菌抑制率回归模型与方差分析Table 4 ANOVA of the regression equation model of Escherichia coli inhibition rate

表5 粪肠球菌抑菌率回归模型与方差分析Table 5 ANOVA of the regression equation model of Enterococcus faecalis inhibition rate
由表5 可知,粪肠球菌抑菌率二次回归模型P<0.000 1,表明该模型达到极显著水平;失拟项P>0.05,表明该模型未产生失拟现象;模型相关系数R2=0.996 1,说明拟合度较好,校正决定系数=0.991 1,表明99.11%的响应值变化可用该模型来解释,并且R2和R2adj均接近1,说明模型准确性和通用性较高,可用该模型来分析和预测提取因素对粪肠球菌抑菌率的影响。方差分析表明,乙醇含量、液料比对龙葵提取物抑制粪肠球菌活性具有极显著(P<0.01)影响。比较F值可知,乙醇含量对龙葵提取物抑菌影响最大,其次为液料比、提取温度。
2.4.2 响应面分析 各因素交互作用对大肠杆菌、粪肠球菌抑菌率影响如图3、图4所示。通过响应面坡度陡峭程度(图3)可知,乙醇含量对黑果龙葵抑制大肠杆菌生长影响最大,其次为液料比、提取温度;当提取温度为28.08 ℃、乙醇含量为44.46%、液料比(mL·g-1)为5.13∶1.00时,黑果龙葵果提取物对大肠杆菌抑制率达到理论最高,为79.66%。

图3 各因素交互作用下大肠杆菌的抑菌率Fig. 3 Inhibition rate of Escherichia coliunderinteraction of various factors
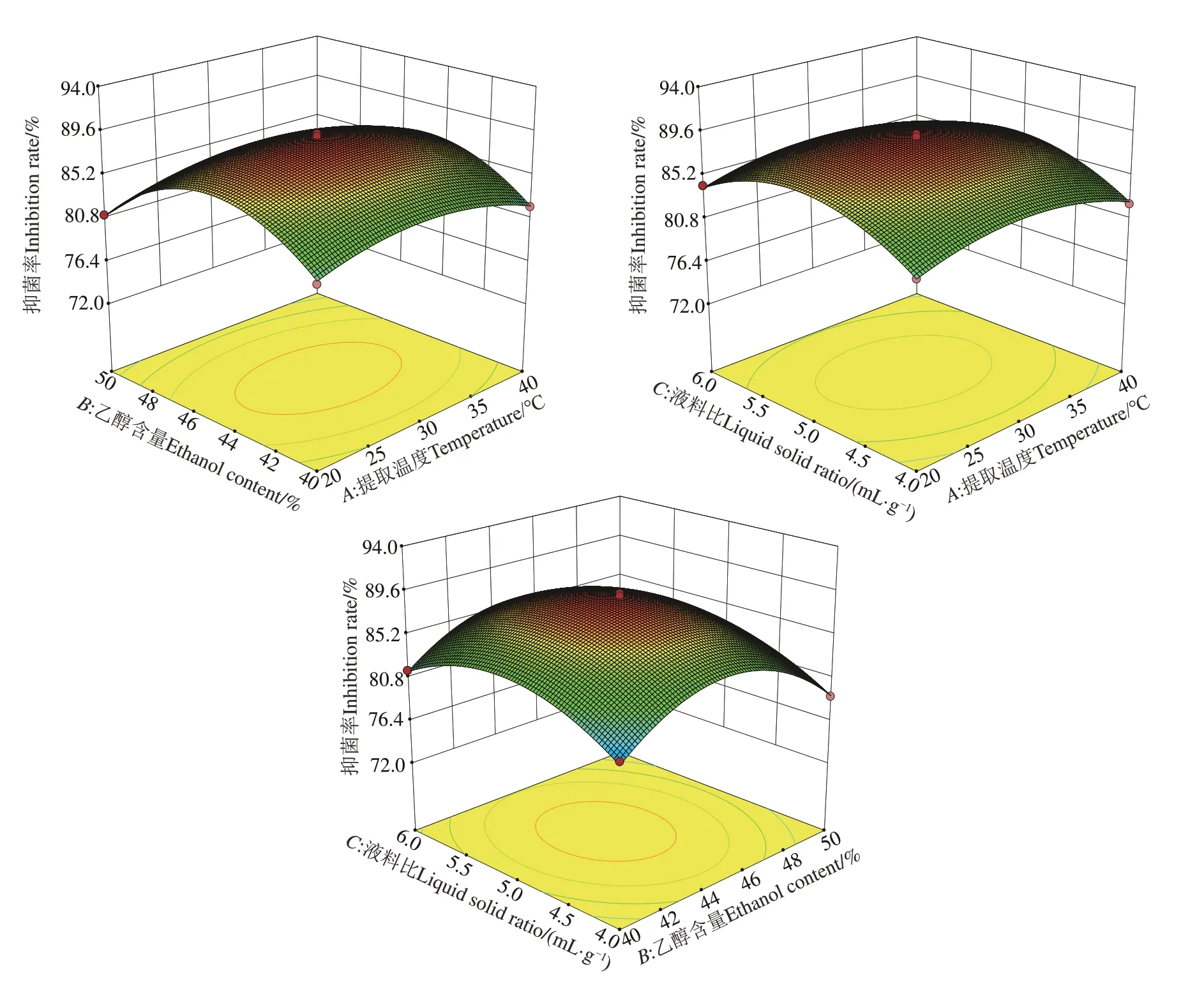
图4 各因素交互作用下粪肠球菌的抑菌率Fig. 4 Inhibition rate of Enterococcus faecalis underinteraction of various factors
由图4 可知,乙醇含量对黑果龙葵抑制粪肠球菌生长影响最大,其次为液料比、提取温度;当提取温度为29.55 ℃,乙醇含量为44.65%,液料比(mL·g-1)为5.07∶1.00 时,黑果龙葵果提取物对粪肠球菌抑制率达到理论最高,为89.00%。
2.5 最佳工艺条件验证
为验证最佳提取工艺,结合实际操作可行性,分别在提取温度为28 ℃、乙醇含量为44.5%、液料比(mL·g-1)为5.1∶1.0 以及提取温度为29.5 ℃,乙醇含量为44.7%,液料比(mL·g-1)为5.1∶1.0 条件下对大肠杆菌与粪肠球菌进行模型验证试验,此时龙葵提取物对2 种菌的生长抑制率分别为81.44%±1.78%、90.63%±2.33%,与理论值相近,说明该模型可靠,可有效预测黑果龙葵果提取物对大肠杆菌与粪肠球菌的生长抑制率。在此条件下,黑果龙葵果提取物对大肠杆菌、粪肠球菌最小抑菌质量浓度均为50 mg·mL-1。
2.6 黑果龙葵果提取物对大肠杆菌、粪肠球菌生物膜形成的影响
生物膜在培养基与空气交界处形成,保护细菌免受外部胁迫[26],不易被冲洗。从图5 可知,提取优化后的黑果龙葵提取物能够有效抑制大肠杆菌、粪肠球菌生物膜形成,培养时间相同时,OD值随提取物含量升高而降低,表明黑果龙葵果提取物剂量依赖性抑制了大肠杆菌、粪肠球菌生物膜的形成,培养48 h 后,30.0 mg·mL-1提取物对大肠杆菌、粪肠球菌生物膜形成抑制率分别可达83.52%、85.13%。30.0 mg·mL-1提取物培养大肠杆菌、粪肠球菌48 h后,对生物膜形成的抑制比培养6 h 仅提高10.42%、2.74%,可知随着培养时间增加,提取物抑制细菌生物膜形成能力减弱。
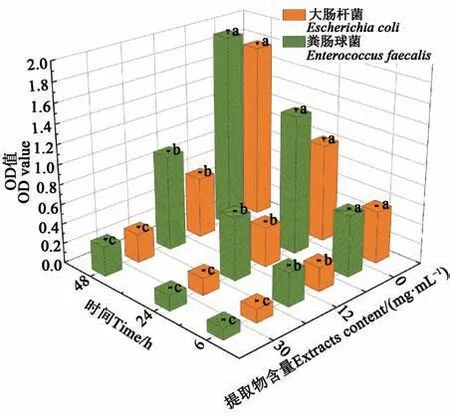
图5 黑果龙葵果提取物对细菌生物膜形成的影响Fig. 5 Effect of Solanum nigrum L. fruit extracts on bacterial biofilm formation
2.7 黑果龙葵果提取物对大肠杆菌、粪肠球菌表面疏水性的影响
细菌表面疏水性与生物膜形成密切相关,表面疏水性越低,黏附性越差,生物膜形成能力越弱[27]。由图6 可知,优化后的黑果龙葵果提取物对大肠杆菌、粪肠球菌表面疏水性均有影响,大肠杆菌、粪肠球菌表面疏水性随着提取物含量升高而降低,当提取物含量为100.0 mg·mL-1时,大肠杆菌、粪肠球菌表面疏水性分别为48.65%±0.75%、43.81%±1.07%。进一步表明龙葵果提取物可抑制生物膜形成。
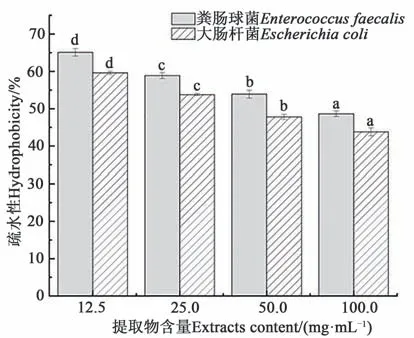
图6 黑果龙葵果提取物对细菌表面疏水性的影响Fig. 6 Effect of Solanum nigrum L. fruit extracts on hydrophobicity
2.8 黑果龙葵果提取物对大肠杆菌、粪肠球菌泳动性的影响
由图7 可知,黑果龙葵果提取物能够有效抑制细菌泳动,阻碍细菌迁移,并呈现剂量依赖性。加入25.0 mg·mL-1龙葵果提取物后,大肠杆菌、粪肠球菌菌落泳动直径分别为(8.37±0.12) mm、(10.06±0.15)mm,与 对 照 组 相 比 抑 制 率 可 达45.39%、46.28%,具有显著性差异(P<0.05)。
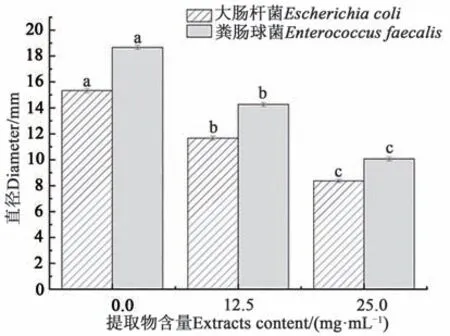
图7 黑果龙葵果提取物对细菌泳动性的影响Fig. 7 Effect of Solanum nigrum L. fruit extracts on swimming
2.9 黑果龙葵果提取物对大肠杆菌、粪肠球菌自聚集性的影响
细菌自聚集性被广泛用于评估其黏附能力和生物膜形成能力[28]。细菌自聚集性越强,定殖能力越强,黏附性、生物膜形成能力越强[29]。从图8 可知,大肠杆菌、粪肠球菌自聚集性均受到黑果龙葵果提取物的抑制,并随着提取物含量增大自聚集性降低。经25.0 mg·mL-1龙葵果提取物培养后,大肠杆菌、粪肠球菌自聚集性分别降低6.1%、8.4%。
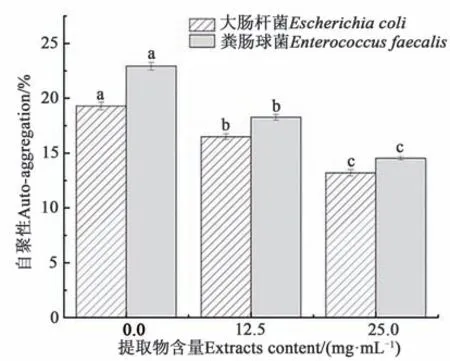
图8 黑果龙葵果提取物对细菌自聚集性的影响Fig. 8 Effect of Solanum nigrumL. fruit extracts on auto-aggregation
2.10 生物膜形成能力与影响因素相关性分析
大肠杆菌、粪肠球菌泳动性、表面疏水性、自聚集性与生物膜形成的相关性分析如图9、图10所示。细菌泳动性、疏水性、自聚集性均可影响生物膜形成,相关性越大对应在相关性分析图中椭圆越扁。从图9、图10可知,大肠杆菌生物膜形成能力与细菌疏水性呈显著正相关(P<0.05),粪肠球菌生物膜形成能力与细菌泳动性、自聚集性呈显著正相关(P<0.05)。并且对于泳动性、自聚集性而言,大肠杆菌、粪肠球菌均具有显著的相关性(P<0.05),可能由于菌毛运动被抑制,细菌运动性下降,从而影响菌落聚集,影响了生物膜的形成[30]。

图9 大肠杆菌生物膜形成能力与细菌理化性质相关性分析Fig. 9 Correlation analysis between biofilm formation ability and physicochemical properties of Escherichia coli
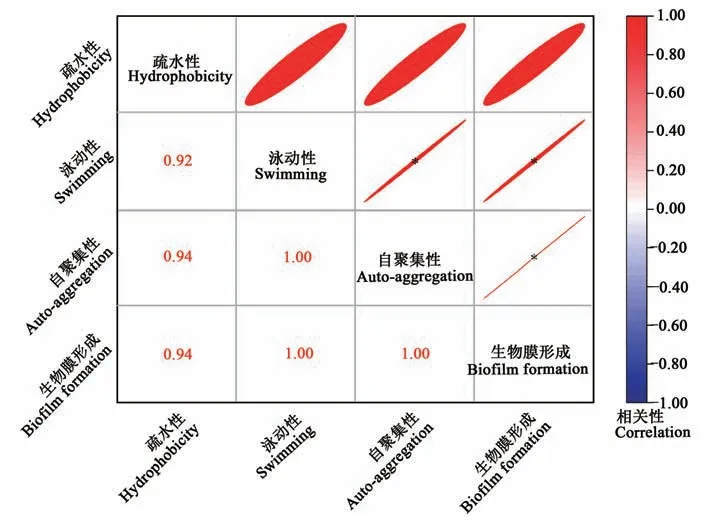
图10 粪肠球菌生物膜形成能力与细菌理化性质相关性分析Fig. 10 Correlation analysis between biofilm formation ability and physicochemical properties of Enterococcus faecalis
3 讨 论
本研究比较了黑果龙葵、黄果龙葵、红果龙葵果及其茎叶提取物的抑菌能力,发现3 种龙葵果及其茎叶提取物对大肠杆菌、粪肠球菌生长均有抑制能力,并且果实提取物抑菌效果优于茎叶提取物,可能与果实中含有较多的活性物质有关,果实为生殖器官,聚集着许多抑菌活性物质,而茎主要起输导作用,不利于大量活性物质储存[31]。对常见抑菌活性物质初筛发现,果实提取物中储存有较高含量的皂苷与萜类,但仍需进一步确定龙葵提取物中抑制大肠杆菌、粪肠球菌生长的主要活性物质。本研究中,黑果龙葵提取物对大肠杆菌、粪肠球菌的抑菌效果优于黄果龙葵、红果龙葵提取物,可能与其活性物质含量不同有关,可进一步对3种龙葵进行成分比较。
本研究发现,3 种龙葵的提取物对革兰氏阳性菌抑菌效果均优于对革兰氏阴性菌,与姜雪琪等[32]的研究结果相似,革兰氏阳性菌表现出对龙葵提取物更强的敏感性。从活性物质分析,龙葵提取物中萜类等抑菌活性物质较为丰富,而萜类物质已被报道对革兰氏阳性菌抑制作用较革兰氏阴性菌更强[33]。从细菌结构分析,革兰氏阴性菌细胞壁成分复杂,由肽聚糖和脂多糖外膜组成,很难被外部因素破坏[34],并且带有强负电荷的革兰氏阴性细菌的外膜可以控制某些物质的进出[35];革兰氏阳性细菌的细胞壁主要由肽聚糖和磷壁酸组成,可渗透可溶性糖、氨基酸和大多数离子[36],故革兰氏阴性菌对龙葵提取物不如革兰氏阳性菌敏感。后续可对龙葵提取物抑制大肠杆菌、粪肠球菌生长途径、机制进行深入研究。
细菌理化性质(自聚集性、泳动性、疏水性)与生物膜形成密切相关。本研究中,黑果龙葵果提取物降低了大肠杆菌、粪肠球菌表面疏水性、泳动性、自聚集性,致使一部分细菌无法从浮游的单细胞状态转变为附着状态的细胞团,减弱了细菌的黏附能力,影响了生物膜形成。但由于大肠杆菌、粪肠球菌表面结构不同,提取物对自聚集性、泳动性、疏水性的影响产生差异[37]。本研究中大肠杆菌生物膜形成能力与细菌疏水性显著正相关,可能是因为疏水性与细菌表面的蛋白和多糖有关,而革兰氏阴性菌较革兰氏阳性菌多了1 层由脂多糖、脂蛋白、膜孔蛋白等物质组成[38-39]的外膜,故革兰氏阴性菌表面疏水性更易受到影响。Song等[40]关于葡萄柚籽提取物对大肠杆菌、金黄色葡萄球菌表面疏水性的研究也证实了这一结论。而在泳动性方面,本研究发现,粪肠球菌生物膜形成能力与泳动性显著正相关,可能是因为粪肠球菌的泳动与其Ebp 菌毛有关,在生物膜早期形成中起重要作用[41-42]。在Liu 等[43]研究中,百里香精油就是通过抑制Ebp 菌毛基因ebpABC下调而抑制粪肠球菌泳动性,进而影响黏附,抑制了生物膜的形成。综上,黑果龙葵果提取物可通过改变细菌自身性质,影响细菌生物膜形成,结果为改善大肠杆菌、粪肠球菌耐药性研究奠定基础。

