不同纬度来源结缕草叶片响应低温胁迫的转录组分析
李双铭,杨 勇,胡龙兴,徐庆国*
(1.湖南工商大学,湖南 长沙 410205;2.长沙学院,湖南 长沙 410022;3.湖南农业大学,湖南 长沙 410128)
低温是影响植物生长发育及其地理分布的重要环境限制因素之一。结缕草(Zoysiajaponica)属于禾本科结缕草属多年生草坪草种,广泛分布在热带、亚热带和暖温带地区。作为暖季型草坪草其最适生长温度为26℃~35℃,对低温的适应能力相对较差,低于12℃时就会休眠,零下温度常造成冻害[1]。因此,低温是影响结缕草地理分布、草坪质量和推广应用的主要限制因素。
秋冬季气温的降低,常诱导植物一系列基因的表达,从而使植株对冷冻的抗性增强[2]。转录组测序技术是探索生物基因总体表达水平的强有力工具[3]。当前,高通量转录组测序技术已在生物响应胁迫机制研究中得到普及应用,一大批植物涉及防御、物质运输、信号转导及次生代谢的基因得到鉴定,对于揭示植物的抗逆机制起了很大的推动作用[4-5]。
结缕草喜温暖湿润气候,具有较强的耐热性,抗寒性较差,但不同地理来源的结缕草由于其遗传背景的不同而耐寒性差异较大,研究不同地理来源结缕草的低温胁迫生理,对扩大其栽培区域具有重要的理论意义和实践应用价值。前人大多只从冷害处理或冻害处理方面进行了低温胁迫下的生理响应研究,但多个连续低温处理的研究国内外报道较少,而自然界草坪草在秋冬季常处于一个逐渐从最适生长温度、亚适温、冷害和冻害逐渐降温的过程。本试验以采自我国不同纬度来源的结缕草为材料,采用转录组测序(RNA-Seq)技术,分析不同纬度来源结缕草种质响应冷害和冻害胁迫的基因表达特性,结合生物信息学分析,以期挖掘和分析与结缕草耐寒性相关基因,为深入解析结缕草耐寒分子机制以及选育耐寒结缕草品种提供参考。
1 材料与方法
1.1 供试材料与培养
本试验根据前期研究结果[6],选择两个不同纬度来源的结缕草基因型为材料,分别为结缕草ZG-36(来源于辽宁,纬度40°18′、经度123°34′)和ZG-32(来源于广东,纬度22°53′,经度112°16′)。
材料于2021年4月分别用草茎扩繁种植于湖南农业大学草业科学系试验基地。2021年7月,选取致密性好的草皮块并去除根部部分泥土,种植于装填了1.2 kg河沙和市售花土(1∶1,v/v)混合基质的塑料盆中。塑料盆的上口径为18 cm、下口径15 cm、高20 cm。每个种质材料种植12盆(3个处理×4次重复),放置于湖南农业大学草业科学系教学科研试验基地玻璃温室中培养。根据土壤基质水分状况及时补充水分以保持盆栽土壤湿润,每3 d修剪一次保持其冠层高度约为5 cm,每星期每盆浇1/2 Hongland营养液200 mL。
1.2 试验设计与处理
材料在温室中培养约45 d待其冠层基本建成后,将各盆栽材料转入人工气候箱中按图1所示进行梯度降温处理。(1)适温处理(OP):初始温度30℃/25℃(昼/夜)处理5 d。(2)冷害处理(CH):经适温处理的材料再在8℃/2℃(昼/夜)处理5 d。(3)冻害处理(FR):经适温和冷害处理的材料再转入温度设为2℃/-4℃的气候箱中处理5 d。人工气候箱相对湿度设为65%~75%,12 h光照时间和500 μmol·m-2·s-1的光照强度。各处理均设4次重复(4盆),在各梯度降温处理结束时,每盆取植株功能叶片混匀,用于各处理的转录组测定分析。
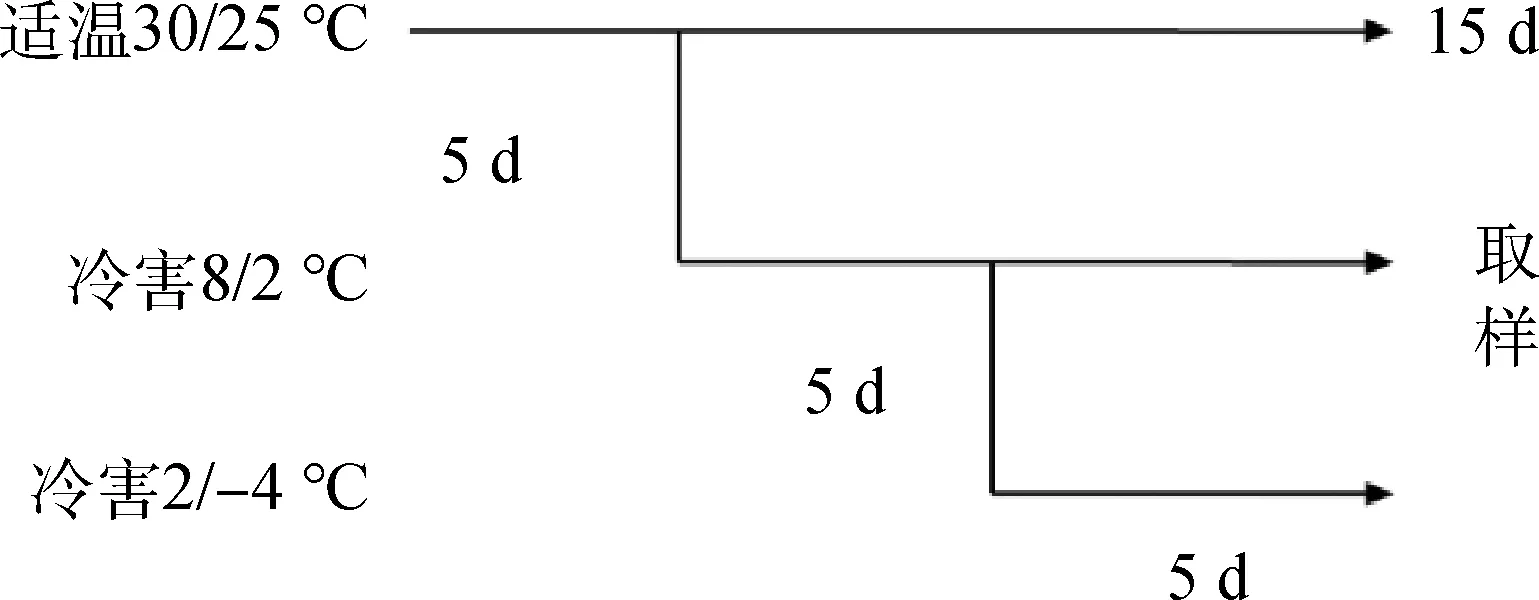
图1 温度处理及取样时间示意图Fig.1 The schematic diagram for the temperature treatments and sampling date
1.3 RNA提取和cDNA文库构建
采用Trizol法提取结缕草总RNA,经DNae I去除DNA后,取2 μL的RNA样品用NanodropTMOne/One C测定样品的OD260/OD280比值,然后用1.0%的琼酯糖凝胶电泳检测RNA的完整性,最后用QubitTM试剂盒测定RNA的含量。取2 μg总RNA采用KCTMStranded mRNA Library Prep Kit for Illumina®试剂盒进行测序文库构建(Catalog NO.DR08402)。使用带有Oligo(dT)的磁珠富集细胞的成熟mRNA,然后将mRNA打断成短的片段,再利用逆转录酶反转录产生cDNA,最后利用Hiseq2500高通量测序仪进行测序,测序工作委托北京诺禾致源科技股份有限公司的高通量测序平台进行。
1.4 转录组测序及拼接组装
对测序所获得的原始数据,首先用Trimmomatic软件(version 0.36)进行接头过滤和去掉低质量的序列(Q值<20),获得高质量的有效读长(clean reads)并进行后续分析。
应用Trinity软件对有效数据(clean data)进行从头(de novo)拼接组装,再采用RSeQC软件去除转录本中的冗余序列,得到非冗余通用基因(universal gene,unigene)。
1.5 测序数据的分析与功能注释
采用BLAST软件,在NCBI的non-redundant(NR),UniProt/Swiss-Prot,Gene Ontology(GO),KEGG(Kyoto Encyclopedia of Genes and Gnomes)等数据库进行比对,并进行差异基因(Differentially expressed genes,DEGs)的功能注释、GO及KEGG分析。差异基因的筛选条件为P-value≤0.01,|log2Fold Changes |≥1。其中,Fold Changes代表不同处理之间基因表达量的比值。该值大于1时,则该基因认定为上调表达;反之,则为下调表达。
1.6 差异表达基因的qPCR验证
为确保试验结果的真实性与有效性,随机挑选10个基因对转录组测序结果予以验证,并利用Primer 5.0 软件设计扩增引物(表1),采用qPCR的方法,对其表达水平进行验证。依据Fermentas cDNA synthesis将RNA反转录合成cDNA。依照TaKara公司的SYBR System操作手册,使用ABI7500型PCR仪进行PCR扩增。其反应程序设定为95℃预变性30 s,95℃ 5 s,52℃~55℃ 20 s,40个循环,每个处理设置3次重复。将所得CT值,使用2-△△CT法依次计算出不同处理下目标基因的相对表达量。
2 结果与分析
2.1 转录组测序质量评价及denovo组装分析
对两个不同纬度来源结缕草种质在低温胁迫下的叶片进行了转录组测序。如表2所示,在低纬度来源结缕草种质ZG-32中共获得160 721 526条原始读序和24.1Gb原始数据;在高纬度来源结缕草种质ZG-36中共获得180 156 874条原始读序和27.02 Gb原始数据,经去掉含有带接头和低量的序列后,在ZG-32中共获得147 849 938条有效读序和21.62 Gb有效数据,在ZG-36中共获得170 849 182条有效读序和25.09 Gb有效数据。所获得的序列中的GC含量为52%~55%,Q30(测序错误率小于0.1%)碱基百分比均为99%以上,测序获得的数据准确可靠。

表1 试验所用基因及其引物序列Table 1 Gene and primer sequence used in the experiment
用Trinity软件对有效读序进行denovo拼接组装,共获得298 364条转录本,最大长度为17 536 bp,平均长度为864.7 bp,N50长度为1 414 bp,对Trinity拼装得到的转录本去除冗余,共获得196 343条单一基因,平均长度为666.4 bp,N50长度为1 004 bp,组装质量较好(表3)。
2.2 单一基因的功能注释
如表4所示,利用七大数据库进行了基因功能注释,共注释到了237 128个基因,在Uniprot,NR,Pfam,Rfam,eggNog,GO和KEGG数据库中分别注释到了188 911,187 679,193 999,35 400,171 745,136 990和48 576个基因,分别占注释基因总量的79.6%,79.1%,81.8%,14.9%,72.4%,57.8%和20.5%。

表2 测序质量评价Table 2 Evaluation of the sequencing results

表3 组装结果分析Table 3 Analysis of assembly

表4 单基因序列注释统计表Table 4 Unigene function annotated
2.3 差异表达基因层次聚类分析
由图2可知,根据ZG-36与ZG-32两个结缕草种质在不同低温处理下基因的表达模式可分为3大组,每大组又可分为两小类。I大组中主要为在冻害条件下的ZG-36或ZG-32结缕草种质中的基因表达量高,而在常温对照和冷害条件下的ZG-36或ZG-32结缕草种质中的基因表达量低的一类;II大组中主要为在冷害条件下的ZG-36或ZG-32结缕草种质中的基因表达量高,而在常温对照和冻害条件下的ZG-36或ZG-32结缕草种质中的基因表达量低的一类;III大组中则主要为在常温对照条件下的ZG-36或ZG-32结缕草种质中的基因表达量高,而在冷害和冻害条件下的ZG-36或ZG-32结缕草种质中的基因表达量低的一类。

图2 结缕草种质低温胁迫处理的基因表达层次聚类图Fig.2 Hierarchical clustering of gene expression in Zoysia germplasms under low temperature stress注:红色表示高表达基因;蓝色表示低表达基因Note:The red indicates highly expressed genes;the blue low expressed genes
2.4 差异表达基因维恩图分析
通过维恩图对单个结缕草种质组内的3个比较组间的所有差异表达基因进行了集合展示。如图3所示,在高纬度来源种质ZG-36中,其3个比较组间共同差异表达的基因有343个,占其差异表达基因总数的5.7%,在各比较组内特异表达的基因数分别为669,596和384个,分别占其总数的11.1%,9.9%和6.4%(图3a);在低纬度来源的结缕草种质ZG-32中,其3个比较组间共同差异表达的基因为153个,占其差异表达基因总数的3.1%,在各比较组内特异表达的基因数分别为2 146,162和83个,分别占其总数的43.1%,3.3%和1.7%(图3b)。

图3 相同结缕草种质内不同温度处理下差异表达基因的维恩图Fig.3 The Venn map of differentially expressed genes within the same Zoysia Germplasm under different temperature treatments注:a为ZG-36,b为ZG-32Note:Panel a,ZG-36;Panel b,ZG-32
如图4所示,与常温对照相比,冷害温度下在ZG-32和ZG-36两个结缕草种质中共有4 997个差异表达基因,其中在ZG-32有3 690个差异表达基因;在ZG-36中有2 957个差异表达基因,在ZG-32和ZG-36间共同表达的差异基因有1 650个,其特异表达的差异基因分别为2 040和1 307个;冻害条件下在ZG-32和ZG-36中共有5 163个差异表达基因,其中ZG-32有2 394个,ZG-36有4 407个,在ZG-32和ZG-36间共同表达的差异基因有1 639个,其特异表达的差异基因分别为755和2 768个。

图4 相同温度处理下不同结缕草种质间差异表达基因的维恩图Fig.4 The Venn map of differentially expressed genes in different Zoysia under the same temperature treatment 注:a为冷害,b为冻害Note:Panel a,chilling;Panel b,freezing
2.5 差异表达基因GO功能分类及富集分析
由图5可知,在冷害低温下,来自低纬度的结缕草种质ZG-32叶片差异表达基因在生物学过程(Biological process,BP)、细胞组分(Celluar component,CC)与分子功能(Molecular function,MF)等3大分类中均有富集,但富集程度均不一样。在上调基因中,在BP分类下富集程度高的为色氨酸代谢过程、天门冬氨酸生物学合成与代谢过程、离子转运和膜脂代谢过程,而在CC分类下仅有质膜组分富集;在MF分类下富集程度高的主要有磷跨膜转运子活性、糖苷转移酶活性、乙酰转移酶活性和分子内裂解酶活性(图5a)。在下调基因中,在BP分类下富集程度高的为光合作用的光反应、花发育与生殖发育、蛋白自磷酸化和丝氨酸生物学合成等过程;在CC分类下富集的有类囊体、微体膜和过氧化物体膜;在MF分类下主要富集的有NADH脱氢酶活性、微管结合、磷脂结合和离子通道活性(图5b)。
由图6可知,在冻害胁迫下,ZG-32的叶片差异表达基因在BP,CC和MF等3大分类中均有富集。在上调基因中,在BP分类下富集程度高的为光合作用光反应、光与紫外线剌激、非生物逆境剌激和芳香氨基酸代谢;在CC分类下富集的有离子通道复合体、甲基化转移酶、质膜蛋白复合体、跨膜转运复合体;在MF分类下富集的种类最多,主要有Ubiquitin特异蛋白酶活性、电子载体活性、离子通道活性、跨膜转运活性等(图6a)。在下调基因中,在BP分类下富集程度高的有多细胞生物体稳态、蛋白修复、光系统II修复、光合作用聚光过程等;在CC分类下富集的组分有光系统II、DNA包装复合体、类囊体和光合膜;在MF分类下主要富集的有氨基糖苷乙酰基转移酶、酸性氨基酸连接酸、辅酶A水解酶和磷跨膜转运子活性(图6b)。

图6 冻害胁迫下结缕草种质ZG-32 FR Vs OP差异表达基因GO功能分类富集图Fig.6 The map of the classification and enrichment of the GO function of the differential expression genes in ZG-32 germplasm FR Vs OP under freezing stress
由图7可知,在冷害胁迫下,高纬度来源结缕草种质ZG-36的差异表达基因在BP,CC和MF等3大分类中均有富集,但富集的组分种类和程度均不一样。在上调基因中,在BP分类下富集程度高的为响应外界剌激、多糖代谢过程、离子稳态、脂转运与定位、光合作用、碳水化合物代谢等过程;在CC分类下富集的仅有叶绿体和细胞外围组分;在MF分类下富集的种类最多,富集程度也较高,主要有组蛋白甲基转移酶活性、赖氨酸甲基转移酶活性、磷跨膜转运子活性、离子通道活性和钙调素结合活性等分子功能(图7a)。在下调基因中,BP分类下富集的组分最多,富集程度较高的主要有昼夜节律、生物向性、分子功能的负调控、催化活性的负调控、硫氨酸生物学合成等过程;在CC分类下富集的组分较少,仅有过氧化物体和微体两个组分;在MF分类下主要富集的有嘌呤跨膜转运子活性、脂酶活性、蛋白二聚与结合活性等分子功能(图7b)。

图7 冷害胁迫下结缕草种质ZG-36CH Vs OP差异表达基因GO功能分类富集图Fig.7 The map of the classification and enrichment of the GO function of the differential expression genes in ZG-36 germplasm CH Vs OP under chilling stress
由图8可知,在冻害胁迫下,ZG-36的差异表达基因在BP,CC和MF 3大分类中均有富集。在上调表达基因中,在BP分类下主要富集与离子运输、硫复合物代谢、细胞呼吸、氨基酸代谢、蛋白代谢和有机酸代谢等过程相关的基因;在CC分类下富集程度高的仅有呼吸链复合体和线粒体呼吸链复合体两个组分;在MF分类下富集程度高的主要有细胞色素C氧化酶活性、电子载体活性、脂酶活性、离子结合活性等分子功能(图8a)。在下调基因中,BP分类下富集程度高的主要有无机离子转运、催化活性的负调控、含硫氨基酸生物学合成、阴离子运输、氧化还原酶代谢等过程;在CC分类下富集程度高的有微体、微体膜、细胞皮层等组分;在MF分类下富集程度高的主要有转移酶活性、脂酶活性、阴离子跨膜转运活性等分子功能(图8b)。
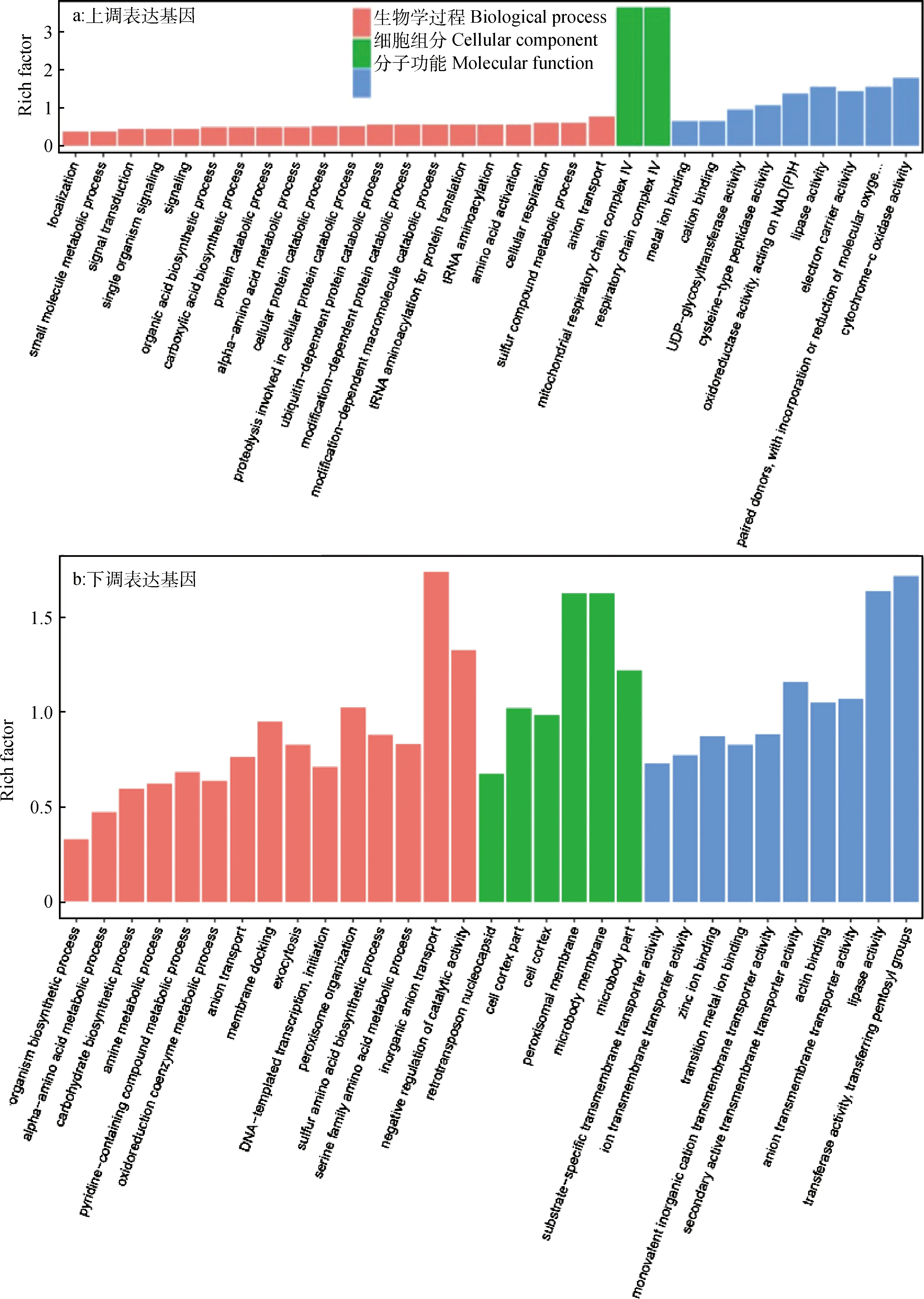
图8 冻害胁迫下结缕草种质ZG-36 FR Vs OP差异表达基因GO功能分类富集图Fig.8 The map of the classification and enrichment of the GO function of the differential expression genes in ZG-36 germplasm FR Vs OP under freezing stress
2.6 Unigene的KEGG代谢通路富集分析
对两个不同纬度来源结缕草种质ZG-32和ZG-36在冷害和冻害胁迫下差异表达的基因进行了KEGG代谢通路富集分析。由图9可知,在冷害胁迫下,ZG-32叶片上调表达差异基因显著富集的前20条代谢通路中,富集系数和成员最多的分别为植物激素信号转导、苯丙素生物合成和类黄酮生物合成等代谢通路;其次为玉米素生物合成、淀粉和蔗糖代谢、氨基酸生物合成等代谢路径(图9a)。在下调表达差异基因显著富集的前20条代谢通路中,富集成员和系数最多的为光合作用、碳固定与代谢、氧化磷酸化等代谢途径;其次为植物激素信号转导、苯丙素生物合成、氨基酸生物合成等代谢通路(图9b)。
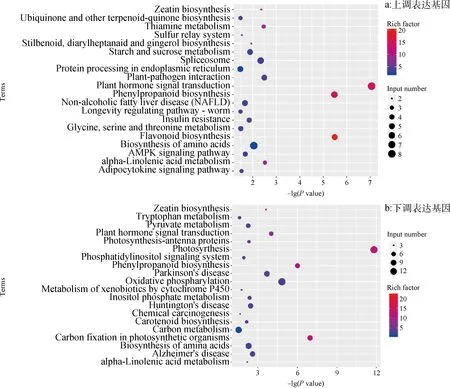
图9 冷害胁迫下结缕草种质ZG-32 CH Vs OP差异表达基因KEGG代谢通路富集分析Fig.9 Analysis of KEGG metabolic pathway enrichment of the differential expression genes in ZG-32 germplasm CH Vs OP under cold stress
由图10可知,在冻害胁迫下,ZG-32叶片上调表达差异基因显著富集的前20条代谢通路中,集中富集在氧化磷酸化、信号转导途径、细胞周期、核糖体和剪切体等代谢通路(图10a);在下调基因显著富集的前20条代谢通路中,富集成员和系数较多的为植物激素信号转导、苯丙素生物合成、淀粉与蔗糖合成、玉米素合成和类胡萝卜素合成等代谢通路,其次为丙酮酸代谢、光合作用、半乳糖代谢、脂肪酸代谢等代谢通路(图10b)。
由图11可知,在冷害胁迫下,ZG-36的叶片上调表达差异基因显著富集的前20条代谢通路中,富集系数和成员最多的为植物激素信号转导、苯丙素生物合成、类黄酮生物合成和光合作用等代谢通路,其次为淀粉和蔗糖代谢、胡萝卜素生物合成和脂类代谢等代谢通路(图11a);在下调表达差异基因显著富集的前20条代谢通路中,富集成员和系数最多的为光合作用、光合碳固定与代谢、苯丙素生物合成等代谢通路,其次为氨基酸生物合成、类黄酮生物合成、丙酮酸代谢、果糖和甘露糖代谢等代谢通路(图11b)。

图10 冻害胁迫下结缕草种质ZG-32 CH Vs OP差异表达基因KEGG代谢通路富集分析Fig.10 Analysis of KEGG metabolic pathway enrichment of the differential expression genes in ZG-32 germplasm FR Vs OP under freezing stress
由图12可知,在冻害胁迫下,ZG-36叶片上调表达差异基因显著富集的前20条代谢通路中,富集系数和成员最多的为AMPK信号途径通路,其次为cAMP信号途径、鞘脂代谢与信号途径、内质网蛋白加工、剪切体和胆碱代谢等代谢通路(图12a);在下调基因显著富集的前20条代谢通路中,富集成员和系数最多的为光合作用、光合碳固定与代谢、植物激素信号转导和苯丙素生物合成等代谢通路,其次为氨基酸生物合成、谷胱甘肽代谢、丙酮酸代谢、果糖与甘露糖代谢、苯丙氨酸代谢等代谢通路(图12b)。
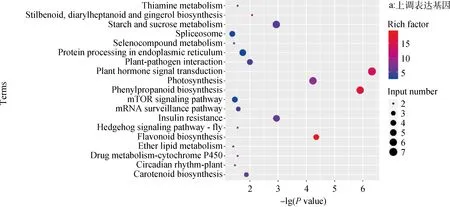
图11 冷害胁迫下结缕草种质ZG-36 CH Vs OP差异表达基因KEGG代谢通路富集分析Fig.11 Analysis of KEGG metabolic pathway enrichment of the differential expression genes in ZG-36 germplasm CH Vs OP under chilling stress

图12 冻害胁迫下结缕草种质ZG-36 CH Vs OP差异表达基因KEGG代谢通路富集分析Fig.12 Analysis of KEGG metabolic pathway enrichment of the differential expression genes in ZG-36 germplasm FR Vs OP under freezing stress
2.7 差异表达转录因子统计分析
转录调节是植物在正常或逆境条件下生长过程的关键过程,转录因子(Transcription factor,TF)在此过程中具有重要作用。如图13所示,低温胁迫后ZG-32和ZG-36两个不同纬度来源结缕草种质中有9 281个转录因子注释到TFs数据库,涵盖了50个TFs家族,其中AP2,bZIP,bHLH,WRRKY,ERF和TALE等转录因子家族在该两个结缕草种质中占较高比例。
如表5所示,在能够注释到TFs数据库的50个转录因子家族中有38个TFs家族在两个不同纬度来源结缕草种质ZG-36或ZG-32中差异表达,其中差异表达数量最多的为bHLH,ERF,MYB,ARF,bZIP等几大类。在差异表达的38个TFs家族中,ZG-36有22个TFs家族,其差异表达的成员数量多于ZG-32,如bHLH,ERF,MYB,bZIP,G2-like,HD-ZIP,Dof,HSF和GRAS等,表明这些差异表达的转录因子可能对增强来自高纬度地区结缕草种质ZG-36的耐寒性起到了重要的调控作用。

图13 转录组中注释到的转录因子Fig.13 Transcription factors annotated in transcriptome

表5 差异表达的转录因子家族统计Table 5 Statistics on the families of differentially expressed transcription factors
2.8 差异表达的LEA基因分析
植物胚胎发育晚期丰富蛋白(Late embriogenesis abundant protein,LEA)是植物应对冷冻、盐碱、干旱等失水胁迫逆境而广泛存在的一种亲水性应答蛋白,它具有较强的热稳定性。如表6所示,冷害或冻害胁迫下,ZG-36和ZG-32两个基因型叶片中共筛选获得了31个差异表达LEA基因。其中,冷害下在ZG-36中上调表达21个,下调表达仅1个;在ZG-32中上调表达14个,下调表达8个。冻害下在ZG-36中上调表达18个,下调表达仅2个;在ZG-32中上调表达7个,下调表达13个。表明冷害和冻害条件下,在ZG-36中上调表达的LEA基因数量显著多于ZG-32的LEA基因数量;而在ZG-32中下调表达的LEA基因数量却显著多于ZG-36,进一步表明LEA基因对不同结缕草种质适应低温胁迫及增强其耐寒性起了非常重要的作用。
2.9 差异表达基因的qPCR验证
如图14所示,以冷害和冻害处理后的ZG-36和ZG-32两个结缕草叶片为材料提取RNA,反转录合成cDNA后为模板,随机选取了10 条差异表达基因进行qRT-PCR验证,其基因表达量变化趋势与转录组测序结果大致相同,其线性回归方程为y=1.119x-0.378 8(R2=0.889),表明这两组数据相关性和转录组测序结果置信度较高。

表6 差异表达的LEA基因分析Table 6 Analysis of differentially expressed late embryogenesis abundant protein genes

图14 qPCR验证RNA-seq数据Fig.14 qPCR validated with RNA-seq data
3 讨论
结缕草广泛分布于世界热带、亚热带和暖温带地区,在我国分布北至东北的辽宁、吉林,南至华南的广东、海南等地。不同纬度来源的结缕草种质其对低温的适应性不同,前期以及本研究结果均表明低纬度来源的结缕草种质对低温较为敏感且其耐寒性弱,而高纬度来源的结缕草种质则耐寒性强[6]。
通过转录组测序技术对基因表达进行分析,可获取细胞内的基因表达全局图,从而有助于解析植物胁迫相互作用的抗性机制,是当前用于植物抗逆机制研究的有力手段[7-8]。为此,本研究基于来自高纬度来源结缕草ZG-36和低纬度来源结缕草ZG-32对低温敏感性的差异,对其在冷害和冻害处理下叶片转录组进行分析。与正常温度处理相比较,冷害胁迫下耐寒性弱且来自低纬度地区的结缕草种质ZG-32中差异表达的基因数量显著多于ZG-36的基因数量,而在冻害胁迫下ZG-36中差异表达的基因数量显著多于ZG-32基因数量,表明不同地理纬度来源的结缕草种质在基因表达层面对低温胁迫的响应时间不一样,低纬度来源结缕草种质ZG-32对低温响应敏感,以较早的响应低温以诱导一系列基因的表达而提高适应性,其耐寒性弱;而高纬度来源结缕草种质ZG-36则对低温适应性强,其响应速度较慢,耐寒性强。并且在冻害条件下高纬度来源结缕草种质ZG-36响应低温胁迫的基因表达数量多,有利于提高其抗冻性。
KEGG代谢通路分析结果表明,植物在冷害下激素信号转导、类黄酮生物合成、淀粉与蔗糖代谢、苯丙素生物合成等通路在ZG-36与ZG-32两个不同纬度来源结缕草叶片上调表达基因中均显著富集,表明零上低温诱导了植物激素中ABA,JA,SA的生物合成与信号转导,从而启动下游基因的表达而提高其耐寒性,增强其适应性[9-10]。此外,冷害也诱导了次生代谢产物代谢通路如类黄酮的生物合成,在耐寒性强且来自高纬度的ZG-36中还诱导了胡萝卜素和脂类的代谢,可提高其细胞膜脂的稳定,从而增加其对低温胁迫的抵御能力[11-13]。ZG-36与ZG-32两个不同耐寒性结缕草种质的光合作用、光合碳代谢、丙酮酸代谢等代谢通路在冷害和冻害胁迫下的下调表达差异基因中富集,表明低温胁迫影响了结缕草的光合作用和二氧化碳的固定,这与前期的研究结果相一致[14]。
转录因子调控植物中与胁迫相关基因的表达,对植物应对低温胁迫等具有重要作用[15]。在本研究中,ZG-36与ZG-32两个不同耐寒性结缕草种质的差异表达基因功能注释发现,差异表达基因在分子功能和生物学过程中富集最多,涉及差异表达的转录因子达38个家族,其中来自高纬度的ZG-36中有22个TFs家族,其差异表达的成员数量多于低纬度来源的ZG-32,主要有bHLH,ERF,MYB,bZIP和HSF等,这些转录因子是植物中重要的转录因子家族之一,所有家族成员对植物抗逆有着非常重要的作用。枇杷ERF基因EjERF39可与EjMYB8共转录激活Ej4CL1表达从而提高枇杷的耐寒性[16];独行菜和苹果bHLH类转录因子LaICE1和MdbHLH3在低温胁迫下可显著诱导表达而提高耐寒性[17];过表达蒙古冰草MwMYB4和苹果MdMYB2可显著提高拟南芥的耐寒性[18-19]。枇杷HSF转录因子EjHSF1和EjHSF3可激活EjHsp和木质素合成相关基因的表达从而提高枇杷的耐寒性[20];棉花bZIP转录因子Ghb,ZIP15和甘蓝型油菜bZIP转录因子在响应低温胁迫而增强了植株的耐寒性[21,22]。上述研究结果表明,这些差异表达的转录因子可能在高纬度来源结缕草种质ZG-36的低温适应性和抗冻性中起了重要的调控作用。
为抵御外界胁迫对机体造成的可能损害,逆境下的植物机体通过诱导产生相应的功能蛋白来适应外部环境变化,从而提高自身逆境适应能力,其中LEA被认为是一类与植物抵御非生物胁迫密切相关的蛋白[23-28]。在拟南芥中过表达陆地棉GhLEA3基因,显著提升了拟南芥种子在低温的萌发率,提高了耐寒性[29];过表达天麻LEA基因可提高大肠杆菌耐寒性[30];玉米ZmLEA3基因编码的蛋白能保护低温胁迫下的乳酸脱氢酶活性,过表达ZmLEA3可显著提高转基因烟草、酵母和大肠杆菌的耐低温能力[31];闫逢英等[32]克隆了结缕草LEA基因ZjLea3,转基因酵母抗逆性分析结果显示转化基因的酵母细胞对冷冻的耐受能力显著提升,表明ZjLea3蛋白参与结缕草抵御低温非生物胁迫的调控。在本研究中,冷害或冻害下,ZG-36与ZG-32两个不同耐寒性结缕草种质的叶片中共筛选获得了31个差异表达的LEA基因,并且在耐寒性强且来自高纬度地区的结缕草种质ZG-36中上调表达的LEA基因数量显著多于耐寒性弱且来自低纬度地区的结缕草种质ZG-32;而在ZG-32中下调表达的LEA基因数量却显著多于ZG-36,表明LEA基因对结缕草适应低温胁迫和增强耐寒性起了非常重要的作用。
4 结论
综上所述,通过转录组测序分析表明来自低纬度的结缕草种质ZG-32对低温胁迫响应敏感,耐寒性弱,以较早的响应低温诱导一系列基因的表达而提高适应性;而来自高纬度的结缕草种质ZG-36则对低温适应性强,响应速度较慢,耐寒性强。此外,高纬度来源种质ZG-36具有较强的耐寒性还与其在低温胁迫下诱导表达的基因数量密切相关,尤其是与植物激素信号转导、胡萝卜素和脂类的代谢等次生代谢产物代谢通路、转录因子(bHLH,ERF,MYB,bZIP,HSF等)和LEA蛋白的表达相关,从而提高了ZG-36细胞膜的稳定性及增强其对低温的适应性和抵御能力。

